
„Zwiększenie liczby wysoko wykwalifikowanych absolwentów kierunków ścisłych Uniwersytetu Jagiellońskiego”
POKL.04.01.02-00-097/09-00
Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
Wykład dla III roku Chemii UJ
„Zwiększenie liczby wysoko wykwalifikowanych absolwentów kierunków ścisłych Uniwersytetu Jagiellońskiego”
POKL.04.01.02-00-097/09-00
dr hab. Marek Mac
Procesy elektrodowe i
korozja
2
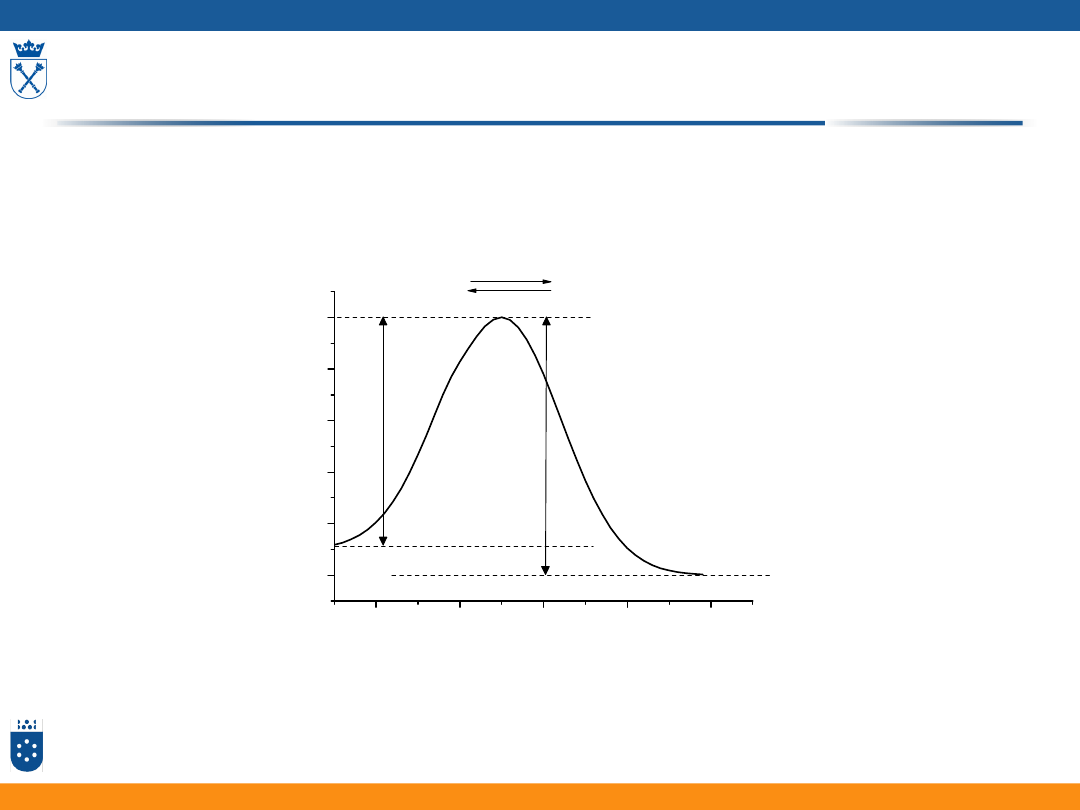
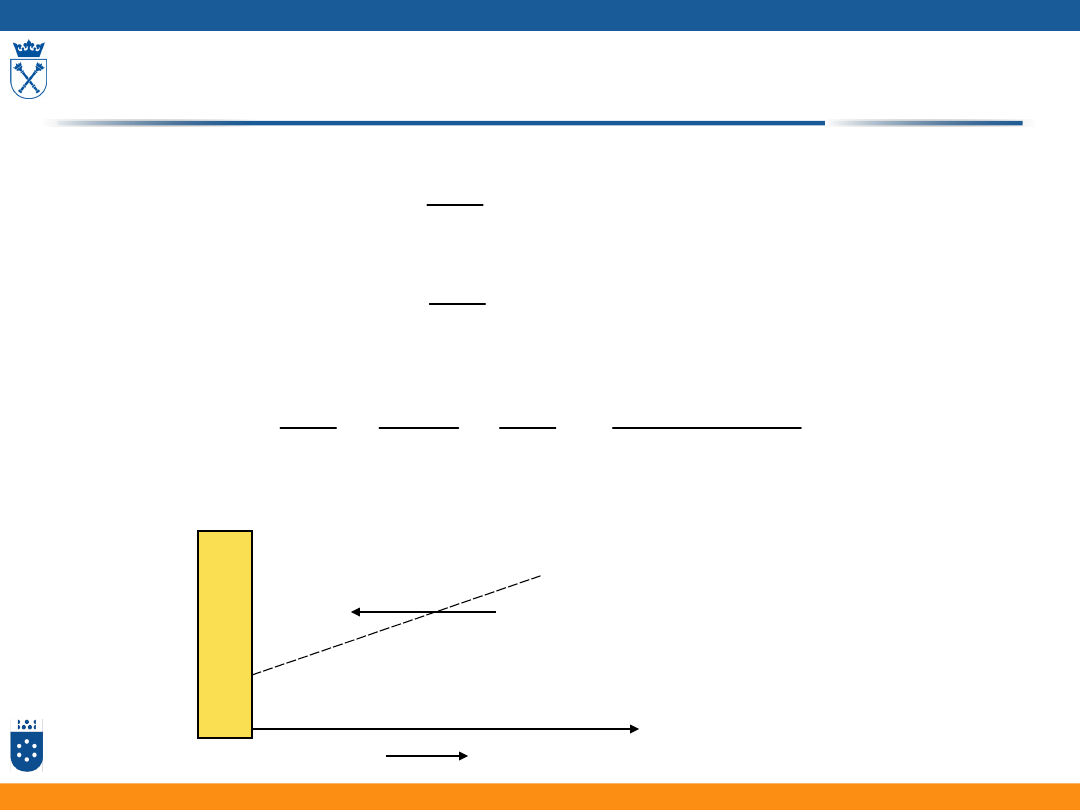
Nadpotencjał aktywacyjny
Me
z+
G
#
red
en
ta
lp
ia
s
w
ob
od
na
r
G
#
ox
Me-ze

3
RT
G
ox
ox
ox
e
k
v
#
RT
G
ox
ox
ox
ox
e
zFk
zFv
j
#
z
red
Me
RT
G
red
red
a
e
k
v
#
z
red
Me
RT
G
red
red
red
a
e
zFk
zFv
j
#
W stanie równowagi
ox
red
j
j
Nadpotencjał aktywacyjny

4
z
red
ox
Me
RT
G
red
RT
G
ox
a
e
zFk
e
zFk
#
#
z
Me
red
ox
a
RT
red
G
zFk
RT
ox
G
zFk
ln
#
)
ln(
#
)
ln(
z
Me
red
ox
a
RT
red
G
ox
G
k
k
ln
#
#
ln
RT
zFE
a
RT
zFE
a
RT
G
k
k
z
z
Me
Me
red
ox
0
ln
ln
ln
z
Me
a
zF
RT
E
E
ln
0
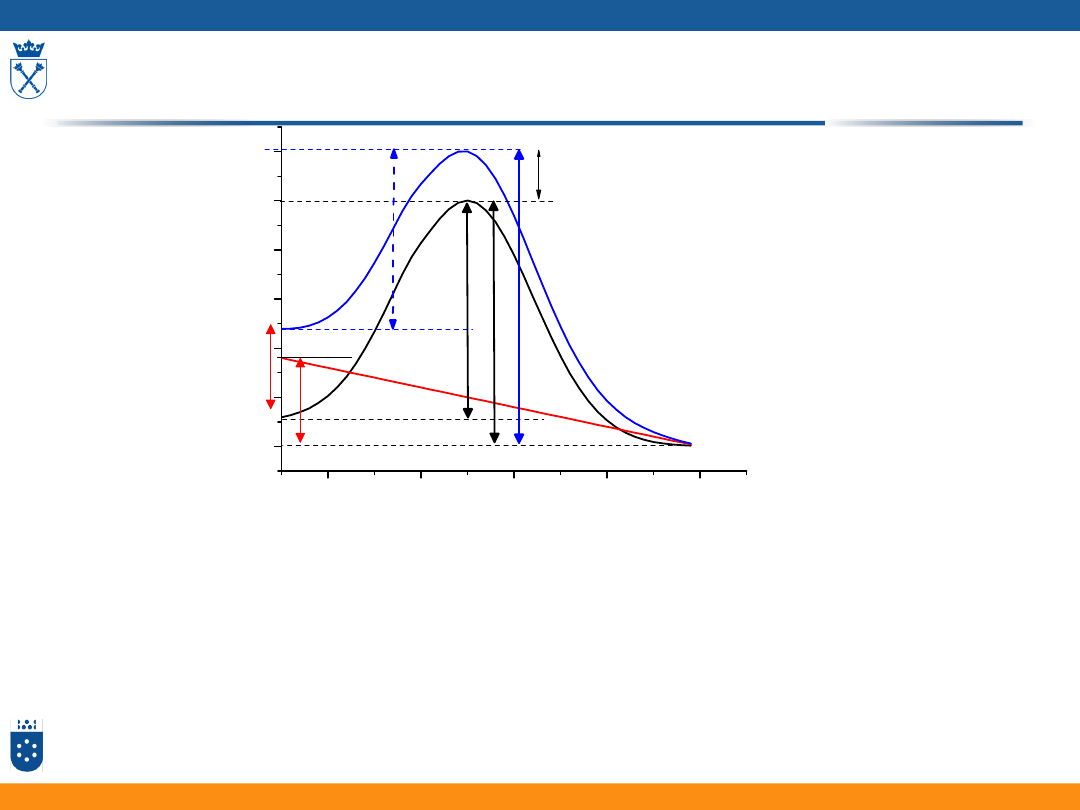
Nadpotencjał aktywacyjny
Wzór Nernsta
5
zF
zF
G
#'
red
G
#'
ox
G
#'
ox
e
nt
a
lp
ia
s
w
ob
od
na
r
zF
zF
G
G
zF
G
zF
G
ox
ox
ox
ox
)
1
(
#
'
#
#
'
#
zF
G
G
red
red
#
'
#

6
RT
zF
G
zFk
RT
G
zFk
j
ox
ox
ox
ox
ox
)
1
(
exp
)
/
exp(
#
'
#
z
z
Me
red
red
Me
red
red
red
a
RT
zF
G
zFk
a
RT
G
zFk
j
#
'
#
exp
)
/
exp(
Ale:
)
/
exp(
#
0
RT
G
zFk
j
ox
ox
z
Me
red
red
a
RT
G
zFk
j
)
/
exp(
#
0
red
ox
j
j
j
7
RT
zF
j
j
ox
)
1
(
exp
0
RT
zF
j
j
red
exp
0
RT
zF
RT
zF
j
j
exp
)
1
(
exp
0
-0,15
-0,10
-0,05
0,00
0,05
0,10
0,15
-20
-15
-10
-5
0
5
10
15
20
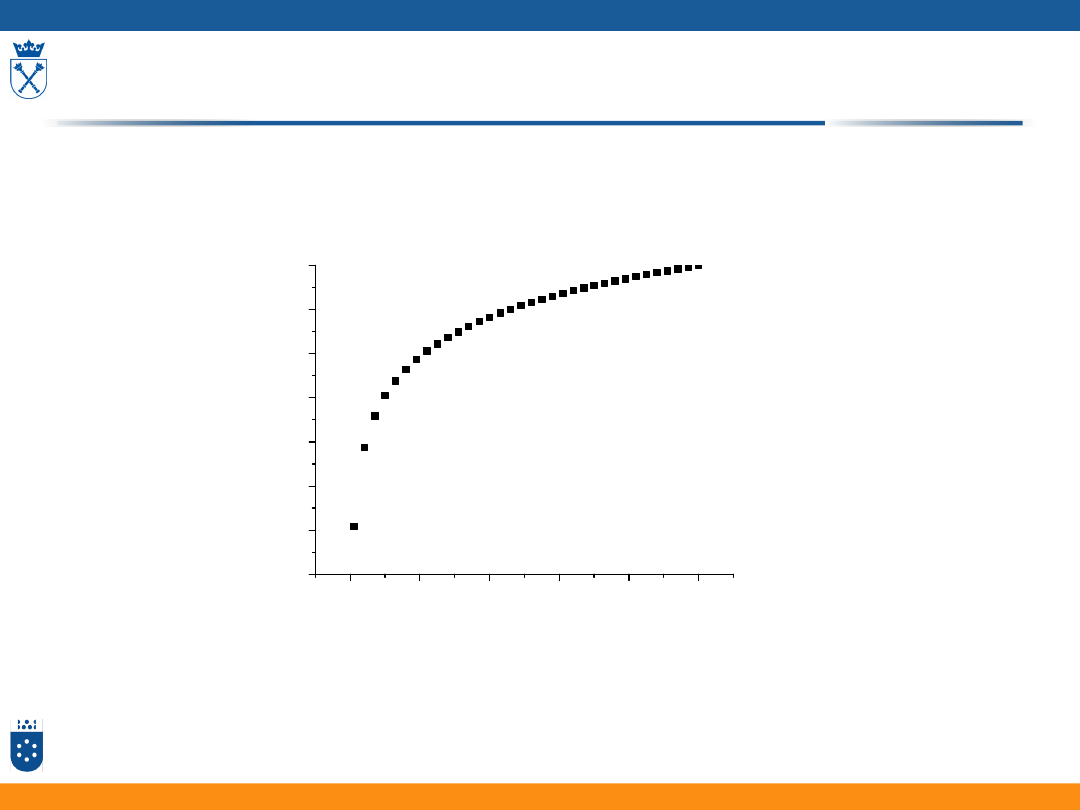
j
j
red
j/j
0
/V
j
ox
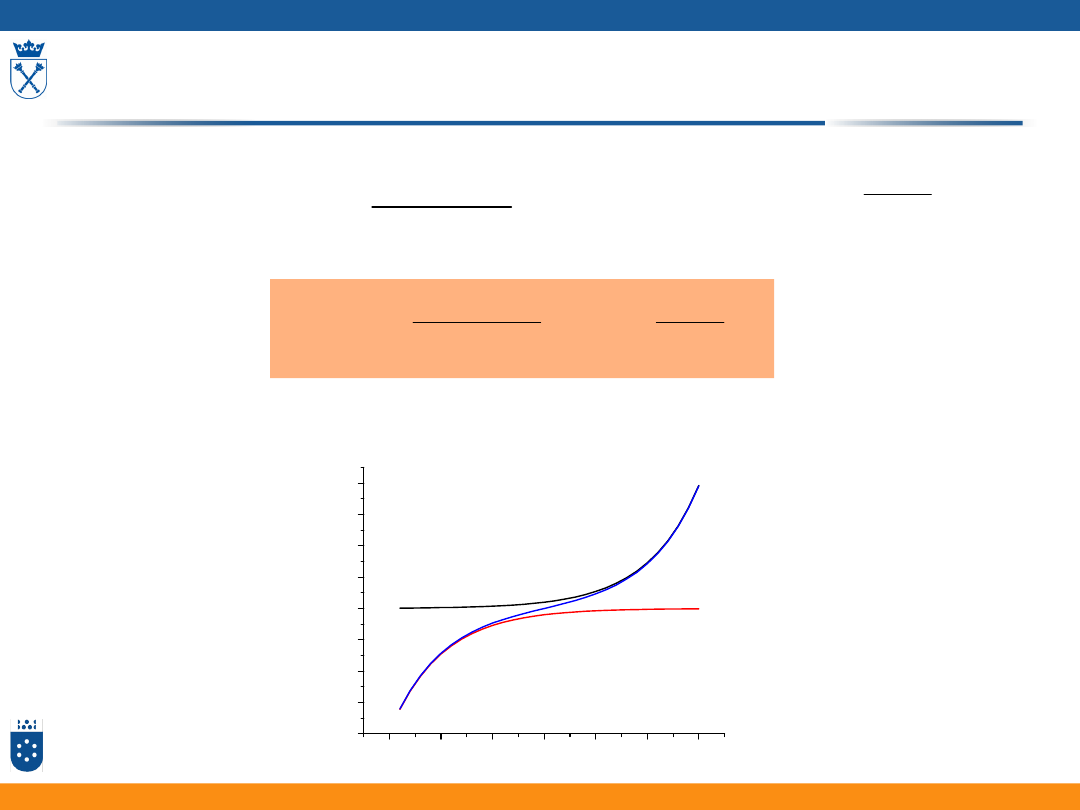
Równanie Butlera-Volmera
Równanie Butlera-Volmera

8
RT
zF
j
RT
zF
RT
zF
j
j
0
0
1
)
1
(
1
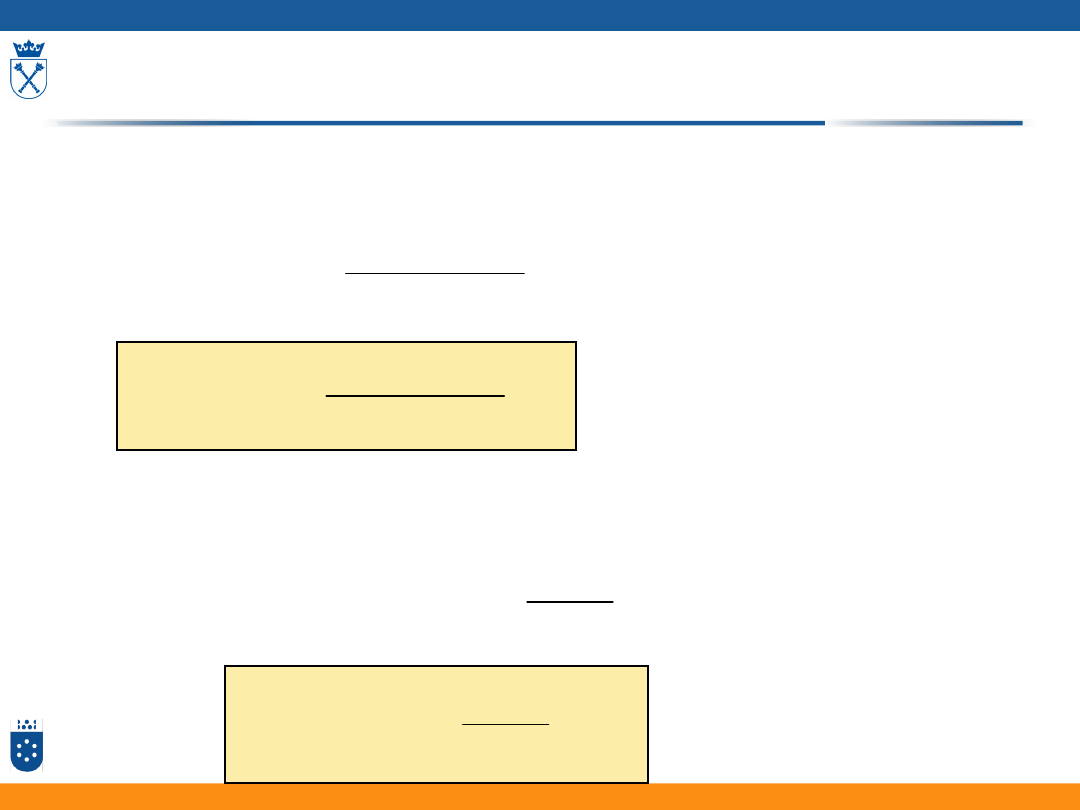
Dla niskich nadpotencjałow
-0,0008
-0,0004
0,0000
0,0004
0,0008
-0,02
0,00
0,02
0,04
j/j
0
/V
1/nachylenie=RT/F=38.9
9
Dla dużych (tzn. dodatnich) nadpotencjałow:
RT
zF
j
j
ox
)
1
(
exp
0
RT
zF
j
j
ox
)
1
(
/
ln
0
Dla małych (tzn. ujemnych) nadpotencjałów:
RT
zF
j
j
red
exp
0
RT
zF
j
j
red
0
/
ln
Równania Tafela
Równania Tafela
10
Nadpotencjał stężeniowy
z
Me
a
zF
RT
E
E
ln
0
z
Me
a
zF
RT
E
E
'
ln
'
0
1
ln
ln
'
'
'
z
z
z
z
z
Me
Me
Me
Me
Me
a
a
a
zF
RT
a
a
zF
RT
E
E
c
Mez+
c’
Mez+
x
11
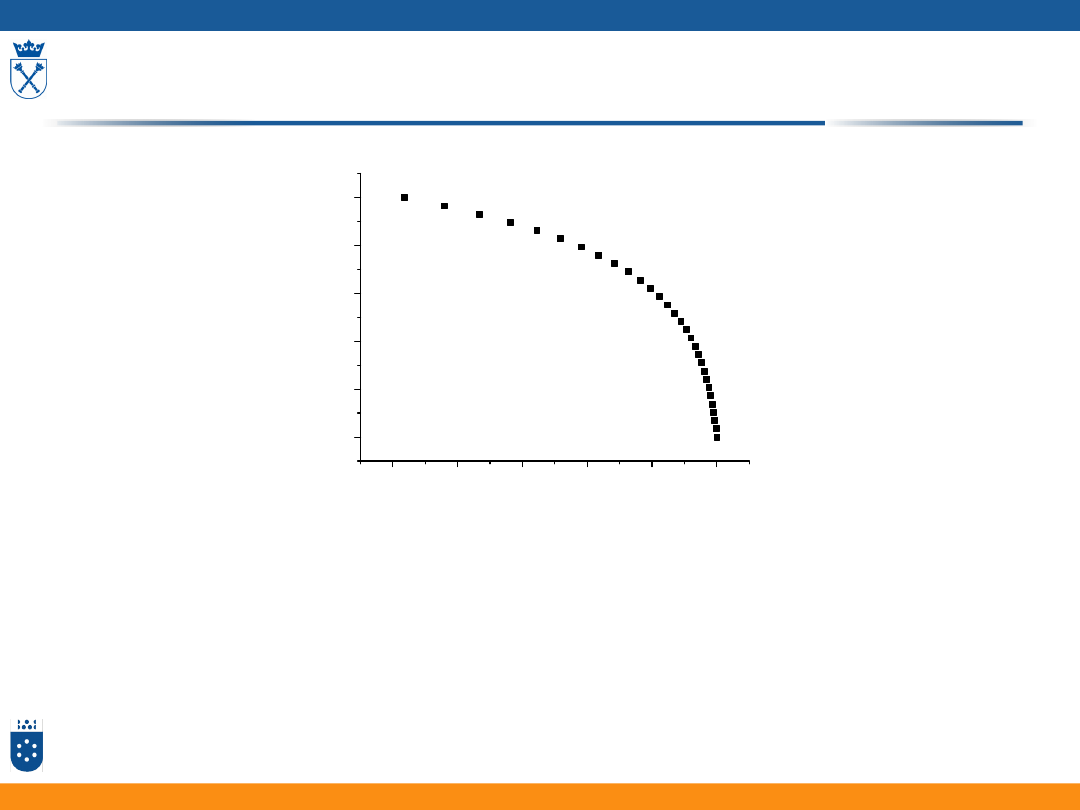
0,0
0,2
0,4
0,6
0,8
1,0
-0,14
-0,12
-0,10
-0,08
-0,06
-0,04
-0,02
0,00
/V
c'/M
Zależność nadpotencjału dyfuzyjnego od stężenia jonu przy elektrodzie

12
dx
dc
D
dt
dn
z
z
Me
Me
z
z
Me
Me
c
c
zFD
j
'
z
Me
gr
c
zFD
j
Gdy
0
'
z
Me
c
gr
Me
Me
Me
j
j
zF
RT
a
a
a
zF
RT
z
z
z
1
ln
1
ln
'
RT
zF
j
j
gr
exp
1
Nadpotencjał stężeniowy
13
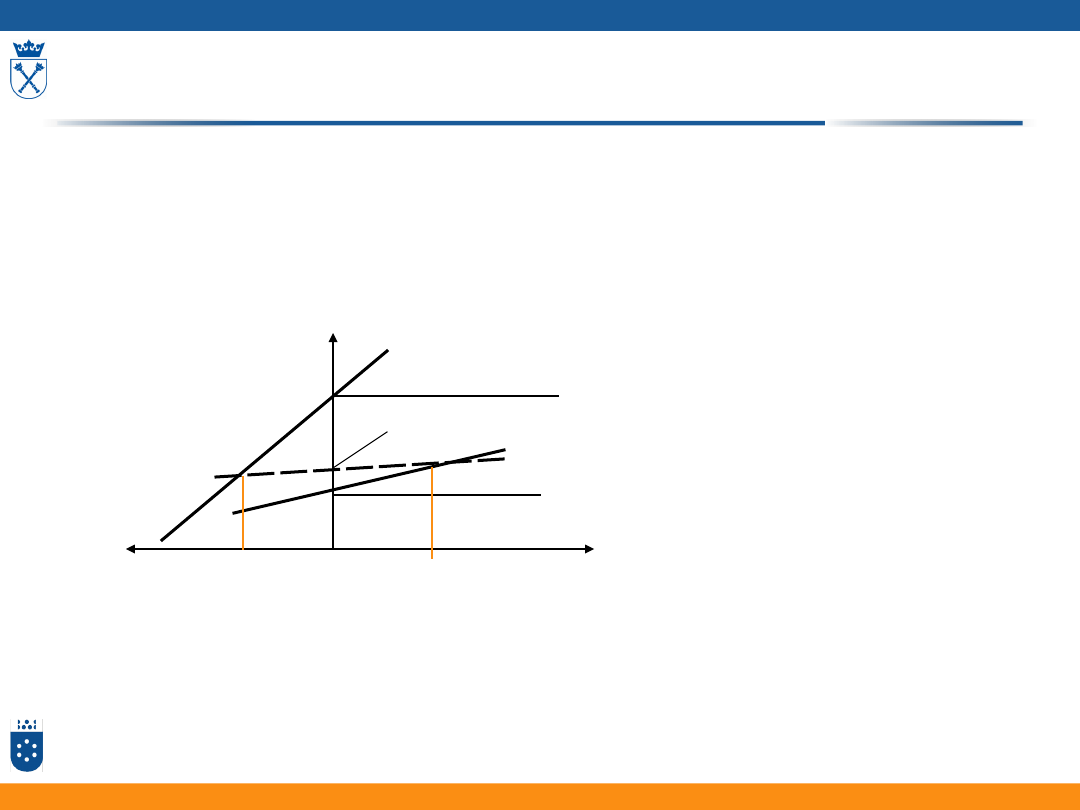
0,00
0,02
0,04
0,06
0,08
0,10
-50
-40
-30
-20
-10
0
V
j/j
g
r
Zależność nadpotencjału dyfuzyjnego
od gęstości prądu

14
Korozja chemiczna
2Fe+2H
2
O+O
2
2Fe(OH)
2
Korozja
15
Korozja elektrochemiczna
Me-zeMe
z+
2H
+
+2e H
2
– środowisko kwaśne
O
2
+2H
2
O+4e 4OH
-
- środowisko zasadowe
i
k
i
a
H2
Me
m
2H
+
+2e H
2
Me-zeMe
z+
m
– potencjał mieszania
i
k0
i
a0

16
Fe
O
2
Fe
2+
2Fe-4e 2Fe
++
- proces anodowy
O
2
+2H
2
O+4e 4OH
-
- proces katodowy
RT
FSEM
A
j
I
kor
4
exp
0
Prąd korozji
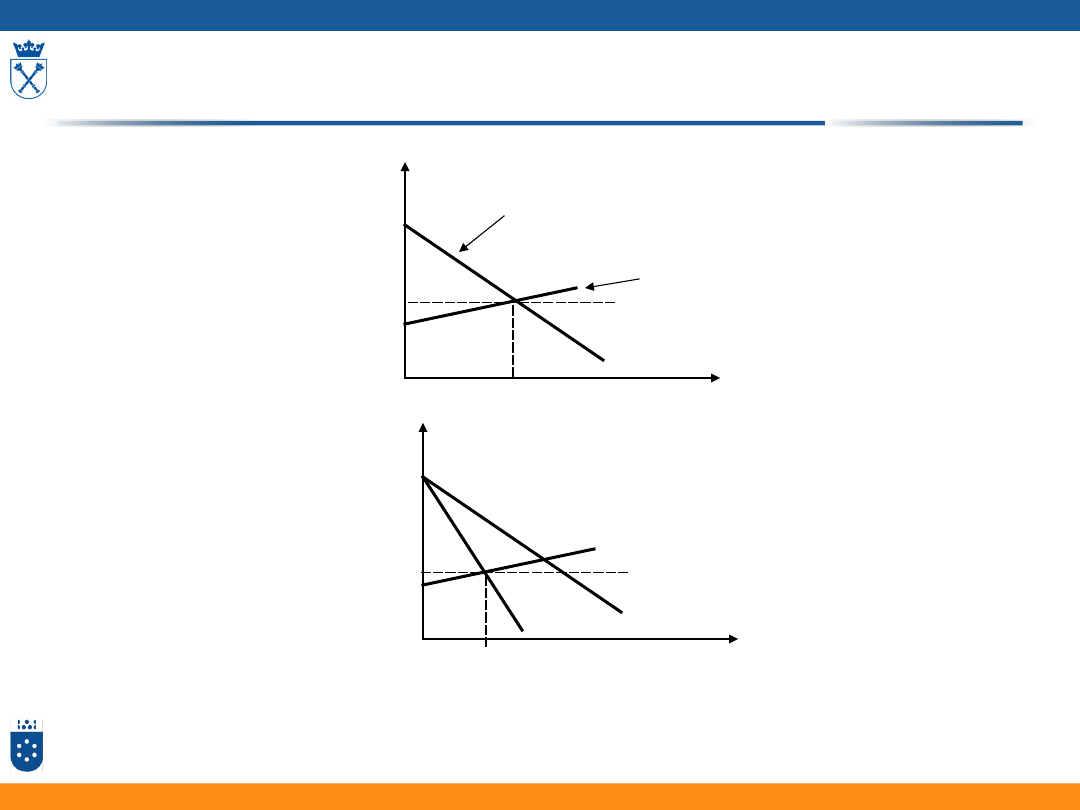
17
|i|
m
Wykres Evansa, potencjał mieszany
i
ko
r
|i|
m
i
ko
r
Reakcja z inhibitorem (związki arsenu)
Me-zeMe
z+
2H
+
+2e H
2

18
Zapobieganie korozji
1. Zmniejszanie powierzchni styku kropli z metalem A
poprzez malowanie
2. Stosowanie przeciwelektrody (anoda protektorowa)
z metalu mniej szlachetnego np. Zn lub Mg
3. Pasywacja, czyli pokrywanie warstwy tlenkiem metalu
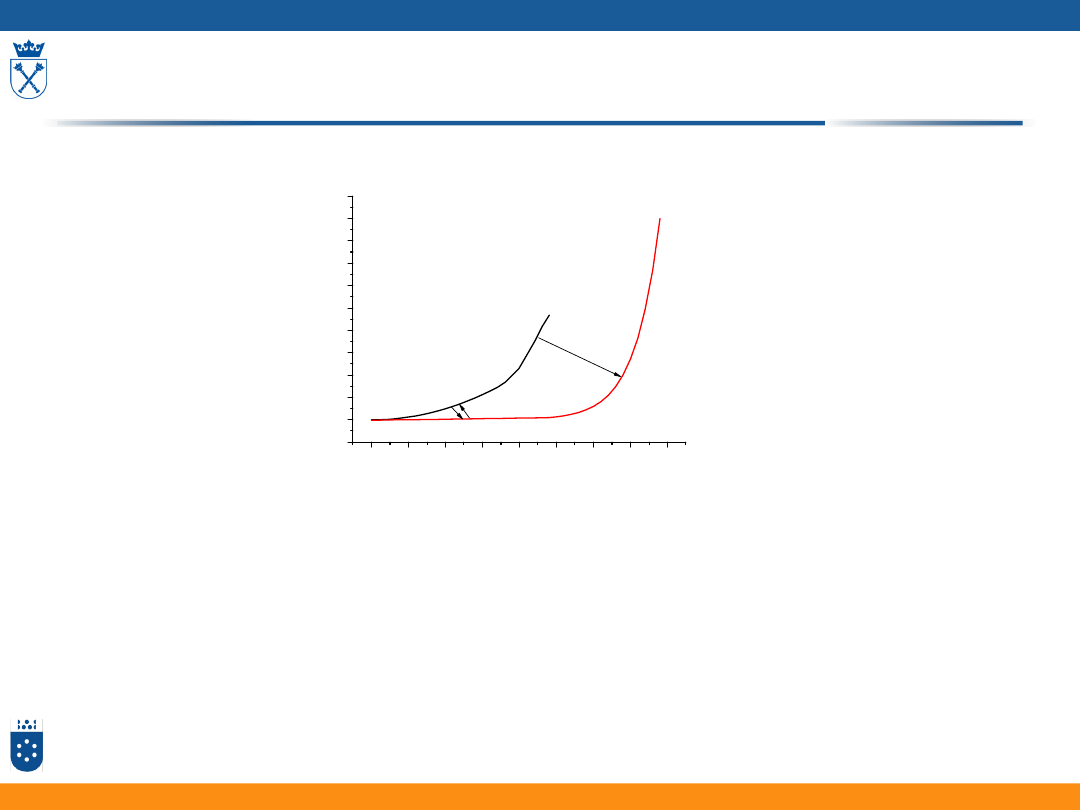
19
Pasywacja anodowa
i
E
anoda
stan aktywny
stan pasywny
Me-zeMe
z+
- stan aktywny
Me
z+
+zOH
-
Me(OH)
z
– stan pasywny
4OH
-
- 4e O
2
+2H
2
O
Depasywacja:
Me(OH)
z
+ ze Me+zOH
-
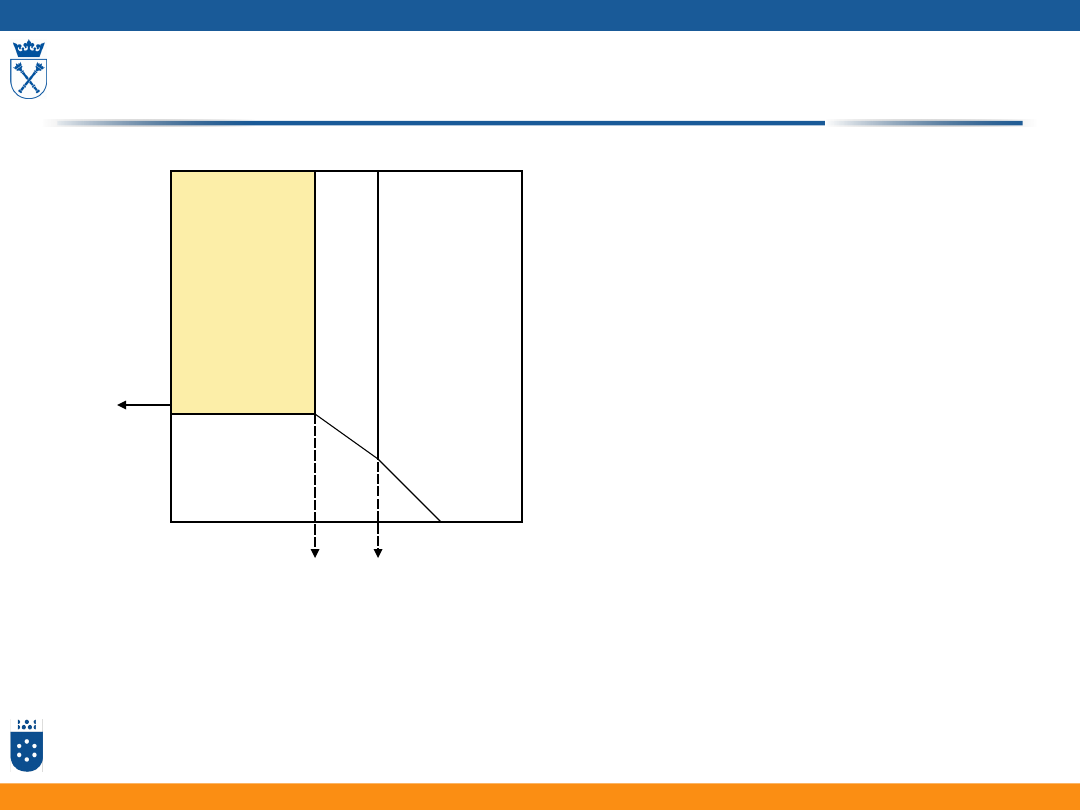
20
Wykresy Pourbaix
Zn
++
Z
n
(O
H
)
2
ZnO
2
2-
Zn
pH
/V
8 11
-
0.8

21
Nadnapięcie wydzielania wodoru
2H
+
+2eH
2
Etap 1 (środowisko kwaśne)
H
3
O
+
+e+Me Me-H+H
2
O
Etap 1 (środowisko zasadowe)
H
2
O+e+Me Me-H+OH
-
Etap 2 rekombinacja
2Me-H 2Me+H
2
Desorpcja elektrochemiczna
Me-H+H
3
O
+
+e H
2
+H
2
O H
2
O+e+Me-H Me +OH
-
+H
2

22
Metal elektrody mechanizm
Wartość b
we wzorze
Tafela
Hg, Pb (wysoki
nadpotencjał)
Etap 1
(determinuje
szybkość
reakcji)
0.116
Pt, Pd (niski
nadpotencjał)
Etap 2 –
(determinuje
szybkość
reakcji)
0.029
Nadnapięcie wydzielania wodoru
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
Wyszukiwarka
Podobne podstrony:
PROCESY ELEKTROCHEMICZNE I KOROZJA
wykład 5 elektroliza i korozja
KOROZJA I PROCESY ELEKTROCHEMIC Nieznany
Wyklad 3b Handel elektroniczny wyniki badan
Wykłady Inżynieria procesowa
Pytania z wykładów na kolokwium z Elektroenergetyki
Modelowanie i symulacja procesów elektrycznych w obwodzie z lampą rtęciową
wde - pytania wykład, wstęp do elektroniki - wykład zaliczenie
Zarządzanie systemami i przedsiębiorstwami- WYKŁAD ZARZĄDZANIE PROCESAMI 08.03.2010., zimar
Wykladkpk4, Uczestnicy procesu karnego
4 WYKLAD 10 PROCES OFERTOWANIA id 38109 (2)
Karta modulu Procesy elektromagnetyczne id 2
więcej podobnych podstron