Atomy wieloelektronowe
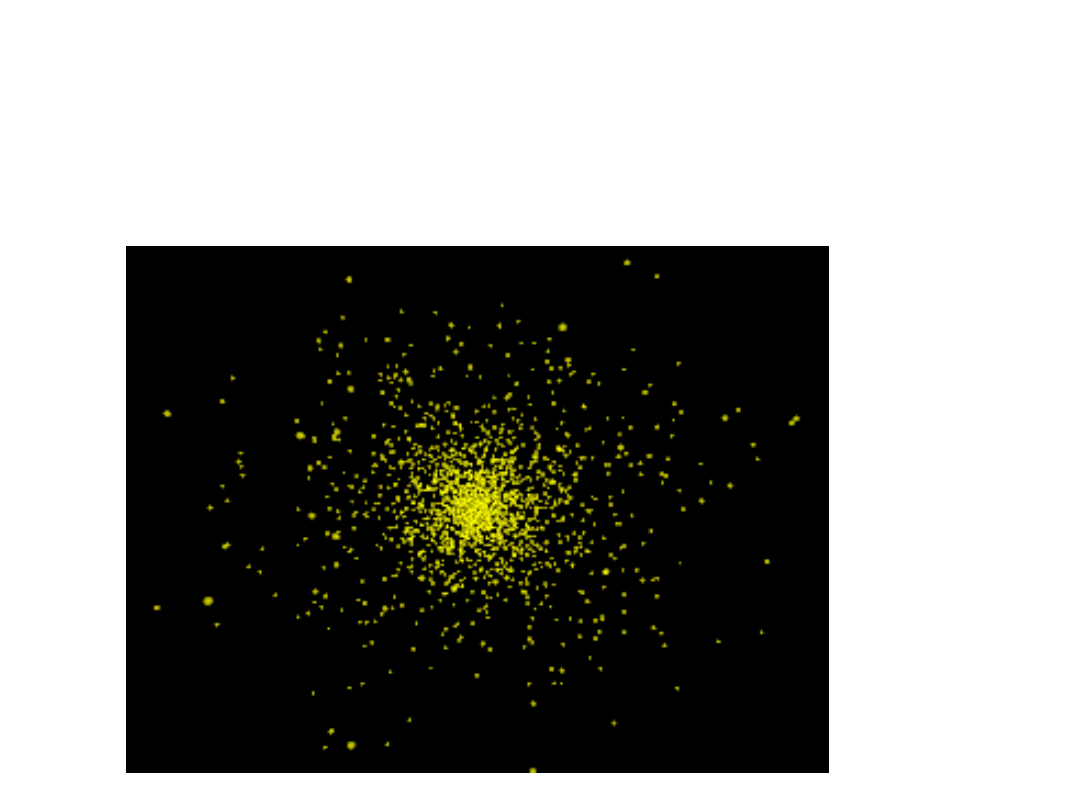
Model atomu wodoru. Jądro jest
niewidoczne i znajduje się w miejscu
o największym zagęszczeniu
punktów
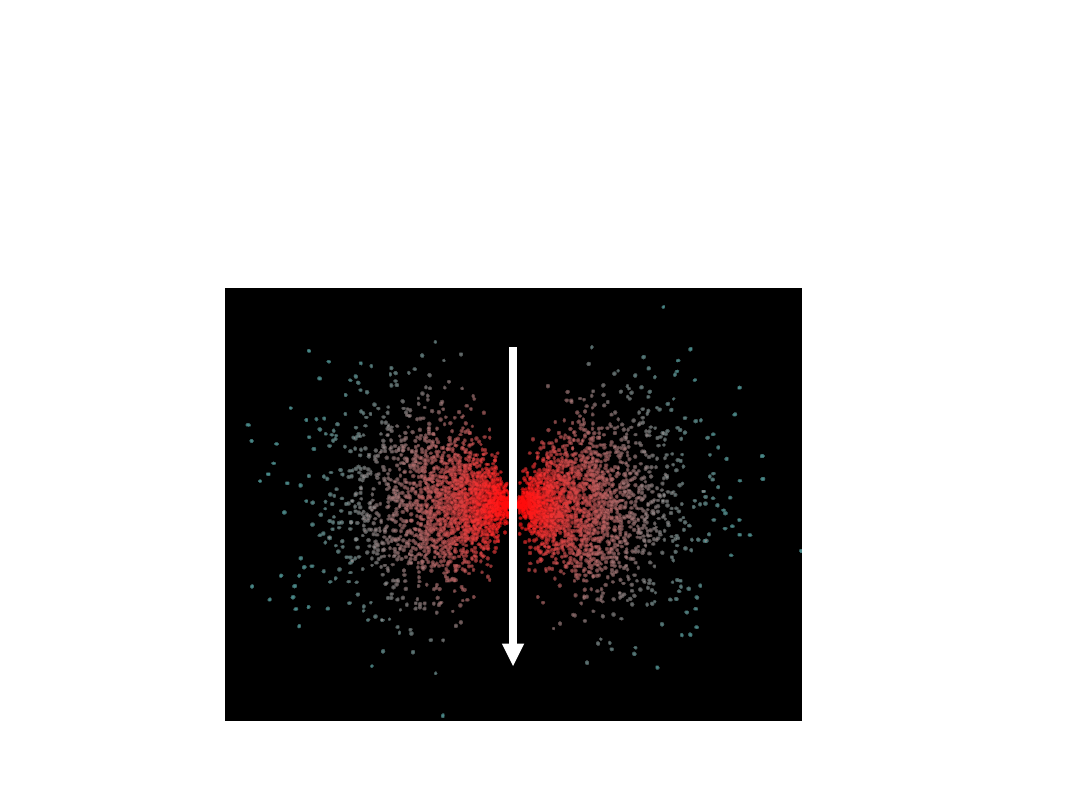
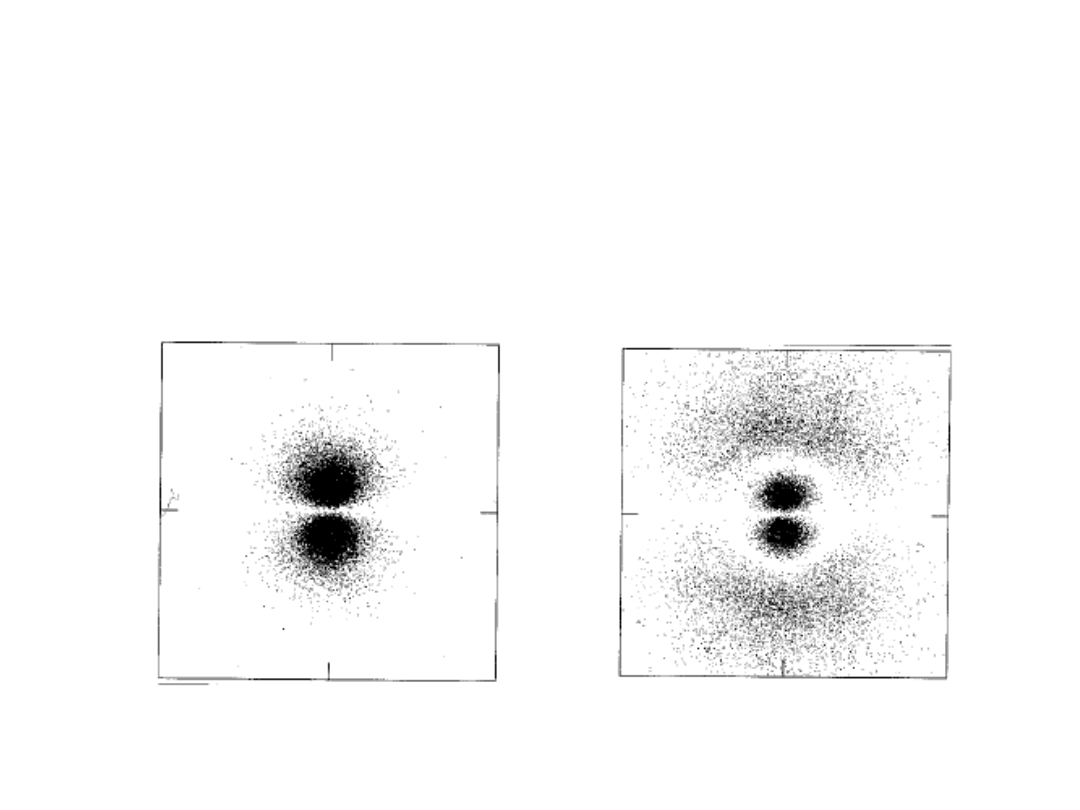
Inny stan atomu wodoru
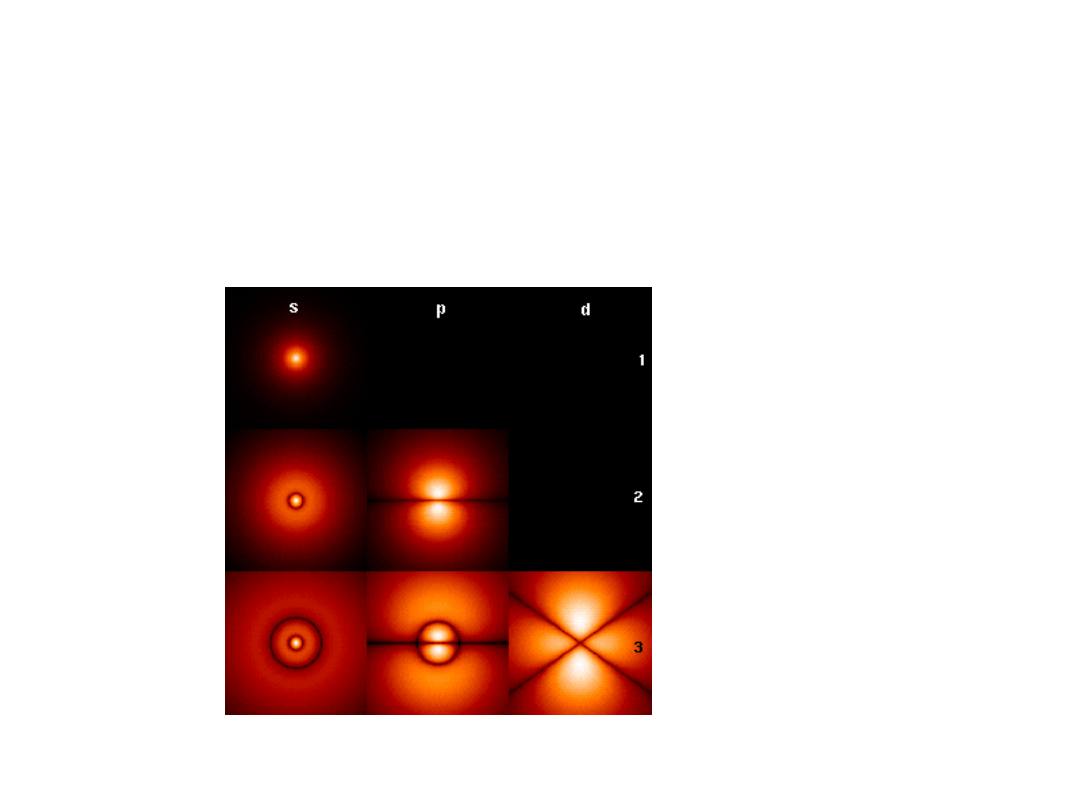
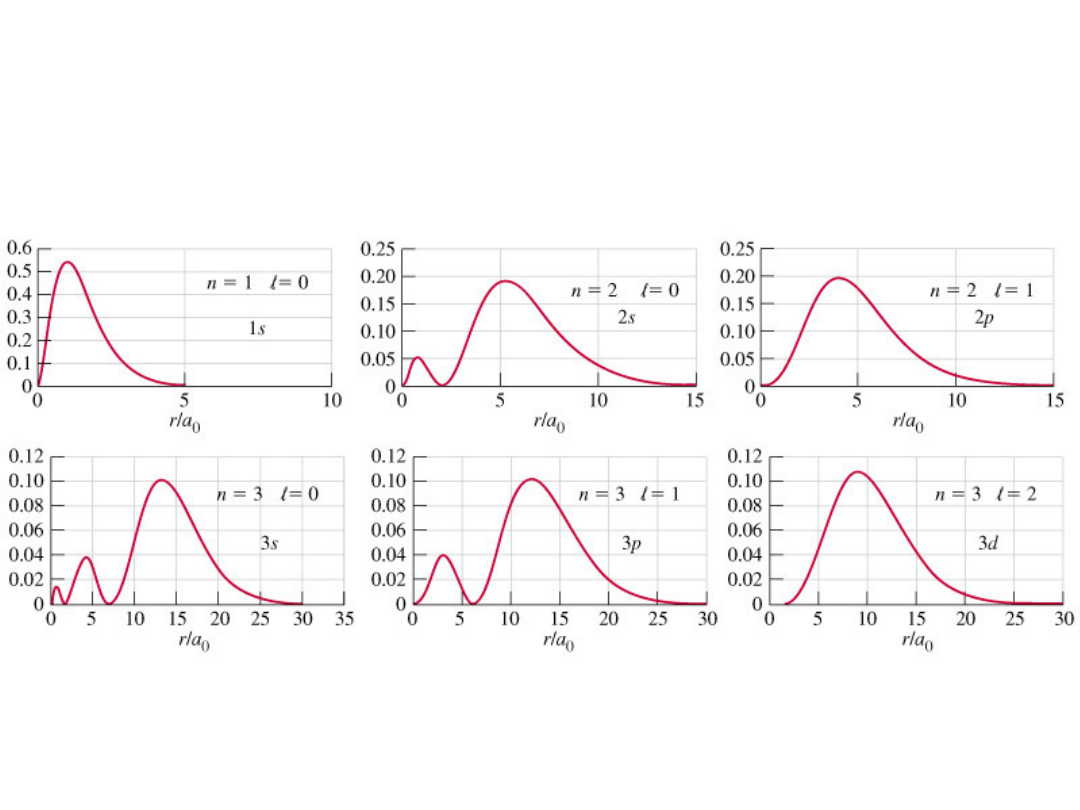
Funkcje falowe dla
elektronu w atomie
wodoru
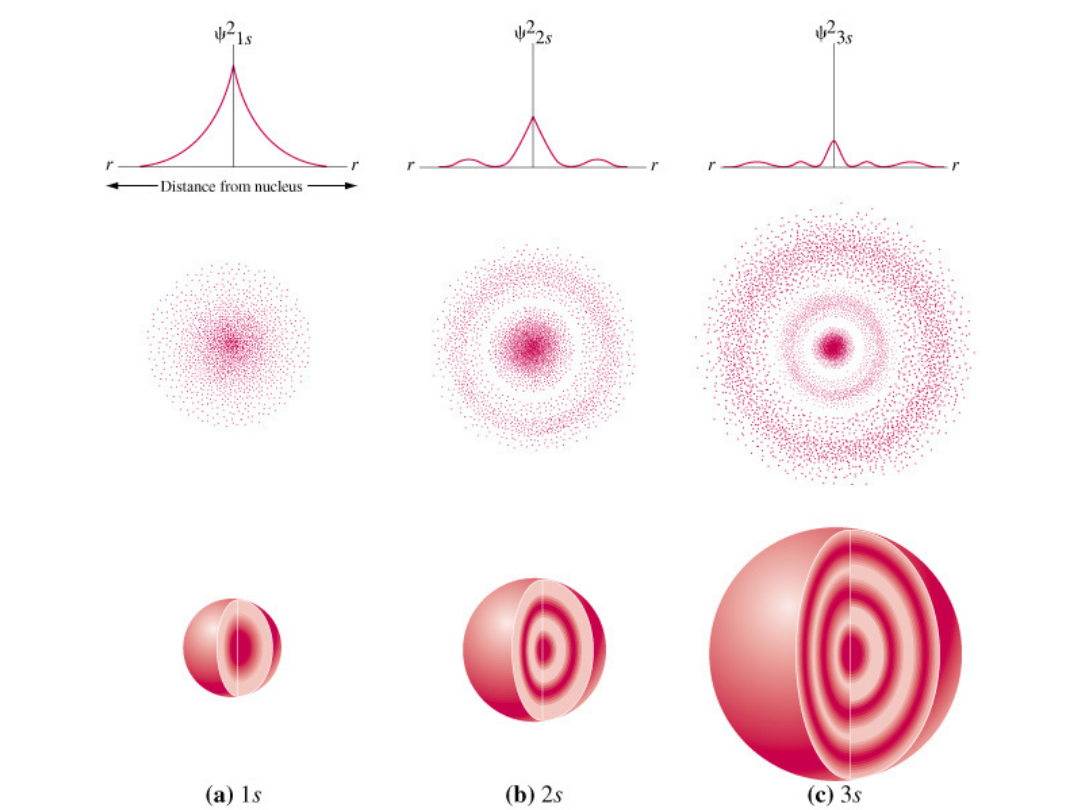
Tylko orbital s
Ma niezerowe
Prawdopodobieństwo
W pobliżu jądra
Dla pozostałych = 0
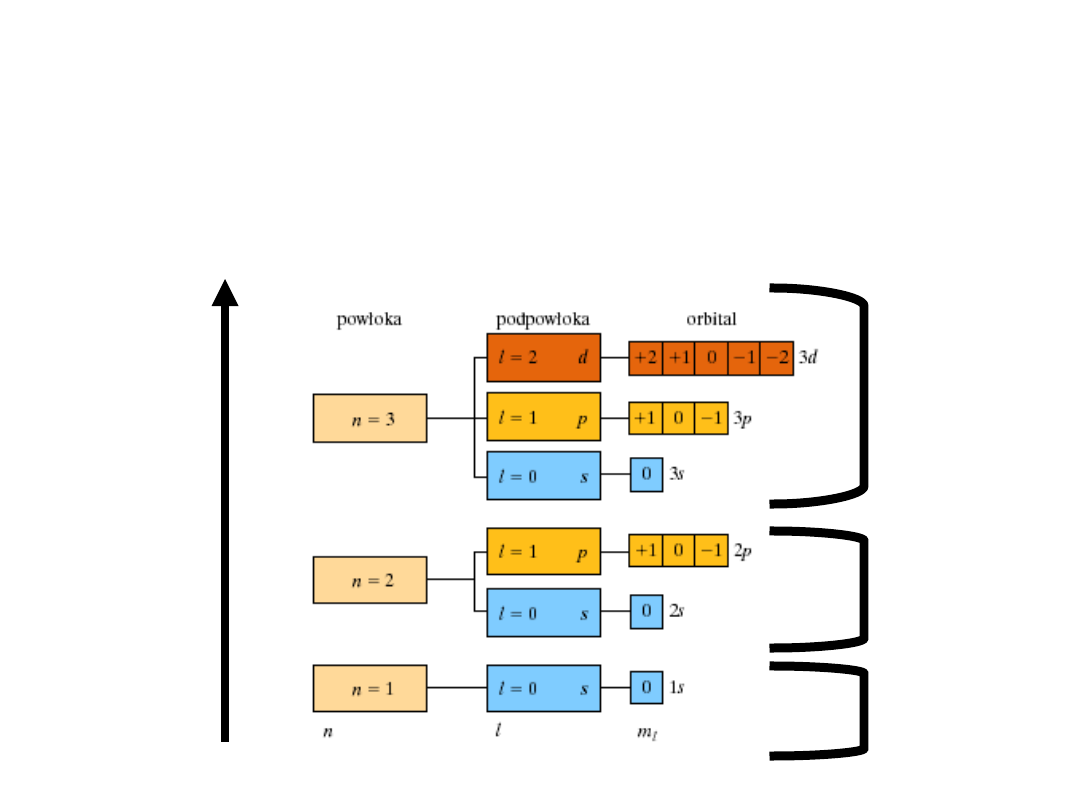
Liczby kwantowe – atom
wodoru
E
E
1
E
2
E
3
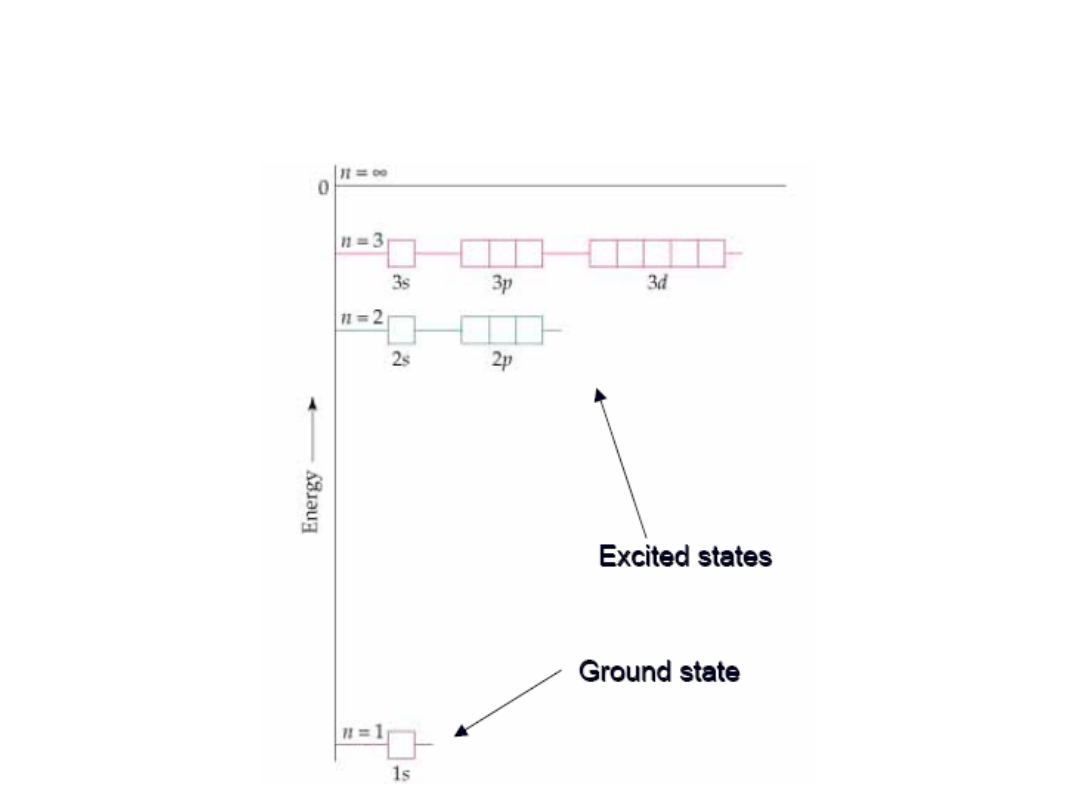
Widmo atomu wodoru

Funkcja falowa
• Informacje uzyskiwane ze
znajomości funkcji falowej: które z
informacji są ważne dla chemika i
dlaczego?
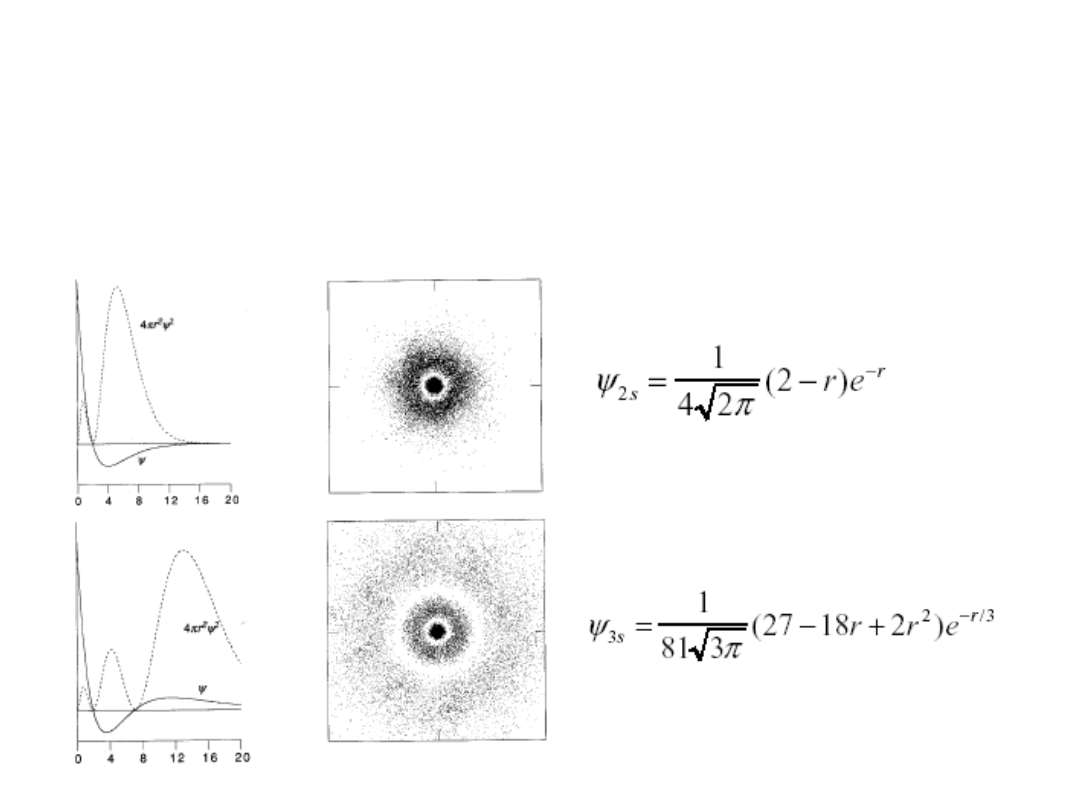
Orbitale s o wyższych
wartościach n
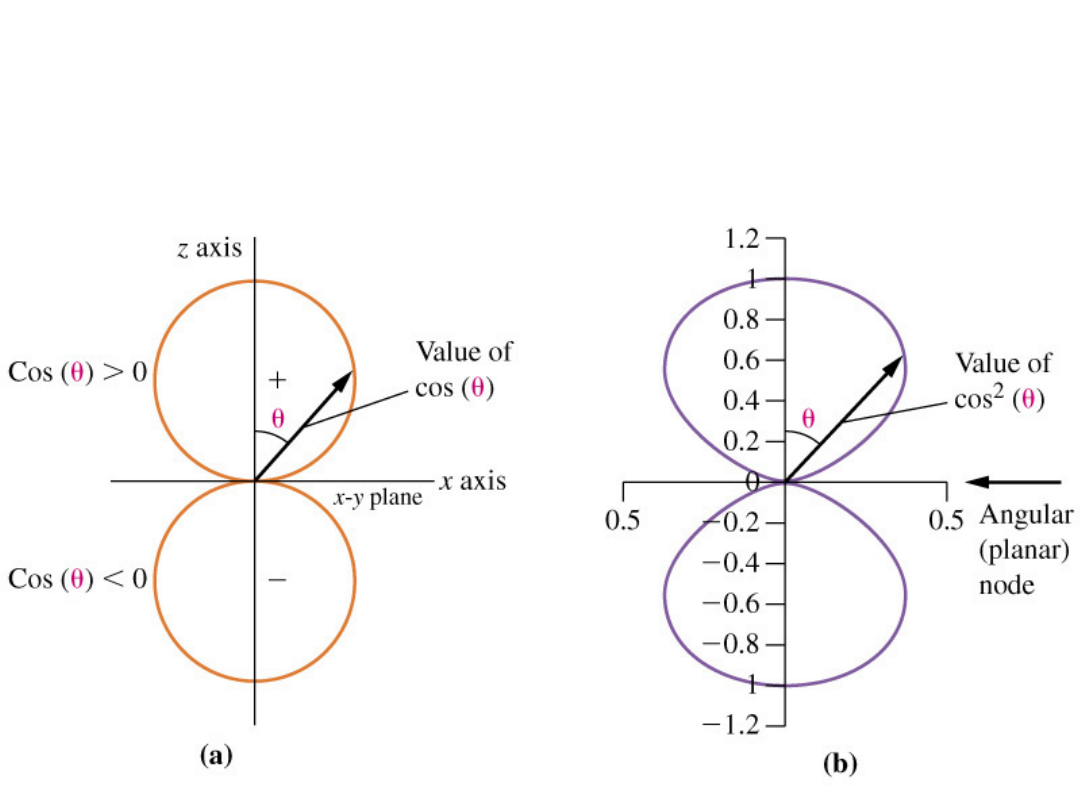
Funkcja falowa – część
kątowa
Orbitale p
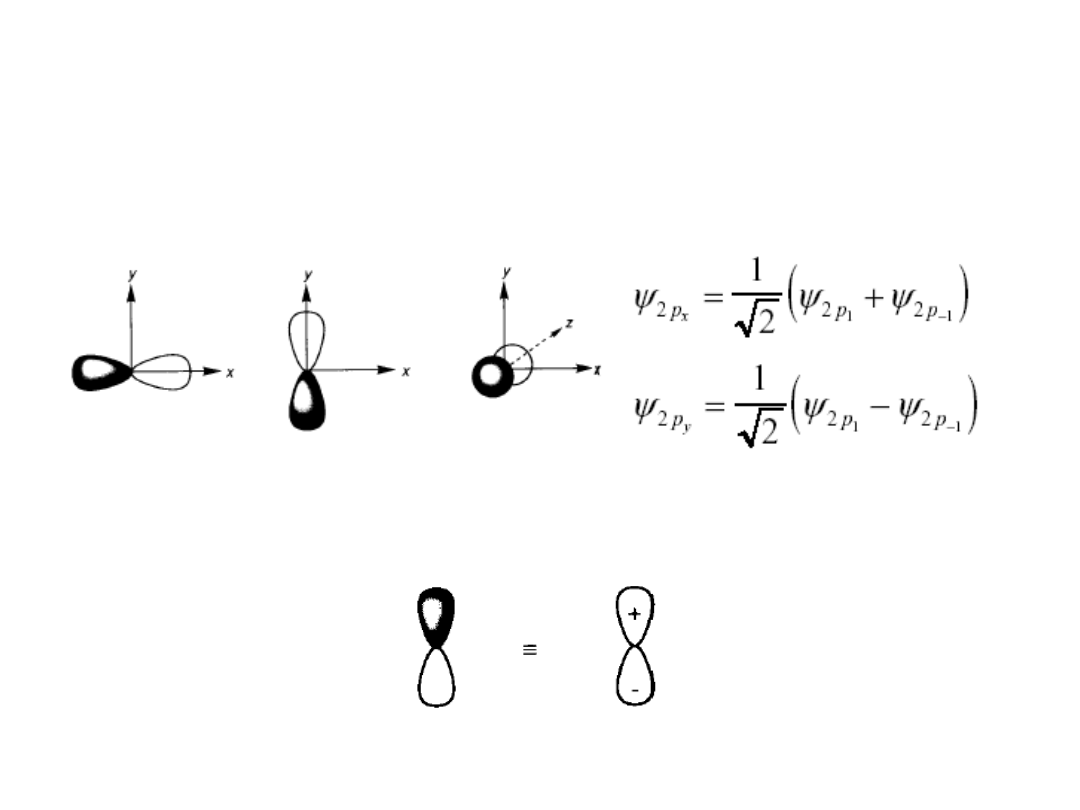
Orbitale p
Własności kierunkowe -
znak
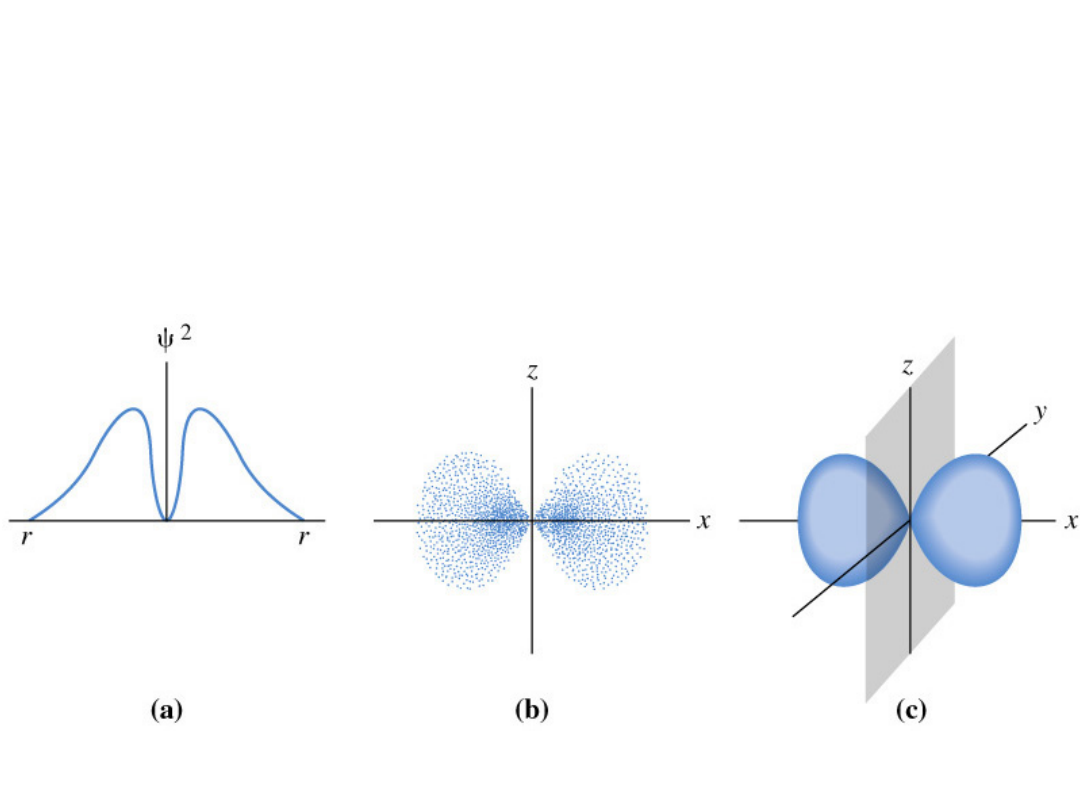
Orbitale p
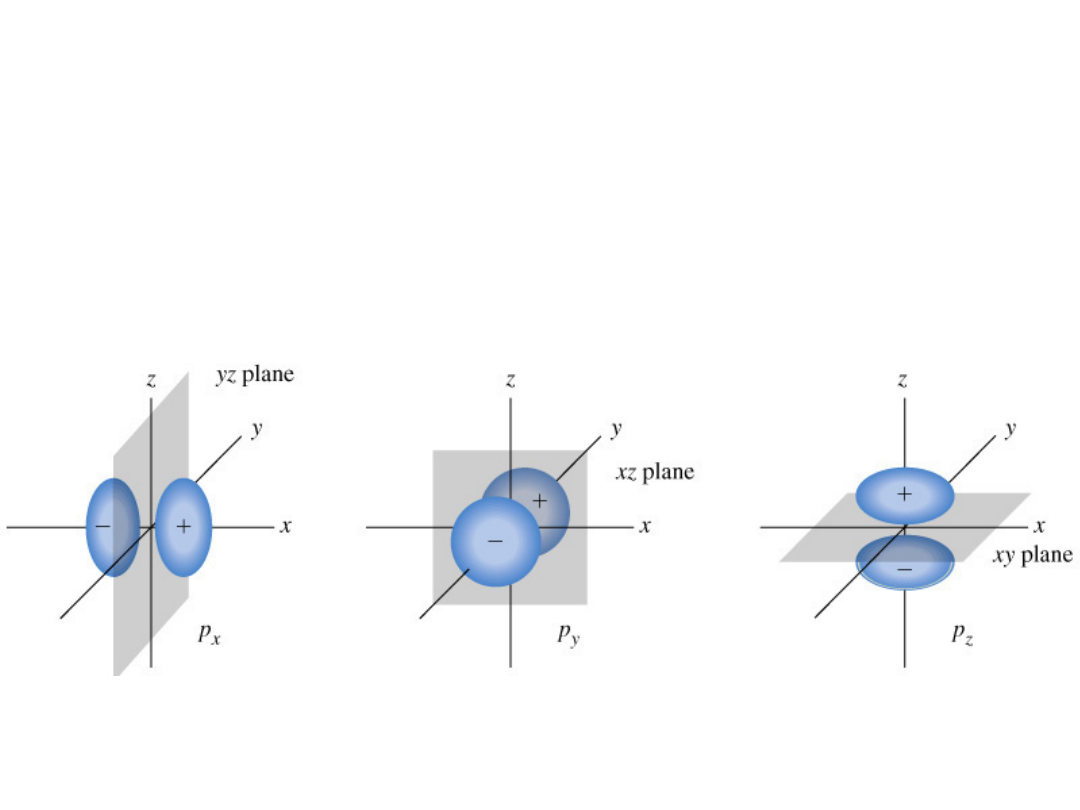
Orbitale p
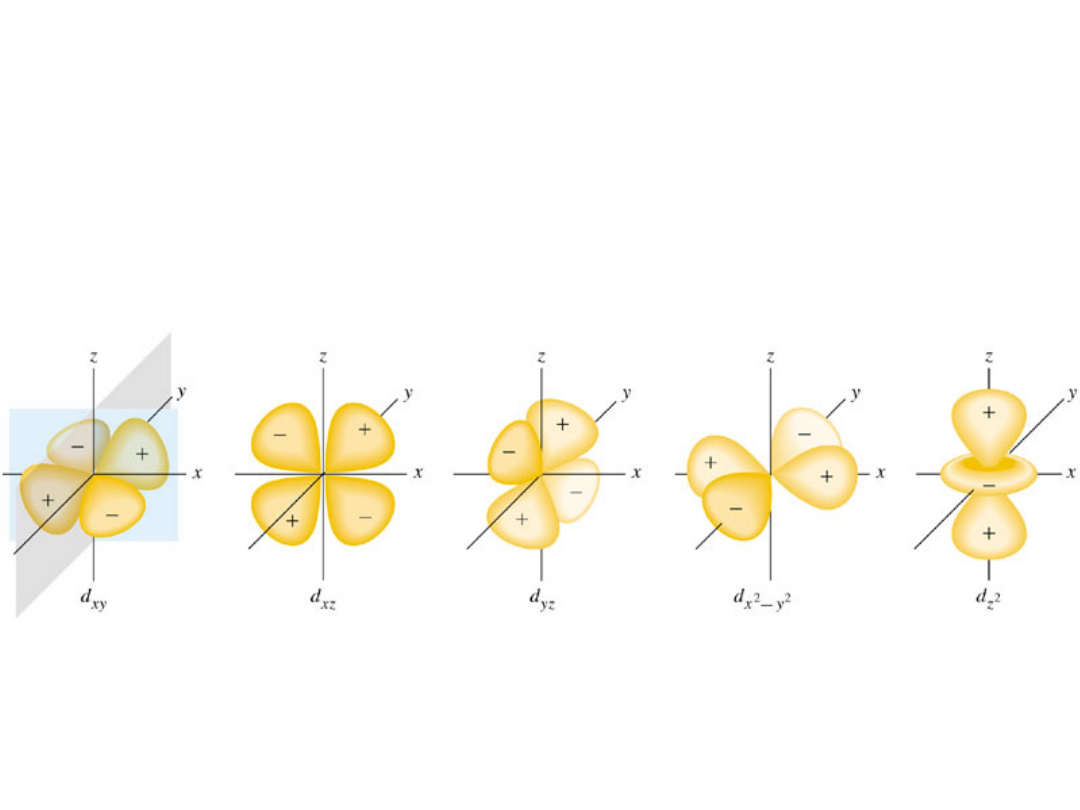
Orbitale d

orbitale F
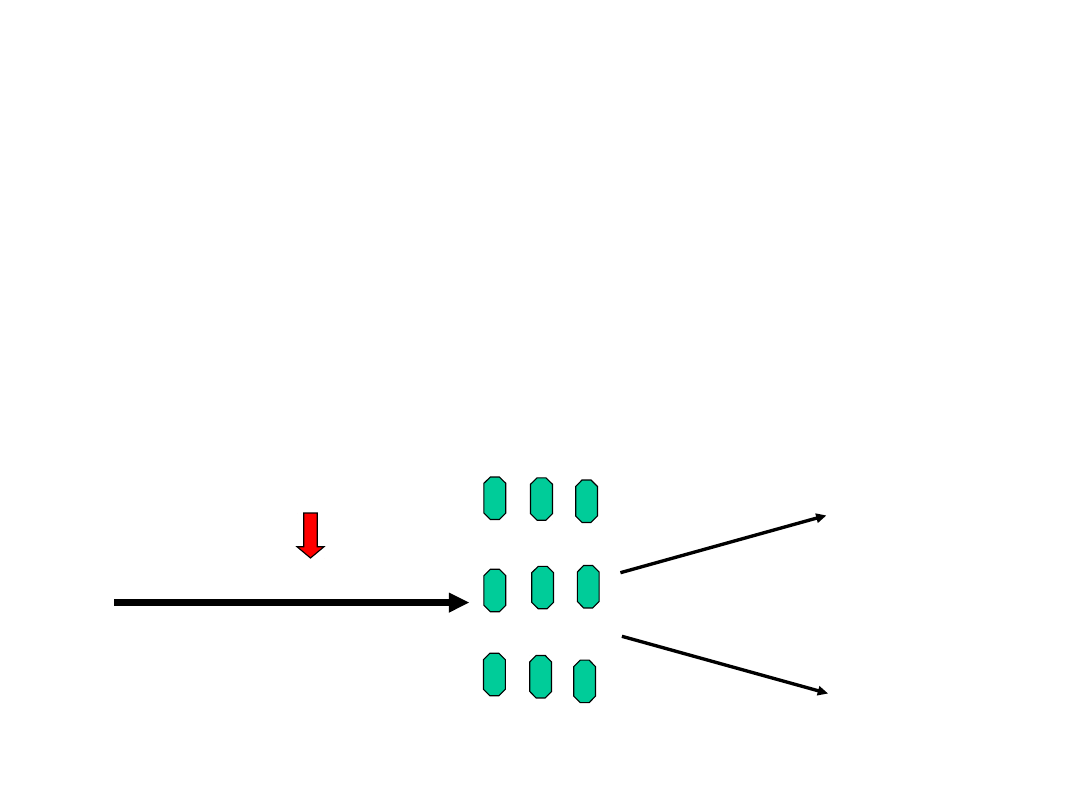
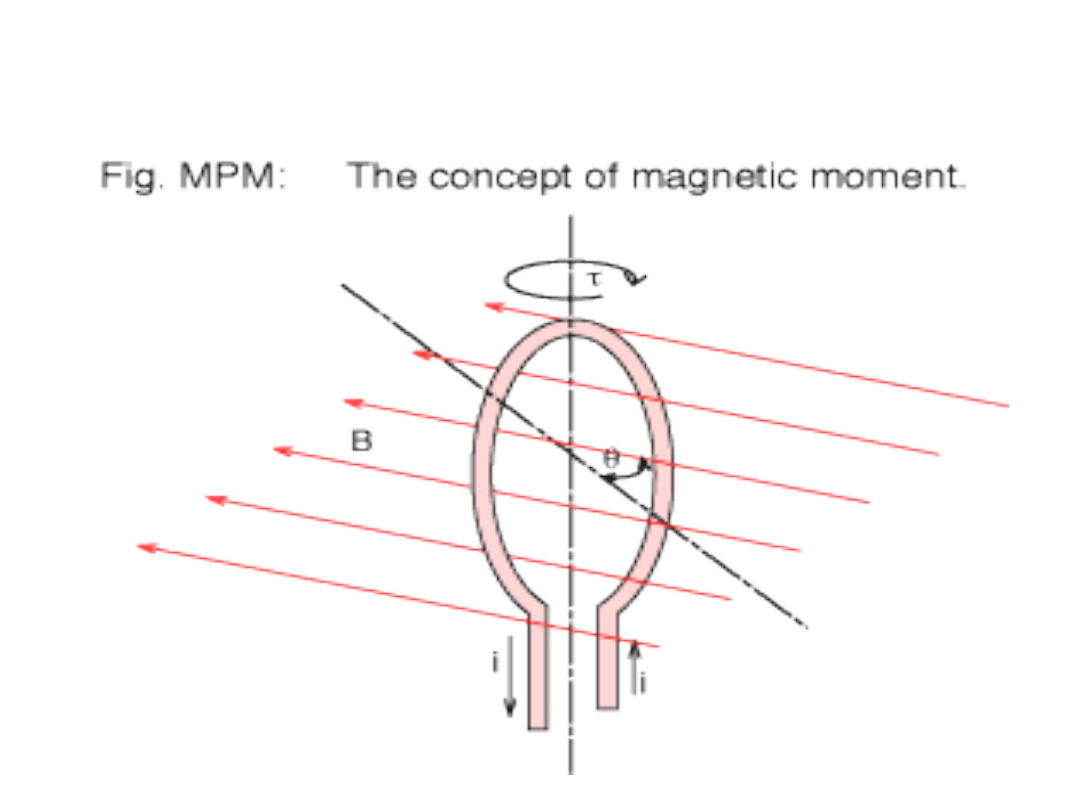
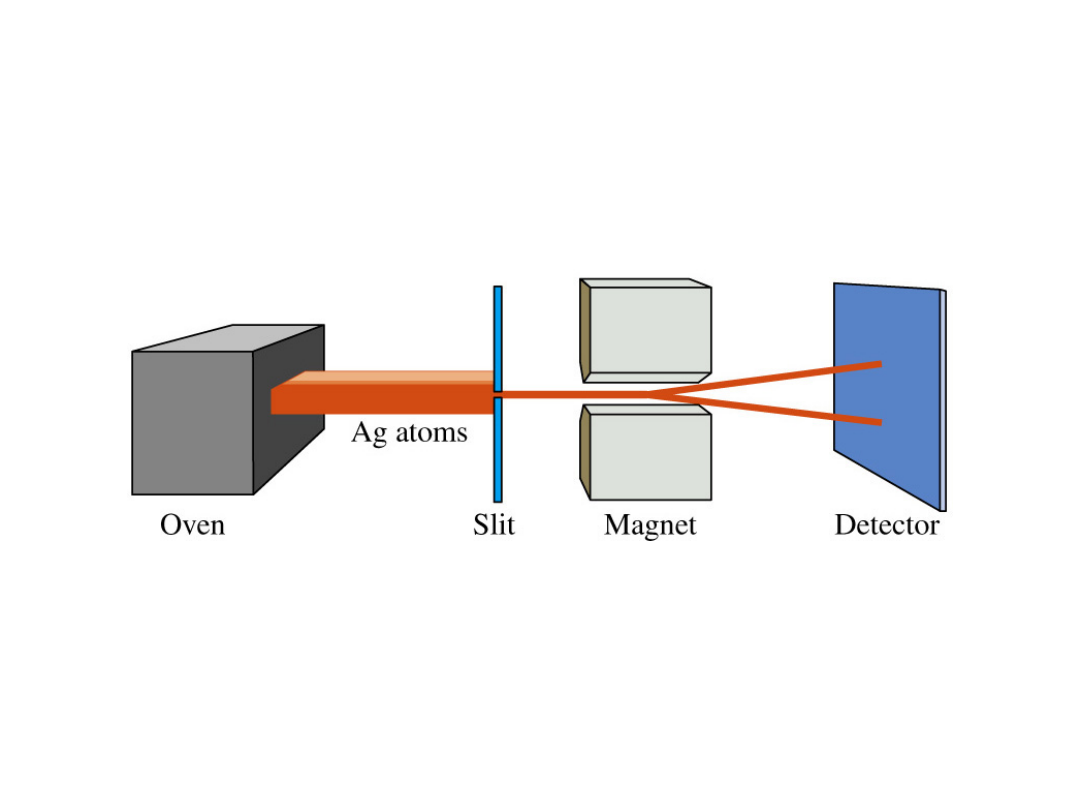
Eksperyment Sterna -
Gerlacha Atomy
wieloelektronowe
B
H, Na, K, Cd,
Th,
Cu, Ag, and Au
Strumień
atomów
Pole magnetyczne
Otrzymano
Dwie wiązki
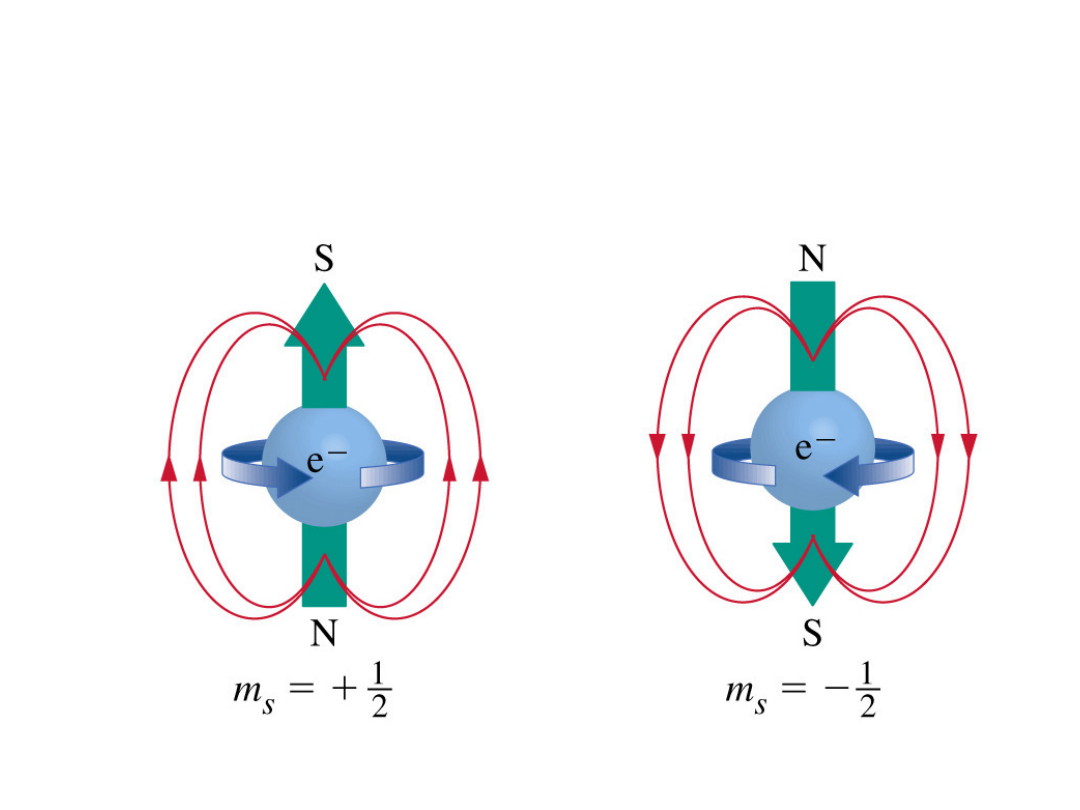
Spinowy moment pędu
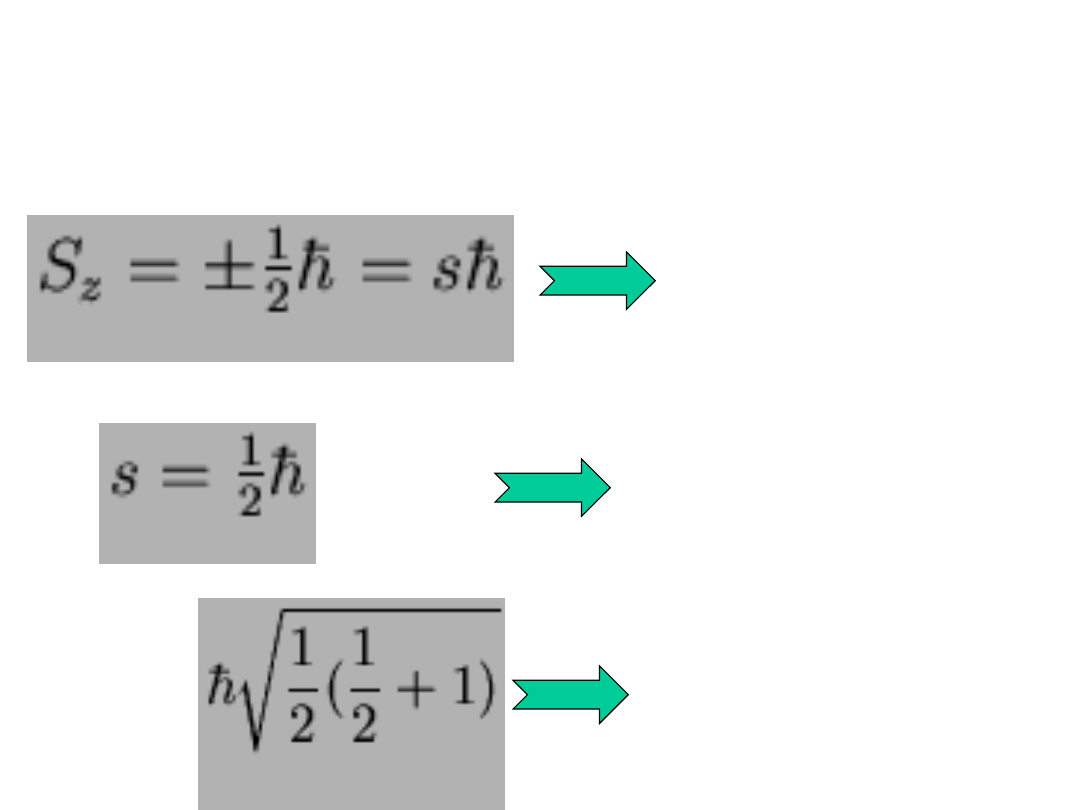
Spinowy moment pędu
•
Spinowy
moment
pędu
(skł.z)
•
Spinowa
liczba
kwantowa
•
Całkowity
spinowy
moment
pędu
S =
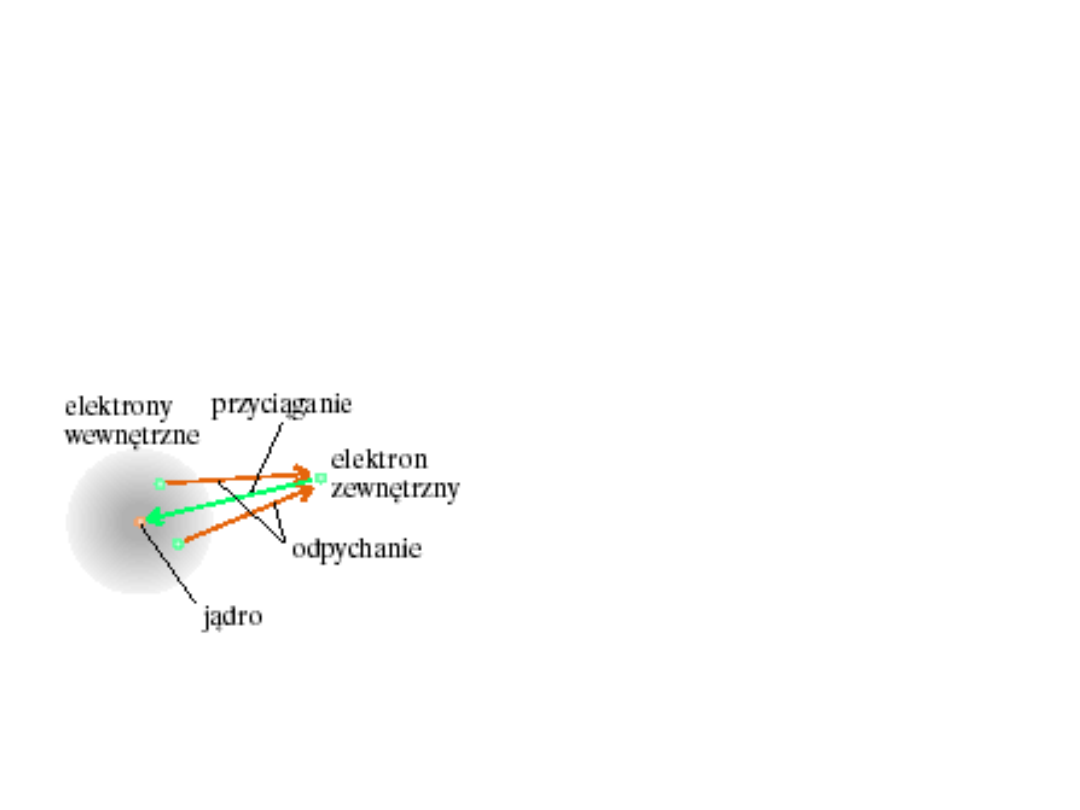
Atomy wieloelektronowe
• Na każdy elektron
działa siła
przyciągająca:
jądro – elektron
• Siły odpychające
pomiędzy
elektronami

Ładunek efektywny
• Każdy elektron jest ekranowany od sił
przyciągających jądra przez pozostałe
elektrony w atomie. Ekranowanie
zmniejsza działanie sił przyciągających
ponieważ pojawiają się siły
odpychające pomiędzy elektronami.
• Zasadnicze różnice pomiędzy
„orbitalami”
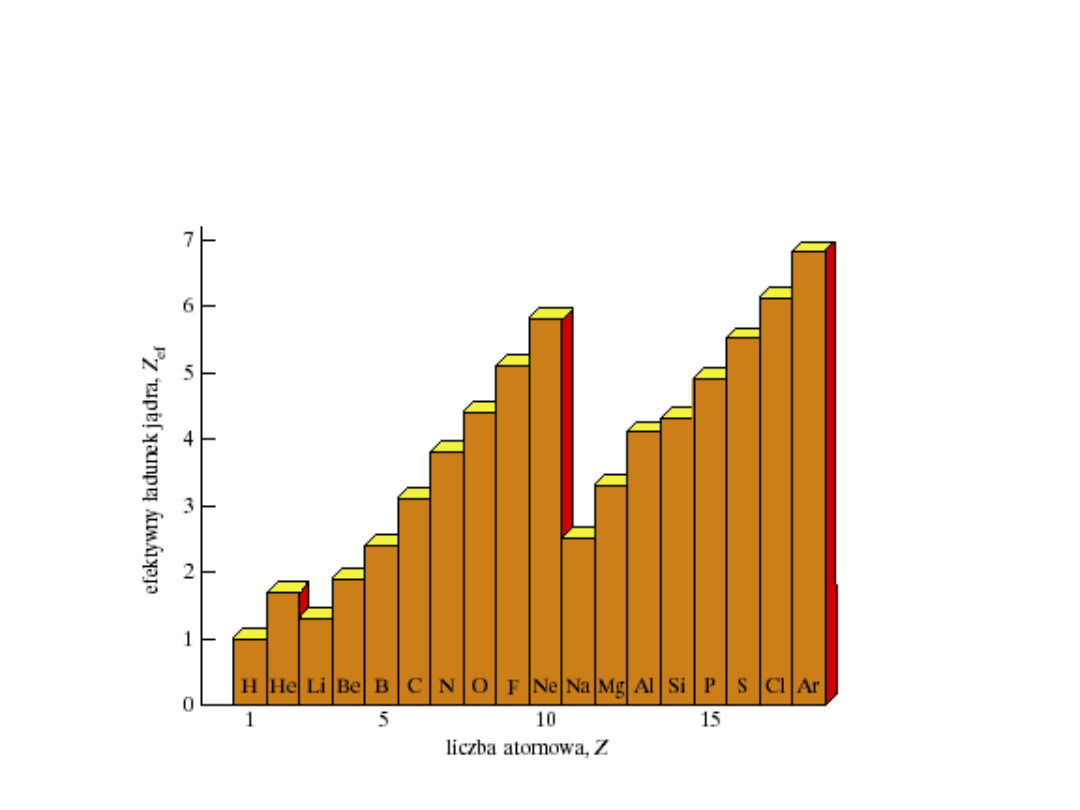
Efektywny ładunek jądra

W przypadku atomu
wieloelektronowego efekty
przenikania i ekranowania
elektronów powodują, że elektrony s
mają mniejszą energię niż elektrony
p tej samej powłoki. Energie orbitali
w tej samej powłoce wzrastają w
kolejności:
s p d f
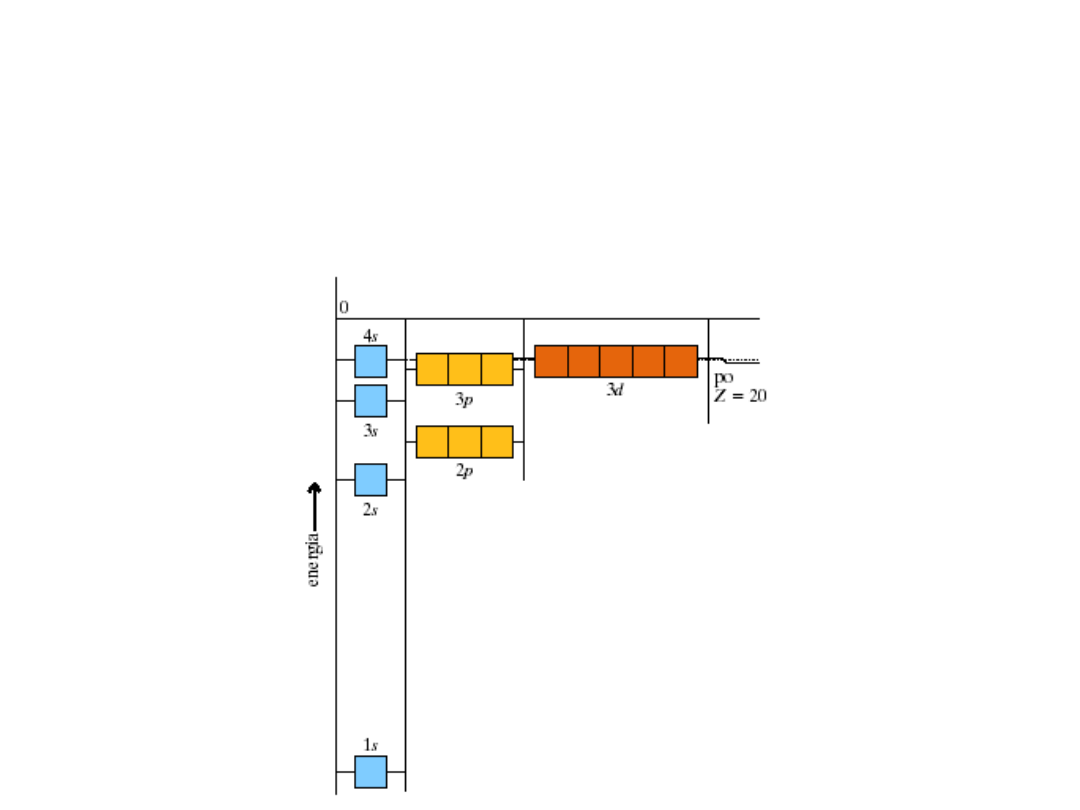
Względne energie orbitali
i podpowłok
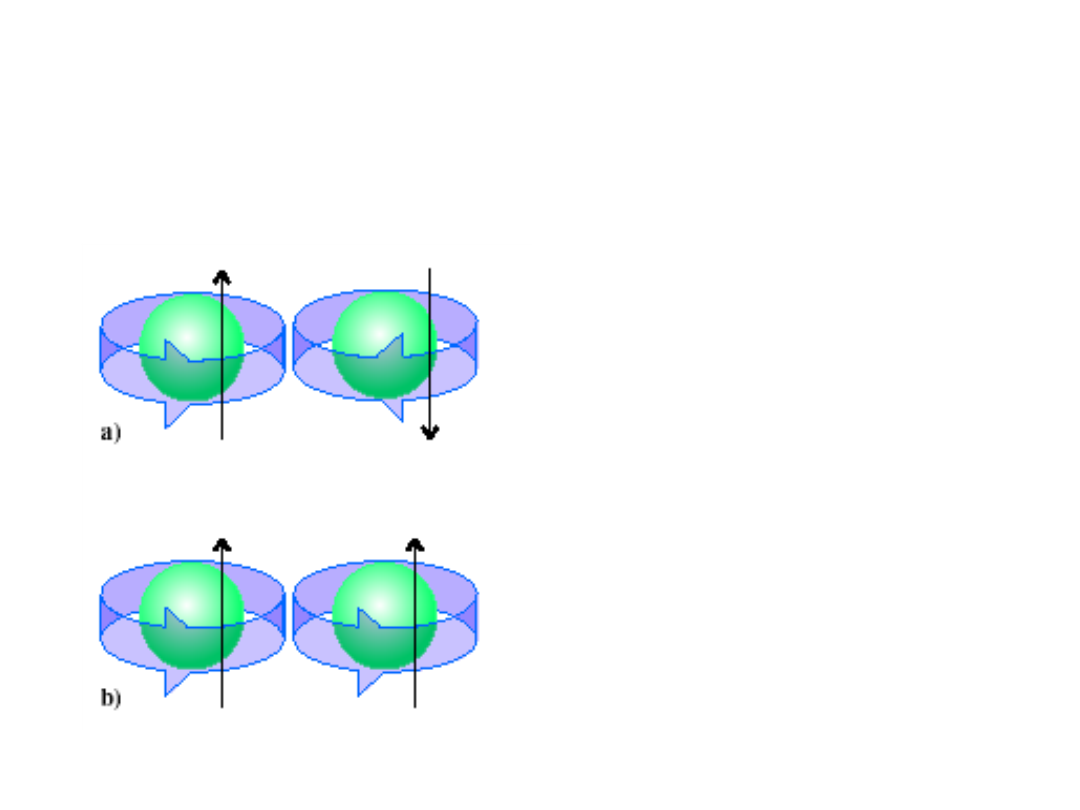
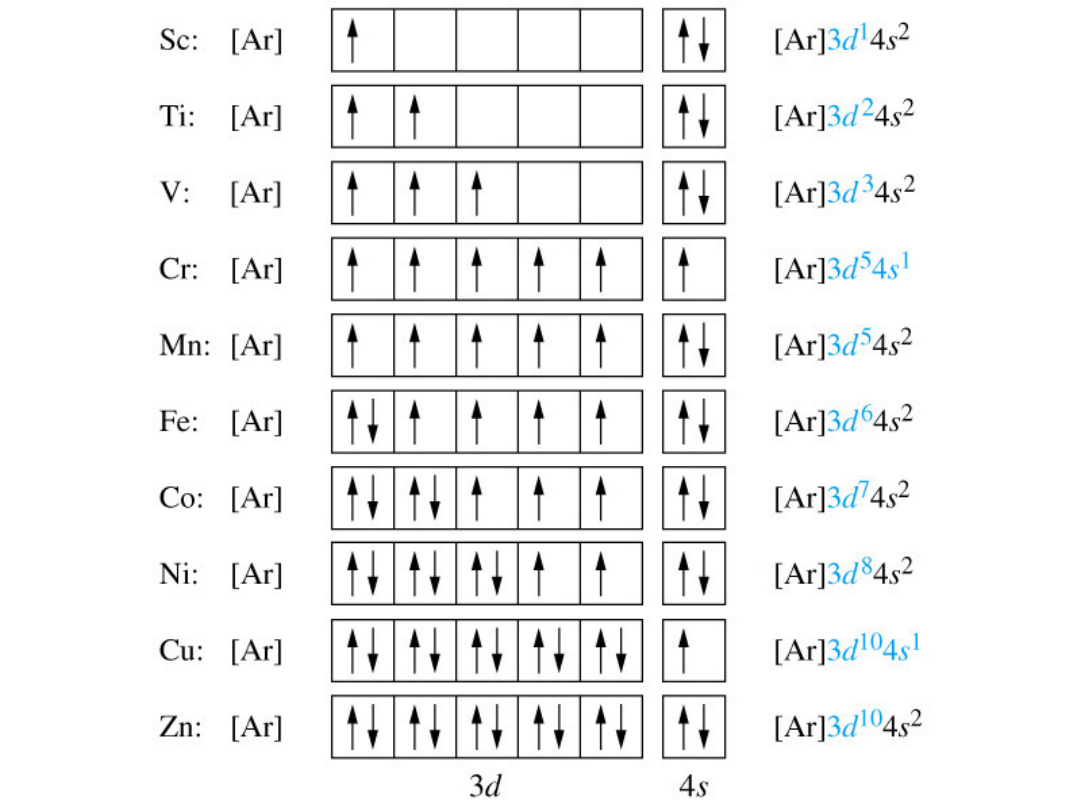
Zakaz Pauliego
• Dowolny orbital
może być
obsadzony przez
najwyżej dwa
elektrony.
• Gdy dwa elektrony
zajmują ten sam
orbital, ich spiny
muszą być
sparowane.
Spiny sparowane
Spiny równoległe
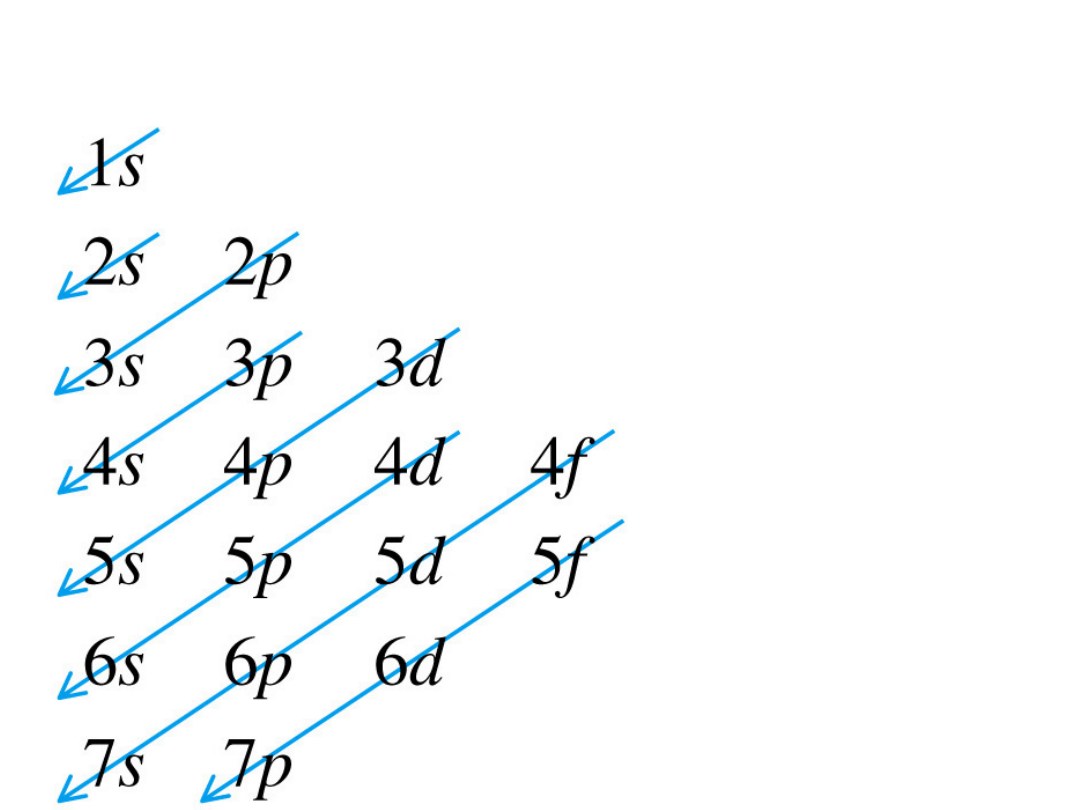
Kolejnoś
ć
zapełnia
nia
orbitali
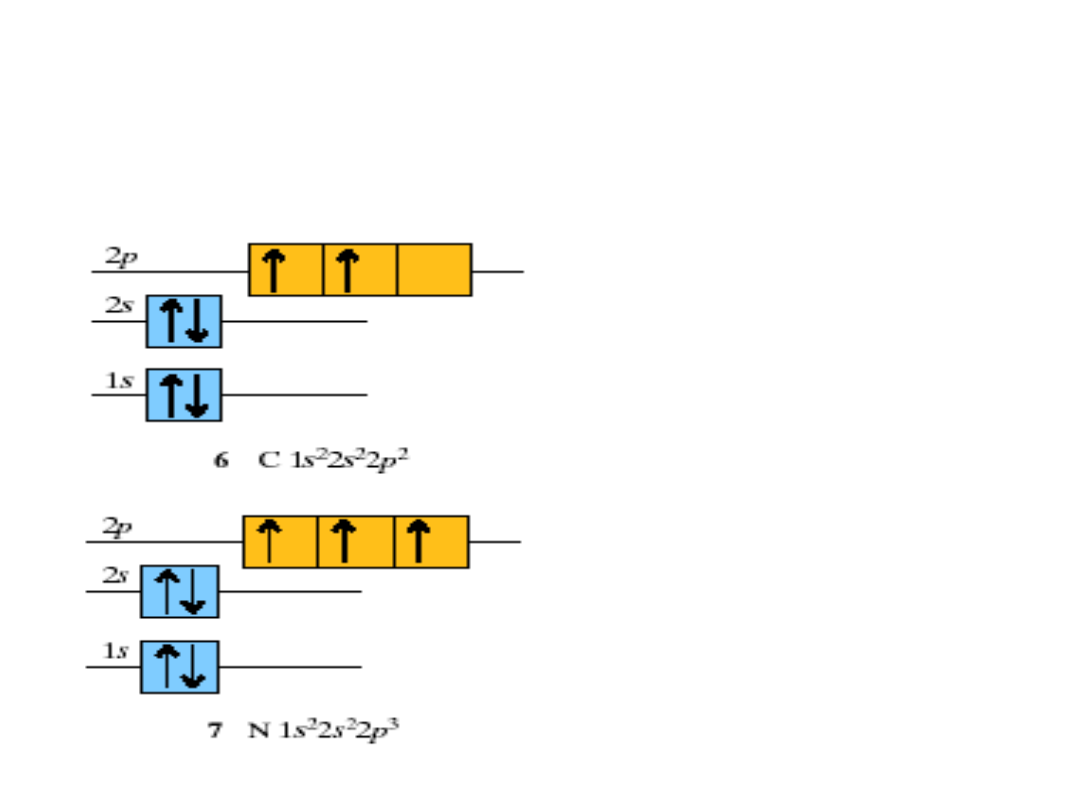
Reguła Hunda
• Elektrony
zapełniają
największą
dopuszczalną
liczbę orbitali

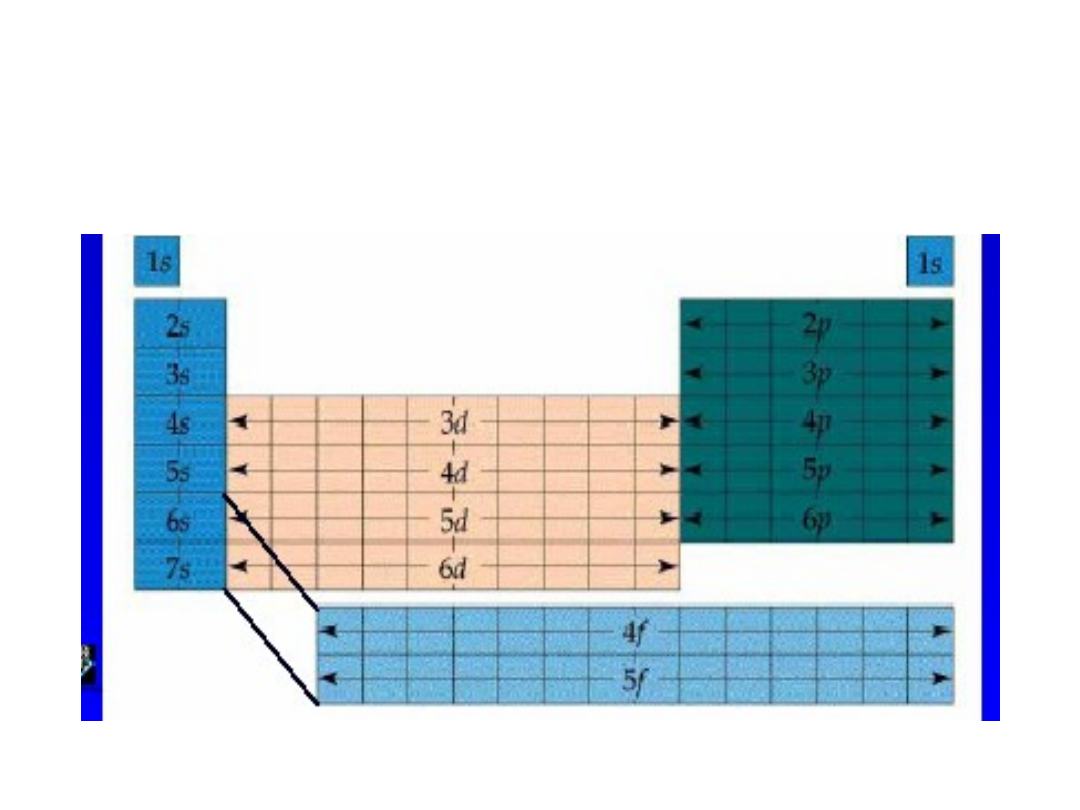
Układ okresowy
• Osobliwości:
Wodór i hel: porównanie
konfiguracji elektronowej i
własności pierwiastków
Powtarzające się
sekwencje elektronowe
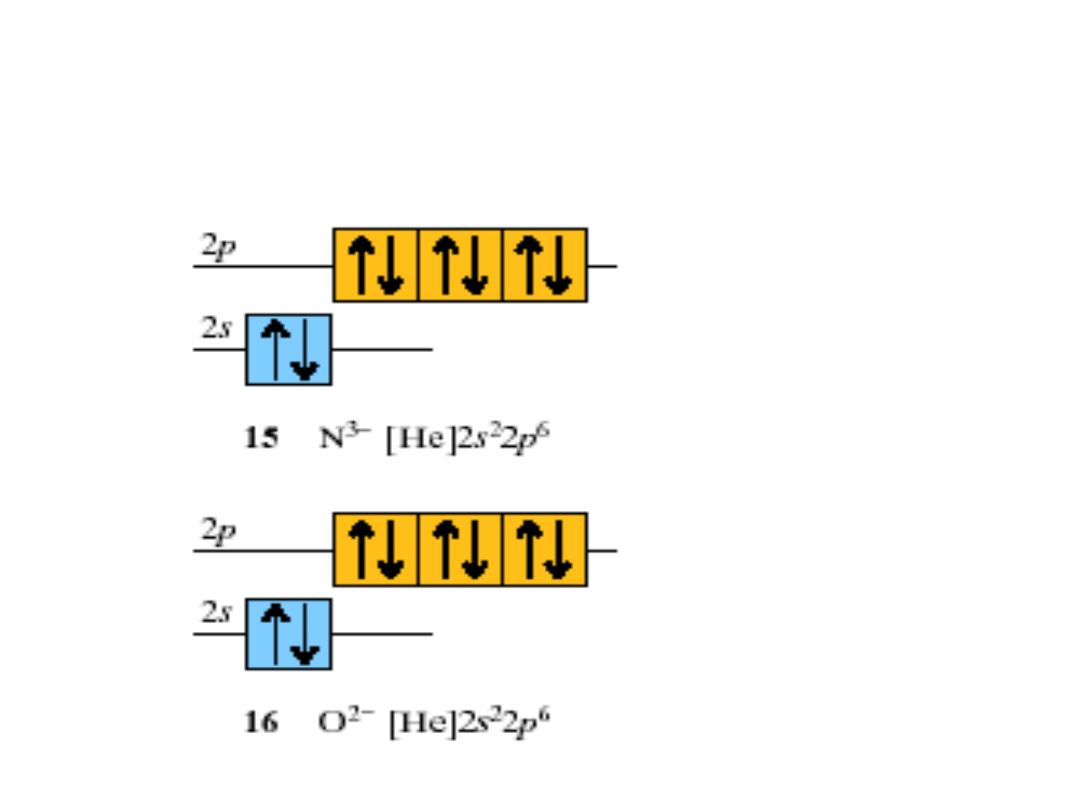
Konfiguracja anionu
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
Wyszukiwarka
Podobne podstrony:
Napęd Elektryczny wykład
wykład5
Psychologia wykład 1 Stres i radzenie sobie z nim zjazd B
Wykład 04
geriatria p pokarmowy wyklad materialy
ostre stany w alergologii wyklad 2003
WYKŁAD VII
Wykład 1, WPŁYW ŻYWIENIA NA ZDROWIE W RÓŻNYCH ETAPACH ŻYCIA CZŁOWIEKA
Zaburzenia nerwicowe wyklad
Szkol Wykład do Or
Strategie marketingowe prezentacje wykład
Wykład 6 2009 Użytkowanie obiektu
wyklad2
wyklad1 4
wyklad 5 PWSZ
więcej podobnych podstron