
Układy dyspersyjne -
roztwory
-Roztwory koloidalne
-Roztwory właściwe
-Sposoby wyrażania stężeń roztworów
-Przeliczanie stężeń
-Reguła mieszania roztworów

Układ
• Układ
– wyodrębniony obszar materii oddzielony od
otoczenia wyraźnymi graniami (
np. roztwór soli w
probówce
)
• Otoczenie
– wszystko to, co znajduje się poza układem
(
np. ścianki probówki i wszystko to, co znajduje się w
jej otoczeniu
)
• Faza układu
– jednorodna pod względem fizycznym
część układu oddzielona od reszty układu wyraźną
powierzchnią rozdziału (
np. woda w stanie ciekłym,
woda stanie stałym – lód, woda w stanie gazowym –
para wodna)
• Składnik układu
– substancja o określonych
właściwościach fizykochemicznych (
np. woda w
różnych stanach skupienia
)
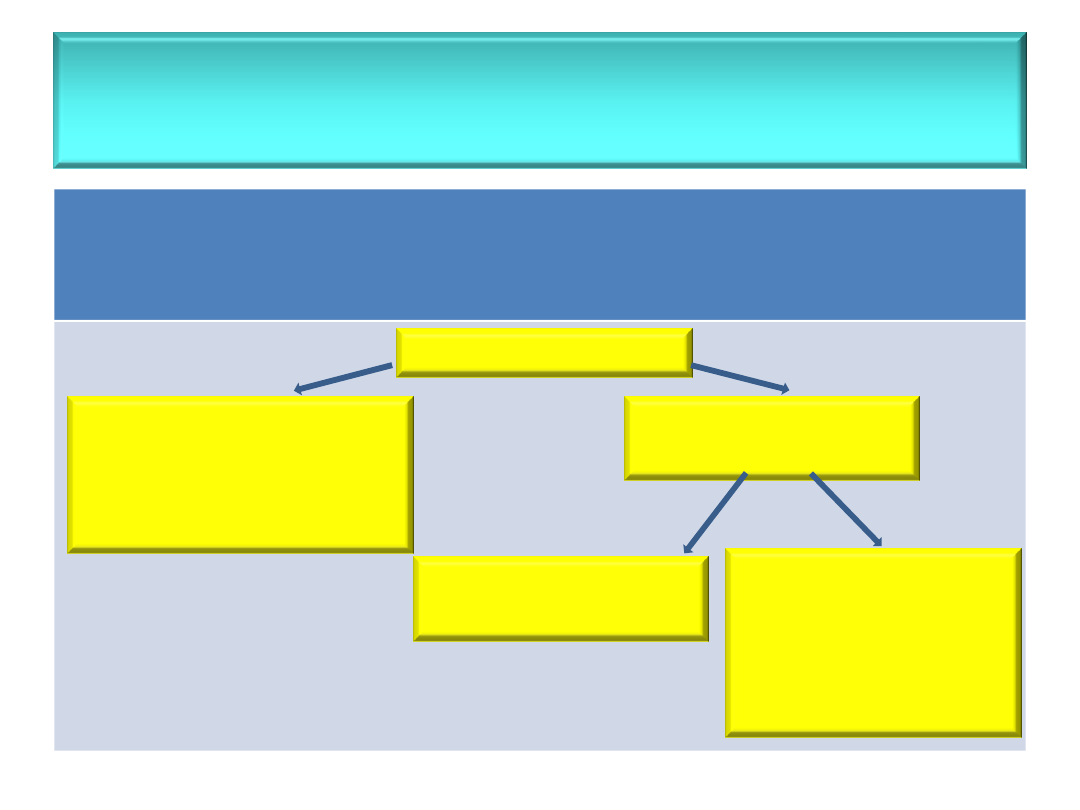
• Układ dyspersyjny
– układ składający się z fazy
zdyspergowanej
(
rozproszonej
- np. sacharoza) –
f
z
oraz fazy
dyspersyjnej
(
rozpraszającej
, np. woda) –
f
d
Układ dyspersyjny
Podział układów dyspersyjnych ze względu na
stan skupienia f
z
i f
d
Stan skup. f
z
f.
rozpraszana
Stan skup. f
d
f. rozpraszająca
Gaz
Ciecz
Ciało stałe
Gaz
Roztwory
gazowe
Aerozol,
mgła
Dym, kurz
Ciecz
Piana
Roztwory
właściwe,
emulsje
Roztwory
właściwe,
koloidy
Ciało stałe
Piana stała
Mokra
gąbka
Stopy metali
Układ dyspersyjny
Podział układów dyspersyjnych ze względu na stan
rozdrobnienia fazy zdyspergowanej (rozproszonej)
średnica (ᴓ) cząsteczek w nm (10
-9
m)
Układ
dyspersyjny
Układ
niejednorodny –
heterogeniczny
Zawiesiny
(rozdrobnienie
makroskopowe)
ᴓ ≥ 200nm
Roztwory
koloidalne
1nm ≤ ᴓ <
200nm
Układ jednorodny –
homogeniczny
–
roztwór właściwy
ᴓ < 1nm

Roztwory koloidalne
• Roztwór koloidalny – układ dyspersyjny, w którym
średnice cząsteczek fazy rozproszonej zawarte są w
granicach
1nm ≤ ᴓ < 200nm
Podział układów koloidalnych ze względu
na :
Rodzaj gazy
rozpraszającej
Powinowactwo do
rozpuszczalnika
Budowę fazy
rozproszonej
-
Hydrozole
(
woda
)
-
Alkozole
(
alkohol
)
-
Aerozole
(
powietrze
)
- Liofilowe
(
duże
powinowactwo
do
rozpuszczalnika,
łatwo
ulegają
solwatacji
- Liofobowe
(
małe
powinowactwo
do
rozpuszczalnika,
|
nie ulegają
solwatacji
-
Cząsteczkowe
(pojedyncze
makrocząsteczki
)
-
Fazowe
(bardzo
małe
kryształy)
-
Miceralne
(micela)
Charakterystyka roztworów
koloidalnych
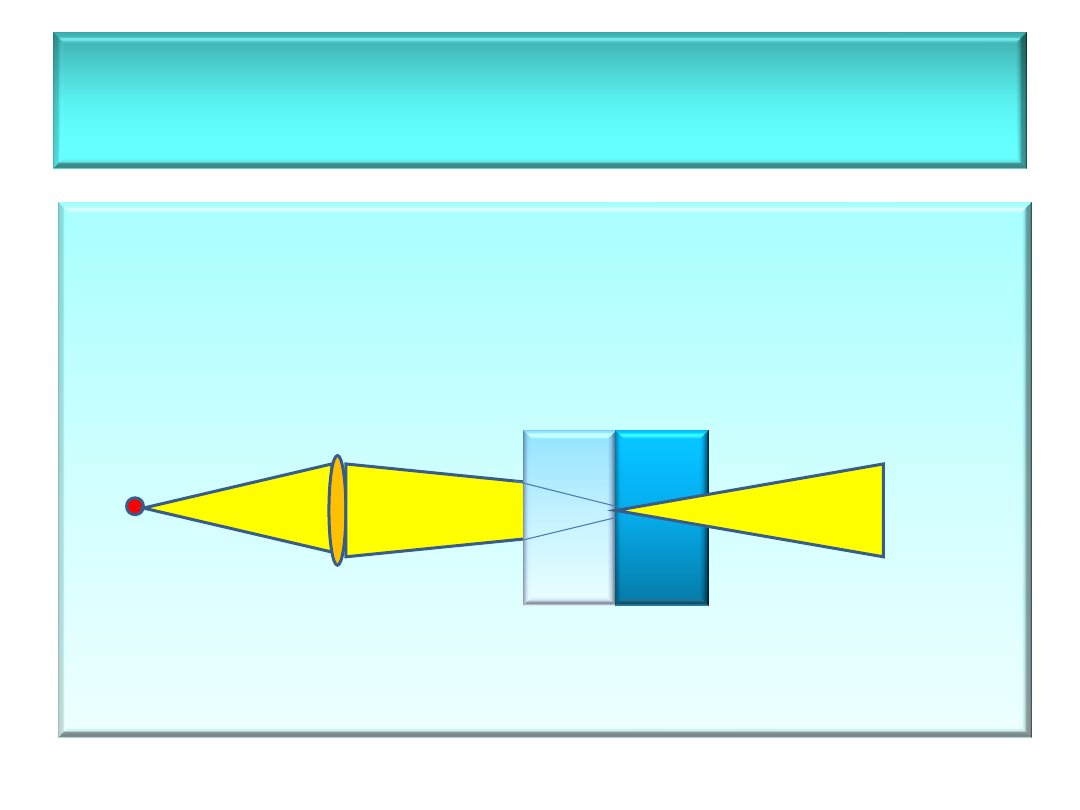
• Efekt Tyndalla
– rozproszenie światła na
cząsteczkach fazy rozproszonej (cząstki fazy
rozproszonej są większe o długości fali
świetlnej)
2 3
1
1 – źródło światła, 2 – roztwór rzeczywisty
(właściwy),
3 – roztwór koloidalny
Charakterystyka roztworów
koloidalnych
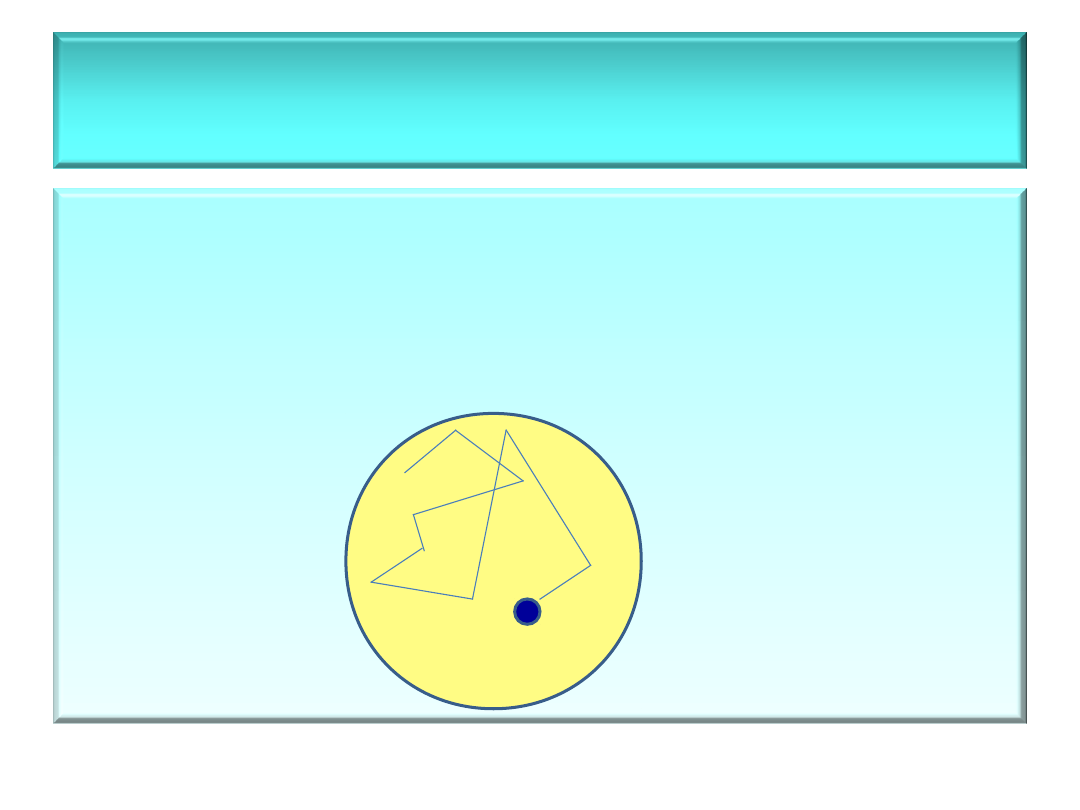
• Ruchy Browna
– cząstki fazy
rozproszonej
poruszają się w
roztworze po torach zygzakowatych
od
odbicia (zderzenia) do odbicia
(zderzenia) z innymi cząstkami

Charakterystyka roztworów
koloidalnych
• Koagulacja
– zjawisko łączenia się
cząstek fazy rozproszonej koloidu w
większe zespoły tworzące
nieregularną sieć – koagulat
• Peptyzacja
– zjawisko odwrotne do
koagulacji
KOAGULACJA
(
koloid
)
ZOL
ŻEL
(
koagulat
)
PEPTYZACJA
• Denaturacja
– nieodwracalny proces
przechodzenia zolu w żel

Charakterystyka roztworów
koloidalnych
Czynniki powodujące proces koagulacji i
denaturacji koloidu
Koagulacja koloidu
Denaturacja koloidu
•
Dodanie niektórych
elektrolitów
•
Dodanie
nieelektrolitów
•
zmiana temperatury
(obniżenie
lub podwyższenie)
•
Działanie czynnikami
mechanicznymi
•
Przepływ prądu
elektrycznego
•
Działanie świtała
•
inne
•
Dodanie:
- stężonych roztworów
kwasów
lub zasad
- roztworów soli metali
ciężkich
- niektórych związków
organicznych
(alkoholu,
aldehydu)
•
Wysokie zmiany
temperatury
Charakterystyka roztworów
koloidalnych
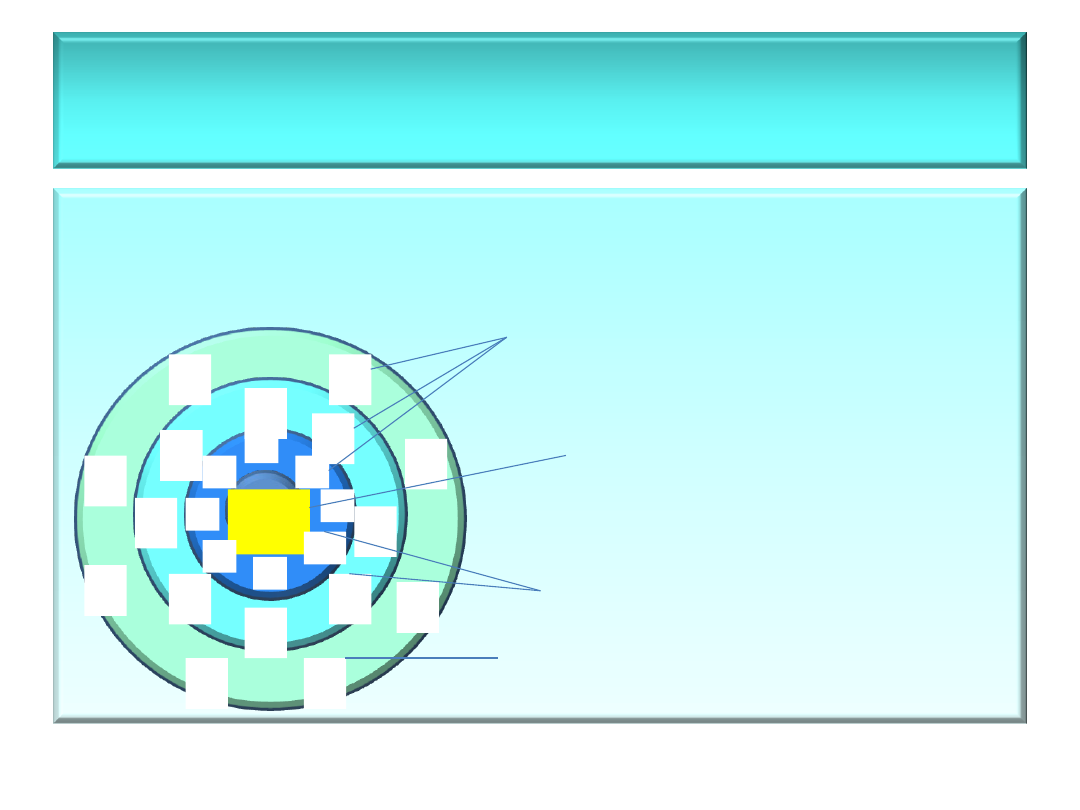
• Budowa miceli
– naładowana
cząstka dowolnego koloidu
[schemat miceli (AgI)n]
K
warstwy jonów
jądro miceli
warstwa
adsorpcyjna
warstwa dyfuzyjna
(rozmyta)
K
+
K
+
K
+
K
+
K
+
K
+
K
+
K
+
K
+
K
+
K
+
K
+
K
+
K
+
K
+
K
+
(AgI)
n
I
-
I
-
I
-
I
-
I
-
I
-
I
-
I
-

Roztwory właściwe
• Roztwór właściwy
–
jednorodna
(homogeniczna) mieszanina dwóch
lub
więcej
składników
, składnik występujący
w
nadmiarze nazywa się rozpuszczalnikiem
a
pozostałe
składniki substancjami
rozpuszczonymi
(
w zależności od stanu
skupienia wyróżnia się roztwory: gazowe,
ciekłe, stałe
)
• Mieszanina
– układ złożony z co najmniej
dwóch substancji
w dowolnym stosunku
• Rozpuszczanie
– proces mieszania prowadzący
do powstania roztworu
• Rozpuszczalność
–
maksymalna liczba gramów
substancji
,
która rozpuszcza się w określonych
warunkach temp.
i ciśnienia w
100g rozpuszczalnika
dając
roztwór nasycony
Roztwory właściwe
• Podział roztworów ze względu na
zawartość substancji
rozpuszczonej
c – stężenie roztworu
c
max
– stężenie roztworu wynikające z
rozpuszczalności
Roztwory
Roztwór
nienasycony
c < c
max
Roztwór
nasycony
c = c
max
Roztwór
przesycony
c > c
max

Efekty towarzyszące
procesom rozpuszczania
• Solwatacja
– proces otaczania jonów lub cząsteczek
przez cząsteczki rozpuszczalnika (
jeżeli
rozpuszczalnikiem jest woda – uwodnienie –
hydratacja
)
• Efekty energetyczne
–
proces endoenergetyczny z
pobieraniem energii cieplnej z otoczenia
,
proces
egzoenergetyczny z oddaniem energii cieplnej do
otoczenia
•
Efekt ebulioskopowy
– temp. wrzenia roztworu jest
wyższa niż temp. wrzenia rozpuszczalnika
• Efekt krioskopowy
– temp. krzepnięcia roztworu jest
niższa niż temp. krzepnięcia rozpuszczalnika
• Kontrakcja
– zmniejszenie objętości układu po
połączeniu dwóch różnych cieczy (np. woda + etanol)
• Dyfuzja
– proces prowadzący do wyrównania stężenia
w całej objętości roztworu
• Dysocjacja
– rozpad cząsteczek substancji rozpuszczaj
na jony pod wpływem polarnego rozpuszczalnika

Sposoby wyrażania stężeń
roztworów
• Stężenie procentowe [%]:
C
p
(C
%
) -
procent masowy (wagowy)
substancji rozpuszczonej
w roztworze (w 100g roztworu)
• m
s
– masa substancji rozpuszczonej
[g]
• m
r
– masa roztworu [g]
• m
rozp
– masa rozpuszczalnika [g]
• m
r
= m
s
+ m
rozp
%
100
p
s
p
m
m
c

Sposoby wyrażania stężeń
roztworów
• Stężenie molowe [mol/dm
3
] = [mol
.
dm
-3
]
:
C
m
– liczba moli substancji rozpuszczonej
(zawartej)
w 1dm
3
roztworu
- n – liczba moli substancji rozpuszczonej
- V
r
– objętość roztworu w dm
3
ms - masa sub. rozp.
m
r
- masa roztw.
M – masa molowa sub. rozp.
dr – gęstość roztw.
r
m
V
n
C
M
m
n
s
r
r
r
d
m
V

Przeliczanie stężeń
roztworów
Przeliczenie z C
p
na
C
m
Przeliczenie z C
m
na C
p
C
m
– stężenie molowe roztworu [mol/dm
3
]
C
p
– stężenie procentowe roztworu [%]
d
r
– gęstość roztworu w g/dm
3
(
gęstość należy
przeliczyć
z g/cm
3
mnożąc ją przez 1000, np. d =
1,2g/cm
3
= 1200g/dm
3
)
M – masa molowa [mol/dm
3
]
M
d
C
C
r
p
m
%
100
r
m
p
d
M
C
C
%
100

Reguła mieszania
roztworów – metoda
krzyżowa
• Uwagi
:
-
rozcieńczając roztwór wodą
, należy przyjąć, że jest
to
roztwór 0%
-
zatężając roztwór solą bezwodną
, należy przyjąć, że
jest to
roztwór
100%
-
zatężając roztwór hydratem
(solą uwodnioną),
należy przyjąć, że jest
to
roztwór wodny o określonym stężeniu
: np.
CuSO
4
.
5H
2
O
m
r
= M =
64g/mol + 32g/mol + 4
.
16g/mol
+
5
.
18g/mol =
160g/mol
+
90g/mol =
250g
/mol
m
s
= 160g
%
64
%
100
250
160
%
100
g
g
m
m
C
r
s
p

Reguła mieszania roztworów –
metoda krzyżowa
(C
p
)
• Obliczanie stężenia procentowego
po
wymieszaniu roztworu o masie
m
r1
i
stężeniu
C
p1
z roztworem o masie
m
r2
i
stężeniu
C
p2
(
C
p1
>
C
px
> C
p2
)
m
r1
C
p1
C
p1
–
C
px
m
r2
C
px
m
r2
C
p2
C
px
–
C
p2
m
r1
Z proporcji:
(C
p1
– C
px
) . m
r1
= (C
px
– C
p2
)
.
m
r2

Reguła mieszania roztworów –
metoda krzyżowa
(C
m
)
• Obliczanie stężenia molowego
po
wymieszaniu roztworu o objętości
V
r1
i
stężeniu
C
m1
z roztworem o objętości
V
r2
i stężeniu
C
m2
(
C
m1
>
C
mx
> C
m2
)
V
r1
C
m1
C
m1
–
C
mx
m
r2
C
px
V
r2
C
m2
C
mx
–
C
m2
m
r1
Z proporcji:
(C
m1
– C
mx
) . V
r1
= (C
mx
– C
m2
)
.
V
r2
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
Wyszukiwarka
Podobne podstrony:
Cwiczenie nr 04 Uklady dyspersy Nieznany
APD 5 układy bramkowe
Układy Napędowe oraz algorytmy sterowania w bioprotezach
Układy wodiociągowe ze zb przepł końcowym i hydroforem
15 Uklady PLL i t s
W3B Układy fazowe
UKŁADY ENERGOELEKTRONICZNE W GRZEJNICTWIE 5F SZER
Uklady kombinacyjne
12 Podstawy automatyki Układy sterowania logicznego
Inf przestrz wekt uklady rown
5 Układy kogeneracyjne
więcej podobnych podstron