
WODY
POWIERZCHNIOWE
•
Konspekt
1.
obiekty
hydrograficzne
2.
czynniki kształtujące
skład wody
3.
skład wód
powierzchniowych
4.
metody oznaczania
cech fizycznych wody
5.
metody oznaczania
własności
chemicznych wody
Wody powierzchniowe -
wody występujące na
powierzchni ziemi, łatwe do
bezpośredniego ujęcia
(czerpania).
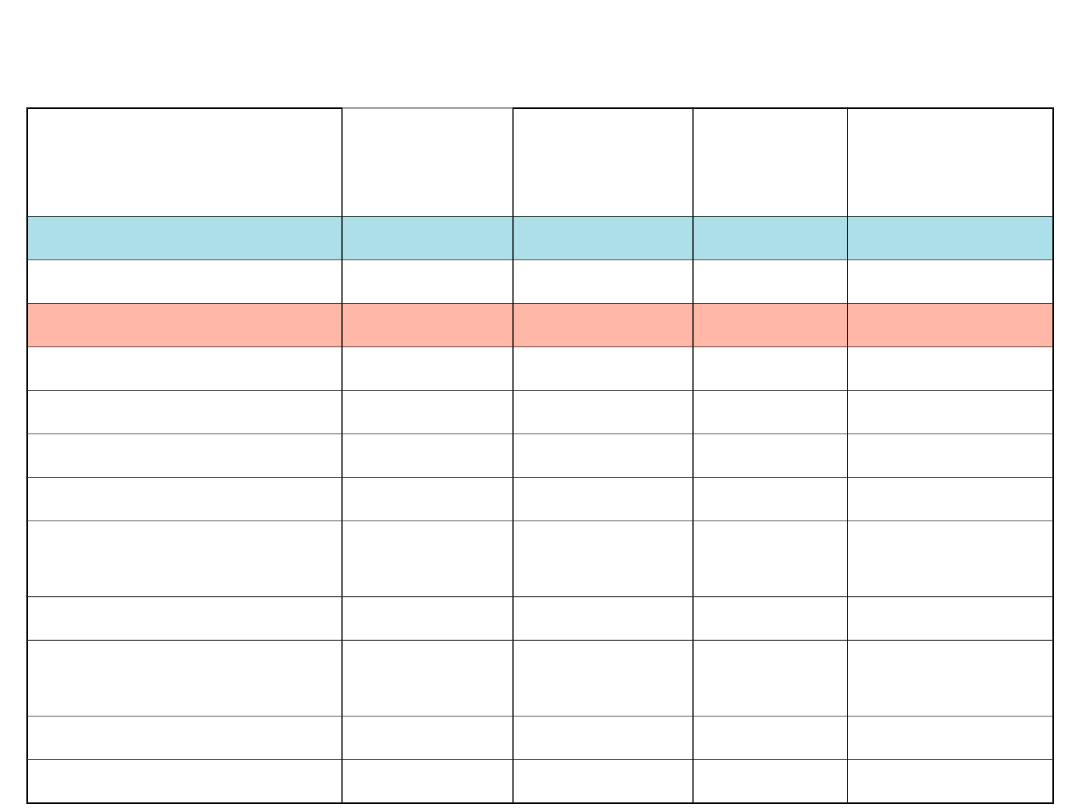
Objętość
w tys. km
3
% całości
wody
słodkiej
Strumień
w tys.
km
3
/rok
czas obiegu
w latach
Woda słona
Oceany
1 350 000
425
3 000
Woda słodka
Lód
27 800
69
2.4
12 000
Wody podziemne
8 000
30
15
500
Jeziora
220
0.5
Wilgoć glebowa
70
0.2
90
0.8
Atmosfera
15 0.038
496
0.03
Zbiorniki wodne
5 0.013
Rzeki
2 0.005
40
0.05
Biomasa
2 0.005
RAZEM
40 114
Hydrosfera

punktowe obiekty hydrograficzne
kryterium podziału - sposób wypływu wody
(Thieneman 1926)
Źródłem nazywamy wypływ wód podziemnych, lub inaczej
miejsce w którym wody podziemne wydostają się na
powierzchnię.
reokreny - woda wypływa na powierzchnię
bezpośrednio po stoku, dając najczęściej
początek potokowi
limnokreny - woda wypływa na powierzchnię
bezpośrednio do zbiornika, którego misa
może być niewielka (poj. kilku litrów) lub
mieć wielkość kilku ha
helokreny - woda wysięka bezpośrednio pod
warstwą gleby tworząc rozległe tereny
podmokłe, zwane inaczej młakami

cieki naturalne :
strumyk
potok
rzeka
bieg górny
bieg
środkowy
bieg dolny
delta
estuarium
Zlewnia
- jest to całość obszaru, z którego
wody spływają do danej rzeki (jeziora, bagna
itp.) lub jej fragmentu.
Zlewnia dotyczy zarówno wód
powierzchniowych, jak i podziemnych.
Częścią zlewni może być dorzecze danej rzeki.
Dorzecze
- obszar, z którego wody powierzchniowe
spływają do jednej rzeki, zwanej rzeką główną.
Rzeki wpadające do rzeki głównej noszą nazwę
dopływów
1 rzędu.
Granicą dorzecza jest
dział wodny
.
liniowe obiekty hydrograficzne

W Polsce wyznaczono obszary dorzeczy:
Odry obejmujące również dorzecza rzek Przymorza
na zachód od ujścia Słupi, a także wpadających do
Zalewu Szczecińskiego,
Wisły obejmujące również dorzecza rzek Przymorza
na wschód od ujścia Słupi, a także wpadających do
Zalewu Wiślanego
obszary dorzeczy obejmujące znajdujące się na
terytorium Rzeczypospolitej Polskiej części
międzynarodowych dorzeczy: Dniestru, Dunaju,
Jarft, Łaby, Niemna, Pregoły, Świeżej, Ücker.
Osiągnięciu dobrego stanu ekologicznego wód na
terenie całej Unii Europejskiej do roku 2015 będą
służyły programy działań zawarte w planach
gospodarowania wodami na obszarach dorzeczy, które
zostaną opracowane do roku 2009.
obszarowe obiekty hydrograficzne
małe zbiorniki wodne
(staw, sadzawka, basen,
wyrobisko, zapadlisko)
jeziora

czynniki kształtujące skład
wody
1. budowa geologiczna zlewni
2. zdolność sorpcyjna kompleksu glebowego
3. topografia zlewni i jej zagospodarowanie
4. procesy wietrzenia skał
5. procesy fizyczne
6. procesy chemiczne
7. powierzchnia wody
8. głębokość zbiorników
9. stopień regulacji rzek
10. prędkość przepływu

wskaźniki:
•fizyczne
•chemiczne
•biologiczne
domieszki
•
zawieszone
• koloidalne
•
rozpuszczon
e
ROZPORZĄDZENIE MINISTRA ŚRODOWISKA
z dnia 11 lutego 2004 r.
w sprawie klasyfikacji dla prezentowania stanu wód
powierzchniowych i podziemnych, sposobu
prowadzenia monitoringu oraz sposobu
interpretacji wyników i prezentacji stanu tych wód
(Dz. U. Nr 32, poz. 284)
Na podstawie art. 49 ust. 4 pkt 1 i 2 lit. a-c i lit. e-g
oraz pkt 3 ustawy z dnia 18 lipca 2001 r. - Prawo
wodne (Dz. U. Nr 115, poz. 1229, z późn. zm. )
zarządza się, co następuje:

cechy fizyczne
wody
1. barwa
2. zapach
3. temperatura
4. odczyn
5. mętność – zawiesiny
ogólne
6. przezroczystość
7. smak
8. gęstość
9. rozpuszczalność

1. Barwa
(pozorna, rzeczywista),
zielonkawa
1. związki
humusowe
2. plankton
3. roślinność
4. jony metali (Fe,
Mn
)
chloroplatynian potasu
K
2
PtCl
6
chlorek kobaltu CoCl
2
·
6H
2
O
K
2
Cr
2
O
7
+ CoSO
4
· 7H
2
O
skala wzorców
550 mg Pt/dm
3
5250 mg Pt/dm
3
1mg Pt/dm
3
1mg Pt/l

2. Zapach
H
2
S,
Cl
1. związki pochodzenia organicznego - zakwit
glonów
2. produkty mineralizacji osadów dennych
3. gazy
3. Temperatura
głębokość temperatura
lato zima
krotność rozcieńczenia
1 - 20
wody naturalne nie zanieczyszczone charakteryzują się
zapachem roślinnym.
o
C
22 –28
o
C
zmienna w ciągu roku
0-25
o
C
4. Odczyn
pH 6,59,0
•
kwaśne deszcze
•
związki humusowe
•
ścieki, FeSO
4
siła
elektromotoryczna
pehametr
papierek wskaźnikowy

5.
Mętność
(załamanie światła)
•związki organiczne
•glina, iły
•związki Mn, Fe, Al
wizualne i
instrumentalne
kilka kilkadziesiąt
1000g/m
3
stan mętność
wizualna turbidymetryczna 05 mg/dm
3
wizualna turbidymetryczna 550 mg/dm
3
(rozcieńczanie)
nefelometryczna, mętnościometr, wykreślenie krzywej
turbidymetryczna świecowa Jacksona
1mg SiO
2
/dm
3
wody (ziemia
okrzemkowa)

5a. Zawiesiny ogólne
mg/dm
3
mg/l
15 – 100 mg/l
wagowo po filtracji przez sączek z włókna szklannego
6.
Przezroczystość
(zamiast mętności)
określenie wysokości słupa wody w cm
przez, który obserwowany druk wzorcowy
daje się odczytać
7.
Smak
funkcja rodzaju i ilości występujących substancji
oraz temperatury
•procesów biochemiczne
•zanieczyszczenia pochodzenia antropogenicznego

zamarzając woda
zmniejsza
a nie
zwiększa
swoją gęstość
zabezpieczenie zbiorników wodnych (jeziora,
stawy) przed zamarzaniem do dna podczas
surowych zim, umożliwiając tym samym
przetrwanie życia w tych zbiornikach
8. Gęstość
[g/cm
3
]
0
o
C - 0,99987 g/cm
3
areometr
piknometr
największa gęstość wody występuje nie w
punkcie zamarzania - 0
o
C, lecz w
temperaturze 3,98
o
C 4
o
C

9. Rozpuszczalność
zasada rozpuszczania:
polarne w polarnych
niepolarne w
niepolarnych
bardzo dobry rozpuszczalnik w porównaniu z innymi
cieczami
wynik polarności
woda idealnie czysta jako zbiór cząsteczek H
2
O praktycznie
nie istnieje
SKŁAD CHEMICZNY WODY
substancje rozpuszczone
gm
-3
= mg
dm
-3
składniki podstawowe
kilkaset g
m
-3
makroskładniki
kilkaset mg
m
-3
-
kilkanaście g
m
-3
mikroskładniki
kilkaset mg
m
-3
przewodzenie kationy:
Ca
2+
, Mg
2+
, Na
+
, K
+
twardość
elektryczne aniony:
HCO
3
-
, SO
4
2-
, Cl
-
krzemionka:
SiO
2

substancje
organiczne
natura
lne:
•substancje humusowe 60-
80%
•białka
•węglowodany
•oleje, woski
•produkty syntezy organizmów
wodnych
obce:
•WWA
•pochodne fenoli i in. związków
organicznych
•pestycydy
•pochodne ropy naftowej
•substancje powierzchniowo czynne
wskaźniki tlenowe
tlen rozpuszczony
(+) – z atmosfery, fotosynteza
(-) – biochemiczne i chemiczne utlenianie
substancji
organicznej i
nieorganicznej,
desorpcja tlenu do atmosfery
(+)
(-)
zawartość
normalna
014 mg O
2
/dm
3
stan nasycenia – procent
nasycenia (%)
74 mg O
2
/l

oznaczen
ie
metoda miareczkowa
Winklera
[Mn(OH)
2
] Mn
2+
+ O
2
Mn
4+
Mn
4+
+ 2I
-
Mn
2+
+I
2
miareczkowanie tiosiarczanem sodu
(Na
2
S
2
O
3
)
MnSO
4
+ (KI + KOH) Mn(OH)
2
(pH 7)
Mn(OH)
2
[O]
MnO(OH)
2
[H]
Mn
4+
+
3H
2
O
Mn
4+
+ 2I
-
Mn
2+
+ I
2
I
2
+ 2S
2
O
3
2-
2I
-
+ S
4
O
6
2-

Synteza Rozkład
fotosyntez
a
biosynteza
anaerobo
wy
aerobowy
oznaczenia
•BZT
5
•ChZT
•Utlenialność - indeks
tlenowy
•OWO,
•RWO,
•EWCh
•EWA
wpływ:
temp. 20-30
o
C, 10
o
C, 40
o
C, 4
o
C
pożywki
pH 7-8
substancje toksyczne
związki org. + O
2
bak., enzymy
CO
2
+ H
2
+ bakterie
[O] [O]
NH
3
NO
2
-
NO
3
-
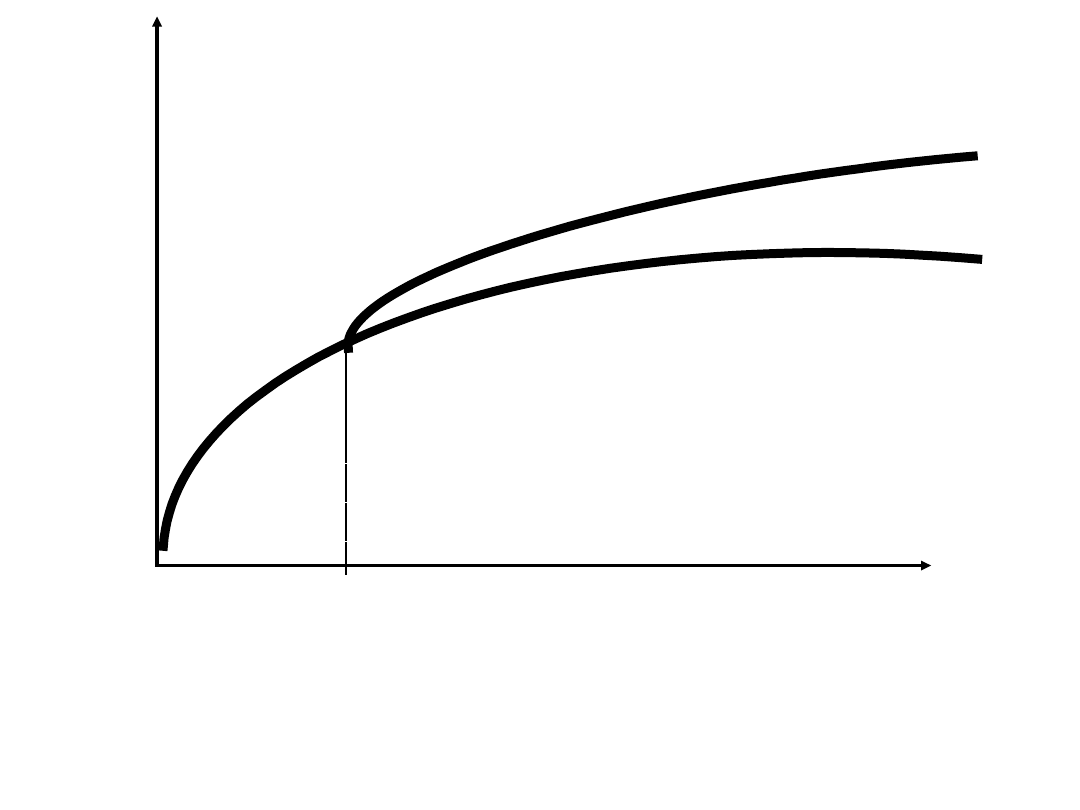
BZT
5
[mgO
2
/dm
3
]
warunki aerobowe, 20
o
C, bez światła
2-12 mg O
2
/l
metody oznaczenia:
rozcienczeń ponad 10mg
O
2
/dm
3
1:10
manometryczna Sierpa
(Wartburga)
b
a
10 Dni
BZT
5
I faza 0 – 20 dni (węglowodany)
II faza po 10 dniach (związki azotowe)

Pomiary OxiTop®
polegają na pomiarach
ciśnienia w zamkniętym
systemie:
mikroorganizmy
znajdujące się w próbie
zużywają tlen i
produkują przy tym
CO
2
,absorbowany przez
NaOH. Powstaje
podciśnienie, które jako
wartość pomiarowa
może być bezpośrednio
odczytana w mg/l.
Główki OxiTop® (zielone i
żółte) posiadają funkcję
AutoTemp: kiedy
temperatura próby jest za
zimna, automatycznie
następuje opóźnienie
pomiaru, dopóki
temperatura nie
ustabilizuje się,
najczęściej trwa to 1
godzinę.
OxiTop®IS6/IS12
Opracowany przez
niemiecką firmę
Wissenschaftlich-
Technische Werkstaetten
GmbH (WTW) system.

ChZT
utlenianie związków
K
2
Cr
2
O
7
ChZT BZT
5
metoda
oznaczenia:
miareczkowanie po ogrzewaniu z
K
2
Cr
2
O
7
10-60 mg O
2
/l
(CHO)
n
+ Cr
2
O
7
2-
+ H
+
2Cr
3+
+ CO
2
+H
2
O
utlenianie związków organicznych (np.
glukozy):
odmiareczkowanie nadmiaru K
2
Cr
2
O
7
Cr
2
O
7
2-
+ 6Fe
2+
+ 14H
+
2Cr
3+
+
6Fe
3+
+ 7H
2
O

utlenialnoś
ć
ChZT+ związki nieorganiczne z Fe
2+
C
6
H
12
O
6
+ Mn
7+
(KMnO
4
) + H
+
Mn
2+
+CO
2
+ H
2
O
Mn
7+
+ H
2
C
2
O
4
+ H
+
Mn
2+
+CO
2
+ H
2
O
3-24 mg O
2
/l
metoda
oznaczenia:
miareczkowanie po ogrzewaniu z
KMnO
4
pH<7
nadmiar
KMnO
4
redukuje się dodanym w
równoważnej ilości kwasem szczawiowym, którego
nadmiar miareczkuje się
KMnO
4

EWCh -
ekstrakt węglowo-
chloroformowy
w wodach czystych wynosi dziesiętne części
g/m
3
a w bardzo zanieczyszczonych kilka g/m
3
odzwierciedla poziom zanieczyszczenia wody
związkami refrakcyjnymi
EWA -
ekstrakt węglowo-
alkoholowy
OWO -
ogólny węgiel
organiczny
5-20 mg C/l
spektometria IR
dziesiąte części mg/dm3

związki azotu
78,08% powietrza
N
2
(gaz)
NO
2
-
NO
3
-
NH
4
+
N organiczny 50%
(proteiny, aminokwasy, aminy,
mocznik)
[N
2
] - temp.
[N
2
] -
głębokość
N
2
+ bakterie (glony) białko (aminokwasy)
CO(NH
2
)
2
+ 2H
2
O
ureaza
2NH
3
+
H
2
CO
2
0,00x mg NO
2
-
/dm
3
0,1 mg NO
2
-
/dm
3
wskaźniki biogenne
2NH
4
+
+ 3O
2
Nitrosomonas
HNO
2
+ H
2
O
2NO
2
-
+ O
2
Nitrobacter
2NO
3
-
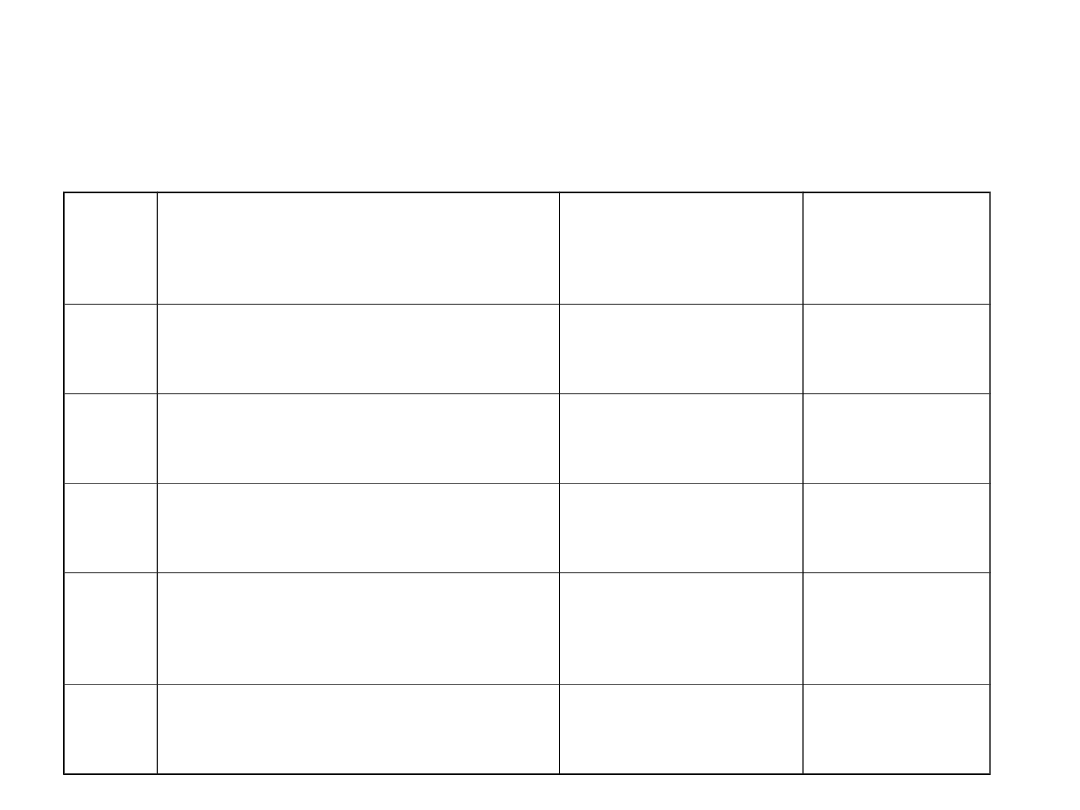
Lp Forma azotu
Jednostk
a
Zakres
1
amoniak NH
3
mg NH
4
/l
0,5-4
2
azot Kjeldahla
mg N/l
0,5-4
3
azotany NO
3
-
mg NO
3
/l
5-50
4
azotyny NO
2
-
mg NO
2
/l
0,03-
1,0
5
azot ogólny
mg N/l
2,5-20
w/g rozporządzenia Ministra Środowiska
z dnia 11 lutego 2004 r. (poz. 284)

NO
3
-
[NO
3
-
] okres wegetacyjny zima
[NO
3
-
] 10 mg N/dm
3
NO
2
-
N-
nitrozy
NO
2
-
+ kwas sulfanilowy diazozwiązek +
naftyloamina zabarwienie
czerwonofioletowe
(spektrometria UV-VIS, chromatografia
jonowa)
NO
3
-
redukcja do
NO
2
-
oznaczenie
azotany(V)
NH
4
+
do xx mg NH
4
+
/dm
3
biochemiczny rozkład związków organicznych
ścieki
oznaczenie
•NH
4
+
+ fenol + KClO barwa
(błękit indofenolowy)
•odczynnik Nesslera K
2
HgI
4
barwa
żółta
•destylacja
N org. mineralizacja z H
2
SO
4
stężonym

Fosfor PO
4
3-
(P
5+
)
wietrzenie skał
ścieki
nawożenie
wody opadowe
kilka g PO
4
3-
/ dm
3
[PO
4
3-
] okres wegetacji zima
HPO
4
2-
, H
2
PO
4
-
i związki organiczne
jeziora rzeki
Lp
Forma fosforu
Jednostka
Zakres
1
fosforany
mg PO
4
/l
0,2-1,0
2
fosfor ogólny
mg P/l
0,2-1,0
w/g rozporządzenia Ministra Środowiska z dnia
11 lutego 2004 r. (poz. 284)

oznaczenie
PO
4
3-
+ molibdenian amonu
zabarwienie reakcja
(NH
4
)
4
Mo
7
O
24
+ SnCl
2
Sn
+2
Sn
+4
Mo
+6
Mo
+4
w środowisku kwaśnym
jony PO
4
3-
+ jony Mo
+4
związek kompleksowy o
niebieskim
zabarwieniu
któremu przypisuje się wzór:
(NH
4
)
3
[P(Mo
3
O
10
)
4
]
metoda błękitu
molibdenowego
intensywność zabarwienia
spektrofotometrycznie
metoda ICP > tradycyjna metoda kolorymetryczna

zasadowość wody
Zdolność przyjmowania protonów (zobojętnianie kwasów)
Zasadowość wody jest to zdolność wody do
zobojętniania mocnych kwasów
zasadowość wody określa odporność wód
zasadowość odporne na zakwaszenie
kamień i pienienie wody
w kotłach
wskaźniki zasolenia
Zasadowość zdefiniowana jest przewagą stężenia
jonów wodorotlenkowych (OH
-
) nad stężeniem jonów
wodorowych (H
+
).
nadają: HCO
3
1-
, CO
3
2-
, Ca(OH)
2
, Mg(OH)
2
stanowią o
zdolności buforowej wody
[mmol/dm
3
] lub
[mval/dm
3
]

oznaczenie
zasadowości
miareczkowanie mocnym kwasem
wobec oranżu metylowego
z
m
pH = 4
fenoloftaleiny
z
f
pH = 8
podczas dodawania kwasu
zachodzą reakcje:
H
+
+ OH
-
H
2
O
(do pH
= 10~11)
H
+
+ CO
3
-2
HCO
3
-
(do pH =
8,3)
2H
+
+ CO
3
-2
H
2
CO
3
H
+
+ HCO
3
-
H
2
CO
3
(do pH =
4,3)

Kwasowość
jest to zdolność wody
do zobojętniania (wiązania) silnych
zasad.
Właściwość tę nadają wodzie
obecne w niej kwasy, a głównie H
+
,
H
2
CO
3
*
,
HCO
3
-
.
Podczas dodawania zasady zachodzą
reakcje:
OH
-
+ H
+
H
2
O
(do pH =
4,3)
OH
-
+ HCO
3
-
H
2
O + CO
3
-2
OH
-
+ H
2
CO
3
HCO
3
-
+ H
2
O
(do pH
= 8,3)
mval/dm
3
Oznaczenie wykonuje się wg normy:
Oznaczanie kwasowości i zasadowości mineralnej i
ogólnej metodą miareczkową wobec wskaźników.
PN-74/C-04540
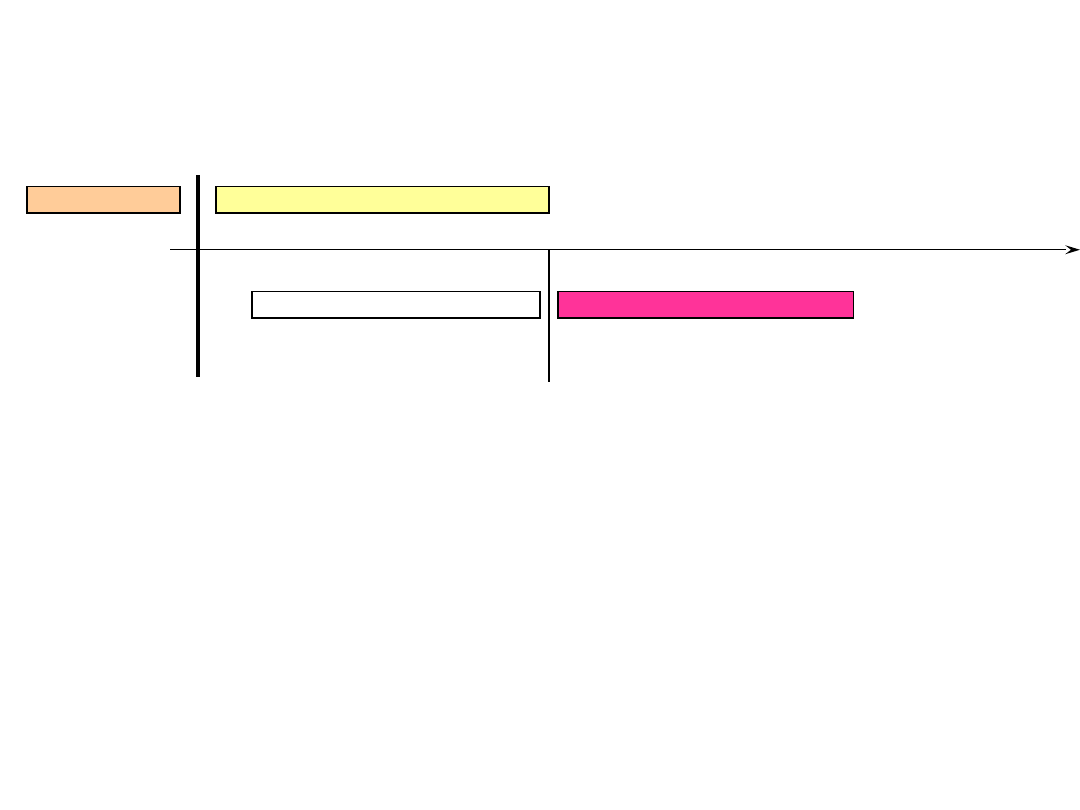
fenoloftaleina
oranż metylowy
zmiany zabarwienia dwóch wskaźników
pozwalają oś odczynu podzielić na 3 obszary:
Odczyn poniżej
4,3
Odczyn pomiędzy 4,3 a 8,3
Odczyn powyżej
8,3
4,3
8,3
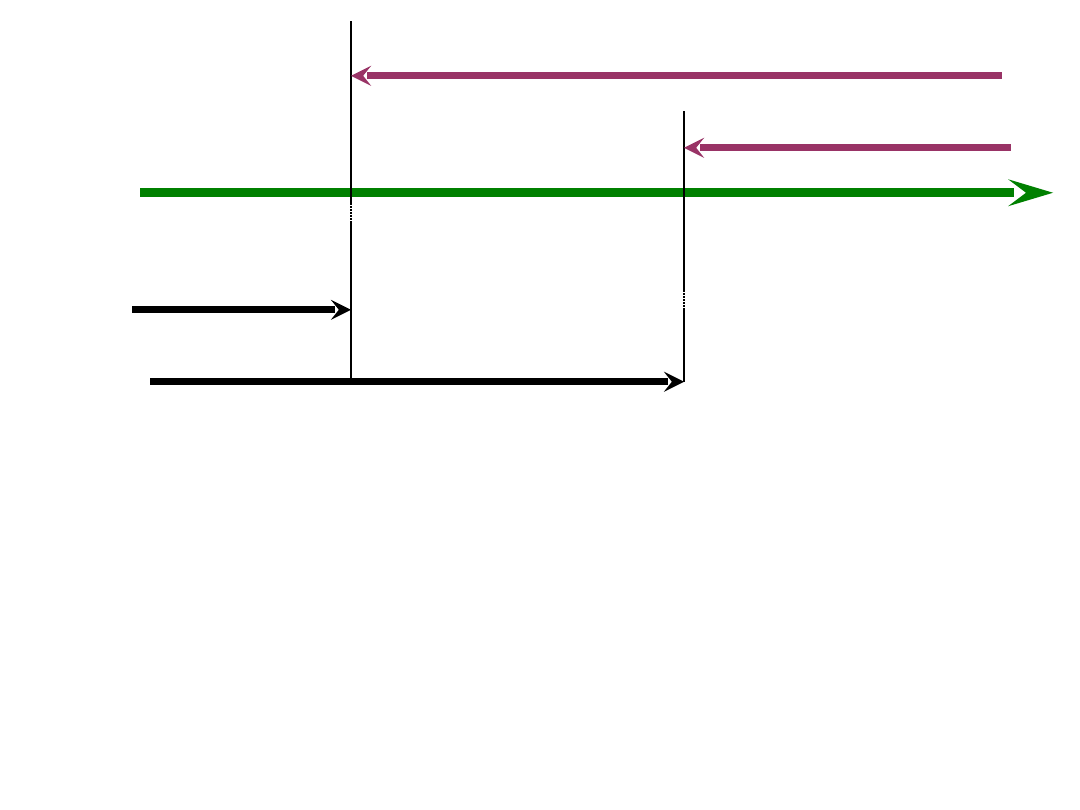
Z
og
Z
min
4,3 8,3
pH
Kw
min
Kw
og
pH < 4,3 Z
og
= 0, Z
min
= 0,
Kw
min
, Kw
og
4,3 < pH < 8,3 Z
og
, Z
min
= 0,
Kw
min
=
0, Kw
og
pH > 8,3 Z
og
, Z
min
, Kw
min
= 0,
Kw
og
= 0
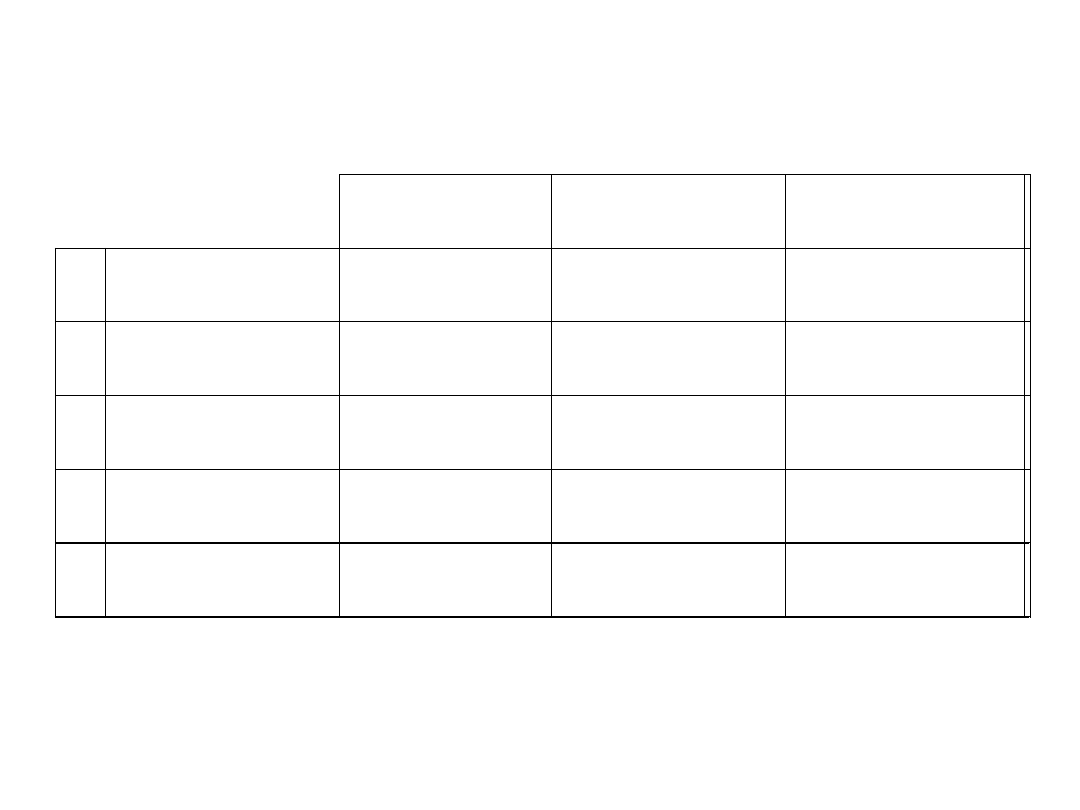
obliczanie stężeń na podstawie oznaczonej
zasadowości
[HCO
3
-
]
[CO
3
-2
]
[OH
-
]
1
Z
min
= 0
Z
og
0
0
2
2Z
min
< Z
og
Z
og
-2Z
min
2Z
min
0
3
2Z
min
= Z
og
0
2Z
min
0
4
2Z
min
> Z
og
0
2(Z
og
- Z
min
)
2Z
min
- Z
og
5
Z
min
= Z
og
0
0
Z
og

CO
2
X 1X g CO
2
/m
3
Źródło:
utlenianie związków organicznych
wietrzenie i wymywanie skał
węglanowych
z powietrza
Zużycie:
fotosynteza
chemosynteza
rozpuszczanie skał
[CO
2
] = (pH) przewaga HCO
3
-
doba i rok

SO
4
2-
[H]
SO
3
2-
[H]
S
2-
bakterie redukujące
siarczany
skały osadowe
substancja organiczna
wody opadowe
utlenianie siarki 2S + 3O
2
+ 2H
2
O
= 2H
2
SO
4
metoda turbidymetryczna
oznacze
nie
SO
4
2-
+ BaCl
2
BaSO
4
+2Cl
-
koloid
zmętnienie nefelometr krzywa wzorcowa
fotometr
Siarczany
100-300 mg
SO
4
/l

0,4 170g Cl
-
/dm
3
b. łatworozpuszczalne
wskaźnik
zanieczyszczenia
mineralizacja
[Cl
-
]
•z oceanów
•wymywanie skał
i gleb
•ścieki
Cl
-
SO
4
2-
HCO
3
-
(CO
3
2-
)
Na
+
K
+
Mg
+2
Ca
+2
Zasolenie Sorensena 1kg
wody
Ag
+
+ Cl
-
AgCl (biały)
K
2
Cr
2
O
7
oznaczenie
Związki krzemu
0 70g Si/m
3
[Si] =const
wymywanie podłoża
i gleb
Chlorki
100-400 mg
Cl/l

Wapń i magnez Ca, Mg
CaCO
3
węglanowa
Ca(HCO
2
)
3
przemijająca
ogólna CaSO
4
CaCl
2
Ca(NO
3
)
2
jony Mg w tych samych związkach
1n
o
= 10mg CaO/dm
3
Ca
2+
+ 2C
17
H
35
COOH =
(C
17
H
35
COO)
2
Ca + 2H
+
50-400 mg Ca/l
25-200 mg Mg/l

Ca
2+
miareczkowanie wersenianem disodu
EDTA
Mg
2+
miareczkowanie wersenianem
disodu
EDTA
disodowa sól kwasu
etylenodiaminotetra octowego
C
10
H
12
O
8
N
2
Na
2
H
2
· 2H
2
O
CaCO
3
+ CO
2
+ H
2
O Ca
+2
+ 2HCO
3
-
gips
MgCO
3
+ CO
2
+ H
2
O Mg
+2
+ 2HCO
3
-
skały magmowe
wzrost zużycia
mydła
podrażnienie, wysuszenie
skóry
osad na materiale
pogorszenie własności odżywczych mięsa
korozja w wymiennikach Mg
+2
+2H
2
O=Mg(OH)
2
+H
2
kamień kotłowy

żelazo Fe
3+
do kilku g/m
3
Fe(OH)
3
FePO
4
związki humusowe
c
Fe
= ƒ (pH i potencjał redoks)
powierzchniowe. podziemne
metale, w tym metale ciężkie Z > 20
0,1-2,0 mg Fe/l
Fe
3+
– w małych stężeniach pierwiastek niezbędny do
życia
duże stężenia zmieniają smak wody
dopuszczalne stężenie w wodzie do picia wynosi 0,5 mg/l
oznaczenie
redukcja do Fe
+2
i reakcja z
fenantroliną
różowe zabarwienie
, krzywa wzorcowa

Mangan Mn
2+
, (Mn
3+
), Mn
4+
,
Mn
7+
0,05-1,0 mg
Mn/l
wymywanie skał i gleb
ścieki
bakterie manganowe C
Mn
= ƒ (pH i potencjał redoks)
mangan
– pierwiastek niezbędny do życia zwierzętom.
Braki mogą powodować chorobę zwaną chlorosis.
Duże stężenia są toksyczne .
Dopuszczalne stężenie w
wodzie do picia wynosi 0,1
mg/l
oznaczenie
Mn
2+ [O]
Mn
+7
Sód
Na
+
wody śródlądowe
0,x g/m
3
- kilkadziesiąt
g/m
3
c
K
c
Na
oznaczenie K i Na
metoda fotometrii
płomieniowej
Potas
K
+
kilka
g/m
3
nawoz
y
ścieki

Zn
2+
i związki kompleksowe 1-10 g/dm
3
Cd
2+
do 10ppb
Cu
2+
, Cu
+
i związki kompleksowe 2 g/dm
3
Pb
2+
1-10 g/dm
3
Ołów – działa toksycznie na organizm człowieka
zastępuje wapń w układzie kostnym
max. stężenie ołowiu w wodzie do picia wynosi 0,05 mg/l
Hg
2+
, związki kompleksowe i HgS
metale ciężkie
Z > 20
oznaczenie metali ciężkich
elektrody
wyskalowane
As
+3
-
związki As
3+
są bardziej toksyczne niż związki As
5
+
najbardziej toksyczny jest arsenowodór AsH
3
max. zawartość arsenu w wodzie pitnej wynosi 0,05
mg/l
dopuszczalne stężenie rtęci w wodzie do picia wynosi 0,001 mg/l
mikrozanieczyszczenia - wskaźniki
zanieczyszczeń przemysłowych
benzen
+ OH
-
=
fenol
C
6
H
6
+ OH
-
= C
6
H
5
OH C
6
H
5
O
-
+ H
+
ekstrakt z chloroformem 4-
aminoantypiryna (C
11
H
13
N
2
O)
kolorymetrycznie
oznaczenie
dioksyny
2,3,7,8 tetrachlorodibenzeno-p-
dioksyna (TCDD)
najwyższy stopień toksyczności
Cl
Cl
O
O
Cl
Cl

WWA
ścieki przemysłowe (benzopiren) smoła z
papierosów
max dop. 200ng/dm
3
[WWA] głębokość
pestycydy
– środki chemiczne do zwalczania
szkodników w hodowli do roślin i zwierząt
zlewnie rolnicze [pestycydy] głębokość
herbicydy, fungicydy, insektycydy (HCN, HCOH, SO
2
,
CS
2
)
DDT – heksachlorocykloheksan – 30 lat
Pochodne ropy naftowej zawiesina, emulsja, rozpuszczone
węglowodory alifatyczne, karbocykliczne,
heterocykliczne;
0,01mg/dm
3
metody oznaczenia:
ekstrakcja rozpuszczalnikami organicznymi
eter naftowy, heksan (C
6
H
12
), Cl
3
C-CF
3
, mieszaniny
ekstrakcja rozdział odparowanie

SPC
fosforany i eutrofizacja wód; wzrost
rozpuszczalności
cząsteczki o budowie polarnej i
asymetrycznej
jonowe i niejonowe
polimery tlenku etylenu
CH=CH
O
Związki
anionoaktywne dysocjują: RCOONa
RCOO
-
+ Na
+
ROSO
3
Na ROSO
3
-
+ Na
-
kationoaktywne dysocjują: RNH
2
· HCl RNH
2
H
+
+
Cl
-
metody
oznaczenia
:
składnik anionowy + błękit metylenowy
niebieskie zabarwienie spektrofotometr
RSO
3
-
+ BM
+
RSO
3
BM barwny kompleks
hydrofobowa i
hydrofilowa część
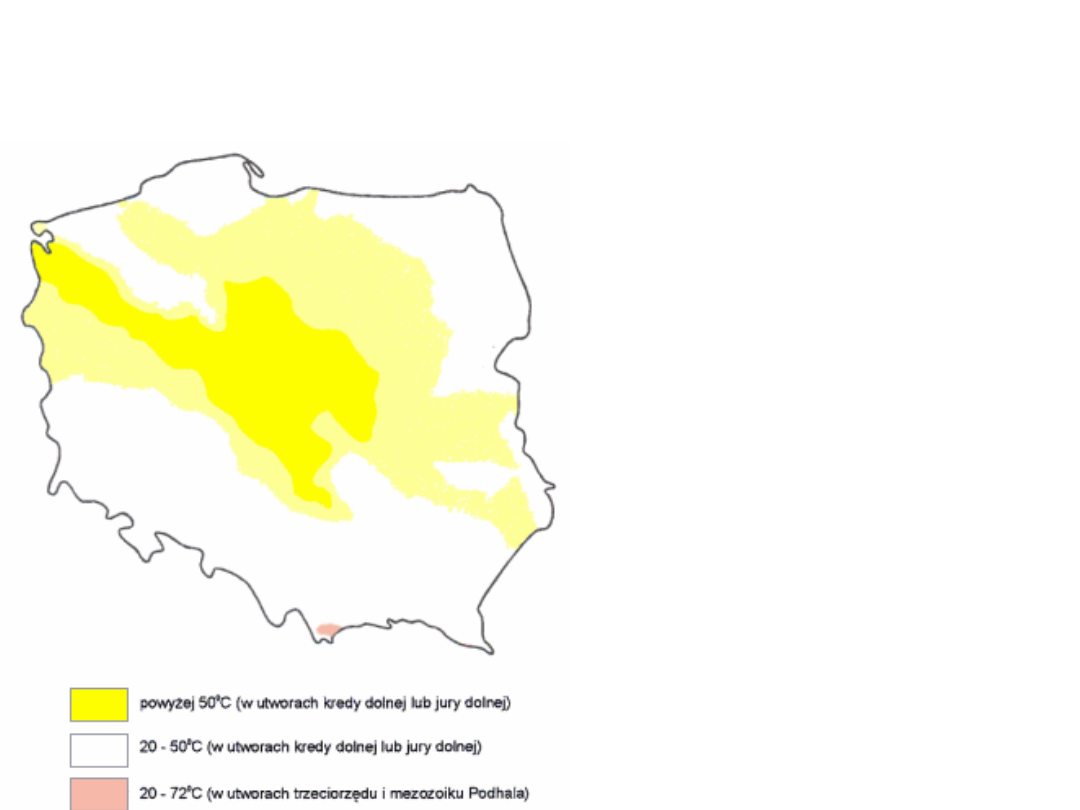
Wody
geotermalne
występują na
różnych
głębokościac
h, prawie na
całym
obszarze
Polski.
energetyka
geotermalna
złoża wód
geotermalnych
wykorzystywane
są
w
elektrowniach
i
ciepłowniach
geotermalnych
W Polsce -
Pyrzyce
WODY PODZIEMNE

a) Sieć stanów wód gruntowych – zarządzana przez
Instytut Meteorologii i Gospodarki Wodnej
IMGW
(
),
b) Sieć stacjonarnych obserwacji wód podziemnych –
zarządzana przez Państwowy Instytut Geologiczny
PIG
c) Monitoring Wód Podziemnych – realizowany przez
Państwowy Instytut Geologiczny funkcjonujący w
bloku monitoringu jakości środowiska systemu
Państwowego Monitoringu Środowiska (Dz.U. 1991,
Nr 70, Poz. 335;
PIOŚ,
krajowy monitoring wód podziemnych
w Polsce działają trzy sieci monitoringu
wód podziemnych o zasięgu
ogólnokrajowym

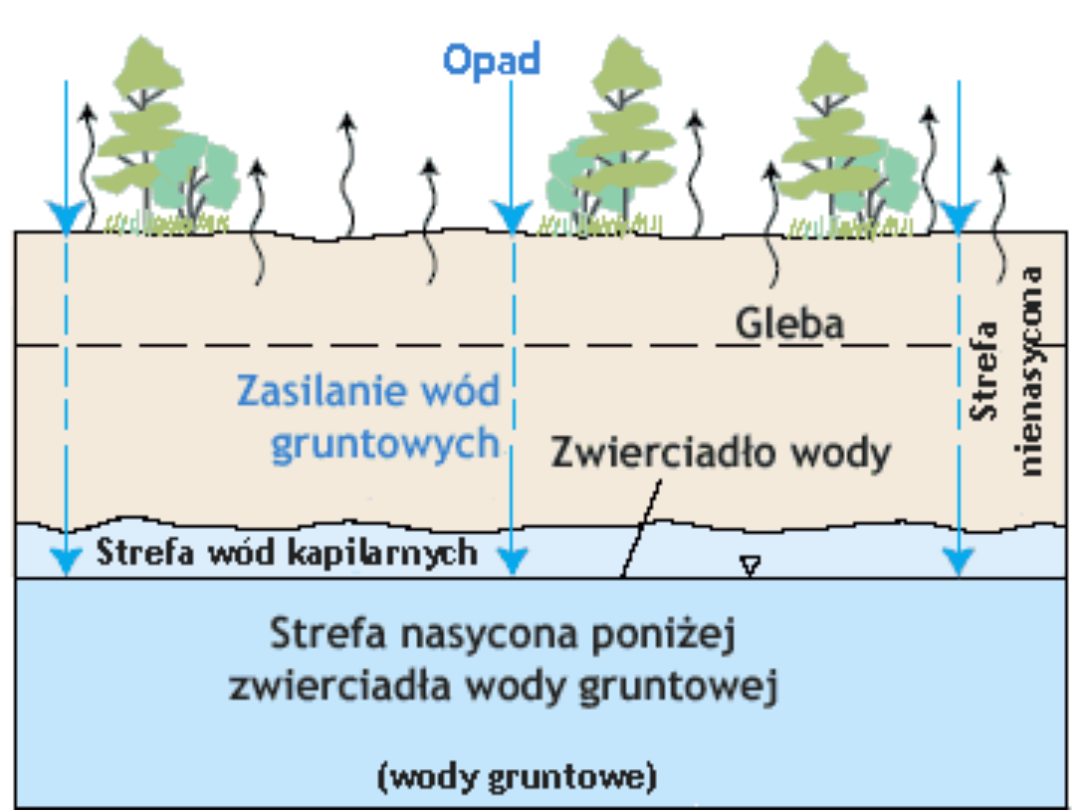
Woda opadowa
przesącza się przez pory i szczeliny
w glebie, a nawet litej skale i dociera do
warstwy
nieprzepuszczalnej.
Zaczyna wówczas wypełniać wolne przestrzenie w
porowatym materiale, stopniowo go nasycając.
Warstwa przepuszczalna
, magazynująca wodę,
zwana jest
warstwą wodonośną
.
Może ona być zbudowana z piasku, żwiru albo z
litej skały. Większość skał ma
zdolność
magazynowania
wody
, ale największą pojemność
mają skały porowate, np. wapień czy piaskowiec.
Cykl hydrologiczny
(obieg wody w przyrodzie) opisuje
istnienie i ruch wody na, w i ponad powierzchnią Ziemi.
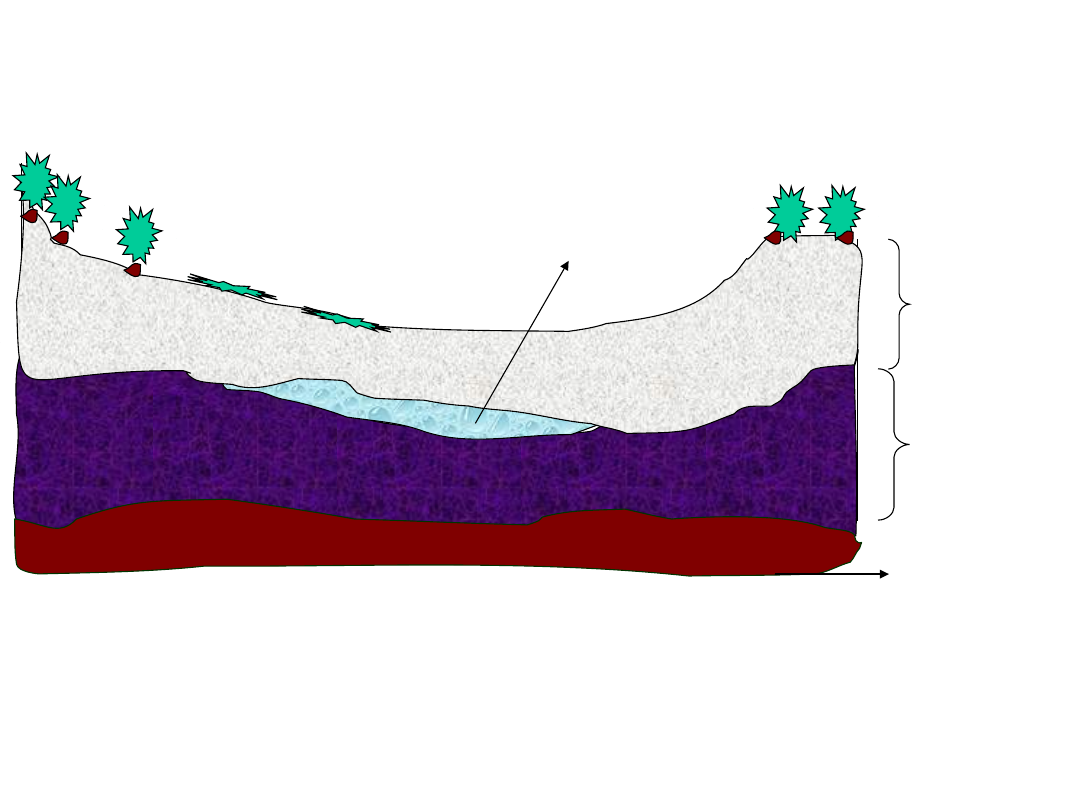
strefy: aeracji i
saturacji
strefa aeracji
strefa saturacji
warstwa
nieprzepuszczalna
zwierciadło wody
podziemnej
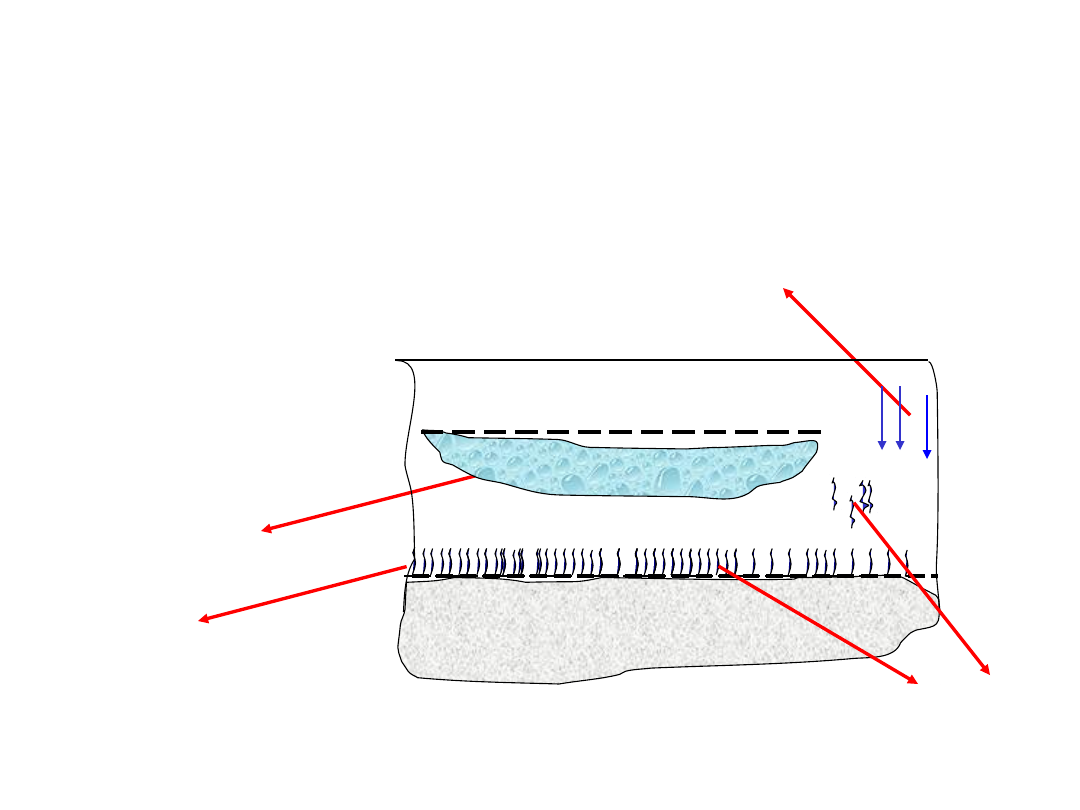
wody wolne
1. wody wsiąkowe
2. wody
zawieszone
wody zawieszone
wody
wsiąkowe
wody kapilarne
zwierciadło wody gruntowej
strefa aeracji
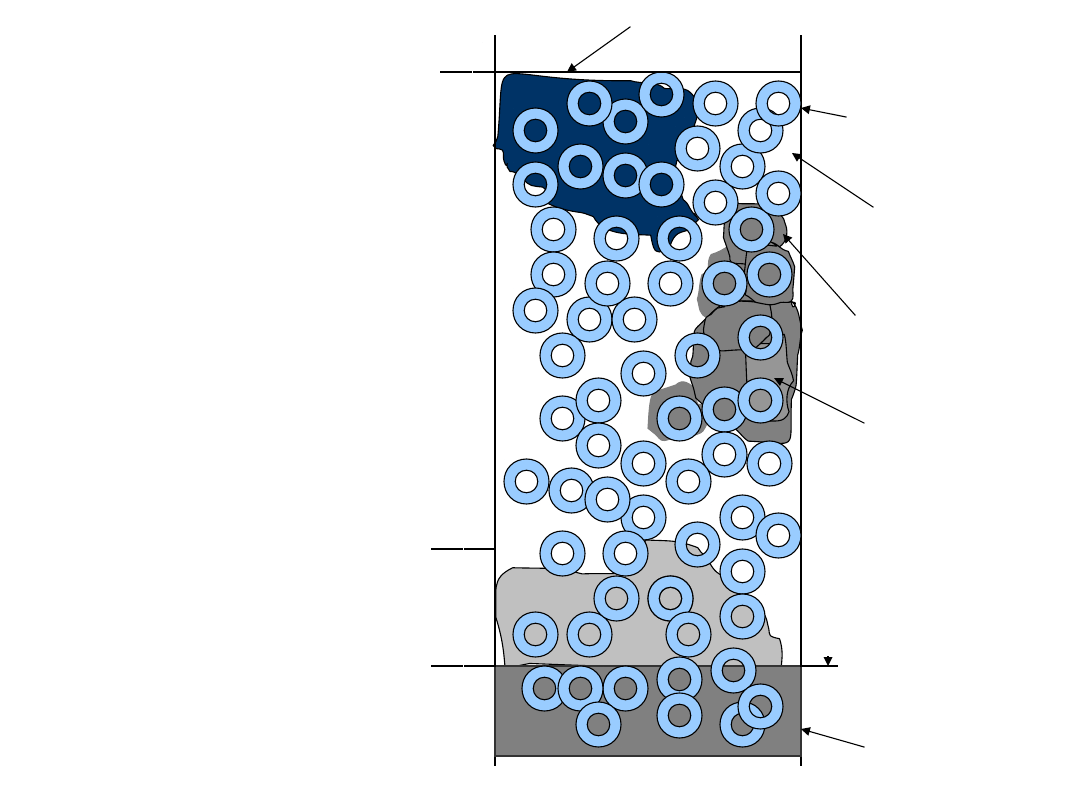
Strefa aeracji
Strefa wzniosu
kapilarnego
Strefa saturacji
Woda wsiąkowa
Zwierciadłp wody
podziemnej
Ziarno otoczone
wodą higroskopijną
Powietrze gruntowe
Woda błonkowata
Woda kapilarna
Woda wolna
wody związane
1. wody
higroskopijne
2. wody
błonkowate
3. wody kapilarne
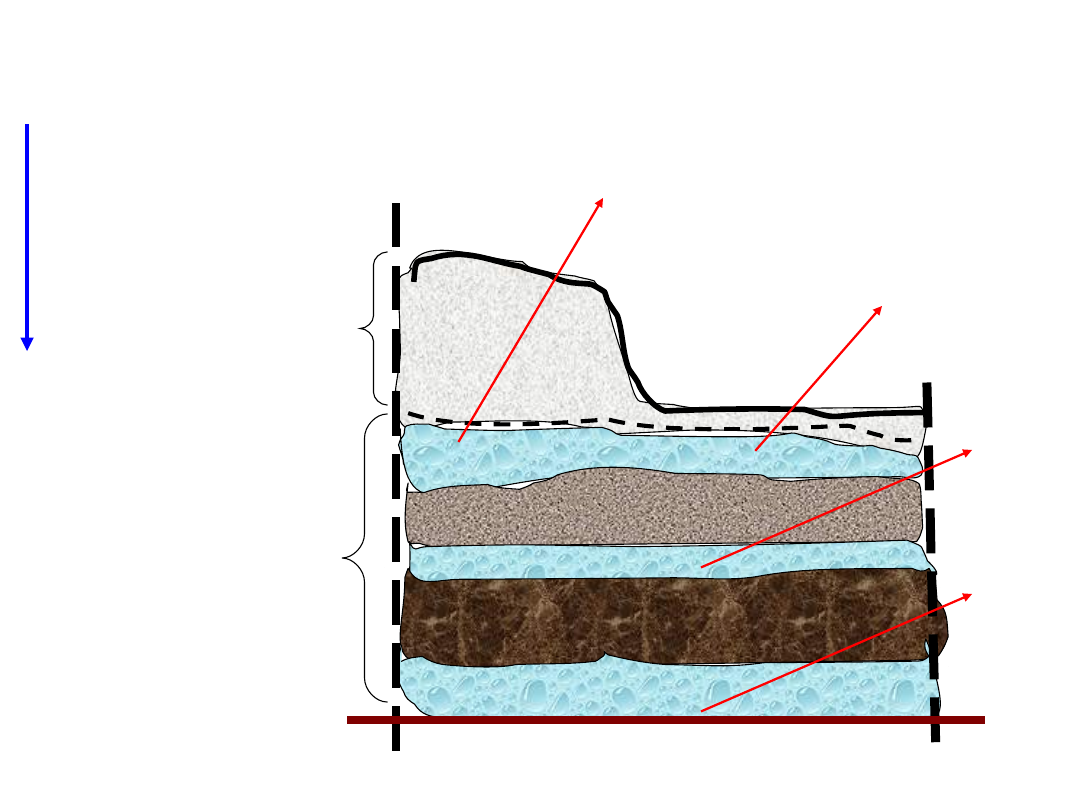
strefa saturacji
wody
przypowierzchniowe
wody
gruntowe
wody
wgłębne
wody
głębinowe
strefa aeracji
strefa saturacji
wody przypowierzchniowe
wody gruntowe
wody
wgłębne
wody
głębinowe

kryteria
klasyfikacji
pochodze
nie
wody metamorficzne
powstające w czasie przeobrażenia termicznego niektórych
minerałów np.: hydrokrzemianów
wody kondensacyjne
pod powierzchnią ziemi w wyniku kondensacji pary wodnej
zawartej w atmosferze
wody juwenilne
powstające z ostygającej magmy, które po raz pierwszy włączają
się w obieg wody
wody reliktowe
leżące pod dużymi seriami warstw nieprzepuszczalnych, które
uniemożliwiają lub utrudniają włączenie się w obieg
temperatura
chłodne
- t <
20
o
C
termalne:
hipotermalne =
20-
35
o
C
homeotermalne =
35-40
o
C
hipertermalne
>
40
o
C

głębokość i forma występowania
1. wody przypowierzchniowe
(zaskórne)
najczęściej na terenach podmokłych, zwykle nie nadające się
do spożycia
2. wody gruntowe -
występujące głębiej, wykorzystywane głównie w rolnictwie, i
do celów komunalnych
3. wody wgłębne
znajdujące się w warstwie wodonośnej
4. wody głębinowe
znajdujące się głęboko pod powierzchnią ziemi i izolowane od
-niej, nie odnawiane, nie zasilane, silnie zmineralizowane, bez
znaczenia gospodarczego
5.
wody szczelinowe –
tworzące sieć żył wodnych w szczelinach
6. wody krasowe
występujące w próżniach i kanałach powstałych wskutek
procesów krasowych

źródłami:
•wysypiska i zwałowiska odpadów stałych;
•stawy ściekowe i osadowe;
•nieszczelności w urządzeniach
kanalizacyjnych;
•tereny niewłaściwego magazynowania
surowców, półproduktów i wyrobów
gotowych;
•emisje pyłów i gazów;
•wody powierzchniowe będące odbiornikami
dużej ilości ścieków i słonych wód
kopalnianych;
zanieczyszczenia pochodzące z przemysłu

zanieczyszczenia pochodzące z
rolnictwa
•obszary intensywnego stosowania nawozów i
środków ochrony roślin;
•miejsca niewłaściwego magazynowania
nawozów mineralnych;
•miejsca usuwania przeterminowanych
pestycydów;
•miejsca wykonywania kiszonek paszowych;
•tereny rolniczego wykorzystywania gnojowicy;
•obejścia gospodarskie.
•nawadnianie terenów
rolniczych
•produkcja zwierzęca
największy problem utrzymania czystości
tych wód stwarza:
chemizacja rolnictwa
-wielkoobszarowe wprowadzanie do gleby
substancji chemicznych będących
składnikami nawozów sztucznych i
środków ochrony roślin.
zanieczyszczenia związane z gospodarką
komunalną

zanieczyszczenia związane z transportem
dystrybucja i magazynowanie substancji
ropopochodnych i innych substancji
niebezpiecznych dla wód podziemnych
•związki nieorganiczne
stosowane do
zimowego utrzymania dróg, a więc sole
rozmrażające
(NH
4
Cl, CaCl
2
, MgCl
2
),
środki przeciwkorozyjne, metale ciężkie;
•substancje organiczne
, a więc różnego
rodzaju pozostałości po spalaniu
materiałów pędnych (w tym rakotwórcze
wielopierścieniowe węglowodory
aromatyczne), oleje, smary, środki
oczyszczające, konserwujące, silikony,
detergenty, smoły i wiele innych
1. Utlenianie i redukcja
-1
0
1
REDUKCJA UTLENIANIE
-e
Fe
2+
Fe
3+
+e
S SO
4
2-
S
2-
Fe Fe
2+
Fe
3+
Mn Mn
2+
Mn
4+
Mn
7+
N N
3+
FeS
2
SO
4
2-
(utlenianie)
SO
4
2-
S
2-
(redukcja)
2. Rozpuszczanie i strącanie
Halit -
Na
+
i Cl
-
kalcyt – (CaCO
3
) -
Ca
2+
i HCO
3
2-
dolomit - CaMg (CO
3
)
2
-
Ca
2+
, Mg
2+
i HCO
3
2-
glinokrzemiany, skalenie i minerały ilaste–(Ca,Na)(Al,Si)
AlSi
2
O
8
Na
+
, K
+
, Ca
2+
, Mg
2+
i Al
3+
skały osadowe skały krystaliczne
procesy chemiczne i fizyczne zachodzące w
wodach

hydroliza zmiana odczynu wody
FeSO
4
+ 2H
2
O Fe(OH)
2
+ H
2
SO
4
Fe
+2
+ SO
4
2-
+ 2H
2
O Fe(OH)
2
+ 2H
+
+ SO
4
2-
odczyn kwaśny
pH<7
3. Hydratacja i hydroliza
hydratacja czyli uwodnienie
Al
3+
i Fe
3+
jony hydroniowe
H
3
O
+
· 3H
2
O = H
9
O
4
4. Sorpcja i desorpcja
pochłanianie gazów, cieczy, substancji
rozpuszczonych przez ciało porowate
a
= (c, T)
Adsorpcja -
powierzchnia
Absorpcja - objętość
proces desorpcji

H
2
CO
3
H
+
+ HCO
3
-
H
+
+ CO
3
2-
H
2
CO
3
=
1%
pół związany związany
1. - z pirytu
.
2 redukcja SO
4
2-
.
3 redukcja zanieczyszczeń
antropogenicznych
CO
2
•Infiltracja
•Przemiany biochemiczne
•Wietrzenie minerałów FeCO
3
•redukcja siarczanów FeSO
4
+ 4C FeS +
2CO
2
H
2
S
siarkowodór
środowisko redukujące
(pH) =
H
2
S, HS
-
, S, SO
4
2-
6. Migracja - wędrówka
5. Wietrzenie
izomorficzna wymiana z kationem K
+
7. Procesy biochemiczne

związki humusowe
prod. przemiany materii organizmów żywych
produkty rozkładu organizmów obumarłych
związki org. pochodzenia antropogenicznego
(WWA)
zanieczyszczenia organiczne
ilości śladowe do
kilkuset g C/m
3
substancje organiczne nadają wodom
charakter redukcyjny i obniżają pH
fenole -
0,001-0,05mg/l
SPC -
0,1-1mg/l
oleje mineralne -
0,01-0,05mg/l
WWA -
0,01-0,05/l
pestycydy
- 0,01-0,05/l
SUBSTANCJE ROZPUSZCZONE W WODACH
PODZIEMNYCH
wody podziemne wody
powierzchniowe
aniony:
HCO
3
-
, SO
4
2-
, Cl
-
kationy:
Ca
2+
, Mg
2+
, Na
+
, K
+
, Fe
2+
, Mn
2+

HCO
3
-
H
2
CO
3
H
+
+ HCO
3
-
HCO
3
-
H
+
+ CO
3
2-
K
1
=[H
+
] · [HCO
3
-
] = 4· 10
-7
mol/dm
3
[H
2
CO
3
]
K
2
=[H
+
] · [CO
3
2-
] = 4· 10
-11
mol/dm
3
[HCO
3
-
]
pH 4
brak HCO
3
-
pH 6 4 głównie HCO
3
-
pH = 8
jedynie HCO
3
-
pH 10
głównie CO
3
2-
połączenie z Ca
2+
i Mg
2+
(Fe
2+
, Mn
2+
)
Na
+
NaHCO
3
duża rozpuszczalność
duże stężenie
głębokość

SO
4
2-
pH SO
4
2-
kilkanaście kilkaset kilka tysięcy g SO
4
2-
/m
3
1. minerały
gips CaSO
4
·2H
2
O, anhydryt CaSO
4
2. rozkład substancji organicznej
3. utlenianie siarczków
4. wietrzenie złóż siarki
2S + 3O
2
+ H
2
O 2H
2
SO
4
5. kwaśnie deszcze i ścieki
25-500mg SO
4
/l
Cl
-
25-500mg Cl/l
głębokość i mineralizacja chlorki
z opadów
z wód
morskich
ze ścieków
z minerałów
50g Cl
-
/m
3
agresywny charakter w
stosunku do betonu i żelaza

Ca
2+
40 –
calcium
wapienie –
CaCO
3
+ CO
2
+H
2
O Ca
2+
=
2HCO
3
-
gips
Mg
2+
24 – magnesium
dolomit
CaMgCO
3
skały magmowe
rozpuszczalność
MgCO
3
CaCO
3
mineralizacja w st. ogólnym -
Ca
2+
: Mg
2+
4:1 2:1
wzrost mineralizacji -
2:1 1:1
dalszy wzrost mineralizacji -
przewaga Mg
2+
50-300mg Ca/l
30-150mg Mg/l

Na
+
23
sodium
.
1
wietrzenie skał
.
2 intruzja wód słonych do warstw
wodonośnych
.
3 opady atmosferyczne
.
4 zanieczyszczenia antropogeniczne
NaCl,
NaNO
3
K
+
39 kalium
np. KCl
wietrzenie skał
ługowanie soli potasowych
rozkład substancji organicznej
źródła antropogeniczne np. nawożenie pól
stężenie K stężenie Na
60-300mg Na/l
10-20mg K/l

Fe
2+
i Fe
3+
56 ferrum
hematyt Fe
2
O
3
magnetyt Fe
3
O
4
limonit
Fe(OH)
3
syderyt
FeCO
3
piryt
FeS
c
Fe
= (pH, t, CO
2
)
wymywanie skał
wietrzenie skał magmowych
Fe(HCO
3
)
2
FeSO
4
kwasy huminowe
warunki: redukujące
Fe
2+
utleniające
Fe
3+
FeCO
3
+ CO
2
+ H
2
O Fe(HCO
3
)
2
(CO
2
)
c
Fe
= ślady kilkadziesiąt g
Fe/m
3
CO
2
, pH Fe
0,1-5mg Fe/l

Mn
2+
55 manganum
c
Mn
= (pH
wymywanie skał i gleb
pochodzenie antropogeniczne
pH <
Mn
7+
pH =
Mn
4+
(Mn
3+
)
pH
>
Mn
2+
c
Mn
= ślady kilka g Mn / m
3
mineralizacja [Mn]
0,05-1mg Mn/l

związki azotu - wskaźnik
zanieczyszczenia wód
N
2
, (gazowy)
azot organicznych
azot mineralny
(NO
2
-
, NO
3
-
, NH
4
+
,
CN
-
)
amonifikacja, dezaminacja
R-NH
2
-OH R-OH + NH
3
+ energia
CO(NH
2
)
2
+ 2H
2
O 2NH
3
+ CO
2
+2H
2
O
Nitryfikacja NH
4
+
NO
2
-
NO
3
-
[O]
Denitryfikacja HNO
3
HNO
2
NO [H]
trwałość związków azotu = (pH, aktywność biologiczna)

Azotany
NO
3
-
forma dominująca i bardzo dobrze rozpuszczalna
opady atmosferyczne
pochodzenie antropologiczne (gnojowica i
nawozy mineralne, ścieki, odcieki z
wysypisk odpadów)
NO
3
-
w wodach opadowych 1-10
g NO
3
-
/m
3
10-100mg NO
3
/l
Azotyny
NO
2
-
0,01-0,25mg NO
2
/l
Amoniak
NH
3
0,1-3mg NH
4
/l
obecność NH
4
+
i brak NO
2
-
, NO
3
-
świeże
zanieczyszczenie ściekami
Mikroskładniki: Si, F, Al,
P
Metale ciężkie Pb, As,
Ni, Cr
dopuszczalne stężenia setne i tysięczne części
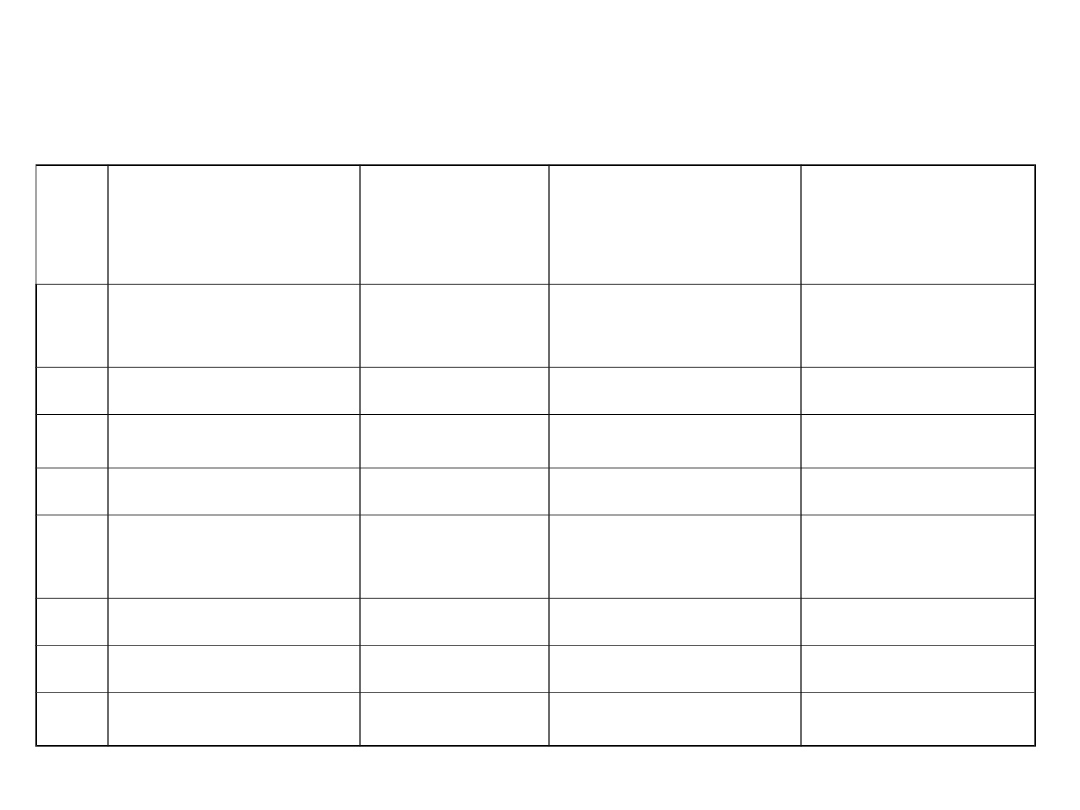
Charakterystyka wód
naturalnych
Lp Parametr
Jednostka Wody
powierzchniow
e
Wody
podziemne
1
temperatura
o
C
zmienna/rok
0-25
stała/rok 4-
6
2
barwa
mg Pt/l
od 20 do 200
od 5 do 10
3
mętność
mg SiO
2
/l
do 50
poniżej 1
4
pH
-
6,5-8,5
6-8
5
tlen
rozpuszczony
mg O
2
/l
poniżej 5
nie występuje
6
żelazo
mg Fe/l
śladowy
do 50
7
mangan
mg Mn/l
do 0,3
do 2
8
CO
2
mg CO
2
/l
śladowy
powyżej 100
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
Wyszukiwarka
Podobne podstrony:
WODA DRUK HYDROGEO
Bakterie spiralne do druk
Ochrona budowli przed wodą i wilgocią gruntową
Kopia woda
woda plus oplaty
Tajemnice szklanki z wodą 1
Środowisko bytowania woda, powietrze, gleba 2
Ćwiczenia i seminarium 1 IV rok 2014 15 druk
WODA PITNA kolokwium
Jak zrobić prosty trik z wodą
jama ustna druk kolor
druk desmurgia
1 Koszulka Model druk
02 Biochemia woda
cw07b 2012 NSAIDS druk (1)
Związki chemiczne produkty reakcji tlenków z wodą
więcej podobnych podstron