
PODSTAWY
MINERALURGII
Wykład 12
FLOTACJA
(Cecha główna -
hydrofobowość)

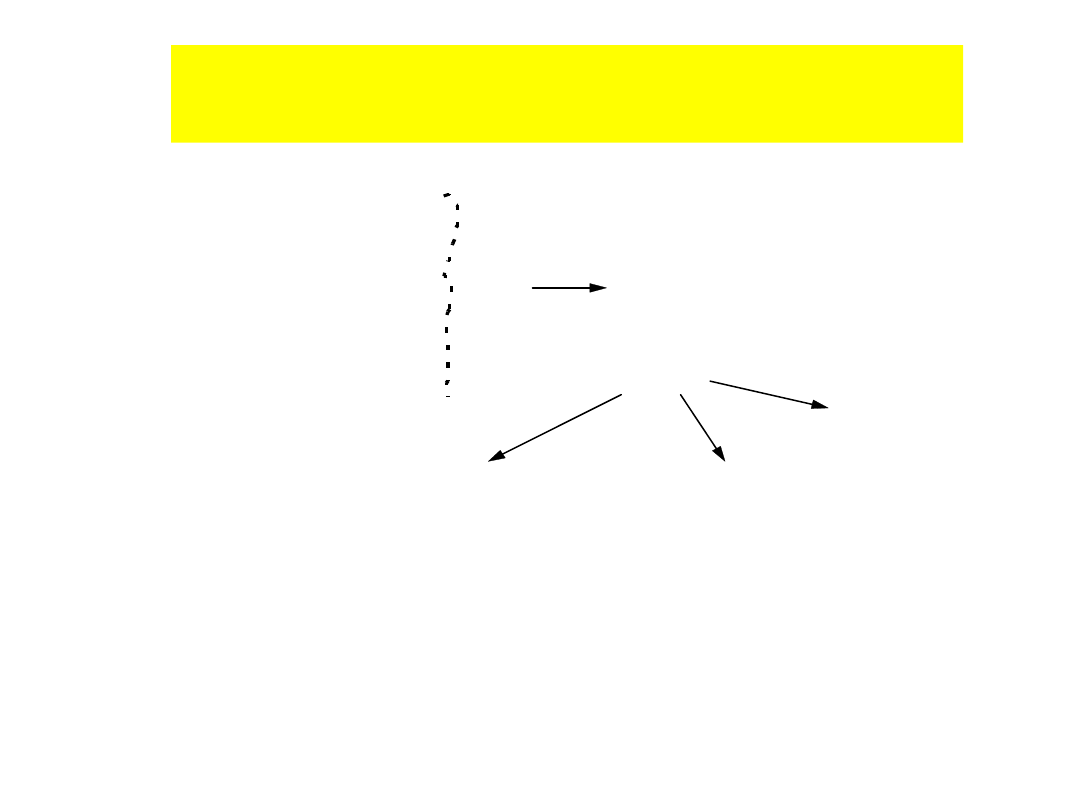
ziarno płonne (hydrofilne)
ziarno hydrofobowe
pęcherzyk gazowy
woda
zrost
Istota flotacji

woda
pęcherzyk
ziarno
Kąt zwilżania
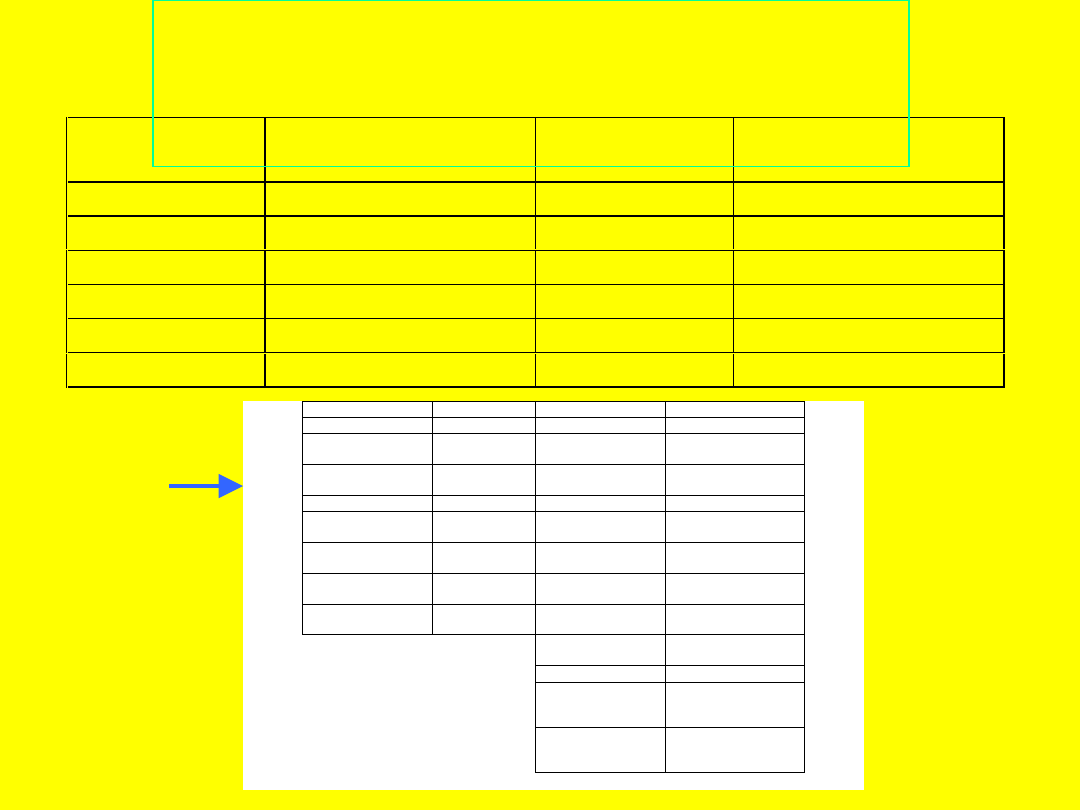
Substancja
Postępujący kąt zwilża-
nia
Substancja
Postępujący kąt zwilża-
nia
Teflon
112
siarka
86*
Parafina
110
grafit
86
Polietylen
103
stybnit (Sb
2
S
3
)
84
Skóra ludzka
90
AgI
17
Naftalen
88
kalcyt
~0*
Kwas stearynowy
80
szkło
~0
Kąt zwilżania wybranych
substancji
( w stopniach)
Polerowane powierzchnie
Źródło*
Ziarna
Źródło
Uwięziony pęcherzyk
Adamson, 1967
ciepło zwilżania ziarn
Neumann i Good, 1979
Siedząca kropla
Adamson, 1967
flotometria
Drzymała i Lekki, 1989a,b
Drzymała, 1995; 1999a,b,c
Nachylona płytka
w cieczy
Hiemenz, 1986
kształt granicy wodnej faz Aveyard i Clint, 1995
Siła odrywania
Hiemenz, 1986
lewitacja
Li i współ., 1993
Zwilżanie płytki
Adamson, 1967
prasowany dysk
Heertjes i Kossen, 1967,
He i Laskowski, 1992
Kropla na nachylonej
płytce
Hiemenz, 1986
szybkość penetracji
cienkiej warstwy ziarn
van Oss i współ., 1992
Profil kropli
Ralson
i Newcombe, 1992
szybkość penetracji
kolumny ziarn
Washburn, 1921, Crowl
i Wooldridge, 1967
Rozmiar kropli
Ralson
i Newcombe, 1992
uwięzionego pęcherzyka
dla ziarn
Hanning i Rutter, 1989
waga Langmuira
Clint i Tylor, 1992;
Aveyard i współ., 1944
wirówkowa
Huethorst i Leenaars, 1990
wzniesienia kapilarnego
w kolumnie ziarn bez
cieczy wzorcowej
White, 1982
wzniesienia kapilarnego
w kolumnie ziarn z cieczą
wzorcową
Bartell i Whitney, 1933
Metody
pomiaru
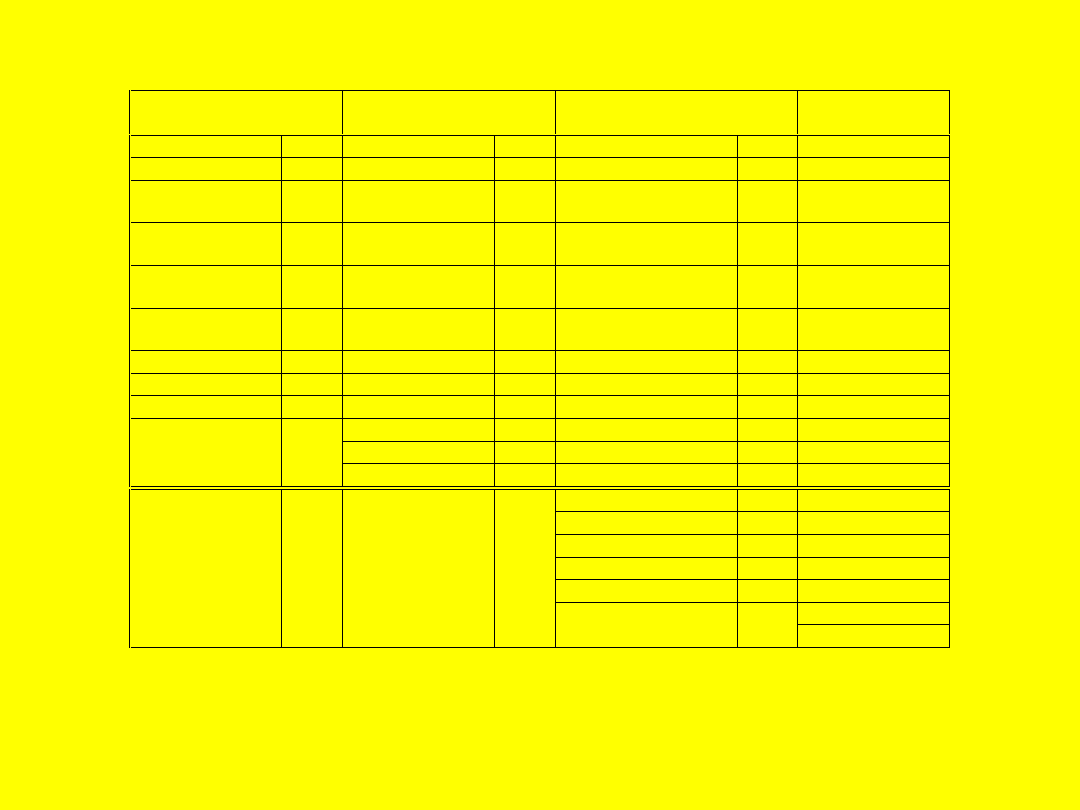
Silnie hydrofobowe*
Średnio hydrofobowe
Słabo hydrofobowe
Hydrofilne**
= 0
Substancja
substancja
substancja
substancja
1
2
3
4
5
6
7
Parafina,
C
n
H
2n+2
90+ siarczki
44–0 fluoryt, CaF
2
10–13
gips,
CaSO
4
·2H
2
O
Teflon, C
2
F
4
90+
węglik krzemu,
SiC
27,6 arszenik, As
2
O
3
9,3 żelazokrzem
Siarka, S
63,2 węgiel kamienny 26–0 perowskit, CaTiO
3
9
dolomit,
CaMg(CO
3
)
2
Rtęć, Hg
45,6 ind, In
25
szelit, CaWO
4
9
magnetyt,
Fe
3
O
4
Ge
39,7 jodargyryt, AgI
23,5 diament, C
7,9 halit, NaCl
Si
35,4 kasyteryt, SnO
2
22– cyna, Sn
7,5 węgiel brunatny
Talk
35,2 srebro, Ag
14
kwas borny, H
3
BO
3
6,4 kaolin
ilmenit, Fe
14
grafit, C
6,2+ hematyt, Fe
2
O
3
molibdenit, MoS
2
5,9+ PbJ
2
6
kwarc, SiO
2
złoto, Au
5
kalcyt, CaCO
3
baryt, BaSO
4
5
anhydryt, CaSO
4
korund, Al
2
O
3
4
kości
HgO
3,3 turmalin
HgJ
2
3
warzywa
miedź, Cu
3
żelazo, Fe
bursztyn
lód, D
2
O
Podział substancji ze względu na
hydrofobowość
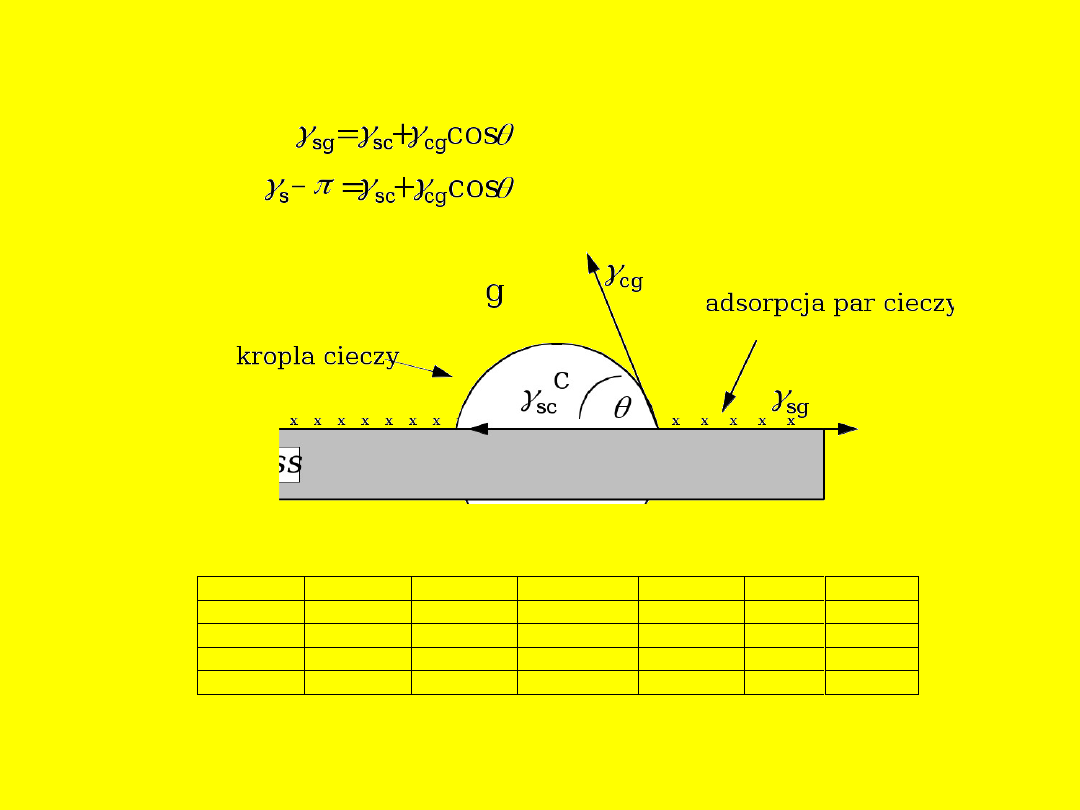
Zależność
Younga
Substancja
s
, mN/m
e
, mN/m
sw
, mN/m
cg
, mN/m
obliczone
zmierzone
*
Lód
90–120
~0
22–33
72,8
0
0
Kwarc
120–135
~małe
46
72,8
~0
0
Parafina
50– 68
0
51
72,8
77– 91
110
Rtęć
484
~75
415
72,8
95
43–110
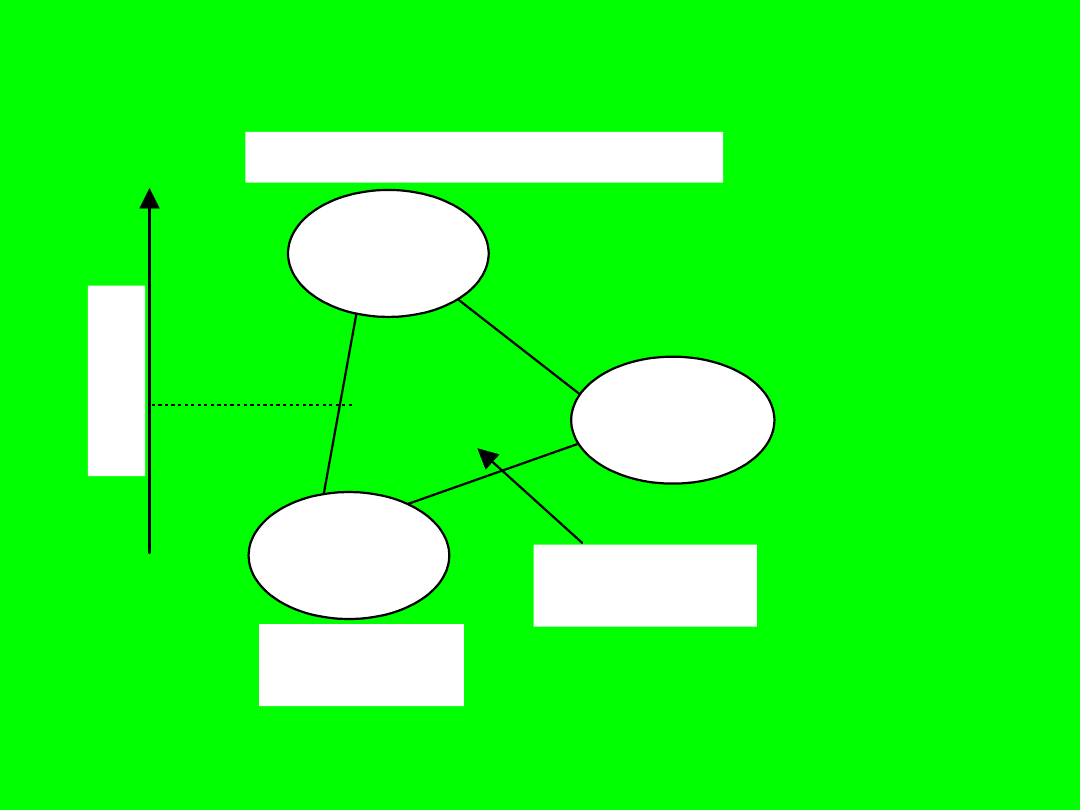
cg
elektrolity
(regulatory pH
oraz sole)
zw. hydrofobizujace (kolektory)
sg
sc
cos
= --------------
sc
cg
sg
sg
,
sc
cg
iep 21
związki
hydrofilizujące
0
k
ą
t
zw
il
ża
n
ia,
wyjściowy
kąt zwilżania
substancje
modyfikujące
cg
sc
sg
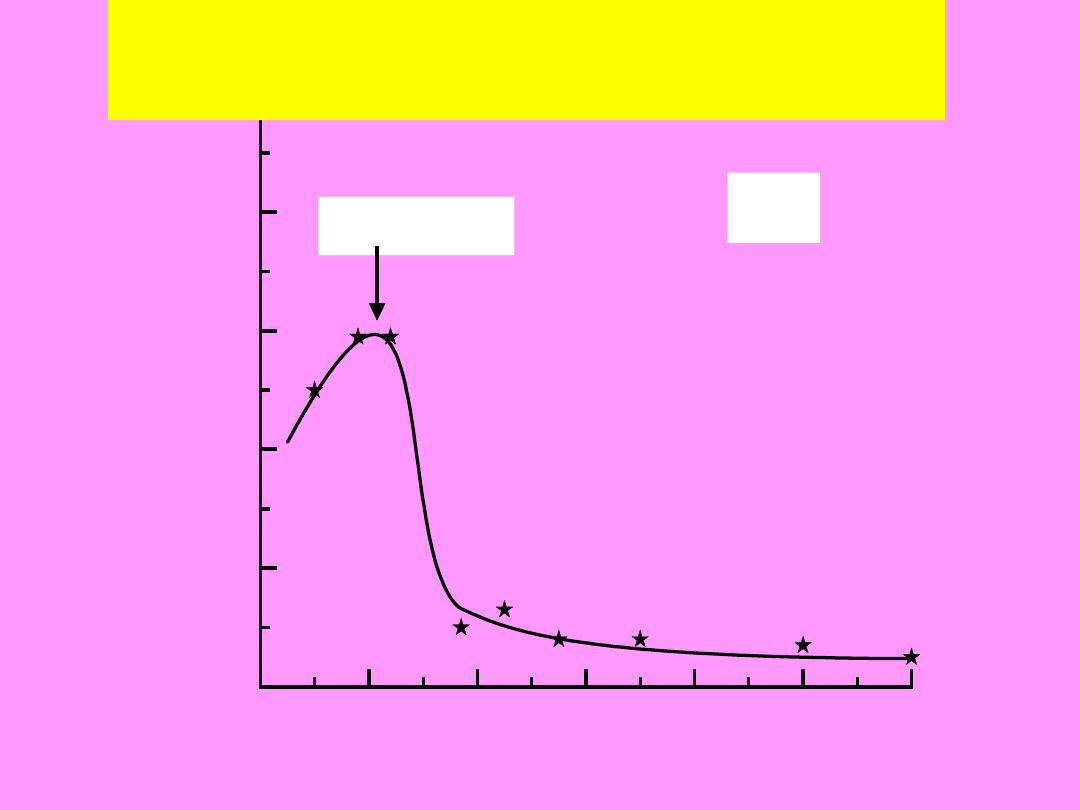
0
2
4
6
8
10
12
pH
0
20
40
60
80
100
u
z
y
s
k
f
o
ta
c
ji
,
%
Ge
pH
iep
= 2,8
Wpływ pH (właściwości elektrycznych)
na flotację
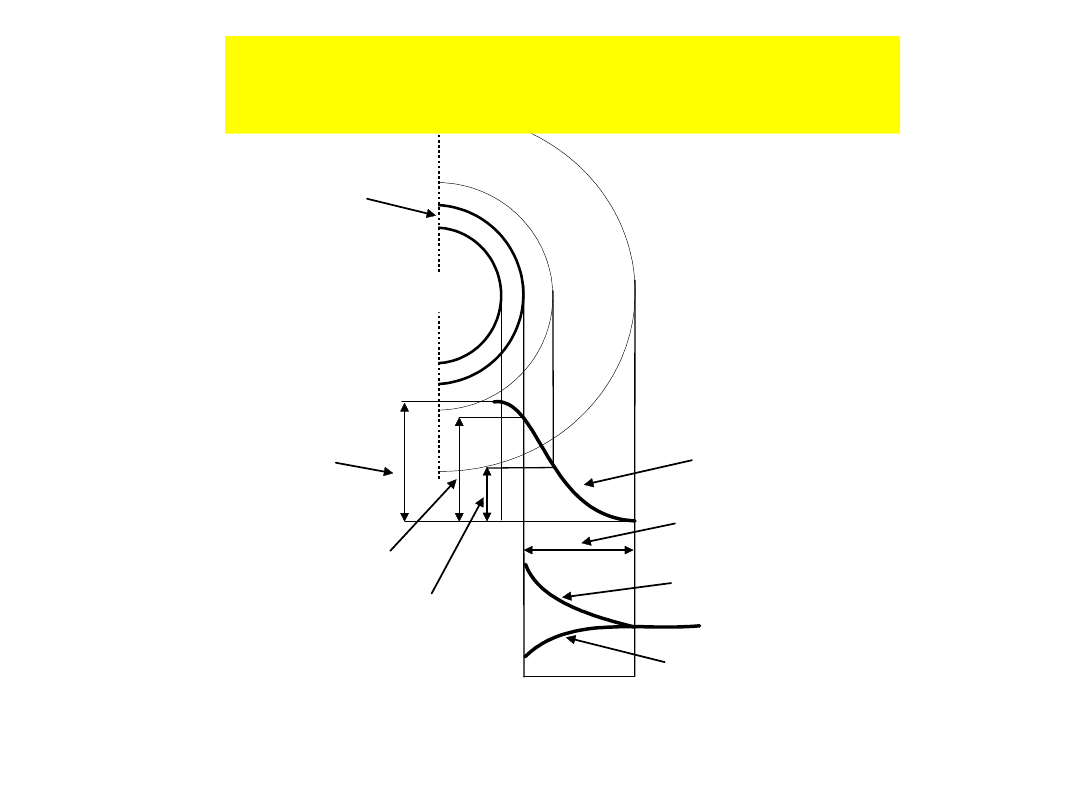
ziarno
potencjał
potencjał
Galvaniego
0
potencjał
dzeta
potencjał
powierzchni
0
warstwa dyfuzyjna
stężenie kationu
stężenie anionu
+ - + -
- + - +
+ - + -
+ - + -
+ - + -
- + - +
- + - +
- + - +
- + - +
+
+
+
+
+
+
+
-
-
naładowana warstwa
powierzchniowa
-
-
-
-
-
-
np. [OH] = [OH]
r
exp
(
/RT)
np. [H] = [H]
r
exp
(
/RT)
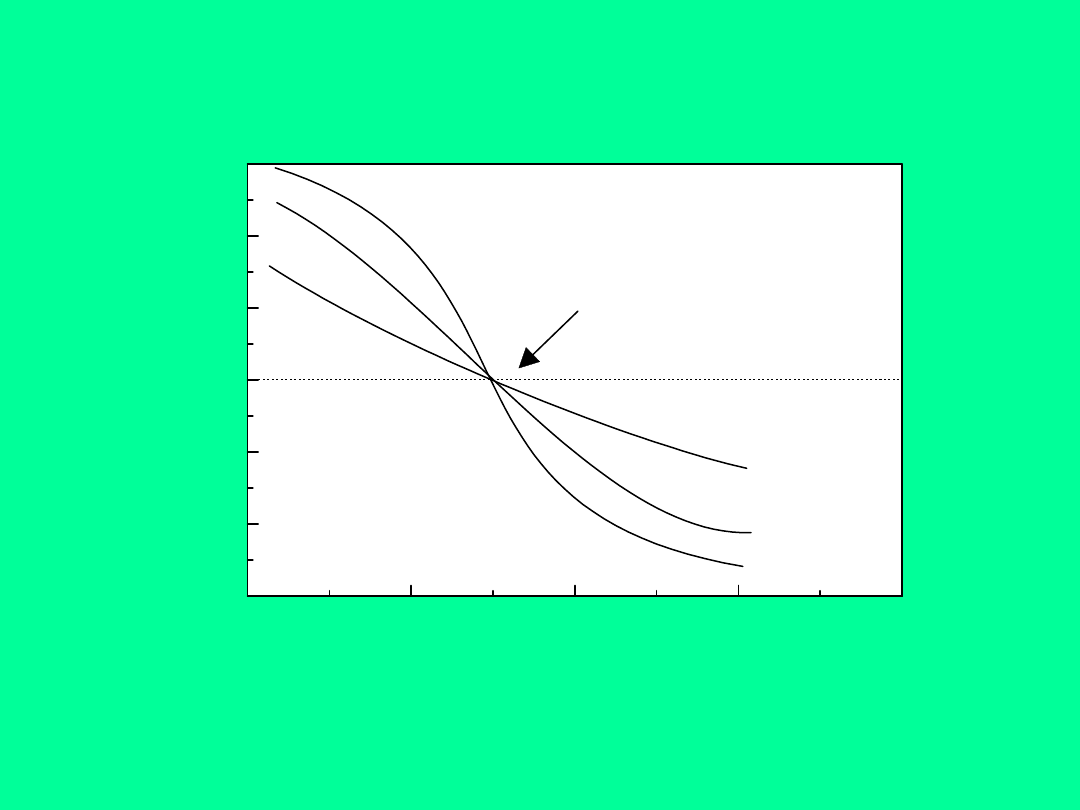
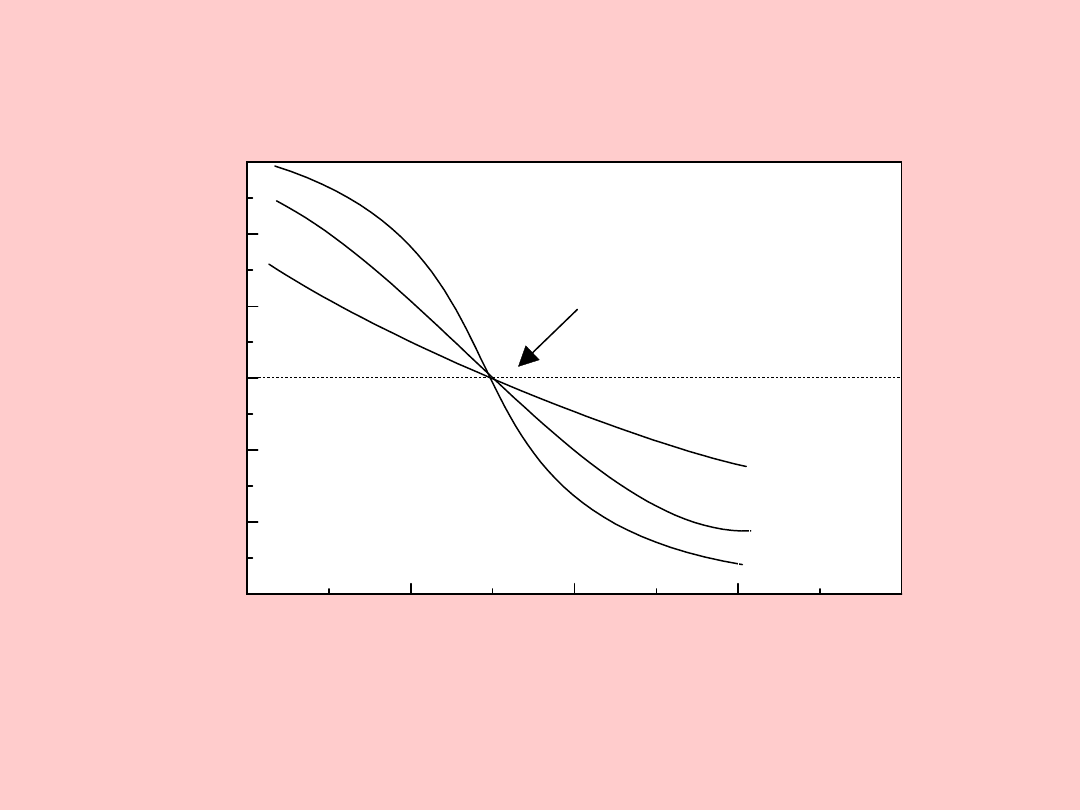
budowa elektrycznej warstwy
podwójnej
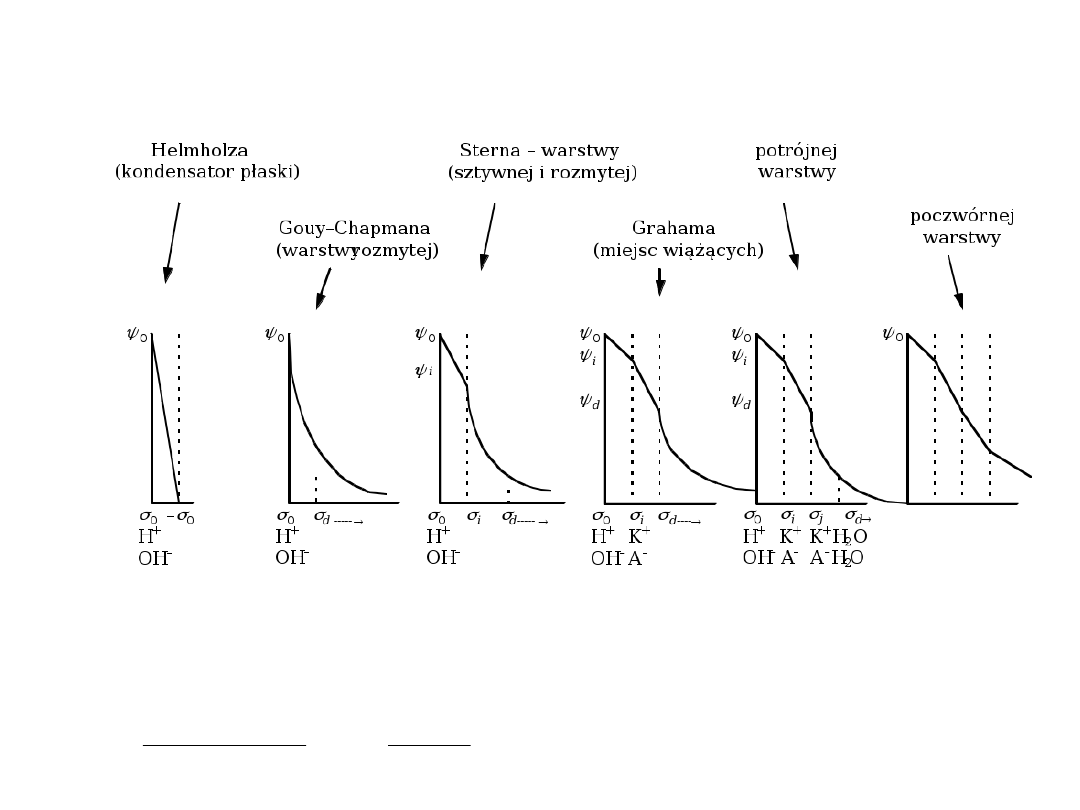
Modele ewp
0
=
0
0
kondensator płaski
kT
ze
ze
kT
d
2
sinh
2
0
0
0
kondensator rozmyty
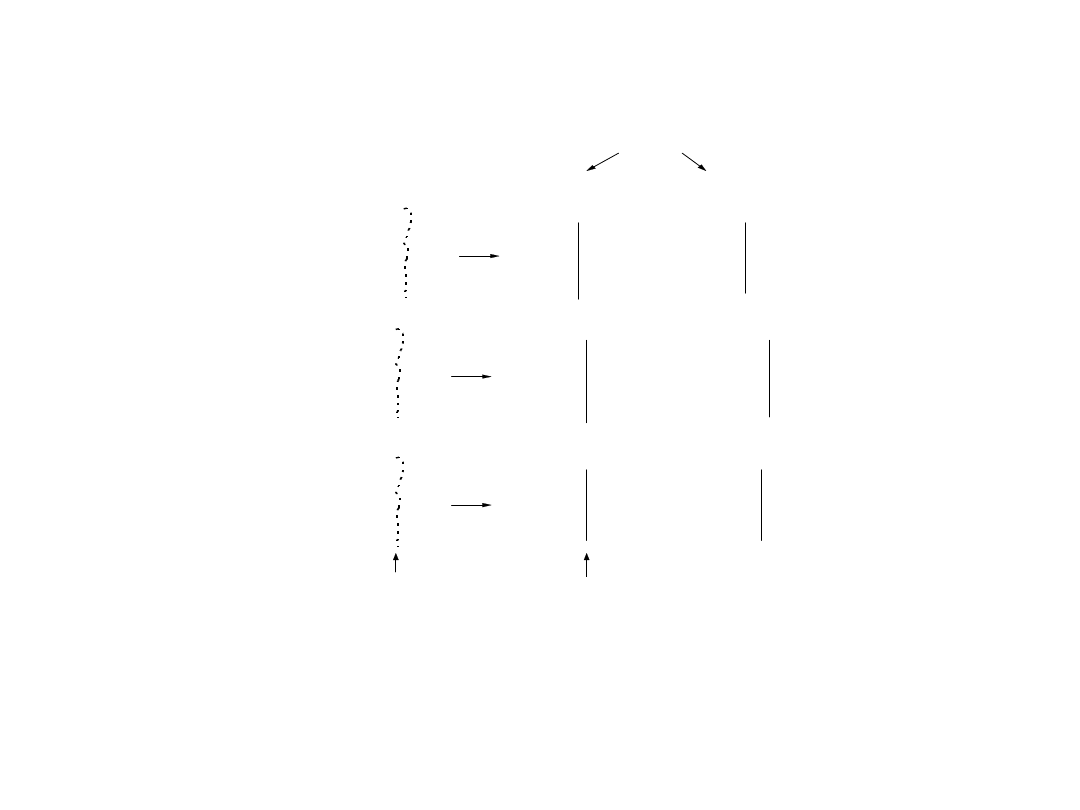
Formowanie się ładunku
elektrycznego
+ n X
-
lub
dodatni
ładunek pow ierzchniow y
ujemny
miejsce przełomu ziarna
+ n M e
+
M e M e M e M e
M e M e M e M e
M e M e M e M e
H
2
O
rtęć
lub
M e M e
M e
-
M e M e
M e M e
M e M e
M e M e
+
elektrony
M e O M e O
O M e O M e
M e O M e O
H
2
O
O M e O
-
M e O H
O M e O
-
M e X M e X
X M e X M e
M e X M e X
H
2
O
M e X
X
-
M e X
+ n M e
+
X M e
M e
+
X M e
lub
+ n H
+
O M e O H
2
+
M e O H
O M e O H
2
+
+ n O H
tlenki
sole
granica faz ziarno/w oda
Rys. 12.13. Formowanie się ładunku powierzchniowego na metalach, tlenkach i solach
Me S Me S
S Me S Me
Me S Me S
H
2
O
S MeOH
Me SH
S MeOH
+ H
+
S MeOH
2
+
Me SH
S MeOH
2
+
+ n OH
-
S MeOH
Me S
-
S MeOH
inne
lad2
Rys. 12.14. Form
owanie się ładunku powierzchniowego na siarczkach
Formowanie się ładunku
elektrycznego
2
4
6
8
10
pH
-60
-40
-20
0
20
40
60
ła
d
u
n
e
k
p
o
w
ie
rz
c
h
n
io
w
y,
µ
C
/c
m
2
p.z.c.
0,001M NaCl
0,01M NaCl
0,1M NaCl
2
4
6
8
10
pH
-60
-40
-20
0
20
40
60
p
o
te
n
c
ja
ł
d
ze
ta
,
m
V
i.e.p.
0,001M NaCl
0,01M NaCl
0,1M NaCl
Wartości
punktu
zerowego
ładunku
(pzc)
i
punktu
izoelektrycznego
(iep)
dla
różnych
substancji
w
roztworach
wodnych.
Zbiór pzc i iep dla wielu substancji można znaleźć w pracy Parksa (1965)
Substancja
pH
pzc
pH
iep
Kwarc, SiO
2
<5
1,54
Kwas oleinowy, C
17
H
33
COOH
2,0
Kasyteryt, SnO
2
<5,5
2,0–5,5
Siarka, S
–
2,1
Siarczki, MeS
–
2,1–7,0
Lód, D
2
O
7,0 0,5
3,0–3,5
Węglowodory, C
n
H
2n+2
6,3
3,3
Powietrze, O
2
+N
2
+CO
2
–
3,5
Diament, C
–
3,5
Bakterie (Nocardia)
–
3,5
Rutyl, TiO
2
4,8–5,3
Ilmenit, FeTiO
3
5,6
Hematyt, Fe
2
O
3
6,5–8,5
4,8–8,7
Baryt, BaSO
4
–
6,0–8,1
Tenoryt, CuO
6,5–8,5
6,0–7,6
Dolomit, (Ca,Mg)CO
3
–
7,5
Magnezyt, MgCO
3
7,5
Korund, Al
2
O
3
9,1
Peryklaz, MgO
12,0

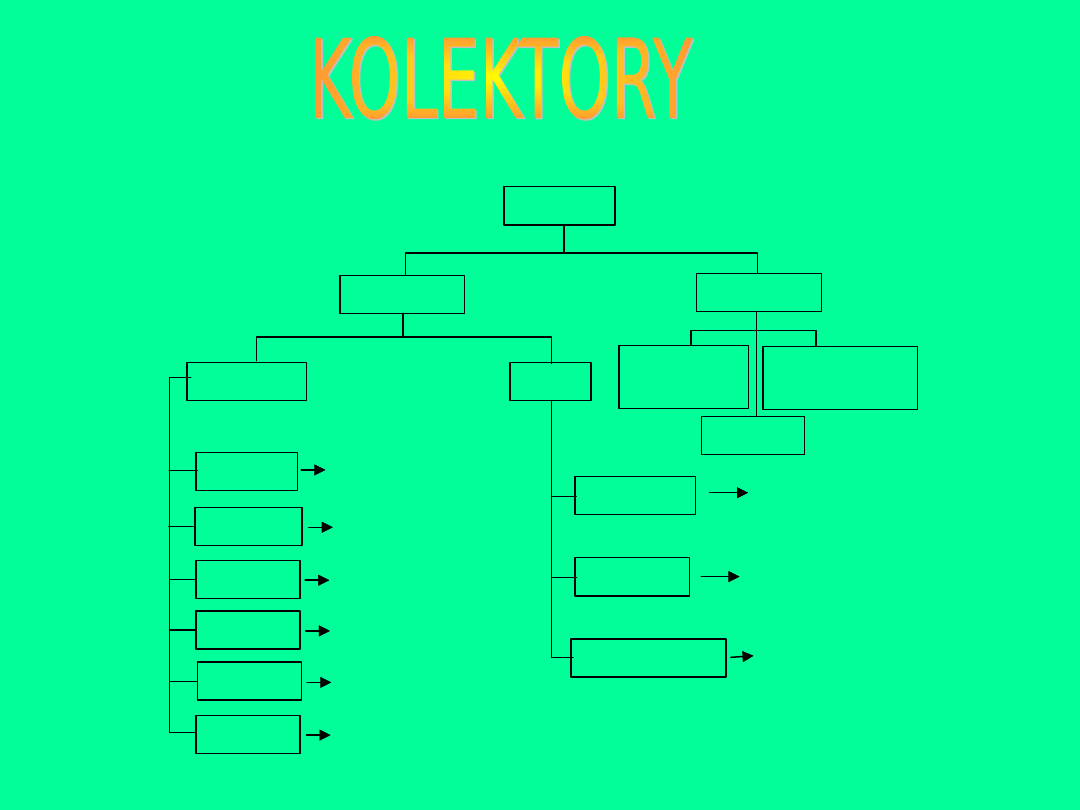
kolektory
jonogenne
niepolarne
chelatowe
amfoteryczne
proste
węglowodory
i pochodne
kationowe
anionowe
typu S-S
kwasy tłuszczowe
aminy
oksymy
ksantogeniany
amino-
alkilokwasy
związki
siarkowe
typu O-O
merkaptany
monotiowęglany
karbaminiany
typu O-N
typu S-N
typu O-S
typu N-N
dwuaminy
fot13
alkohole
a
o
le
j
b
-O-H
-O
c
Me
S
d
S
S
Me
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
głowa
(hydrofilowa)
ogon
(hydrofobowy)
COO
–
Budowa
kolektora
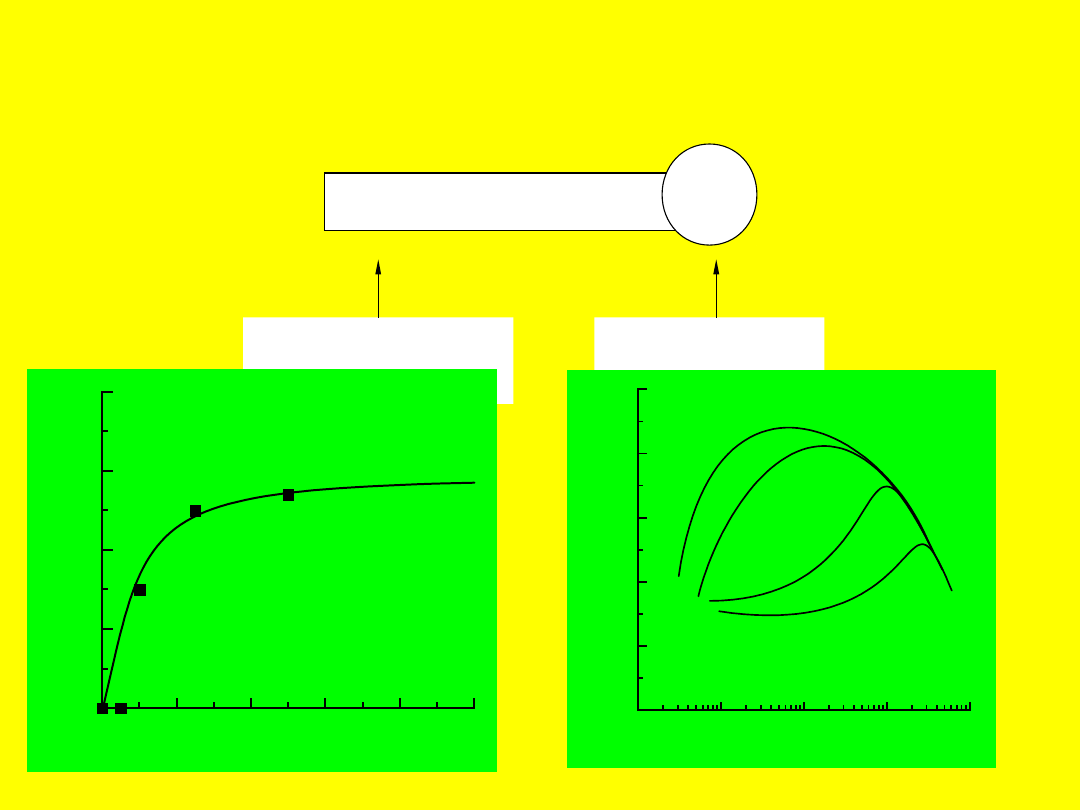
0
2
4
6
8
10
stężenie ksantogenianu etylowopotasowego, g/m
0
20
40
60
80
k
ą
t
z
w
il
ż
a
n
ia
,
s
to
p
n
ie
galena
3
10
-07
10
-06
10
-05
10
-04
10
-03
stężenie oleinianiu sodu, kmol/m
3
0
20
40
60
80
100
k
ą
t
zw
il
ża
n
ia
,
,
s
to
p
n
ie
hematyt - NaOl
pH = 7
pH = 9
pH = 10
pH = 10,5

Przykładowe kolektory niepolarne
Typ kolektora
Przykłady
Węglowodory i pochodne
olej napędowy, nafta, heptan, benzen, halogenopochodne
węglowodorów
Związki siarkowe
dwuksantogen (R–O–C(=S)–S–)
2
ksantogenian mrówkowy R–O–C(=S)–S–C(=O)–O–R´,
dwusiarczki alkilowe R–S–S–R
Alkohole i pochodne
alkilofenylo(polietoksy)alkohole (Triton, Tergitol),
alkilofenole, wyższe alkohole
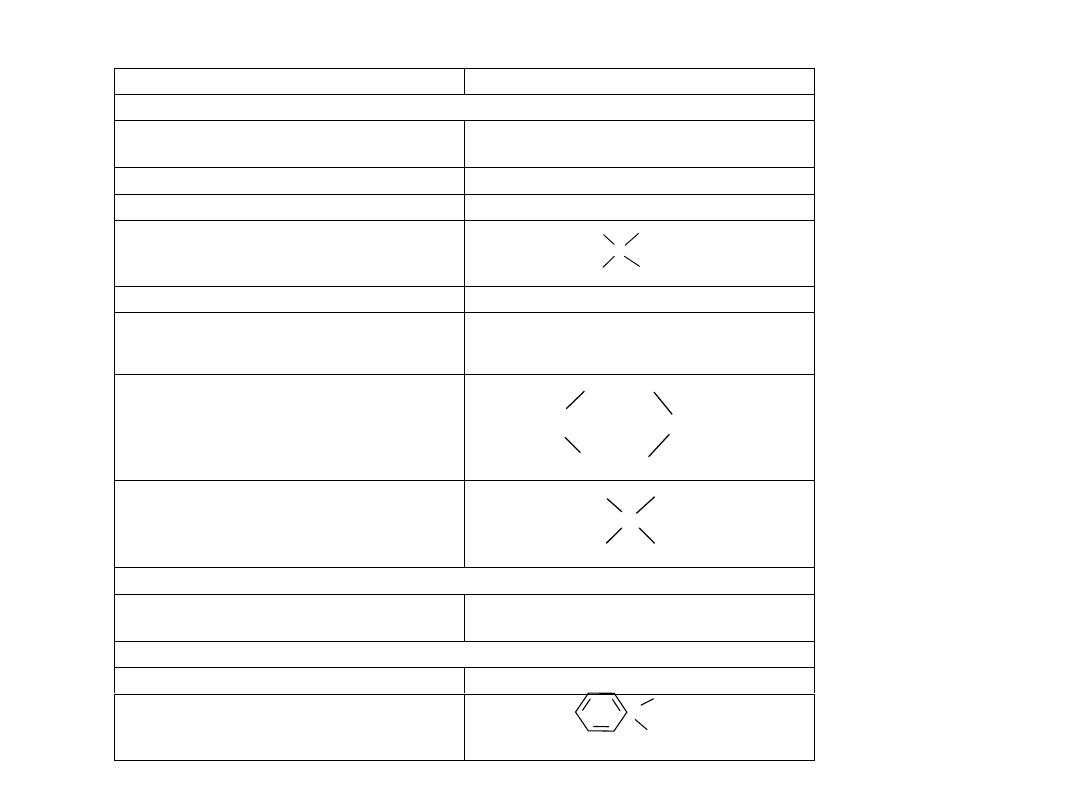
P rzy kłado w e ko lektory jo no genne pro ste
K o lekto r
P rzy kłady
katio no w e
A m iny pierw szo rzędo w e* R – N H
2
dodecy lo am ina C
12
H
25
– N H
2
lub C
12
H
25
– N H
2
·H C l
(C
12
H
25
– N
+
H
3
C l
–
)
A m iny drugo rzędo w e* R – (R ´)N – H
di-n-am y lo am ina, (C
5
H
11
)
2
– N H
A m iny trzecio rzędo w e* R – (R ´)N – R ´´
tri-n- am ylo am ina, (C
5
H
11
)
3
– N
S o le am o nio w e (am iny cz w arto rzędow e)
N +
R ' '
R
R '
R ' '
C l -
D iam iny o raz triam iny
diam ina R – N H – (C H
2
)
x
– N H
2
S o le piry dyno w e
S o le m o rfo linio w e
R N H
C H
2
- C H
2
C H
2
- C H
2
O C l
-
+
S o le sulfo niow e
R
R '
R ' '
S
C l-
+
aniono w e
M erkaptany , R – S H
z po w o du nieprzy jem nego zapachu nie stosuje się
w prakty ce przem y sło w ej
am fo tery czne
K w as N - do decylo -2-am ino propio now y
C
12
H
25
– N
+
H
2
– (C H
2
)
2
– C O O
–
Inne
C
12
H
25
– N H – C H
2
– C O O N a,
C
12
H
25
– N (C H
2
– C O O N a)
2
, R – (C H
3
)
2
N
+
– C H
2
–
C O O
–
(alkilo betaina)
* W prakty ce stosuje się zw y kle ich chloro w o do rki: R – N H
2
·H C l.
N
C l
R
+
-
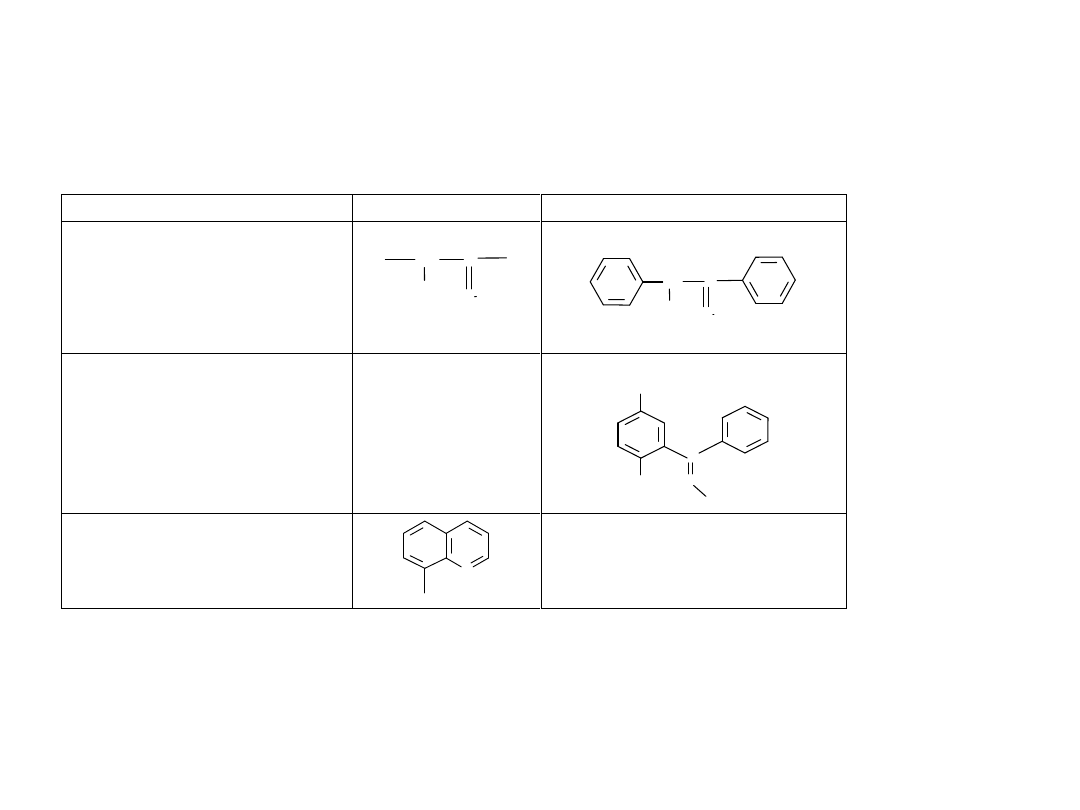
. Wybrane kolektory chelatujące typu O–O
Kolektor
Wzór
Przykłady
Pochodne kwasu węglowego
(kwasy tłuszczowe)
R–COOH
kwas oleinowy (olej talowy), linolowy,
linolenowy, stearynowy
Pochodne kwasu siarkowego
(siarczany)
R–O–SO
3
H
dodecylosiarczan
Pochodne kwasu siarkowego
(sulfoniany)
R–SO
3
H
dodecylosulfonian
Pochodne kwasu fosforowego
(fosforany)
(RO)
2
–P(O)–OH
kwas dwualkilofosforowy
Pochodne kwasu fosfonowego
(fosfoniany, difosfoniany)
(RO)–(R)P(O)–OH
R–(PO
3
H
2
)
2
(difosfonian)
kwas dwualkilofosfonowy,
Flotol-7, 9 (kwas 1-hydroksyalkilidie-
ne-1,1-difosfonowy
Pochodne kwasu fosfinowego
(fosfiniany)
(R)
2
–P(O)–OH
kwas dwualkilofosfinowy
Nitrozofenylohydroksyloamina
(sól amonowa)
(Ar–N(O
–
)–N=O)NH
4
kupferron
Salicyloaldehyd
OH–Ar–CHO
salicyloaldehyd
Nitrozonaftole
ON–nA–OH
-nitrozo--naftol, -nitrozo--naftol
Nitrozofenole
R–(OH)Ar(OH)–NO
nitrozoalkilorezorcynal
Barwniki organiczne
alizaryna i jej pochodne
Kwasy hydroksamowe
R–CO–NH–OH
kwas benzohydroksamowy, hydrok-
samian oktylowo-potasowy, IM-50
(C7-C9)
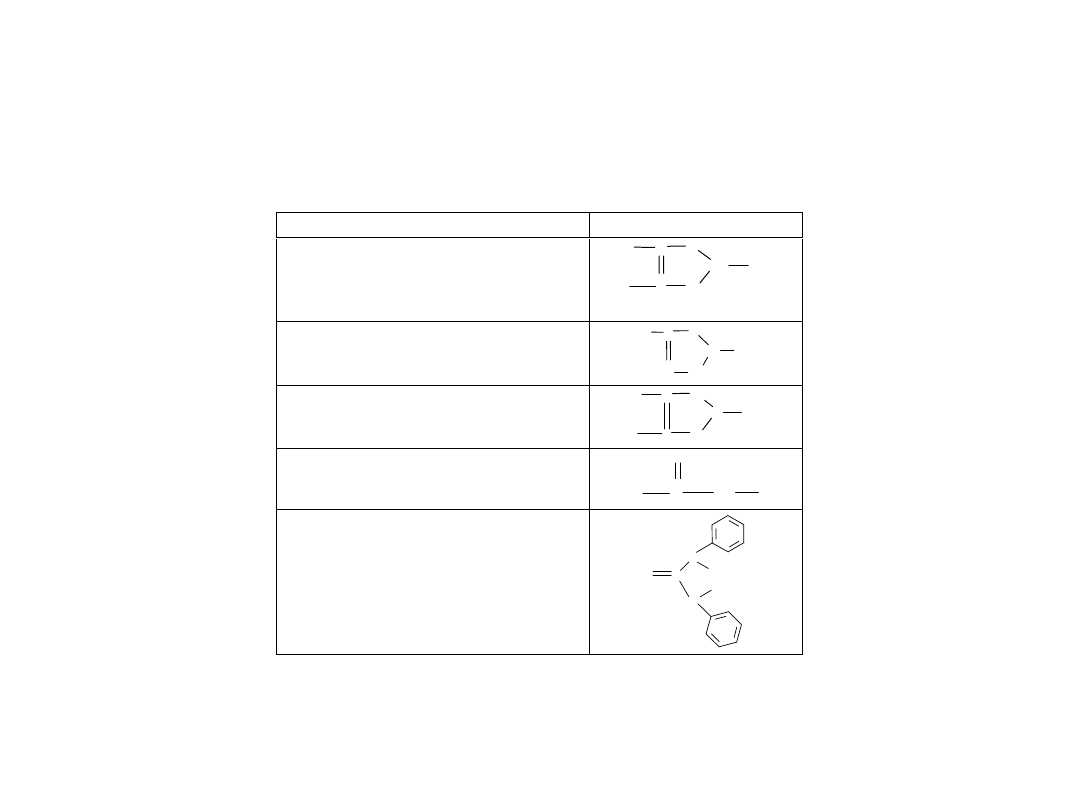
W
ybrane kolektory chelatujące typu S
–S
Kolektor
W
zór
Przykłady
Ksantogeniany (ditiowęg
lany)
S
C - O-
S
-
ksantogenian etylow
o-potasow
y
(R
–O
C
S
S
K)
Tioksantogeniany (trójtiowęg
lany)
S
C - S-
S
-
D
itiofosforany
S
P(OR)
2
S
-
aerofloaty ((R
O
)
2
P(=
S
)–S
K)
D
itiofosfiniany
S
PR
2
S
-
D
itiokarbam
iniany
S
C - NR
2
S
-
W
y
b
r
a
n
e
k
o
le
k
to
ry
c
h
e
la
tu
ją
c
e
typ
u
O
–N
K
o
le
k
to
r
W
zó
r
P
r
zy
kła
d
y
O
k
sy
m
y
CH
OH
N
C
OH
-b
e
n
zo
in
o
o
k
s
ym
CH
OH N
C
OH
d
w
u
m
e
ty
lo
g
lio
k
s
ym
H
y
d
r
o
k
sy
o
k
s
ym
y (L
IX
-y
)
L
IX
6
5
N
OH
C
9
H
19
C
N
OH
8
-h
y
d
r
o
k
sy
c
h
in
o
lin
a
i je
j p
o
c
h
o
d
n
e
N
OH
8
-h
y
d
r
o
k
sy
c
h
in
o
lin
a
(o
k
s
y
n
a
)
W
y
b
r
a
n
e
k
o
le
k
t
o
r
y
c
h
e
la
t
u
ją
c
e
t
y
p
u
S
–
N
K
o
le
k
t
o
r
W
z
ó
r
M
e
r
k
a
p
t
o
b
e
n
z
o
t
r
ia
z
o
le
C S
N
S
H
C
C
(
fl
o
t
a
g
e
n
)
M
e
r
k
a
p
t
o
t
io
d
ia
z
o
le
CN
R
S
S
H
C
N
T
io
t
e
r
t
r
a
h
y
d
r
o
g
ly
o
k
s
a
lin
a
C N
H
N
S
H
C
C
M
o
n
o
- o
r
a
z
d
it
io
k
a
r
b
a
m
in
ia
n
y
C
4
H
9
O
S
C
N
H
C
2
H
5
F
e
n
y
lo
t
io
m
o
c
z
n
ik
S
C
N
N
H
H
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
W12 mod
wde w12
bd w12
Handout w12 2011
ASD w12
anl1 w12 lato2009
W12-SZ-W12 - Chemioterapia zakażeń grzybiczych i wirusowych (Bonns), Naika, stomatologia, Farmakolog
bal w12
Oe i To1 w12
787 W12 VLAN, VPN
W12 CLASS MANG WORK FORMS
stata w12
LOGISTYKA W12, LOGISTYKA - WYKŁAD 12
budow wykłady Budownictwo w12
więcej podobnych podstron