
ROZTWORY KOLOIDALNE
ROZTWORY WŁAŚCIWE
SPOSOBY WYRAŻANIA STĘŻEŃ ROZTWORÓW
PRZELICZANIE STĘŻEŃ
REGUŁA MIESZANIA ROZTWORÓW
Układy dyspersyjne -
roztwory

Układ
•
Układ
– wyodrębniony obszar materii oddzielony od
otoczenia wyraźnymi graniami (
np. roztwór soli w
probówce
)
•
Otoczenie
– wszystko to, co znajduje się poza układem
(
np. ścianki probówki i wszystko to, co znajduje się w jej
otoczeniu
)
•
Faza układu
– jednorodna pod względem fizycznym
część układu oddzielona od reszty układu wyraźną
powierzchnią rozdziału (
np. woda w stanie ciekłym,
woda stanie stałym – lód, woda w stanie gazowym – para
wodna)
•
Składnik układu
– substancja o określonych
właściwościach fizykochemicznych (
np. woda w różnych
stanach skupienia
)
•
Układ dyspersyjny
– układ składający się z fazy
zdyspergowanej
(
rozproszonej
- np. sacharoza) –
f
z
oraz
fazy
dyspersyjnej
(
rozpraszającej
, np. woda) –
f
d

Układ dyspersyjny
Podział układów dyspersyjnych ze względu na
stan skupienia
f
z
i f
d
Stan skupienia
f.
rozpraszanej
Stan skupienia
f. rozpraszającej
Gaz
Ciecz
Ciało stałe
Gaz
Roztwory
gazowe
Aerozol,
mgła
Dym, kurz
Ciecz
Piana
Roztwory
właściwe,
emulsje
Roztwory
właściwe,
koloidy
Ciało stałe
Piana stała
Mokra gąbka Stopy metali
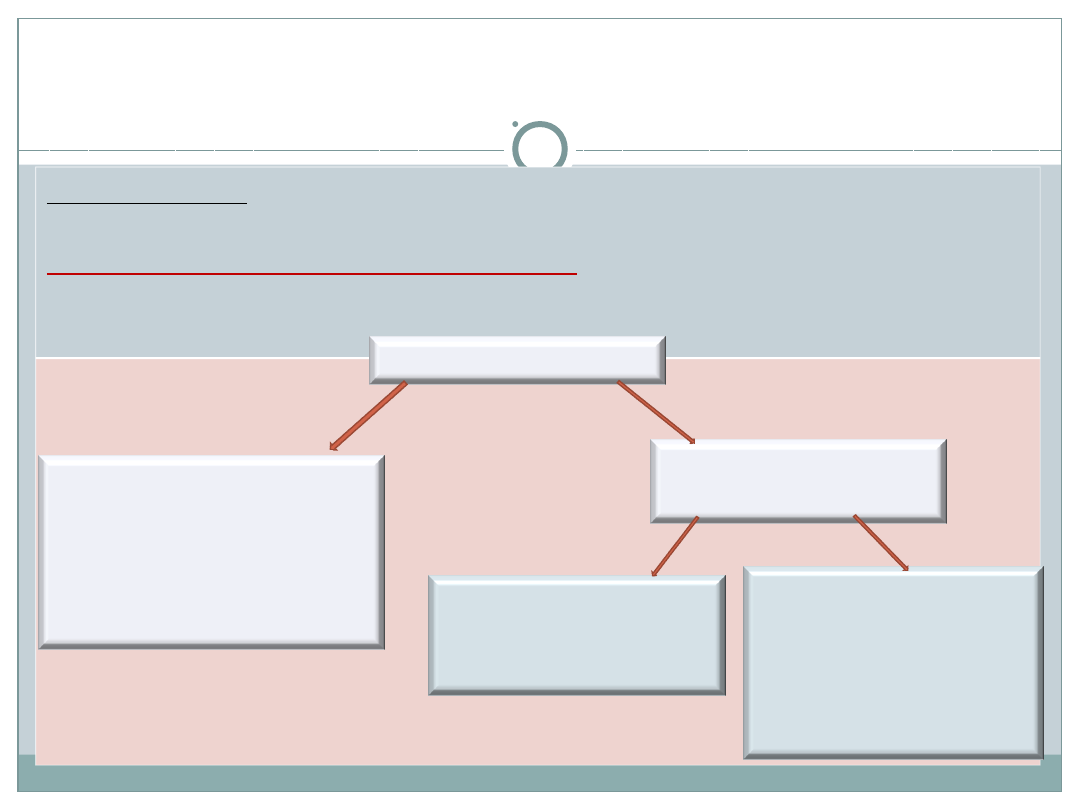
Układ dyspersyjny a mieszanina
Mieszaniny to układy złożone z co najmniej dwóch składników,
zwanych fazami, z których jeden jest rozproszony w drugim.
Podział układów dyspersyjnych ze względu na stan
rozdrobnienia fazy zdyspergowanej (rozproszonej) średnica (x)
cząsteczek w nm (10
-9
m)
Układ
dyspersyjny
Układ
niejednorodny –
heterogeniczny
Zawiesiny
(rozdrobnienie
makroskopowe)
x ≥ 100nm
(10
-7
m)
Roztwory
koloidalne
1nm ≤ x <
100nm
(10
-9
m - 10
-7
m)
Układ jednorodny –
homogeniczny
–
roztwór właściwy
x < 1nm
(10
-9
m)
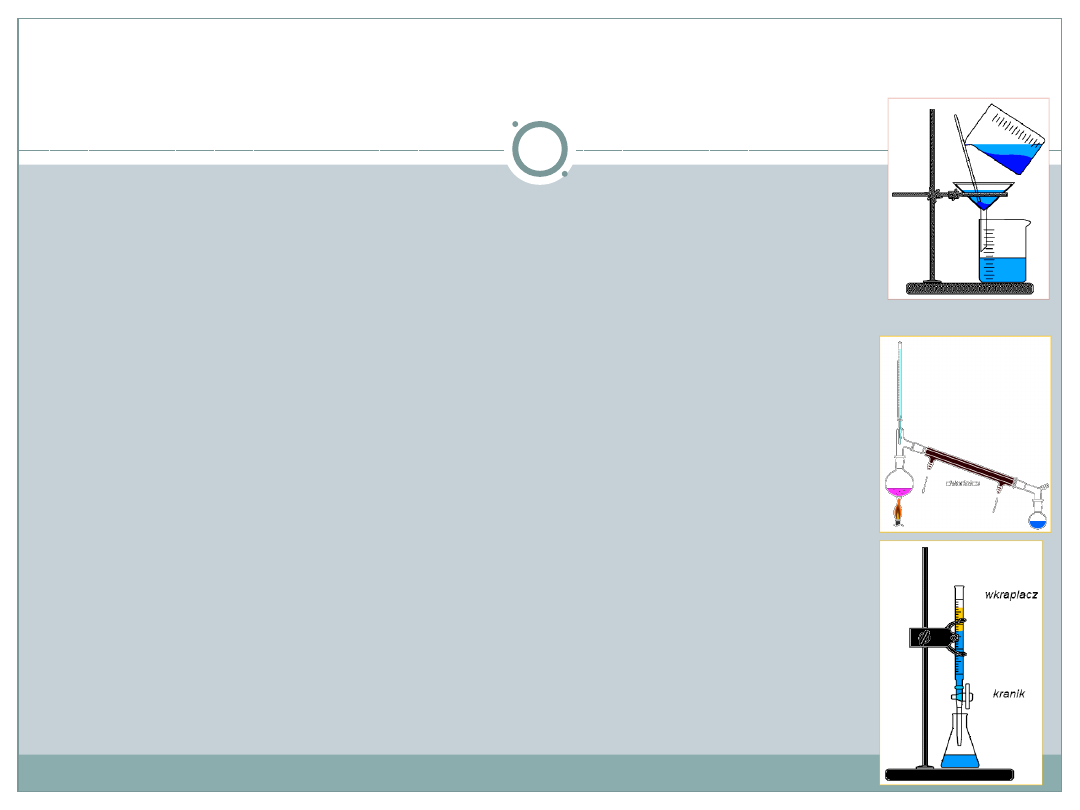
Sposoby rozdzielania mieszanin
Filtracja (sączenie) – metoda oddzielania substancji stałych od cieczy i gazów,
na sączkach o odpowiedniej wielkości porów. Ciecz lub gaz
otrzymywane po filtracji nazywa się filtratem inaczej przesączem, na
sączku zostaje osad.
Sedymentacja – rozdzielanie ciała stałego od cieczy, gdy pod wpływem działania
siły grawitacji gęstsze składniki mieszaniny osadzają się na dnie zbiornika.
Dekantacja -proces oddzielania substancji stałej od cieczy przez zlanie cieczy
znad osadu (po sedymentacji).
Destylacja - to rozdzielanie ciekłej mieszaniny przez odparowanie, a następnie
skroplenie jej składników w różnych temperaturach; produkt to destylat.
Rektyfikacja (destylacja frakcyjna) –to proces wielokrotnej destylacji, w którym
mieszanina ciekła jest rozdzielana na frakcje.
Krystalizacja - to proces wydzielania kryształków substancji stałej z roztworu
podczas odparowania lub schłodzenia roztworu nasyconego.

Sposoby rozdzielania mieszanin
Ekstrakcja następuje przez rozpuszczenie tylko niektórych składników mieszaniny
w rozpuszczalnikach; otrzymujemy ekstrakt.
Chromatografia - to technika
służąca do rozdzielania składników mieszanin w wyniku
przepuszczenia roztworu badanej mieszaniny przez specjalnie spreparowaną fazę
rozdzielczą (złoże, np. bibułę), po której składniki mieszaniny poruszają się z
różną szybkością.
Elektroforeza - technika stosowana w chemii i biologii , jej istotą jest rozdzielenie
mieszaniny na możliwie jednorodne frakcje przez wymuszanie wędrówki ich cząsteczek w
polu elektrycznym.
Wymiana jonowa - to proces wymiany ruchliwych jonów na inne tego samego znaku
zachodzący na specjalnym materiale zwanym jonitem
Adsorpcja — to proces wiązania się („przyczepiania się”) drobin na powierzchni.
adsorbenta, powodujący lokalne zmiany stężenia
Osmoza - swobodna dyfuzja dowolnej substancji z jednego roztworu do drugiego przez
membranę półprzepuszczalną (czyli przepuszczalną dla jednego składnika). Siłą napędową
osmozy jest różnica stężenia danej substancji chemicznej w obu roztworach.

Roztwory koloidalne
Roztwór koloidalny – układ dyspersyjny, w którym
średnice cząsteczek fazy rozproszonej zawarte są w
granicach
1nm ≤ x < 100nm
Podział układów koloidalnych ze względu
na :
Rodzaj fazy
rozpraszającej
Powinowactwo do
rozpuszczalnika
Budowę fazy
rozproszonej
-
Hydrozole
(
woda
)
-
Alkozole
(
alkohol
)
-
Aerozole
(
powietrze
)
- Liofilowe
(duże
powinowactwo
do
rozpuszczalnika,
łatwo
ulegają
solwatacji)
- Liofobowe
(
małe
powinowactwo
do
rozpuszczalnika,
nie ulegają
solwatacji)
-
Cząsteczkowe
(pojedyncze
makrocząsteczki
)
-
Fazowe
(bardzo
małe
kryształy)
-
Micelarne
(micela)

Charakterystyka roztworów
koloidalnych
Schemat budowy miceli AgI
wytrąconego nadmiarem KI.
Na trwałość roztworów koloidalnych
liofobowych (wodorotlenki metali, halogenki
srebra) a także niektórych liofilowych (białko)
wpływa występowanie ładunku elektrycznego
na powierzchni cząstki koloidalnej oraz
solwatacja cząstek.
Cząstka dowolnego koloidu posiadająca
ładunek nosi nazwę miceli.
Przykładem miceli może być cząstka jodku
potasu.
Micela składa się z jądra, w skład którego
wchodzą obojętne cząsteczki. Na powierzchni
jądra absorbowane są z roztworu wspólne jony
w przypadku KI jony jodkowe I
-
. Warstwa ta
nosi nazwę warstwy adsorbcyjnej i wiąże się
ona luźno z warstwą rozmytą albo dyfuzyjną
zawierającą jony K
+
.
Jadro razem z warstwą adsorpcyjną nosi nazwę
granuli.
Na granicy faz jądro cząstki koloidalnej -
roztwór, powstaje podwójna warstwa
elektryczna.
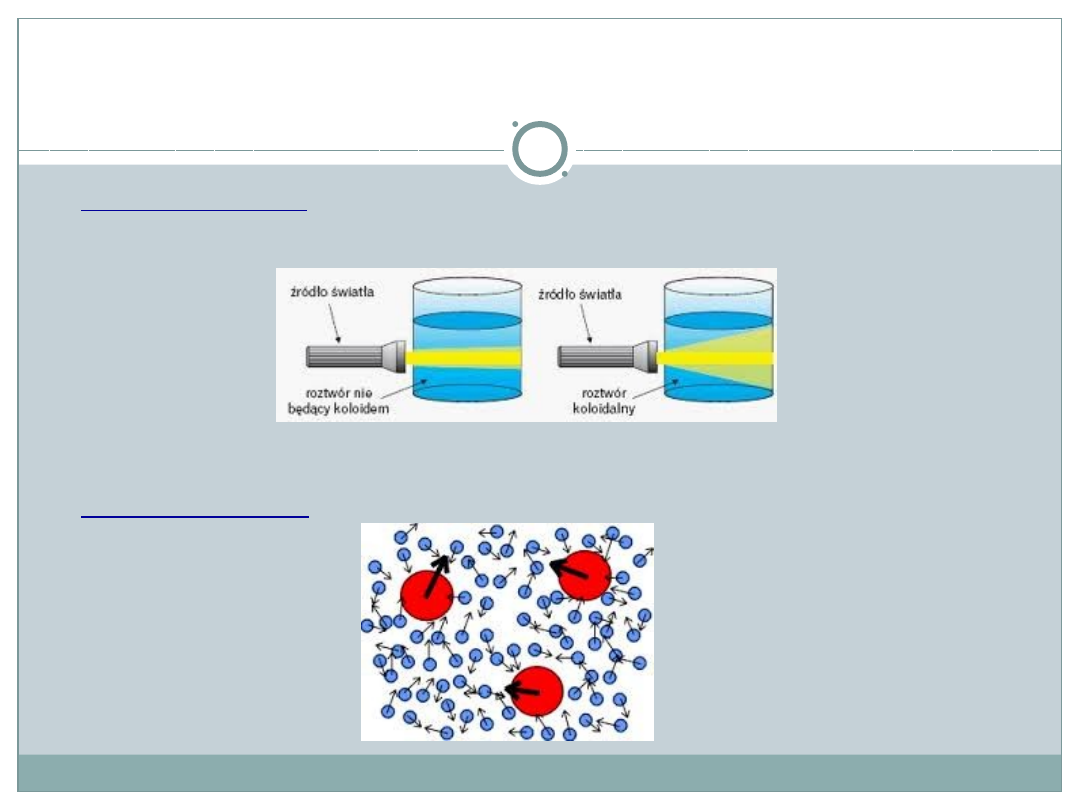
Charakterystyka roztworów
koloidalnych
•
Efekt Tyndalla
–
rozproszenie światła
na cząsteczkach fazy
rozproszonej (cząstki fazy rozproszonej są większe od długości
fali świetlnej)
•
Ruchy Browna
– cząstki fazy rozproszonej
poruszają się w
roztworze po torach zygzakowatych
od odbicia (zderzenia) do
odbicia (zderzenia) z innymi cząstkami
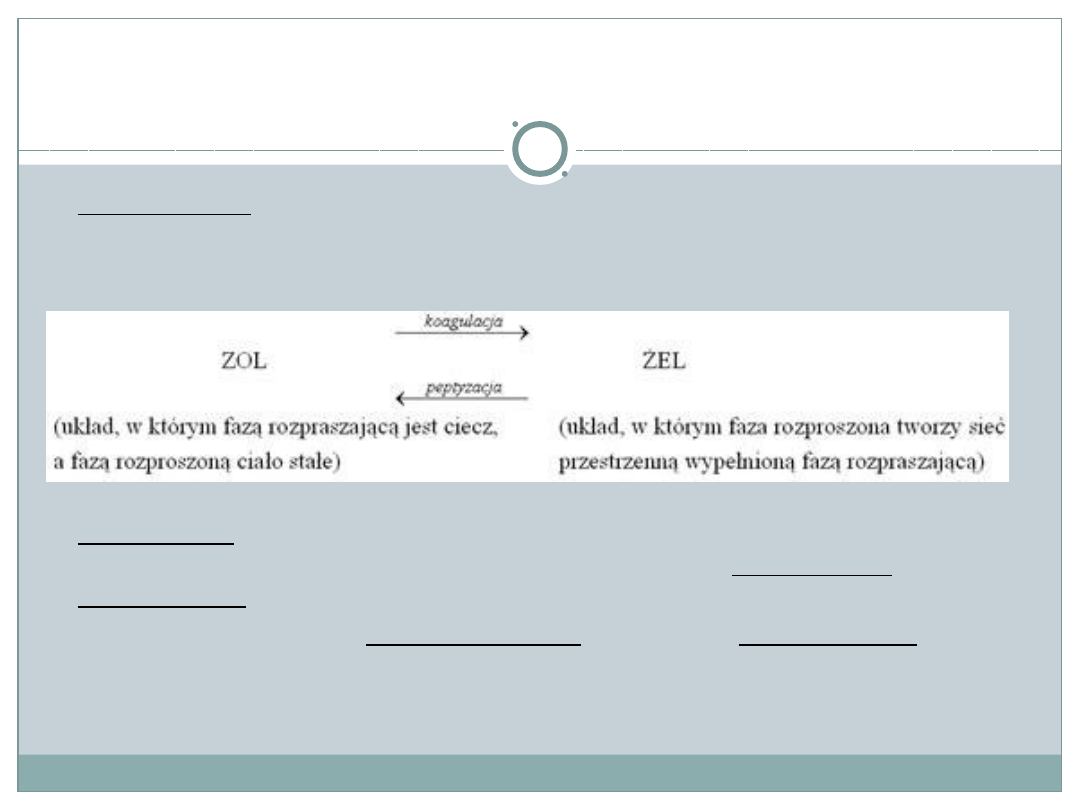
Charakterystyka roztworów
koloidalnych
Koagulacją nazywa się przejście zolu w żel. Jest to łączenie
się cząstek substancji rozproszonej w większe skupienia pod wpływem
np. wysokiej temperatury, mieszania, naświetlania, wstrząsania)
Peptyzacja to przejście żelu w zol. Jest to rozdrobnienie cząstek fazy
rozproszonej. Peptyzacja zachodzi wówczas, gdy koagulacja jest
odwracalna.
Jeżeli koagulacja jest nieodwracalna mówi się o denaturacji koloidu.
Charakterystyka roztworów
koloidalnych
Czynniki powodujące proces koagulacji i
denaturacji koloidu
Koagulacja koloidu
(wysolenie)
Denaturacja koloidu
•dodanie soli metali lekkich
(Na, K, NH
4
)
• dodanie nieelektrolitów
(cukru)
• zmiana temperatury
(obniżenie lub podwyższenie)
• działanie czynnikami
mechanicznymi
• przepływ prądu elektrycznego
• działanie światła
• inne
•dodanie:
- stężonych roztworów kwasów
lub zasad
- roztworów soli metali
ciężkich
- niektórych związków
organicznych (alkoholu,
aldehydu)
• duże zmiany temperatury
• promieniowanie UV
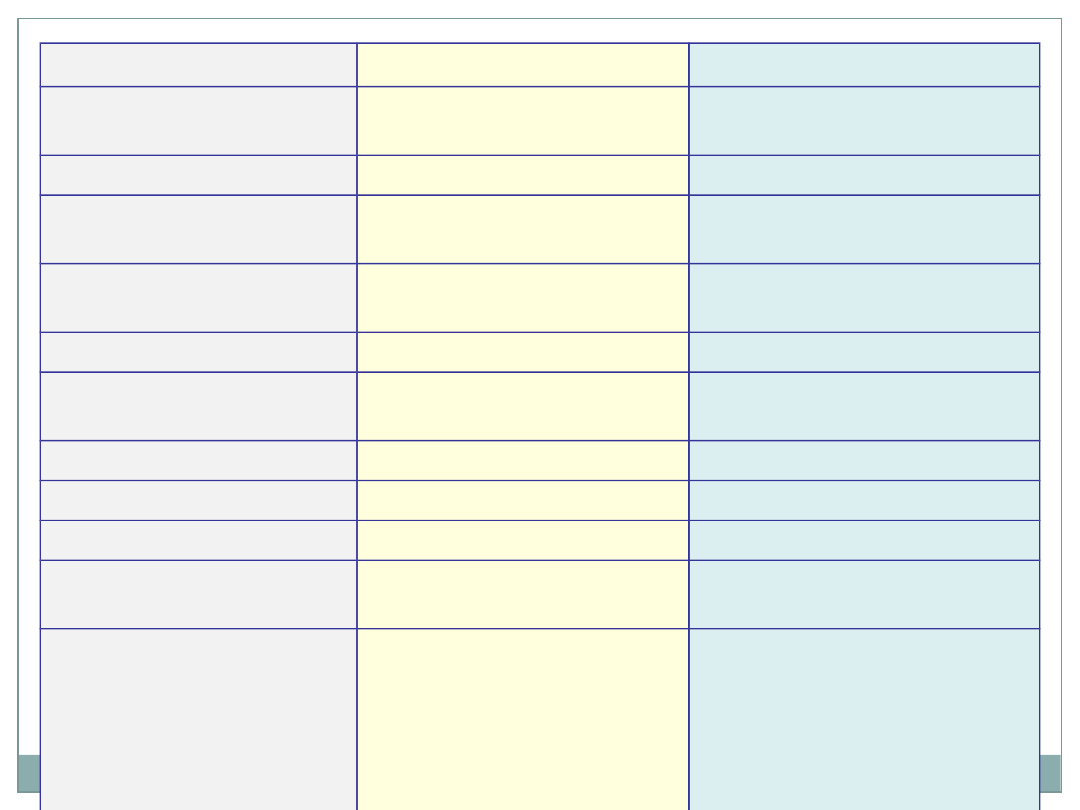
Koloidy liofobowe
Koloidy liofilowe
Otrzymywanie
metodą dyspersji lub
kondensacji
przez zwykłe
rozpuszczanie
Struktura cząstek
zespoły cząsteczek
cząsteczki olbrzymy
Stężenie fazy
rozproszonej
na ogół nieznaczne
może być duże
Ruchy Browna
występują wyraźnie
często bardzo
niewyraźne
Efekt Tyndalla
wyraźny
niewyraźny
Ładunek elektryczny
cząstki są zawsze
naładowane
ładunek nieznaczny lub
brak
Lepkość
nieznaczna
znaczna
Tworzenie piany
nie tworzą piany
łatwo tworzą pianę
Tworzenie galaret
nie tworzą
tworzą łatwo
Wrażliwość na
elektrolit
duża, zachodzi
koagulacja
mała
Trwałość
trwałość tych koloidów
wiąże się z istnieniem
sił elektrostatycznego
odpychania cząstek
fazy rozproszonej
wywołanych przez
jednoimienne ładunki
powierzchniowe
trwałość tych koloidów
wiąże się z istnieniem
otoczki solwatacyjnej
Charakter
koagulacji
z reguły
nieodwracalna
z reguły odwracalna

Roztwory właściwe
•
Roztwór właściwy – jednorodna (homogeniczna) mieszanina
dwóch lub więcej składników, składnik występujący w
nadmiarze nazywa się rozpuszczalnikiem a pozostałe
składniki substancjami rozpuszczonymi ( w zależności od
stanu skupienia wyróżnia się roztwory: gazowe, ciekłe, stałe).
•
Mieszanina – układ złożony z co najmniej dwóch substancji
w dowolnym stosunku.
•
Rozpuszczanie – proces mieszania prowadzący do powstania
roztworu
•
Rozpuszczalność – maksymalna liczba gramów substancji,
która rozpuszcza się w określonych warunkach temp. i
ciśnienia w 100g rozpuszczalnika dając roztwór nasycony .
Roztwory właściwe
Podział roztworów
ze względu na zawartość substancji
rozpuszczonej
c – stężenie roztworu
c
max
– stężenie roztworu wynikające z rozpuszczalności
Roztwory
Roztwór
nienasycony
c < c
max
Roztwór
nasycony
c = c
max
Roztwór
przesycony
c > c
max

Efekty towarzyszące procesom
rozpuszczania
•
Solwatacja – proces otaczania jonów lub cząsteczek przez
cząsteczki rozpuszczalnika (jeżeli rozpuszczalnikiem jest woda –
uwodnienie – hydratacja)
•
Efekt ebulioskopowy – temp. wrzenia roztworu jest wyższa niż
temp. wrzenia rozpuszczalnika (w zależności od ilości drobin
substancji rozpuszczanej).
•
Efekt krioskopowy – temp. krzepnięcia roztworu jest niższa niż
temp. krzepnięcia rozpuszczalnika (w zależności od ilości drobin
substancji rozpuszczanej).
•
Kontrakcja – zmniejszenie objętości układu po połączeniu dwóch
różnych cieczy.
•
Dyfuzja – proces prowadzący do wyrównania stężenia w całej
objętości roztworu
•
Efekty energetyczne – proces endoenergetyczny z pobieraniem
energii cieplnej z otoczenia , proces egzoenergetyczny z oddaniem
energii cieplnej do otoczenia.

Efekty towarzyszące procesom
rozpuszczania
Etapy rozpuszczania i efekt energetyczny rozpuszczania
Dla rozpuszczania się kryształów jonowych:
Etap I – rozerwanie oddziaływań międzycząsteczkowych w rozpuszczalniku
(wiązań wodorowych w zasocjowanych aglomeratach wody)
etap
endoenergetyczny
(E1)
Etap II - wyrwanie jonów z węzłów sieci krystalicznej przez dipole wody i
zniszczenie kryształu jonowego –
etap endoenergetyczny
(E2)
Etap III – solwatacja (uwodnienie - hydratacja) jonów przez dipole wody –
proces egzoenergetyczny
(E3)
Efekt energetyczny rozpuszczania substancji jest sumą efektów
energetycznych etapów :
jeżeli E1 + E2 < E3 to kryształ jest rozpuszczalny w wodzie -
proces
egzoenergetyczny
jeżeli E1 + E2 > E3 to związek jest praktycznie nierozpuszczalny, jego
rozpuszczalność można zwiększyć przez podgrzanie roztworu (dostarczenie
energii do układu) -
proces endoenergetyczny
Krystalizacja – proces odwrotny do rozpuszczania, efekty energetyczne
odwrócone w stosunku do procesu rozpuszczania.
Sposoby wyrażania stężeń
roztworów
Stężenie procentowe C
p
- procent masowy (wagowy) substancji
rozpuszczonej w roztworze (w 100g roztworu)
•
m
s
– masa substancji rozpuszczonej [g]
•
m
r
– masa roztworu [g]
•
m
rozp
– masa rozpuszczalnika [g]
m
r
= m
s
+ m
rozp
Stężenie molowe [mol/dm
3
] C
m
– liczba moli substancji
rozpuszczonej (zawartej) w 1dm
3
roztworu.
•
n – liczba moli substancji rozpuszczonej
•
V
r
– objętość roztworu w dm
3
m
s
- masa sub. rozp. m
r
- masa
roztworu
M – masa molowa sub. rozp. d
r
– gęstość
roztworu
%
100
p
s
p
m
m
c
r
m
V
n
C
M
m
n
s
r
r
r
d
m
V
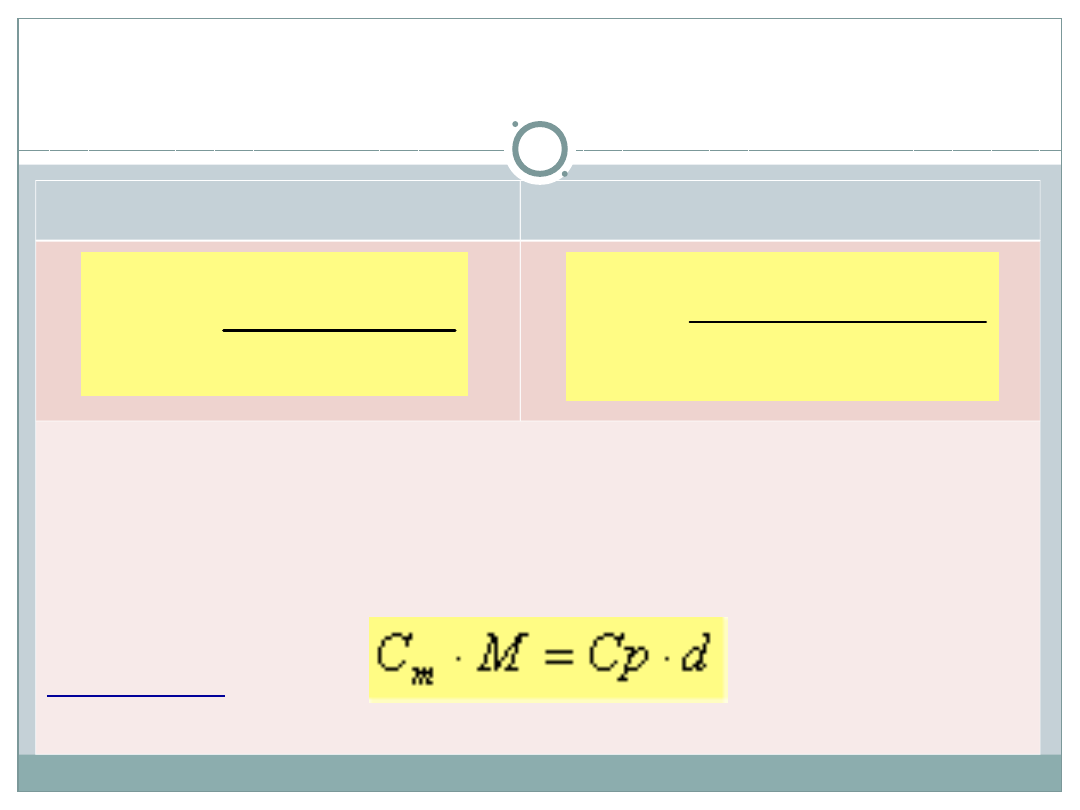
Przeliczanie stężeń roztworów
Przeliczenie z C
p
na C
m
Przeliczenie z C
m
na C
p
C
m
– stężenie molowe roztworu [mol/dm
3
]
C
p
– stężenie procentowe roztworu [%]
d
r
– gęstość roztworu w g/dm
3
(gęstość należy przeliczyć
z g/cm
3
mnożąc ją przez 1000)
M – masa molowa [mol/dm
3
]
Krótko :
C
p
podajemy w ułamku!
M
d
C
C
r
p
m
%
100
r
m
p
d
M
C
C
%
100
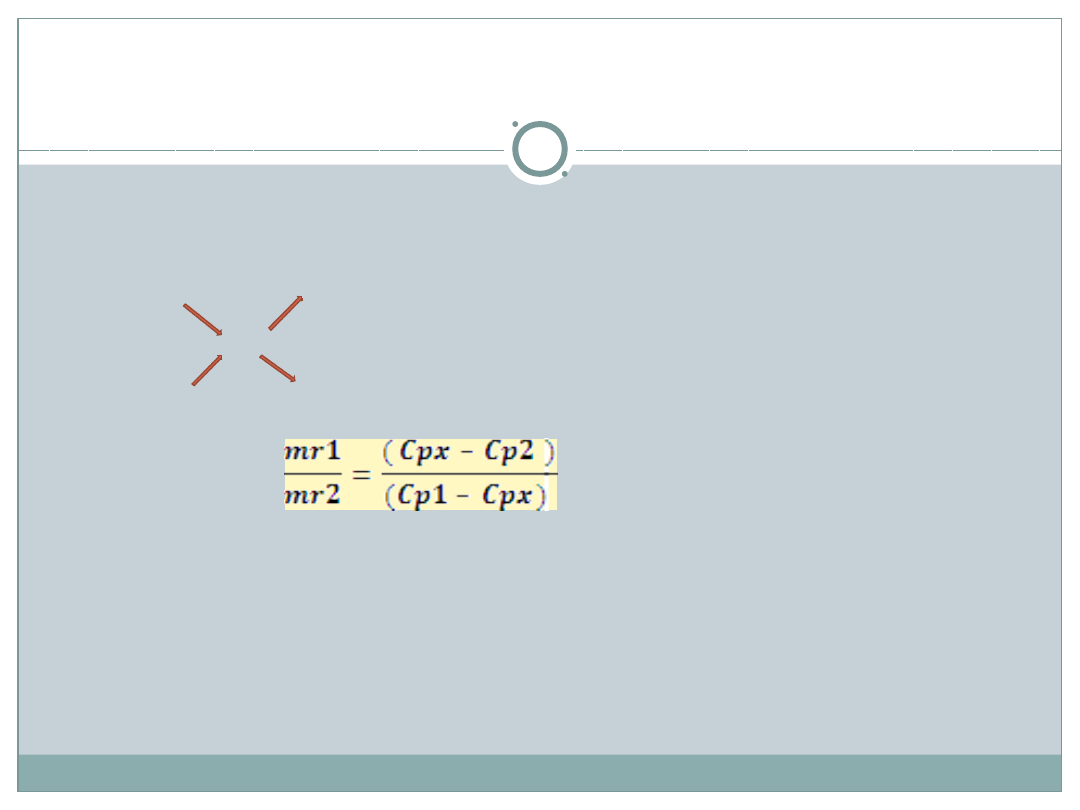
Reguła mieszania roztworów –
metoda krzyżowa
(
dla C
p
)
Obliczanie stężenia procentowego po wymieszaniu roztworu o masie m
r1
i
stężeniu C
p1
z roztworem o masie m
r2
i stężeniu C
p2
(C
p1
> C
px
> C
p2
)
m
r1
C
p1
C
px
– C
p2
C
px
m
r2
C
p2
C
p1
– C
px
Z proporcji:
Uwagi :
rozcieńczając roztwór wodą
, należy przyjąć, że jest to
roztwór ma stężenie 0%
zatężając roztwór solą bezwodną
, należy przyjąć, że jest to
roztwór ma
stężenie 100%
zatężając roztwór hydratem
(solą uwodnioną), należy przyjąć, że jest to
roztwór wodny o określonym stężeniu
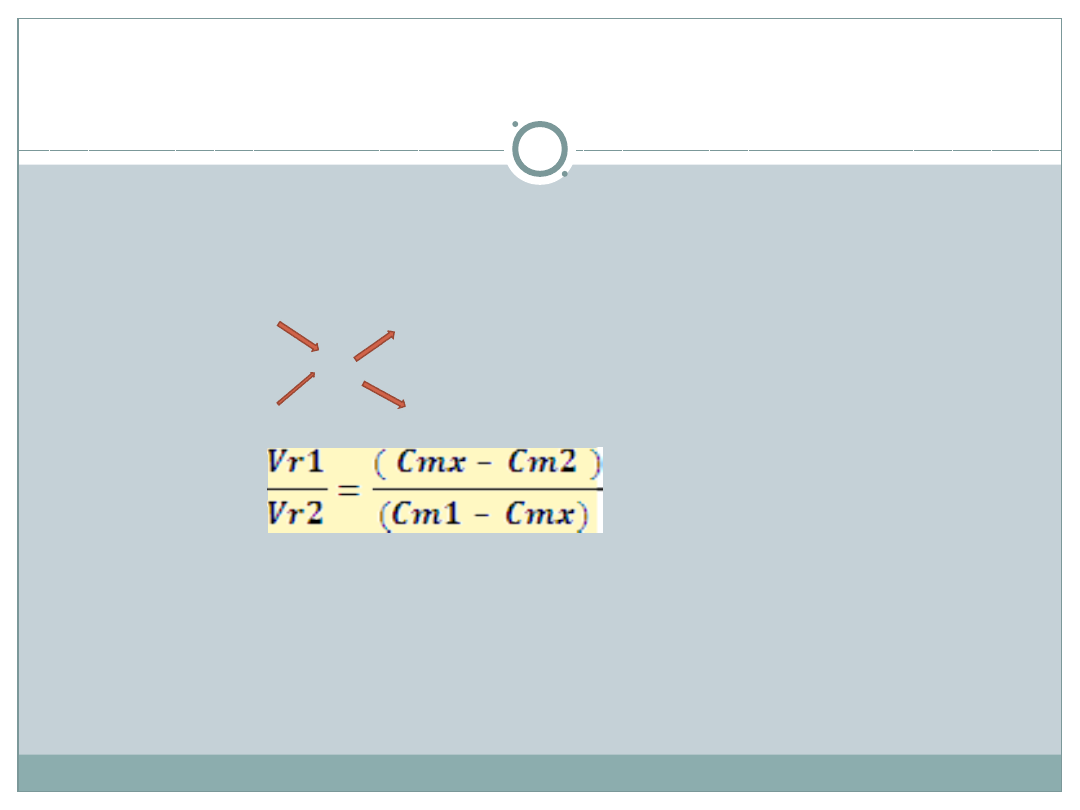
Reguła mieszania roztworów –
metoda krzyżowa
(C
m
)
Obliczanie stężenia molowego po wymieszaniu roztworu o
objętości V
r1
i stężeniu C
m1
z roztworem o objętości V
r2
i stężeniu
C
m2
(C
m1
> C
mx
> C
m2
)
V
r1
C
m1
C
mx
– C
m2
C
px
V
r2
C
m2
C
m1
– C
mx
Z proporcji:
Uwagi :
rozcieńczając roztwór wodą
, należy przyjąć, że jest to
roztwór ma stężenie
0 mol/dm3
zatężając roztwór hydratem
(solą uwodnioną), należy przyjąć, że jest to
roztwór wodny o określonym stężeniu
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
Wyszukiwarka
Podobne podstrony:
Rozdział mieszanin i roztworów, Biotechnologia, Semestr 1, Chemia ogólna, Egzamin
mieszanie roztworów, semestr 1, Chemia, teoria
Wykład 2. Roztwory i stężenia, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wyklad 2. Roztwory i stezenia, Inżynieria środowiska, inż, Semestr I, Chemia ogólna
4 Roztwory i stężenia
9 roztwory-stężenie molowe
chemia-mieszaniny (2) , MIESZANINA - układ co najmniej dwuskładnikowy
chemia, Mieszaniny buforowe, ĆWICZENIE 8
5 5 Mieszanie roztworów
Chemia labolatorium, Roztwory, Wojciech Zdanowicz
Chemia, zestaw ze stężeń
Roztwory i stężenia
Wyklad 2. SKP PCHN Roztwory i stężenia studport
więcej podobnych podstron