Temat: Mieszaniny buforowe Ćw.”H”
1. Część teoretyczna
Stężenie jonów hydroniowych wywiera wpływ na stan równowagi chemicznej w roztworach wodnych, jak również na przebieg reakcji chemicznych. W celu wytworzenia i utrzymania właściwego stężenia jonów hydroniowych w roztworze stosujemy mieszaniny buforowe: są to mieszaniny słabych zasad lub kwasów z ich solami np. CH3COOH i CH3COONa lub NH4OH i NH4Cl oraz mieszaniny soli słabych kwasów wieloprotonowych o różnych stopniach neutralizacji np. NaH2PO4 i Na2HPO4 lub Na2HPO4 i Na3PO4. Mieszaniny buforowe mają określone pH, którego wartość zmienia się nieznacznie po wprowadzeniu do roztworu pewnego nadmiaru jonów H3O+ lub OH-. Inaczej mówiąc, mieszaniny te wykazują „działanie buforujące", tzn. uniemożliwiają gwałtowną zmianę pH roztworu. Podobnie rozcieńczanie czy zwiększanie stężenia roztworów buforowych nie ma wpływu na wartość ich pH. Dla buforu o charakterze kwaśnym, np. CH3COONa + CH3COOH, stężenie jonów hydroniowych [H3O+] oblicza się ze wzoru
![]()
gdzie:
Kk - stała dysocjacji i słabego kwasu
Ck - stężenie kwasu
Cs - stężenie soli
Mechanizm działania roztworu buforującego jest taki: po dodaniu do mieszaniny buforowej kwasu anion soli zawartej w buforze tworzy z jonem H3O+ słabo zdysocjowany kwas, natomiast po dodaniu zasady jon hydroniowy kwasu zawartego w mieszaninie tworzy z jonem OH' słabo zdysocjowane cząsteczki wody. Wskutek powstania słabo zdysocjowanych cząstek kwasu i wody, pH roztworu zmienia się nieznacznie.
![]()
![]()
![]()
W przypadku buforu zasadowego np. NH4OH i NH4Cl, do obliczenia stężenia jonów hydroniowych [H3O+] stosuje się równanie
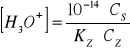
gdzie:
Cs - stężenie soli,
Cz - stężenie zasady,
Kz - stalą dysocjacji słabej zasady danego buforu.
2. Część doświadczalna
Doświadczenie 1:
Sporządzamy roztwory 0,1 M i 0,2 M w następujących proporcjach
Roztwór 1 chlorek amonu/wodorotlenek amonowy - 1/16
Roztwór 2 chlorek amonu/wodorotlenek amonowy - 1/4
Roztwór 3 chlorek amonu/wodorotlenek amonowy - 1/1
Roztwór 4 chlorek amonu/wodorotlenek amonowy - 4/1
Roztwór 5 chlorek amonu/wodorotlenek amonowy - 16/1
A następnie odczytujemy za pomocą papierka lakmusowego pH
Wynik:
Związek chemiczny |
Stosunek objętościowy roztworów |
||||
0,1 mol/dm3 chlorek amonowy |
1 |
1 |
1 |
4 |
16 |
0,1 mol/dm3 wodorotlenek amonowy |
16 |
4 |
1 |
1 |
1 |
Wartość pH |
9,1 |
8,8 |
8,5 |
8,2 |
7,8 |
0,2 mol/dm3 chlorek amonowy |
1 |
1 |
1 |
4 |
16 |
0,2 mol/dm3 wodorotlenek amonowy |
16 |
4 |
1 |
1 |
1 |
Wartość pH |
9,1 |
8,8 |
8,5 |
8,2 |
7,8 |
Doświadczenie 2:
Stosując roztwory 0,1 M, sporządzamy mieszaniny buforowe mieszając je w następujących proporcjach:
Roztwór 1 wodoroortofosforan(V) sodowy/dwu wodoroortofosforan(V) sodowy - 1/16
Roztwór 2 wodoroortofosforan(V) sodowy/dwu wodoroortofosforan(V) sodowy - 1/4
Roztwór 3 wodoroortofosforan(V) sodowy/dwu wodoroortofosforan(V) sodowy - 1/1
Roztwór 4 wodoroortofosforan(V) sodowy/dwu wodoroortofosforan(V) sodowy - 4/1
Roztwór 5 wodoroortofosforan(V) sodowy/dwu wodoroortofosforan(V) sodowy - 16/1
A następnie dodajemy dwuchromian(VI) potasu - barwa żółta
Wynik:
Kolor badanej substancji zmienia się od żółtego do jasno żółtego.
Doświadczenie 3:
Stosując roztwory 0,1 M, sporządzamy mieszaniny buforowe mieszając je w następujących proporcjach:
Roztwór 1 kwas octowy/octan sodowy - 1/16
Roztwór 2 kwas octowy/octan sodowy - 1/4
Roztwór 3 kwas octowy/octan sodowy - 1/1
Roztwór 4 kwas octowy/octan sodowy - 4/1
Roztwór 5 kwas octowy/octan sodowy - 16/1
Wynik:
Związek chemiczny |
Stosunek objętościowy roztworów |
||||
0,1 mol/dm3 kwas octowy |
1 |
1 |
1 |
4 |
16 |
0,1 mol/dm3 octan sodowy |
16 |
4 |
1 |
1 |
1 |
Wartość pH |
5,6 |
5,2 |
4,8 |
3,6 |
3,2 |
Plik pochodzi ze strony:
Wyszukiwarka
Podobne podstrony:
Chemia labolatorium, Mieszanina buforowa, Mieszanina buforowa - stosowana w celu wytworzenia właściw
ćw06 Mieszaniny buforowe2, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Obliczanie pH roztworów mocnych oraz słabych kwasów i zasad oraz mieszanin buforowych, UWM Weterynar
Chemia fizyczna 20-wyniki, chemia fizyczna, chemia, FIZYCZNA - raporty, Ćwiczenie 8
dyd k3a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
Labolatoria (semestr III), Technologia chemiczna, Chemia organiczna, 4 semestr, ćwiczenia
Chemia fizyczna 19, chemia fizyczna, chemia, FIZYCZNA, 19, Ćwiczenie 19
Chemia fizyczna 18-wyniki, chemia fizyczna, chemia, FIZYCZNA - raporty, Ćwiczenie 10
Chemia fizyczna 15, chemia fizyczna, chemia, FIZYCZNA, 15, Ćwiczenie 15
Chemia fizyczna 09, chemia fizyczna, chemia, FIZYCZNA - raporty, Ćwiczenie 1
chemia-mieszaniny (2) , MIESZANINA - układ co najmniej dwuskładnikowy
Chemia mieszaniny, roztwory, stężenia
Chemia fizyczna 27-wyniki, chemia fizyczna, chemia, FIZYCZNA - raporty, Ćwiczenie 23
Chemia fizyczna 25, chemia fizyczna, chemia, FIZYCZNA - raporty, Ćwiczenie 7
więcej podobnych podstron