POLITECHNIKA ŚLĄSKA
WYDZIAŁ CHEMICZNY
TEMAT ĆWICZENIA:
„Wyznaczanie przewodnictwa granicznego elektrolitów”
LABORATORIUM Z CHEMII FIZYCZNEJ
Kufelin Sandra
grupa 1
Inżynieria chemiczna i procesowa
CEL ĆWICZENIA
Celem ćwiczenia jest wyznaczenie przewodnictwa granicznego elektrolitu, chromianu (IV) potasu- K2CrO4.
WSTĘP TEORETYCZNY
Opór elektryczny R, zwany też rezystancją, wyrażany jest w omach(Ω). Opór przewodnika równa się jednemu omowi, jeżeli niezmienne napięcie równe jednemu wlotowi istniejące na końcach przewodnika wywołuje w nim prąd o natężeniu jednego ampera.
![]()
Odwrotność oporu rezystancji nosi nazwę przewodności elektrycznej lub konduktancji i jej jednostką jest simens(S).
![]()
Chemiczną miarą przewodności roztworów elektrolitów jest przewodność molowa, definiowana jako:
![]()
gdzie:
κ- jest właściwą przewodnością elektrolityczną [ S/m],
c- stężeniem badanego roztworu [ mol/m3].
Przewodność molowa zależna jest od stężenia jonów zawartych w badanym roztworze, które są nośnikami ładunku w roztworze i w układzie SI wyrażana jest w jednostce simens razy metr do kwadratu na mol.
Im roztwór jest bardziej rozcieńczony tym wartość przewodności molowej jest większa. W nieskończenie wielkim rozcieńczeniu roztworu, gdzie stężenie dąży do zera i przewodnictwo molowe osiąga wartość graniczną mamy do czynienia z przewodnictwem granicznym.
Prawa dotyczące przewodności elektrolitów opisał Kohlrausch.
W przypadku elektrolitów mocnych przewodnictwo molowe w roztworach o nieskończenie wielkich rozcieńczeniach maleje liniowo według równania Kohlrauscha:
![]()
gdzie:
a- jest stałą
Przewodnictwo graniczne można wyznaczyć po pomiarach przewodnictwa molowego roztworu. Graficznie można to zrobić sporządzając wykres zależności Λm= f(√C) i ekstrapolacji do stężenia wartości zero.
Graniczną przewodność molową w elektrolitach słabych obliczamy korzystając z prawa Kohlrauscha o niezależnej wędrówce jonów, gdzie stałą Λm0 można wyrazić jako sumę wkładów pochodzących od kationów i anionów. Ma to związek z tym, iż w słabych elektrolitach wraz ze wzrostem stężenia przewodność molowa zmienia się na tyle szybko, że bardzo trudno wyznaczyć ją doświadczalnie. Dlatego stosujemy równianie:
![]()
gdzie:
λi0- jest granicznym przewodnictwem jonu i,
νi- liczbą moli jonu i
Przewodności jonowej nie można zmierzyć dzięki pomiarom przewodnictwa, ale może ona posłużyć przy wyznaczaniu trudnych do pomiaru przewodności granicznych słabych elektrolitów, np. CH3COOH. Graniczną przewodność obliczamy tutaj jako kombinacje linową składników reakcji CH3COONa, NaCl i HCl.
![]()
CH3COOH= CH3COONa+ HCl- NaCl
Jest to możliwe dzięki addytywności tej wielkości czyli możliwości określenia jej przez inne zsumowane składowe elektrolitów mocnych zawierających te same jony co elektrolit słaby.
WYKONANIE
Aparatura:
mostek uniwersalny z opcją pomiarów zmiennoprądowych E-316
termostat
naczyńko konduktometryczne
Odczynniki:
woda demineralizowana
woda dejonizowana
K2CrO4
Postępowanie w ćwiczeniu:
Włączyć termostat i ustawić temperaturę 298 K.
Przemyć woda destylowaną naczyńko termostatowane i elektrody, na koniec wodą demineralizowaną.
W kolbie miarowej 250 cm3 przygotować roztwór wyjściowy K2CrO4 o stężeniu 2,0⋅10-3 mol/dm3
Z roztworu wyjściowego przygotować serię ośmiu roztworów rozcieńczonych o stężeniach 0,2⋅10-3, 0,4⋅10-3 ,0,6⋅10-3 ,... ,1,4⋅10-3 ,1,6⋅10-3 mol/dm3 do kolb miarowych o poj.50cm3, odmierzając odpowiednio 5, 10, 15, 20, 25, 30, 35, 40cm3 roztworu wyjściowego i dopełniając woda dejonizowaną do kreski.
Wyznaczyć przewodnictwo właściwe wody dejonizowanej.
Zmierzyć opór serii roztworów zaczynając od najbardziej rozcieńczonego.
Przygotować roztwór 0,001M KCl z roztworu 0,01 M i zmierzyć jego opór.
Wykorzystując przewodnictwo właściwe 0,001 M KCl zmierzyć stałą naczyńka.
Obliczyć przewodnictwo właściwe każdego z roztworów.
W obliczeniach uwzględnić przewodnictwo właściwe wody.
![]()
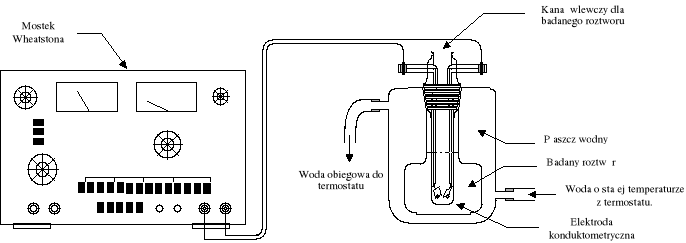
Schemat aparatury pomiarowej wykorzystanej przy wykonywaniu ćwiczenia.
IV.ANALIZA WYNIKÓW
Pierwszymi obliczeniami po wykonaniu ćwiczenia było określenie stałej naczyńka, która według obliczeń wynosi:
kn= 0,05548 [m-1].
Po otrzymaniu tego wyniku trzeba obliczyć przewodnictwo właściwe kolejno dla każdego z roztworów według wzoru:
![]()
gdzie:
kn- stała naczyńka
R- opór zmierzony
Następnie obliczamy κrzeczywiste odejmując od otrzymanych wyników przewodnictwa właściwego wartość przewodnictwa właściwego wody, co ma związek z wahaniami jakości wody dejonizowanej wykorzystanej w ćwiczeniu.
Otrzymane wartości κrzeczywiste wstawiamy do wzoru:
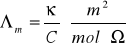
w celu obliczenia wartości przewodnictwa molowego kolejnych roztworów rozcieńczonych i roztworu właściwego.
Rysujemy wykres zależności liniowej c1/2 do Λm.
Do wyznaczenia molowego przewodnictwa granicznego korzystamy z regresji linowej zależności c1/2 do Λm. Wyniki regresji przedstawiają się następująco:
wartość parametru a: -20,3852
po zaokrągleniu wartość parametru a: -20,4 ± 4
wartość parametru b: 0,8178 [m2Ω-1mol-1]
po zaokrągleniu wartość parametru b: 0,82 ± 0,13
Z regresji wynika, że wartość molowego przewodnictwa granicznego wynosi 0,8178[m2Ω-1mol-1].
Wyniki poszczególnych obliczeń znajdują się na karcie wyników dołączonej do sprawozdania.
TABELA WYNIKÓW
RKCl = .......... [Ω] |
κKCl = .......... [S/m] |
stała naczyńka kn = ..........[m-1] |
||||||
Rwody = .......... [Ω] |
κwody = .......... [S/m] |
|
||||||
L.p. |
C [mol/dm3] |
√C |
R [Ω] |
κzmierzone [S/m] |
κrzeczywiste [S/m] |
Λm [m2/Ωmol] |
||
1 |
|
|
|
|
|
|
||
2 |
|
|
|
|
|
|
||
3 |
|
|
|
|
|
|
||
4 |
|
|
|
|
|
|
||
5 |
|
|
|
|
|
|
||
6 |
|
|
|
|
|
|
||
7 |
|
|
|
|
|
|
||
8 |
|
|
|
|
|
|
||
9 |
|
|
|
|
|
|
||
10 |
|
|
|
|
|
|
||
V. WNIOSKI
W tym ćwiczeniu czynnością, która mogła powodować największe błędy był sam pomiar oporności. Powodem tego była dość duża bezwładność wskazań wskazówki pokazującej różnice między oporem mierzonym a kompensowanym. Najmniejsze wychylenie nie było w tym przypadku dość jednoznacznym kryterium i zazwyczaj efekt taki można było osiągnąć w zakresie 0.2 ∼ 0.4 jednostek podziałki oporu kompensującego. Jakkolwiek przy zakresie 10Ω dawało to niewielki błąd bezwzględny, tak już przy zakresie 10kΩ błąd ten sięgał tysięcy omów. Coraz to większy zakres pomiarowy był konieczny przy coraz to mniejszych stężeniach a co za tym idzie powyższy błąd sprzęgał się też z coraz to większym błędem stężenia roztworu. Ciężko było wychwycić odpowiedni moment i wartość, w którym wskazówka „obijała” od wartości zerowej.
Kolejnym kłopotem było odmierzenie odpowiedniej ilości K2CrO4 do sporządzenia roztworu wyjściowego o właściwym stężeniu oraz przygotowaniu pozostałych roztworów rozcieńczonych. Powodem błędów występujących na tym etapie jest sposób w jaki sporządzane były kolejne roztwory czyli metoda łańcuchową.
Ogólnie wyniki obliczeń przedstawiają się dosyć precyzyjnie, ze względu na niską wartość błędu względnego.
Analiza wykresu i wyników wykazuje, że K2CrO4 jest mocnym elektrolitem. Przewodnictwo równoważnikowe wzrasta liniowo, gdy maleje stężenie roztworu.
Wyszukiwarka
Podobne podstrony:
CHEMIA - LABORATORIUM - SPRAWOZDANIE - Wyznaczanie przewodnictwa granicznego elektrolitów, STUDIA
Wyznaczanie rezystywności materiałów elektroizolacyjnych (Politechnika Warszawska)
Sprawozdanie.Lab.Urządzeń.ćw.4, Elektrotechnika Politechnika, urządzenia elektryczne, Sprawozdania
Wyznaczanie energii maksymalnej promienii b, Wyznaczanie energii maksymalnej promieni b 1, Politechn
Wyznaczanie charakterystyk fotokomórki gazowanej, Wyznaczanie charakterystyk fotokomórki gazowanej 2
ZMB IP Techniki elektrochemiczne, Politechnika Śląska ZiIP i inne, Nauka o materiałach
Wyznaczanie przewodności właściwej elektrolitów, AGATA ŻABICKA
Wyznaczanie przewodnoėci wlasciwej elektrolitow opis
Wyznaczanie współczynnika przewodnictwa temperaturowego ciał, POLITECHNIKA CZ˙STOCHOWSKA
WYZNACZANIE STOSUNKU EM ELEKTRONU wersja 2, Pwr MBM, Fizyka, sprawozdania vol I, sprawozdania część
052 Wyznaczanie ładunku właściwego elektronu sprawozdanie
Badanie pola elektromagnetycznego cewki cylindrycznej z przewodzącym rdzeniem - protokół, POLITECHNI
PRZEWODNICTWO RÓWNOWAŻNIKWE ELEKTROLITÓW, studia, chemia, chemia fizyczna, sprawozdania
Przewodnictwo równoważnikowe elektrolitów, Studia, Politechnika
Wyznaczanie ładunku właściwego elektronów, studia, studia, sprawozdania, Ćw 24, ćw24 zaliczone
Wyznaczanie indukcji magnetycznej elektromagnesu przy pomocy teslomierza hallotronowego, Pollub MiBM
więcej podobnych podstron