
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Magdalena Stawarz
Analizowanie procesów chemicznych 311[27].Z1.01
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
dr inż. Ewa Drzewińska
dr inż. Anna Stanisławska
Opracowanie redakcyjne:
dr inż. Magdalena Stawarz
Konsultacja:
mgr Janusz Górny
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 311[27].Z1.01
„Analizowanie procesów chemicznych” zawartego w modułowym programie nauczania dla
zawodu technik papiernictwa.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
4
2. Wymagania wstępne
6
3. Cele kształcenia
7
4. Materiał nauczania
8
4.1. Pojęcie i struktura materii oraz stany skupienia materii
8
4.1.1. Materiał nauczania
8
4.1.2. Pytania sprawdzające
11
4.1.3. Ćwiczenia
11
4.1.4. Sprawdzian postępów
12
4.2. Układ okresowy pierwiastków
13
4.2.1. Materiał nauczania
13
4.2.2. Pytania sprawdzające
14
4.2.3. Ćwiczenia
15
4.2.4. Sprawdzian postępów
16
4.3. Wiązania chemiczne
17
4.3.1. Materiał nauczania
17
4.3.2. Pytania sprawdzające
19
4.3.3. Ćwiczenia
20
4.3.4. Sprawdzian postępów
21
4.4. Zjawiska fizyczne
22
4.4.1. Materiał nauczania
22
4.4.2. Pytania sprawdzające
24
4.4.3. Ćwiczenia
24
4.4.4. Sprawdzian postępów
25
4.5. Reakcje chemiczne, stechiometria reakcji chemicznych
26
4.5.1. Materiał nauczania
26
4.5.2. Pytania sprawdzające
30
4.5.3. Ćwiczenia
31
4.5.4. Sprawdzian postępów
31
4.6. Właściwości, metody otrzymywania oraz zastosowanie związków
chemicznych
32
4.6.1. Materiał nauczania
32
4.6.2. Pytania sprawdzające
34
4.6.3. Ćwiczenia
34
4.6.4. Sprawdzian postępów
35
4.7. Skład pierwiastkowy związków organicznych – węglowodory
36
4.7.1. Materiał nauczania
36
4.7.2. Pytania sprawdzające
38
4.7.3. Ćwiczenia
38
4.7.4. Sprawdzian postępów
39
4.8. Jednofunkcyjne i wielofunkcyjne związki organiczne, związki
heterocykliczne
40
4.8.1. Materiał nauczania
40
4.8.2. Pytania sprawdzające
43
4.8.3. Ćwiczenia
44
4.8.4. Sprawdzian postępów
45

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
4.9. Wielocząsteczkowe związki naturalne i syntetyczne
46
4.9.1. Materiał nauczania
46
4.9.2. Pytania sprawdzające
47
4.9.3. Ćwiczenia
47
4.9.4. Sprawdzian postępów
48
4.10. Układy wieloskładnikowe, mieszaniny i roztwory
49
4.10.1. Materiał nauczania
49
4.10.2. Pytania sprawdzające
51
4.10.3. Ćwiczenia
51
4.10.4. Sprawdzian postępów
53
4.11. Termodynamika i termochemia
54
4.11.1. Materiał nauczania
54
4.11.2. Pytania sprawdzające
56
4.11.3. Ćwiczenia
56
4.11.4. Sprawdzian postępów
57
4.12. Zastosowanie elektrochemii i optyki w procesach kontroli procesów
technologicznych, zagrożenia ekologiczne
58
4.12.1. Materiał nauczania
58
4.12.2. Pytania sprawdzające
61
4.12.3. Ćwiczenia
61
4.12.4. Sprawdzian postępów
62
5. Sprawdzian osiągnięć
63
6. Literatura
68

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
1. WPROWADZENIE
Poradnik ten pomoże Ci w przyswajaniu wiedzy i kształtowaniu umiejętności z zakresu
analizowania procesów chemicznych.
W poradniku zamieszczono:
−
wymagania wstępne – wykaz umiejętności, jakie powinieneś mieć już ukształtowane
przed przystąpieniem do nauki w tej jednostce modułowej,
−
cele kształcenia – wykaz umiejętności jakie ukształtujesz podczas pracy z tym
poradnikiem,
−
materiał nauczania – czyli zestaw wiadomości, które powinieneś posiadać, aby
samodzielnie wykonać ćwiczenia,
−
pytania sprawdzające – zestawy pytań, które pomogą Ci sprawdzić, czy opanowałeś
podane treści i możesz już rozpocząć realizację ćwiczeń,
−
ćwiczenia – mają one na celu ukształtowanie Twoich umiejętności praktycznych,
−
sprawdzian postępów – zestaw pytań, na podstawie których sam możesz sprawdzić, czy
potrafisz samodzielnie poradzić sobie z zadaniami, które wykonywałeś wcześniej,
−
sprawdzian osiągnięć – zawiera zestaw zadań testowych (test wielokrotnego wyboru),
−
literaturę – wykaz pozycji, z jakich możesz korzystać podczas nauki.
W materiale nauczania zostały przedstawione zagadnienia dotyczące klasyfikacji i składu
chemicznego ropy naftowej, gazu ziemnego i wód podziemnych, właściwości
fizykochemicznych kopalin, wykonywania ćwiczeń laboratoryjnych w zakresie badania
właściwości kopalin oraz sporządzania zestawień wyników wraz z ich interpretacją.
Przy wykonywaniu ćwiczeń laboratoryjnych powinieneś korzystać z instrukcji
stanowiskowych, wskazówek i poleceń nauczyciela, zwracając szczególną uwagę na
przestrzeganie zasad bezpieczeństwa i przepisów przeciwpożarowych.
Po wykonaniu ćwiczeń sprawdź poziom swoich postępów rozwiązując test „Sprawdzian
postępów” zamieszczony po ćwiczeniach, zaznaczając w odpowiednim miejscu, jako
właściwą Twoim zdaniem, odpowiedź TAK albo NIE. Odpowiedzi TAK wskazują Twoje
mocne strony, natomiast odpowiedzi NIE wskazują na luki w Twojej wiedzy i nie w pełni
opanowane umiejętności praktyczne, które musisz uzupełnić.
Po zrealizowaniu programu jednostki modułowej nauczyciel sprawdzi poziom Twoich
umiejętności i wiadomości. Otrzymasz do samodzielnego rozwiązania test pisemny oraz
zadanie praktyczne, w formie ćwiczenia laboratoryjnego. Nauczyciel oceni oba sprawdziany
i na podstawie określonych kryteriów podejmie decyzję o tym, czy zaliczyłeś program
jednostki modułowej.
Bezpieczeństwo i higiena pracy
W czasie pobytu w pracowni musisz przestrzegać regulaminów, przepisów bhp i higieny
pracy oraz instrukcji przeciwpożarowych, wynikających z rodzaju wykonywanych prac.
Przepisy te poznałeś już podczas trwania nauki i należy je bezwzględnie stosować.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
Schemat układu jednostek modułowych
311[27].Z1
Chemia stosowana
311[27].Z1.02
Wykonywanie badań laboratoryjnych
311[27].Z1.01
Analizowanie procesów chemicznych

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej, powinieneś umieć:
−
posłużyć się podstawowymi pojęciami chemicznymi,
−
pisać wzory strukturalne i strukturalne uproszczone związków chemicznych,
−
przeliczać jednostki różnych wielkości fizycznych,
−
wykonywać pomiary podstawowych wielkości fizycznych, jak: masa, czas, temperatura,
objętość, itp.,
−
wyrażać i obliczać stężenia roztworów,
−
sporządzać zestawienia w formie tabel,
−
posługiwać się instrukcjami do wykonywania ćwiczeń laboratoryjnych,
−
organizować stanowisko pracy do wykonywania ćwiczeń laboratoryjnych,
−
przestrzegać zasad bezpieczeństwa i higieny pracy, ochrony przeciwpożarowej i ochrony
środowiska,
−
korzystać z różnych źródeł informacji,
−
oceniać własne możliwości w działaniach indywidualnych i zespołowych,
−
zastosować zasady współpracy w grupie,
−
uczestniczyć w dyskusji, prezentacji.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej, powinieneś umieć:
−
wyjaśnić pojęcie materii,
−
określić właściwości pierwiastków na podstawie ich położenia w układzie okresowym,
−
wyjaśnić różnice między zjawiskami fizycznymi a reakcjami chemicznymi,
−
rozróżnić rodzaje reakcji chemicznych i określić ich efekty energetyczne,
−
wskazać czynniki wpływające na stan równowagi i szybkość reakcji chemicznych,
−
określić wpływ różnych parametrów na wydajność reakcji chemicznych, oraz przebieg
procesu technologicznego,
−
ustalić wzór sumaryczny związku chemicznego na podstawie jego składu
elementarnego,
−
scharakteryzować wiązania chemiczne i ich wpływ na właściwości związków
chemicznych,
−
wyszczególnić podstawowe grupy funkcyjne występujące w związkach organicznych,
−
scharakteryzować grupy jednofunkcyjnych związków organicznych oraz metody ich
otrzymywania,
−
scharakteryzować grupy wielofunkcyjnych związków organicznych oraz ich
właściwości i zastosowanie,
−
scharakteryzować
reakcje
otrzymywania
wielkocząsteczkowych
związków
organicznych,
−
określić właściwości oraz metody otrzymywania podstawowych grup związków
nieorganicznych,
−
wyjaśnić pojęcia: ciepło właściwe substancji, znormalizowane ciepło reakcji
chemicznych, stała równowagi chemicznej,
−
scharakteryzować podstawowe równowagi chemiczne występujące w roztworach,
−
wyjaśnić zjawiska zachodzące w procesach krystalizacji, dyfuzji i osmozy,
−
opisać
równowagi
na
granicy
faz
i
scharakteryzować
ich
zastosowanie
w analizie chemicznej (chromatografia, adsorpcja, ultrafiltracja, kataliza),
−
scharakteryzować stany skupienia i przejścia między nimi jako istotne procesy
w rozdzielaniu i oczyszczaniu substancji,
−
scharakteryzować wpływ promieniowania elektromagnetycznego na substancje i określić
jego zastosowanie do określania budowy i czystości substancji,
−
określić wpływ procesów chemicznych na środowisko przyrodnicze,
−
skorzystać z różnych źródeł informacji technicznej.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
4. MATERIAŁ NAUCZANIA
4.1. Pojęcie i struktura materii oraz stany skupienia materii
4.1.1. Materiał nauczania
Pojęcie i struktura materii
Wszystko co nas otacza książka, krzesło, woda jest zbudowane z materii. Materia jednak
to nie tylko rzeczy, których można dotknąć. To także powietrze, którym oddychamy, planety
we Wszechświecie, istoty żywe, na przykład owady i twory martwe, (skały) są zbudowane
z materii. Materia składa się z małych cząstek, zwanych atomami, które są zbudowane
z jeszcze mniejszych cząstek subatomowych. Właściwościami materii są: gęstość, ciężar,
masa, objętość, wytrzymałość, plastyczność, sprężystość, kruchość, rozpuszczalność,
przewodzenie ciepła, przewodzenie elektryczności, temperatura topnienia w wrzenia.
Materia występuje w trzech dających się łatwo rozróżnić stanach skupienia, tj.
−
stałym,
−
ciekłym,
−
gazowym.
Istnieje również czwarty stan skupienia, stan plazmy, który istnieje jedynie w zakresie
niezwykle wysokich temperatur (nie obserwujemy jej jednak często. Występuje głównie we
wnętrzu Słońca i innych gwiazd).
Stan stały charakteryzuje się utrzymaniem kształtu, postaci i objętości próbki, niezależnie
od kształtu naczynia.
Stan ciekły odznacza się tym, że próbka zachowuje swoją określoną objętość podczas
przelewania z jednego zbiornika do drugiego, ale przyjmuje kształt dna mieszczącego ją
naczynia.
Stan gazowy charakteryzuje się tym, że próbka nie ma ani własnego kształtu, ani
objętości i może rozprzestrzeniać się po całej objętości naczynia, w której jest zawarta.
Rys. 1. Stany skupienia materii [19]
Różnice te można łatwo wyjaśnić za pomocą teorii kinetycznej materii zgodnie z którą
w temperaturach powyżej zera absolutnego (tj. powyżej -273
o
C) atomy i cząsteczki substancji
znajdują się w nieustannym ruchu. W ciałach stałych ruch ten nie jest wielki i odnosi się
głównie do oscylacji atomów i cząsteczek względem węzłów sieci krystalicznej. W miarę
ogrzewania rośnie energia kinetyczna ruchów a w temperaturze zwanej temperaturą topnienia
cząsteczki lub pojedyncze atomy, tracą zdolność powrotu do swych pierwotnych położeń
i substancja stała przechodzi w ciecz. Wzajemne oddziaływanie między atomami
i cząsteczkami jest jednak ciągle tak duże, że objętość cieczy w danej temperaturze pozostaje
stała. Dalsze ogrzewanie cieczy prowadzi wreszcie do stanu, w którym cząsteczki uzyskują
energię kinetyczną wystarczającą do pokonania sił wzajemnego przyciągania i ciecz zamienia
się w gaz, zdolny do rozprzestrzeniania się w całej dostępnej przestrzeni.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Wszystko, co możemy zobaczyć, usłyszeć, dotknąć i wyczuć jest zbudowane
z mikroskopijnych cząsteczek nazywanych atomami, których miliardy mieszczą się w kropce.
Atom zaś tworzą cząstki jeszcze mniejsze (subatomowe). W środku każdego atomu znajduje
się jądro zbudowane z protonów i neutronów (nukleonów). Wokół niego krążą cząstki zwane
elektronami, tworzące różne powłoki (warstwy). Protony i neutrony są znacznie cięższe niż
elektrony, masa atomu jest więc praktycznie równa masie jądra. Większe grupy atomów
łącząc się tworzą cząsteczki. Liczba protonów nosi nazwę liczby atomowej. Protony mają
dodatni ładunek elektryczny, natomiast neutrony są elektrycznie obojętne. Elektrony, które
krążą wokół jądra podobnie jak planety wokół Słońca, mają ładunek ujemny; poruszają się
niemal tak szybko jak światło.
Rys. 2. Schemat budowy atomu [11, s. 157]
Atom zawiera zawsze jednakową liczbę elektronów i protonów. Wszystkie atomy danego
pierwiastka zawierają jednakową liczbę protonów, mogą jednak różnić się liczbą neutronów.
W takim wypadku mamy do czynienia z izotopami. Izotopy promieniotwórcze noszą nazwę
radioizotopów. Atomy są znacznie mniejsze, niż to sobie można wyobrazić. 10 milionów
atomów ułożonych obok siebie zmieściłoby się na długości jednego milimetra. Mimo swych
znikomo małych rozmiarów atom stanowi głównie pustą przestrzeń, gdyż elektrony znajdują
się bardzo daleko od jądra. Na każdej z tych orbit elektrony mają ściśle określoną energię.
Pod wpływem pewnych czynników zewnętrznych elektron może przeskoczyć na dalszą od
jądra orbitę- atom jest wtedy w tzw. stanie wzbudzonym, który jest stanem nietrwałym.
Podczas powrotu elektronu na orbitę pierwotną następuje emisja kwantu promieniowania,
o wielkości równej różnicy energii atomu w stanie wzbudzonym i podstawowym.
Opis składu jąder atomowych
Atom, którego jądro zawiera określoną liczbę protonów i neutronów, nazywamy
nuklidem. Opisujemy go za pomocą tak zwanych liczb jądrowych: liczby atomowej Z i liczby
masowej A. Liczby te zapisujemy z lewej strony symbolu pierwiastka chemicznego:
E
A
Z
W takim zapisie A oznacza liczbę masową równą sumie liczb protonów i neutronów
w jądrze, Z to liczba atomowa równa liczbie protonów w jądrze, a „E" - symbol chemiczny
pierwiastka.
Pierwiastek to zbiór atomów o takiej samej liczbie protonów w jądrze.
Dla znanych obecnie 118 pierwiastków wartość liczby atomowej Z wynosi od l (dla
wodoru) do 118 (dla najcięższego pierwiastka).
Wartości liczb masowych wynoszą od l (dla nuklidu H
1
1
) do 293 dla jedynego znanego
dotychczas nuklidu pierwiastka o liczbie atomowej l18. Tak duże atomy położone w dolnej
części układu okresowego są atomami otrzymywanymi sztucznie. Wiele z nich nie ma jeszcze

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
nazwy. Określa się je wtedy zgodnie z zasadami nazewnictwa, uwzględniającymi ich liczbę
atomową – stąd dla 118 pierwiastka stosuje się nazwę ununokt (symbol Uuo). Istnienie
niektórych sztucznie otrzymywanych atomów jest trudne do udowodnienia. Ostatnie badania
podają w wątpliwość istnienie 118 pierwiastka.
Z wartości liczb atomowej i masowej możemy bardzo łatwo określić skład jądra
atomowego, na przykład: dla atomu sodu
Na
23
11
liczba protonów wynosi 11, gdyż Z =11,
neutronów zaś 12 (A - Z = 23 - 11 = 12). Atom chloru
Cl
37
17
ma 17 protonów, ponieważ
Z = 17, i 20 neutronów, gdyż A - Z = 37 - 17 = 20.
Izotopy są to odmiany danego pierwiastka, różniące się liczbą neutronów w jądrze.
Oczywiście, izotopy tego samego pierwiastka muszą mieć jednakową liczbę protonów
w jądrze, co wynika z poznanej już przez nas definicji pierwiastka. Pierwiastki cechują bardzo
różne ilości izotopów: niektóre istnieją w przyrodzie jako tak zwane pierwiastki czyste
izotopowe, czyli w postaci tylko jednego trwałego nuklidu danego pierwiastka (są to między
innymi fluor F
19
9
, sód Na
23
11
, fosfor P
31
15
). Przeważająca większość pierwiastków ma 2 izotopy
lub więcej (najwięcej izotopów charakteryzuje cynę, aż 10 nuklidów tego pierwiastka jest
trwałych).
Ponieważ izotopy danego pierwiastka zawierają różne liczby nukleonów w jądrze, różnią
się od siebie masą atomów. Mają one natomiast identyczne rozmiary atomów, ponieważ
wszystkie charakteryzują się jednakową liczbę elektronów. Ponadto izotopy tego samego
pierwiastka są do siebie podobne pod względem właściwości chemicznych i fizycznych.
Niekiedy jednak wśród izotopów tego samego pierwiastka mogą występować różnice we
właściwościach fizycznych, przy czym są one tym większe, im bardziej izotopy różnią się
masami. Od masy cząsteczek w znacznym stopniu zależy gęstość pierwiastka i szybkość
dyfuzji cząsteczek, natomiast takie cechy, jak na przykład przewodnictwo elektryczne czy
barwa nie zależą od liczby masowej atomu.
Obliczanie średnich mas atomowych
W przyrodzie mamy do czynienia najczęściej z mieszaninami izotopów. Oznacza to, że
bez względu na miejsce wydobycia czy rodzaj związku tworzonego przez dany pierwiastek
składa się on z różnych swoich izotopów. W wodzie morskiej spotykamy na przykład obok
typowego izotopu tlenu
16
O także izotopy
17
O oraz
18
O, tyle że występują one zdecydowanie
rzadziej. Procentowy udział każdego izotopu w masie pierwiastka pozostaje niezmienny,
a ponieważ jednych izotopów jest więcej, a innych mniej, do obliczenia średniej masy
atomowej posługujemy się tak zwana średnią ważoną:
%
100
...
%
%
%
3
3
2
2
1
1
+
⋅
+
⋅
+
⋅
=
p
M
p
M
p
M
M
at
gdzie:
M
1
, M
2
, M
3
– masy atomowe kolejnych izotopów,
p
l
%,p
2
%,p
3
% – zawartości procentowe kolejnych izotopów.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
4.1.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Co to jest materia?
2. Jakie znasz właściwości materii?
3. Jakie znasz stany skupienia materii?
4. Co to jest atom?
5. Jak zbudowany jest atom?
6. Czym charakteryzują się stany skupienia materii?
7. Co to jest pierwiastek i izotop?
4.1.3. Ćwiczenia
Ćwiczenie 1
Oblicz średnią masę atomową boru korzystając z informacji zawartych w poradniku
chemika oraz w niniejszym poradniku.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) znaleźć masy atomowe kolejnych izotopów boru,
2) znaleźć procentowe zawartości kolejnych izotopów boru,
3) zapisać w zeszycie potrzebne wzory obliczeniowe,
4) uwzględniając procentowy udział izotopów, zastosować wzór do obliczenia średniej
masy atomowej,
5) zaprezentować wyniki swojej pracy.
Wyposażenie stanowiska pracy:
−
szkolny poradnik chemika,
−
przybory do pisania,
−
zeszyt,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Oblicz średnią masę atomową tlenu korzystając z poradnika chemika, podręczników do
chemii, a także z informacji zawartych w niniejszym poradniku.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) znaleźć masy atomowe kolejnych izotopów boru,
2) znaleźć procentowe zawartości kolejnych izotopów boru,
3) zapisać w zeszycie potrzebne wzory obliczeniowe,
4) uwzględniając procentowy udział izotopów, zastosować wzór do obliczenia średniej
masy atomowej,
5) zaprezentować wyniki swojej pracy.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
Wyposażenie stanowiska pracy:
−
szkolny poradnik chemika,
−
przybory do pisania,
−
zeszyt,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
4.1.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcie materii?
2) określić właściwości materii?
3) wymienić stany skupienia materii?
4) zdefiniować pojęcie atomu?
5) przedstawić budowę atomu?
6) scharakteryzować stany skupienia materii?
7) zdefiniować pojęcie: pierwiastka i izotopu?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
4.2. Układ okresowy pierwiastków
4.2.1. Materiał nauczania
Współcześnie znanych jest 118 pierwiastków, z których 88 występuje w przyrodzie
w łatwo wykrywalnych ilościach. Kilka następnych otrzymano za pomocą reakcji jądrowych
w analitycznie oznaczalnej ilości, a ostatnich kilka pierwiastków, jak dotychczas, otrzymano
w najmniejszej niedającej się oznaczyć ilości, lecz pomimo to ich chemiczna indywidualność
została jednoznacznie udowodniona. Wszystkie pierwiastki pogrupowane są w tablicy
nazywanej „Układem okresowym pierwiastków”.
Opracowany przez D.I. Mendelejewa układ okresowy pierwiastków jest jednym
z najważniejszych osiągnięć w chemii. Pozwolił w znacznej mierze uporządkować obfity
materiał doświadczalny i właściwie sformułować wnioski co do istoty budowy materii
i zachodzących przemian chemicznych. Używany obecnie układ okresowy
jest
zrekonstruowaną wersją tablicy Mendelejewa, uzupełnioną o grupę mało aktywnych
chemicznie gazów szlachetnych oraz zawierającą nowo odkryte i sztucznie wytworzone
pierwiastki. Układ ten w swej współczesnej postaci przedstawia rysunek 3.
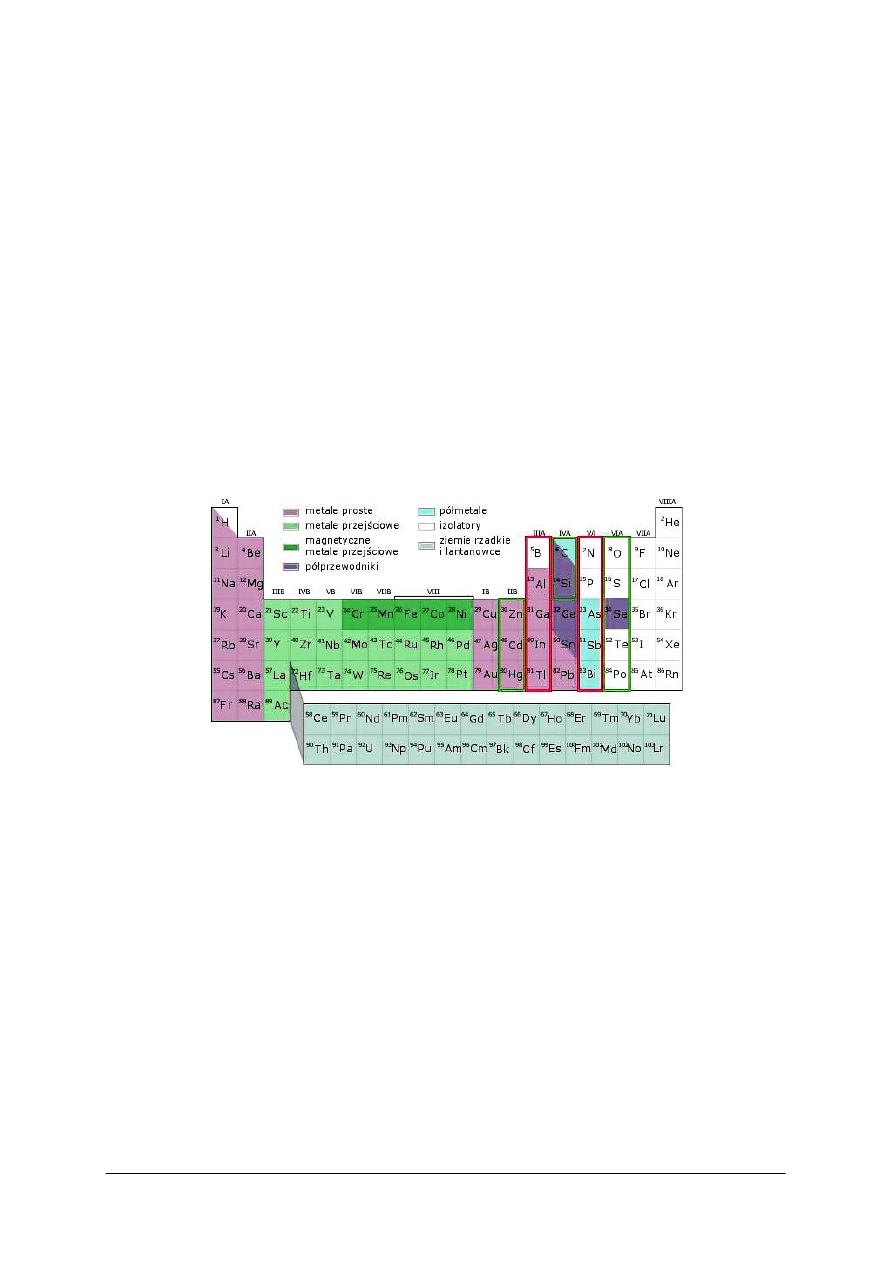
Rys. 3. Układ okresowy pierwiastków [21]
Prawo okresowości mówi, że własności pierwiastków nie są przypadkowe, lecz zależą od
budowy atomu pierwiastka i zmieniają się w sposób ciągły (regularnie) i równocześnie
powtarzalny (okresowo) ze wzrostem liczby porządkowej, widocznej obok symbolu
pierwiastka. Dobrą ilustracją okresowo powtarzających się właściwości jest 1 grupa, która
zawiera takie pierwiastki jak lit (Li), sód (Na), potas (K), rubid (Rb), cez (Cs), frans (Fr) oraz
ostatnia 18 grupa w której znajdują się takie pierwiastki jak, hel (He), neon (Ne), argon (Ar),
krypton (Kr), ksenon (Xe), radon (Rn). Na przykład znając właściwości sodu (Na) w grupie 1,
możemy określić właściwości innych pierwiastków tej samej grupy, czyli litu (Li), potasu
(K), rubidu (Rb), cezu (Cs), fransu (Fr). Pierwiastki te noszą nazwę litowców (metali
alkalicznych).
Budowa układu okresowego
Układ dzieli się na siedem poziomych okresów, każdy okres zawiera ściśle określoną
liczbę pierwiastków, a mianowicie:
−
okres I – 2 (H, He)
−
okres II – 8 (Li, Be, B, C, N, O, F, Ne)
−
okres III – 8 (Na, Mg, Al, Si, P, S, Cl, Ar)

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
−
okres IV – 18 pierwiastków
−
okres V – 18 pierwiastków
−
okres VI – 32 pierwiastki
−
i ostatni, okres VII, niepełny.
Właściwości pierwiastków zmieniają się w okresie stopniowo i powtarzają w okresie
następnym. Było to podstawą do podziału tablicy na osiemnaście grup pionowych. Wszystkie
grupy mają swoją nazwę. I tak pierwiastki poszczególnych grup nazywane są:
−
1 – litowcami
−
2 – berylowcami
−
13 – borowce
−
14 – węglowce
−
15 – azotowce
−
16 – tlenowce
−
17 – fluorowce
−
18 – helowce (gazy szlachetne)
Podobnie nazywa się pierwiastki grup 3 do 12. Przykłady: 3 – skandowce, 4 – tytanowce,
5 – wanadowce, 6 – chromowce, 7 – manganowce.
Należy jeszcze wymienić dwie grupy liczące po czternaście pierwiastków, leżące
w podgrupie trzeciej, są to lantanowce (okres szósty) i aktynowce (okres siódmy). Barwne
oznaczenia umieszczone w tablicy układu okresowego informują nas o charakterze danego
pierwiastka.
Położenie pierwiastka w układzie określamy, podając okres i grupę. Można podać
również liczbę porządkową (liczba stojąca przy symbolu pierwiastka np.
2
He), pod którą
znajduje się ten pierwiastek. Liczba taka nazywana jest liczbą atomową i oznaczana literą
Z. Nie wszystkie pierwiastki występują w przyrodzie. Część otrzymano sztucznie. Są to
pierwiastki stojące poza uranem, dla których liczba porządkowa ma wartość większą od 92.
Istnieje związek między budową układu okresowego a rozkładem elektronów w atomach,
szczególnie zewnętrznych powłok elektronowych. I tak pierwiastki zaliczone do grupy 1 na
ostatniej powłoce walencyjnej mają jeden elektron, grupy 2 – dwa elektrony, grupy 13 - trzy
elektrony, grupy 17 – siedem elektronów i gazy szlachetne (grupa 18) – osiem elektronów.
Podobnie poziome szeregi układu okresowego – okresy – zawierają pierwiastki, których
atomy mają taką samą liczbę powłok elektronowych. Przykłady: pierwiastki pierwszego
okresu posiadają tylko jedną powłokę, pierwiastki drugiego okresu dwie powłoki, pierwiastki
trzeciego okresu trzy powłoki, pierwiastki czwartego okresu cztery powłoki, itd. Zabudowa
powłok elektronowych każdego okresu kończy się ośmioma elektronami (z wyjątkiem
pierwszego). Jest to jedna z najważniejszych prawidłowości układu okresowego, zwana
regułą oktetu.
4.2.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do ćwiczeń.
1. Co to jest układ okresowy pierwiastków?
2. Od czego zależy nazwa grupy w układzie okresowym?
3. Co to jest prawo okresowości?
4. Co jest podstawą do zmiany własności pierwiastków w układzie okresowym?
5. Jaki jest związek między budową układu okresowego a rozkładem elektronów
w atomach?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
4.2.3. Ćwiczenia
Ćwiczenie 1
Określ położenie i ilość elektronów walencyjnych wskazanych pierwiastków w układzie
okresowym.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zgromadzić materiały i przybory potrzebne do wykonania ćwiczenia,
2) zaplanować tok postępowania,
3) ustalić z nauczycielem listę pierwiastków,
4) przygotować tabelę według wzoru,
5) uzupełnić tabelę,
6) dokonać analizy ćwiczenia,
7) zaprezentować pracę.
Lp.
Pierwiastek
Grupa
Okres
Elektrony
walencyjne
1.
Wyposażenie stanowiska pracy:
−
układ okresowy pierwiastków,
−
zeszyt lub arkusz papieru, długopis, linijka, ołówek,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Porównaj właściwości pierwiastków tej samej grupy.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zgromadzić materiały i przybory potrzebne do wykonania ćwiczenia,
2) zaplanować tok postępowania,
3) przygotować tabelę według wzoru,
4) uzupełnić tabelę,
5) dokonać analizy ćwiczenia,
6) zaprezentować pracę.
Litowce
Berylowce
Fluorowce
Tlenowce
Właściwości

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
Wyposażenie stanowiska pracy:
−
układ okresowy pierwiastków,
−
zeszyt lub arkusz papieru, długopis, linijka, ołówek.
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
4.2.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować układ okresowy pierwiastków?
2) określić od czego zależy nazwa grupy w układzie okresowym?
3) wyjaśnić co to jest prawo okresowości?
4) wyjaśnić co jest podstawą do zmiany własności pierwiastków
w układzie okresowym?
5) wyjaśnić jaki jest związek między budową układu okresowego
a rozkładem elektronów w atomach?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
4.3. Wiązania chemiczne
4.3.1. Materiał nauczania
Wiązanie atomowe (kowalencyjne)
Wiązania atomowe (kowalencyjne) powstają, gdy łączą się ze sobą atomy pierwiastków
takich samych wartościach elektroujemności lub o różnicy elektroujemności mniejszej od 0,4.
Wiążące się atomy dążą do osiągnięcia struktury oktetowej najbliższego gazu szlachetnego.
Wiązania tego typu występują w cząsteczkach H
2
, Cl
2
, O
2
, N
2,
itp. Przykładem jest wodór,
dla którego pojedynczy atom ma jeden elektron. Gdy dwa atomy wodoru tworzą cząsteczkę,
ich elektrony rozmieszczają się symetrycznie wokół obydwu jąder, tworząc parę elektronową.
Każdy atom wodoru wykorzystuje wspólnie dwa elektrony i z tego powodu cząsteczka
wodoru jest uboższa energetycznie niż dwa oddzielne atomy a konfiguracja elektronowa staje
się podobna do konfiguracji helu. Dlatego, aby rozbić cząsteczkę wodoru na atomy, należy
doprowadzić do niej pewną ilość energii. W podobny sposób powstają cząsteczki chloru,
bromu, jodu i innych. Wzory cząsteczek wodoru i chloru przedstawiamy symbolami,
w których elektrony walencyjne oznaczone są kropkami.
Rys. 4. Mechanizm powstawania wiązania kowalencyjnego w cząsteczce wodoru [19]
Pary elektronowe można oznaczać również kreskami. Otrzymuje się wówczas klasyczne
wzory strukturalne cząsteczek, na przykład:
H
2
H = H
Cl
2
Cl = Cl
Pary elektronów walencyjnych nie biorących udziału w wiązaniu noszą nazwę wolnych
elektronów. Jeżeli utworzenie jednej wiążącej pary elektronowej nie wystarcza do utworzenia
oktetu, atom może wykorzystać dwa lub trzy elektrony tworząc wiązania podwójne lub
potrójne.
Atom może utworzyć tyle wiązań ile ma niesparowanych elektronów. W wiązaniu
atomowym wiążąca para elektronowa znajduje się w jednakowej odległości od jąder atomów
tworzących wiązanie.
Właściwości fizyczne:
−
w stanie stałym i ciekłym nie przewodzą prądu elektrycznego (wyjątkiem jest grafit),
−
w stanie stałym tworzą kryształy cząsteczkowe lub kowalencyjne,
−
kryształy cząsteczkowe mają stosunkowo niskie temperatury wrzenia i topnienia,
−
kryształy kowalencyjne są trwałe, odporne mechanicznie, mają wysokie temperatury
topnienia,
−
nie ulegają dysocjacji jonowej,
−
reagują zwykle wolno,
−
rozpuszczają się w rozpuszczalnikach niepolarnych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
Wiązanie atomowe (kowalencyjne) spolaryzowane
Wiązanie atomowe spolaryzowane jest wiązaniem pośrednim między jonowym
a atomowym; powstaje wówczas, gdy łączą się ze sobą atomy pierwiastków różniących się
elektroujemnością w zakresie od 0,4 do 1,7.
Cecha charakterystyczną tego wiązania jest przesunięcie pary elektronowej wiążącej
atomy w kierunku atomu pierwiastka bardziej elektroujemnego. Jednym z przykładów tego
wiązania może być połączenie chloru i wodoru w cząsteczce chlorowodoru. Wspólna para
elektronowa w cząsteczce H - Cl jest silniej przyciągana przez atom chloru niż przez atom
wodoru, jest więc przesunięta w kierunku atomu chloru.
Rys. 5. Mechanizm powstawania wiązania kowalencyjnego spolaryzowanego w cząsteczce chlorowodoru [19]
Cząsteczki
z
wiązaniami
kowalencyjnymi
spolaryzowanymi
z
powodu
nierównomiernego, niesymetrycznego w stosunku do środka cząsteczki, rozmieszczenia
ładunków wykazują biegunowość. W cząsteczkach tych wyróżnić można biegun dodatni
i ujemny. Cząsteczki o budowie polarnej nazywamy dipolami, tzn. cząsteczkami
dwubiegunowymi.
Właściwości fizyczne:
−
w stanie stałym i ciekłym nie przewodzą prądu elektrycznego,
−
mają stosunkowo niskie temperatury wrzenia i topnienia,
−
nie ulegają dysocjacji jonowej,
−
reagują zwykle wolno,
−
rozpuszczają się w rozpuszczalnikach niepolarnych.
Wiązanie jonowe
Wiązania jonowe występują w układach złożonych z atomów skrajnie różniących się
elektroujemnością (>1,7).
W czasie powstawania wiązania jonowego atom pierwiastka elektrododatniego oddaje,
a atom pierwiastka elektroujemnego przyłącza elektrony. Tworzą się dwa jony
o różnoimiennych ładunkach, przyciągające się dzięki działaniu sił elektrostatycznych.
Powszechnie znanym przykładem wiązania jonowego jest wiązanie między jonem sodu
i jonem chloru w chlorku sodowym Na
+
Cl
-
lub między jonami magnezu i chloru w chlorku
magnezu Cl
-
Mg
2+
Cl
-
.
A.
B.
Rys. 6. Mechanizm powstawania wiązania jonowego [19]
A –atom sodu (Na) oddaje elektron i staje się kationem (Na+), B – atom chloru (Cl) przyjmuje elektron i staje
się anionem (Cl-)

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
Związki zawierające wiązania jonowe składają się z dodatnich i ujemnych jonów
rozmieszczonych na przemian w przestrzeni. Siły oddziaływania elektrostatycznego
pomiędzy jonami są równomiernie rozłożone we wszystkich kierunkach. Siły działające
w układach o wiązaniu jonowym są znaczne, toteż temperatura topnienia i wrzenia tych
związków jest stosunkowo wysoka.
A.
B.
Rys. 7. A - Siły elektrostatycznego przyciągania utrzymują w całości
cząsteczkę, B – struktura kryształu NaCl [19]
Ponieważ każdy jon sodu jest otoczony sześcioma jonami chlorkowymi, a z kolei każdy
jon chlorkowy sześcioma jonami sodowymi nie można rozróżnić, który z jonów sodu do
którego z jonów chloru należy i na odwrót. Cały kryształ można tu traktować jako jedną
makrocząsteczkę.
Właściwości fizyczne:
−
posiadają budowę krystaliczną,
−
w stanie stopionym przewodzą prąd elektryczny – w stanie stałym są praktycznie
nieprzewodzące,
−
rozpuszczają się w rozpuszczalnikach polarnych, powstałe roztwory dobrze przewodzą
prąd elektryczny,
−
topią się w wysokich temperaturach (> 500
°
C),
−
są trwałe i kruche.
4.3.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do ćwiczeń.
1. Jakie znasz rodzaje wiązań chemicznych?
2. Czym charakteryzuje się wiązanie kowalencyjne?
3. Jaka jest różnica między wiązaniem kowalencyjnym a kowalencyjnym spolaryzowanym?
4. Jak powstaje wiązanie jonowe?
5. Ile wiązań może utworzyć atom w wiązaniu kowalencyjnym?
4.3.3. Ćwiczenia
Ćwiczenie 1
Spośród wymienionych związków określ, które posiadają najsilniej zaznaczony charakter
jonowy wiązania.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zgromadzić materiały i przybory potrzebne do wykonania ćwiczenia,
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
2) zaplanować tok postępowania,
3) ustalić z nauczycielem listę związków,
4) przygotować tabelę według wzoru
5) uzupełnić tabelę,
6) dokonać analizy ćwiczenia,
7) zaprezentować pracę.
Lp. Związek
Charakter wiązania
1.
Wyposażenie stanowiska pracy:
−
zeszyt lub arkusz papieru, długopis, linijka, ołówek,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Przedstaw mechanizm powstawania wiązania kowalencyjnego spolaryzowanego
w cząsteczkach związków.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zgromadzić materiały i przybory potrzebne do wykonania ćwiczenia,
2) zaplanować tok postępowania,
3) ustalić z nauczycielem listę związków,
4) narysować schemat powstawania wiązania dla tych związków,
5) dokonać analizy ćwiczenia,
6) zaprezentować pracę.
Wyposażenie stanowiska pracy:
−
zeszyt lub arkusz papieru, długopis, linijka, ołówek,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
4.3.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) wymienić rodzaje wiązań chemicznych?
2) wyjaśnić czym charakteryzuje się wiązanie kowalencyjne?
3) wyjaśnić różnicę między wiązaniem kowalencyjnym a kowalencyjnym
spolaryzowanym?
4) wyjaśnić jak powstaje wiązanie jonowe?
5) określić ile wiązań może utworzyć atom w wiązaniu kowalencyjnym?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
4.4. Zjawiska fizyczne
4.4.1. Materiał nauczania
Zjawisko fizyczne
Zmiany właściwości podczas których nie obserwujemy powstawania żadnych nowych
substancji chemicznych, nazywamy zjawiskami fizycznymi.
Do zjawisk fizycznych zaliczamy proces tworzenia mieszanin i wyodrębniania z nich
poszczególnych składników. Substancje tworzące mieszaninę przed i po wyodrębnieniu
z mieszaniny mają takie same właściwości. Do zjawisk fizycznych zaliczymy procesy takie
jak: topnienie, parowanie, skraplanie, podgrzewanie, przewodzenie prądu elektrycznego,
rozpuszczanie.
Za przykład może posłużyć nam siarka. Siarka ma barwę żółtą, stały stan skupienia, nie
przewodzi prądu elektrycznego i jest krucha. Nad płomieniem palnika topi i początkowo jest
żółtą, ruchliwą cieczą. W wyższej temperaturze ciemnieje i gęstnieje. Gwałtownie oziębiona -
zastyga w brunatną masę, która z czasem robi się twarda, krucha i żółta.
Rys. 8. Zmiany stanu skupienia siarki [19]
Obserwowaliśmy podwyższenie temperatury siarki i jej topnienie oraz gwałtowne
ochłodzenie. Są to zjawiska fizyczne, ponieważ siarka po gwałtownym ochłodzeniu jest dalej
tą samą siarką co przed ogrzewaniem. Po oziębieniu jest koloru żółtego, twarda i krucha.
Przemiana chemiczna
Przemiany podczas których powstają nowe substancje, nazywamy przemianami
chemicznymi, czyli reakcjami chemicznymi.
Jeżeli siarkę będziemy podgrzewali nad palnikiem w otwartym naczyniu to
w początkowym okresie stopi się, następnie zapali (niebieski płomień) i wypali całkowicie.
W pomieszczeniu pojawi się substancja gazowa o duszących i drażniących właściwościach.
W doświadczeniu obserwujemy przemianę siarki w substancję gazową o nazwie tlenek
siarki(IV). Jest to substancja, która w niczym nie przypomina nam siarki. Jest ona gazem
bezbarwnym, o charakterystycznym duszącym zapachu. Przy długotrwałym oddziaływaniu
drażni śluzówkę przełyku i układu oddechowego.
W przypadku siarki za właściwość chemiczną będziemy uważali jej zdolność do palenia
się w powietrzu i tworzenia produktu gazowego – tlenku siarki(IV). Mówimy wtedy, że
zaszła reakcja chemiczna.
Reakcje chemiczne są to procesy, podczas których jedne substancje przechodzą w drugie.
Właściwością chemiczną substancji jest jej cecha, która jest związana z jej udziałem
w reakcjach chemicznych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
Roztwór – jednorodna mieszanina dwóch lub większej liczby substancji chemicznych
tworzących jedną fazę. Roztwory substancji powstają w wyniku mieszania się ich cząsteczek.
Cząsteczki jednej substancji „wciskają” się w wolne przestrzenie miedzy cząsteczkami
drugiej.
Roztwory: Ciało stałe w cieczy i ciecz w ciele stałym
Cząsteczki cieczy penetrują ciało stałe, w kierunku od jego powierzchni do środka,
wnikając coraz bardziej między jego cząstki. Natomiast cząsteczki ciała stałego stopniowo
poprzez dyfuzję oraz ruchy koloidowe przemieszczają się do cieczy, między jej cząsteczki.
Jeśli ciało stałe i ciecz przenikają się wzajemnie to tworzą roztwór w postaci tzw. żelu.
Przykład: Cukier rozpuszcza się w herbacie – powstaje słodki roztwór.
Gdy rozpuszczamy ciało stałe w cieczy, lub odwrotnie zauważamy, że w zależności od
ilości tych dwóch substancji oraz ich właściwości, powstają roztwory bardziej lub mniej
nasycone. Według stopnia nasycenia roztworów, dzielimy je na:
−
roztwory nienasycone – to roztwory, które przy zachowaniu odpowiednich warunków
termodynamicznych (temperatury i ciśnienia), mogą jeszcze przyjąć pewną ilość
substancji stałej do rozpuszczenia.
−
roztwory nasycone – to roztwory, które przy danych warunkach termodynamicznych
osiągnęły jakby swoje „maksimum” w możliwości rozpuszczania w sobie substancji
stałej. Nawet gdy będziemy ją dalej dodawać do roztworu (przy tych samych warunkach
termodynamicznych!), to on nie zmieni swojego stężenia. Nie wytrąci się też z niego
żaden osad.
−
roztwory przesycone – to roztwory o stężeniu większym od stężenia roztworu
nasyconego przy określonej temperaturze. Roztwory te nie pozostają w takim stanie zbyt
długo, gdyż jest on termodynamicznie bardzo niestabilny. Oznacza to, że każde
zaburzenie tego stanu, przez nawet wstrząśniecie czy pyłek kurzu może spowodować, że
nadmiar substancji rozpuszczonej zacznie się krystalizować. Roztwory przesycone
otrzymuje się poprzez powolne oziębianie roztworów nasyconych. Przykładem roztworu
przesyconego jest miód – nadmiernemu rozpuszczaniu ulega w nim glukoza, a jej
krystalizacja trwa nawet do kilku miesięcy.
Proces krystalizacji. Jeżeli substancją rozpuszczoną w roztworze jest ciało mogące
tworzyć kryształy, to siły zdolne powiązać zdyspergowane cząsteczki w sieć krystaliczną
zamanifestują się wówczas, gdy odległości między cząsteczkami substancji rozpuszczonej
i energia translacyjna cząsteczek, tak substancji rozpuszczonej jak i rozpuszczalnika, będą
tego rzędu, że siły te będą zdolne utworzyć stabilne struktury krystaliczne, nierozpadające się
pod wpływem zderzeń z cząsteczkami rozpuszczalnika. Można zatem powiedzieć, że
substancja rozpuszczona wypada z roztworu w postaci krystalicznej wtedy, gdy roztwór
osiągnie temperaturę nasycenia, poniżej której musiałby istnieć roztwór przesycony.
A ponieważ jest to stan ze względów energetycznych nietrwały, z roztworu wypadną
kryształy substancji rozpuszczonej w takiej ilości, by pozostały roztwór był roztworem
nasyconym.
Ciecz w cieczy
Proces dyfuzji – cząsteczki łączonych cieczy mogą: swobodnie się mieszać jak
w przypadku wody i alkoholu, wody i herbaty, itp., nie mieszać się wcale – jak olej i woda
oraz mieszać się częściowo. Dyfuzja jest procesem samorzutnym, nieodwracalnym,
powodującym wyrównywanie stężenia w całym roztworze.
Roztwory większej ilości cieczy (powyżej 2), najczęściej są również niestabilne i tworzą
tzw. układy fazowe.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
W zależności od stężenia mieszanych cieczy, możemy zaobserwować, że wszystkie
ciecze są jednolicie wymieszane, albo stworzyły dwa (lub więcej) odrębne fazowo roztwory,
albo też wszystkie składowe ciecze są wyraźnie oddzielone.
Proces osmozy – jeżeli dwa roztwory o różnych stężeniach przedzielimy błoną
półprzepuszczalną, to po pewnym czasie zauważymy zjawisko samorzutnego wyrównywania
stężeń po obu stronach błony. Zjawisko to, jest podobne do omówionej wyżej dyfuzji.
Obecność w procesie błony półprzepuszczalnej wprowadza tu jednak pewne nowe elementy.
Błoną półprzepuszczalną nazywamy każdą przegrodę, przez którą (dzięki porowatej budowie)
mogą przenikać drobne cząsteczki na przykład rozpuszczalnika, nie przenikają natomiast
cząsteczki duże, na przykład białka czy cząstki koloidalne. Błona półprzepuszczalna fizycznie
najczęściej jest błoną, ale również może to być przegroda ze szkła porowatego czy inna
struktura ceramiczna – ważna jest nie tyle grubość przegrody co jej funkcja.
Na błonę, od strony czystego rozpuszczalnika działa ciśnienie, wynikające z różnicy
między wypadkową ilością zderzeń cząsteczek cieczy ze strony rozpuszczalnika i ze strony
roztworu. Ponieważ w roztworze część małych cząsteczek rozpuszczalnika zostało
zastąpionych dużymi cząsteczkami substancji rozpuszczonej, parcie na błonę, a tym samym
i ciśnienie, od strony roztworu jest słabsze. Większa ilość zderzeń cząsteczek rozpuszczalnika
ze strony czystego rozpuszczalnika w stosunku do ilości zderzeń cząsteczek rozpuszczalnika
od strony roztworu powoduje, że ilość cząsteczek przechodzących przez błonę
z rozpuszczalnika do roztworu jest większa niż ilość przechodząca od roztworu do
rozpuszczalnika. Oznacza to, że ilość rozpuszczalnika w roztworze rośnie, roztwór zwiększa
swoja objętość i maleje jego stężenie. Proces ten trwa do czasu, gdy ciśnienie hydrostatyczne,
zwiększone po stronie roztworu w skutek zwiększenia się jego objętości, zrównoważy
ciśnienie osmotyczne ze strony czystego rozpuszczalnika. Jeżeli objętość roztworu lub kształt
naczynia (szeroka podstawa) praktycznie nie dopuszcza do wzrostu ciśnienia
hydrostatycznego proces będzie trwał aż do całkowitego przejścia rozpuszczalnika do
roztworu.
Ciało stałe w ciele stałym
Cząsteczki ciał stałych mieszają się ze sobą za pomocą dyfuzji. Jednak, aby była ona
możliwa, ciała muszą do siebie przylegać, gdyż w ciałach stałych cząsteczki mocno
przyciągają się wzajemnie, aby utrzymać zwartą strukturę i powierzchnię. Takie
oddziaływania zabierają im prawie wszystkie „siły” i aby jej resztkami przyciągnąć jeszcze
jakieś cząsteczki z zewnątrz, muszą być bardzo blisko powierzchni drugiego ciała (stykać się
z nim) i to przez dłuższy czas. Roztwory ciał stałych w ciałach stałych nazywamy roztworami
stałymi. Są one kryształami mieszanych substancji chemicznych.
Przykład: stop srebra, złota i innych kruszców.
Ciała stałego w gazie oraz gazu w ciele stałym
Cząsteczki gazu z najbliższego otoczenia ciała stałego stopniowo mieszają się z jego
cząsteczkami za sprawą dyfuzji i ruchów Browna. Rozpuszczaniu się ciała stałego w gazie
najbardziej sprzyja wysokie ciśnienie.
Przykład: sadza i dym unoszące się w powietrzu.
Ciecz w gazie i gaz w cieczy
Cząsteczki cieczy wnikają w gaz i mieszają się z jego cząsteczkami w wyniku dyfuzji
oraz parowania, natomiast cząstki gazu przechodzą do cieczy w wyniku dyfuzji.
Przykład: mgła w powietrzu – roztwór wody i powietrza.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
Gaz w gazie
Gazy bez względu na rodzaj i skład, mieszają się zupełnie swobodnie, dzięki temu, że ich
cząsteczki są znacznie od siebie oddalone i bardzo słabo na siebie oddziałują. Gazy tworzą
zawsze roztwory rzeczywiste, tzn. nie tworzą nigdy koloidu, w którym widoczna byłaby
zawiesina jednego gazu w drugim.
Przykład: powietrze – roztwór gazowy składający się z tlenu, azotu i innych gazów.
Stężenie procentowe roztworów
W laboratoriach chemicznych, a także w życiu codziennym – w gospodarstwie
domowym – stosuje się często roztwory o znanej zawartości substancji w danej masie lub
objętości roztworu, czyli o danym stężeniu. Konieczna jest więc umiejętność obliczania
stężenia roztworów. Jednym ze sposobów wyrażenia stężeń roztworów jest stężenie
procentowe.
Stężenie procentowe roztworu jest to liczba gramów substancji rozpuszczonej w 100 g
roztworu.
4.4.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do ćwiczeń.
1. Jakie znasz zjawiska fizyczne?
2. Co to jest przemiana chemiczna?
3. Co to jest roztwór?
4. Jakie znasz rodzaje roztworów?
5. Jakie znasz przykłady roztworów?
6. Co to jest krystalizacja?
7. Na czym polega proces dyfuzji?
8. Na czy polega proces osmozy?
9. Co to jest stężenie procentowe roztworu?
4.4.3. Ćwiczenia
Ćwiczenie 1
Wykonaj doświadczenia ukazujące zjawisko krystalizacji: Hodowla kryształów siarczanu
(IV) miedzi (II).
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zgromadzić materiały i przybory potrzebne do wykonania ćwiczenia,
2) zaplanować tok postępowania,
3) odczytać z wykresu rozpuszczalności jak należy sporządzić nasycony roztwór siarczanu
(IV) miedzi (II) – CuSO
4
w temperaturze 80
°
C,
4) zmieszać potrzebną ilość wody i CuSO
4
i ogrzać do temperatury 80
°
C,
5) do zlewki wrzucić mały kawałek CuSO
4
i pozostawić do powolnego oziębnięcia na kilka
dni,
6) obserwacje zanotować w zeszycie,
7) dokonać analizy ćwiczenia,
8) zaprezentować pracę.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
Wyposażenie stanowiska pracy:
−
zestaw laboratoryjny do krystalizacji,
−
zeszyt lub arkusz papieru, długopis, linijka, ołówek,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Oblicz stężenie procentowe roztworu 20 g soli kuchennej rozpuszczonej w 180 g wody.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapisać w zeszycie potrzebne wzory obliczeniowe,
2) wykonać niezbędne obliczenia,
3) dokonać analizy ćwiczenia,
4) zaprezentować wyniki swojej pracy.
Wyposażenie stanowiska pracy:
−
zeszyt lub arkusz papieru, długopis, linijka, ołówek,
−
kalkulator,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
4.4.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) wymienić zjawiska fizyczne?
2) wyjaśnić, co to jest przemiana chemiczna?
3) wyjaśnić co to jest roztwór?
4) wymienić rodzaje roztworów?
5) podać przykłady roztworów?
6) wyjaśnić co to jest krystalizacja?
7) wyjaśnić na czym polega zjawisko dyfuzji?
8) wyjaśnić na czym polega proces osmozy?
9) zdefiniować stężenie procentowe roztworu?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
4.5. Reakcje chemiczne, stechiometria reakcji chemicznych
4.5.1. Materiał nauczania
Przemiany, podczas których powstają nowe substancje, nazywamy przemianami
chemicznymi, czyli reakcjami chemicznymi.
Reakcje chemiczne są to procesy, podczas których jedne substancje przechodzą w drugie.
Rodzaje reakcji chemicznych:
1) Reakcje syntezy. Synteza jest reakcją, w której z dwu lub więcej substancji prostszych
powstaje jedna substancja złożona o odmiennych właściwościach chemicznych
i fizycznych:
A + B
→
AB
2) Reakcje analizy. Analiza (rozkład) jest reakcją, w której z jednej substancji złożonej
powstają dwie lub kilka substancji prostszych, różniących się od substratu
właściwościami fizycznymi i chemicznymi:
AB
→
A + B
3) Reakcje wymiany.
−
wymiana pojedyncza (reakcja wypierania) jest reakcją, w której z jednego związku
chemicznego i jednego pierwiastka powstaje inny związek chemiczny i inny, mniej
aktywny pierwiastek:
A + BC
→
AC + B
−
wymiana podwójna jest reakcją, w której biorą udział dwa związki chemiczne i jako
produkty powstają nowe dwa związki:
AB + CD
→
AD + BC
Podział reakcji chemicznych
–
reakcje przebiegające bez wymiany elektronów, polegają głównie na wymianie protonów
między cząsteczkami:
a) reakcje zobojętnienia,
b) reakcje kwasów i zasad z amfoterami,
c) reakcje kwasów i zasad z solami,
d) reakcje soli z solami,
e) reakcje jonów z wodą.
–
reakcje oksydacyjno-redukcyjne (redoks), związane z przeniesieniem elektronów od
jednego reagenta do drugiego, powodujące zmianę stopni utlenienia reagujących atomów
lub jonów.
Efekty energetyczne reakcji
Przebieg zdecydowanej większości reakcji wiąże się z wydzieleniem lub pochłonięciem
przez reagenty pewnej ilości energii. Energia ta może mieć postać ciepła, pracy mechanicznej
lub elektrycznej czy światła.
Mierzeniem i obliczaniem energii cieplnej wymienianej podczas reakcji chemicznej
zajmuje się nauka nazywana termochemią.
Najczęściej podczas reakcji chemicznych zmiany energii występują w postaci ciepła bądź
oddawanego do otoczenia i wtedy mamy do czynienia z przemianą chemiczną egzotermiczną,
bądź pochłanianego z otoczenia, i mamy wtedy do czynienia z przemianą chemiczną
endotermiczną.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
Ciepło wydzielane lub pobrane, w odniesieniu do określonych ilości (moli) substancji
nazywa się ciepłem reakcji. Wartość ciepła reakcji oznacza się różnymi znakami,
w zależności od tego, czy energia jest przekazywana do otoczenia, czy do układu:
−
znakiem minus (-) oznacza się efekt cieplny, podczas którego układ przekazuje do
otoczenia energię na sposób ciepła,
−
znakiem plus (+) oznacza się efekt cieplny, podczas którego otoczenie przekazuje do
układu energię na sposób ciepła.
Efekty cieplne reakcji chemicznych zależą od:
−
temperatury (dosyć istotnie),
−
ciśnienia (niezbyt istotnie),
−
zaawansowania reakcji,
−
stężeń reagentów,
−
stanu skupienia reagentów (bardzo istotnie).
Dlatego, opisując przemianę, należy zawsze podawać równanie stechiometryczne lub
ilość głównego reagentu (substratu lub produktu) oraz stany skupienia wszystkich reagentów.
Stan równowagi reakcji
Równowaga reakcji chemicznych to taki stan, gdy reakcja w jedną i drugą stronę
zachodzi z taką samą szybkością, więc stężenia reagentów nie zmieniają się w czasie.
Stan równowagi reakcji chemicznej nie oznacza, że nie zachodzi ona wcale. Reakcja jako
taka zachodzi, tyle że jej szybkość w obu kierunkach jest jednakowa, czyli w każdej chwili
z substratów tworzy się tyle samo produktów ile z produktów tworzy się z powrotem
substratów.
Teoretycznie wszystkie reakcje chemiczne osiągają stan równowagi o ile pozostawi się je
„w spokoju” na odpowiednio długi czas. Oznacza to, że dla każdej reakcji istnieją takie
warunki, w których jest ona odwracalna. Praktycznie jednak w wielu przypadkach nie
dochodzi do ustalenia się stanu równowagi z różnych względów:
−
produkty reakcji mogą być celowo usuwane z układu reakcji zanim osiągnie on
równowagę,
−
substraty i produkty mogą występować w dwóch fazach, nie mieszając się z sobą,
a reakcja zachodzi na granicy faz,
−
reakcja jest powolna, a jej zatrzymanie następuje przed osiągnięciem stanu równowagi.
Stężenia reagentów w stanie równowagi nie zależą od mechanizmu jej przebiegu, lecz
tylko od termodynamicznych warunków jej prowadzenia, takich jak temperatura ciśnienie.
Stąd rodzaj użytego katalizatora nie ma wpływu na stężenia reagentów w stanie równowagi,
ma jednak duży wpływ na czas ustalenia się tego stanu.
W stanie równowagi, zgodnie z prawem działania mas stosunek iloczynów stężeń
substratów i produktów jest w danych warunkach termodynamicznych stały. Stosunek ten jest
nazywany stałą równowagi, oznaczaną tradycyjnie dużą literą K.
Szybkość zachodzenia reakcji
Reakcje chemiczne przebiegają z bardzo różnymi szybkościami. Najważniejszymi
czynnikami decydującymi o szybkości reakcji chemicznej są:
−
rodzaj i stężenie reagujących substancji lub ciśnienie gazów (jeżeli reakcja przebiega
w fazie gazowej) – szybkość reakcji jest wprost proporcjonalna do iloczynu stężeń
substratów.
−
temperatura – istnieje dość ścisła zależność pomiędzy szybkością i temperaturą reakcji.
Podwyższenie temperatury o 10
o
C podwaja w przybliżeniu szybkość reakcji. Wzrost
szybkości w zależności od temperatury ma charakter wykładniczy. Jeżeli mamy do
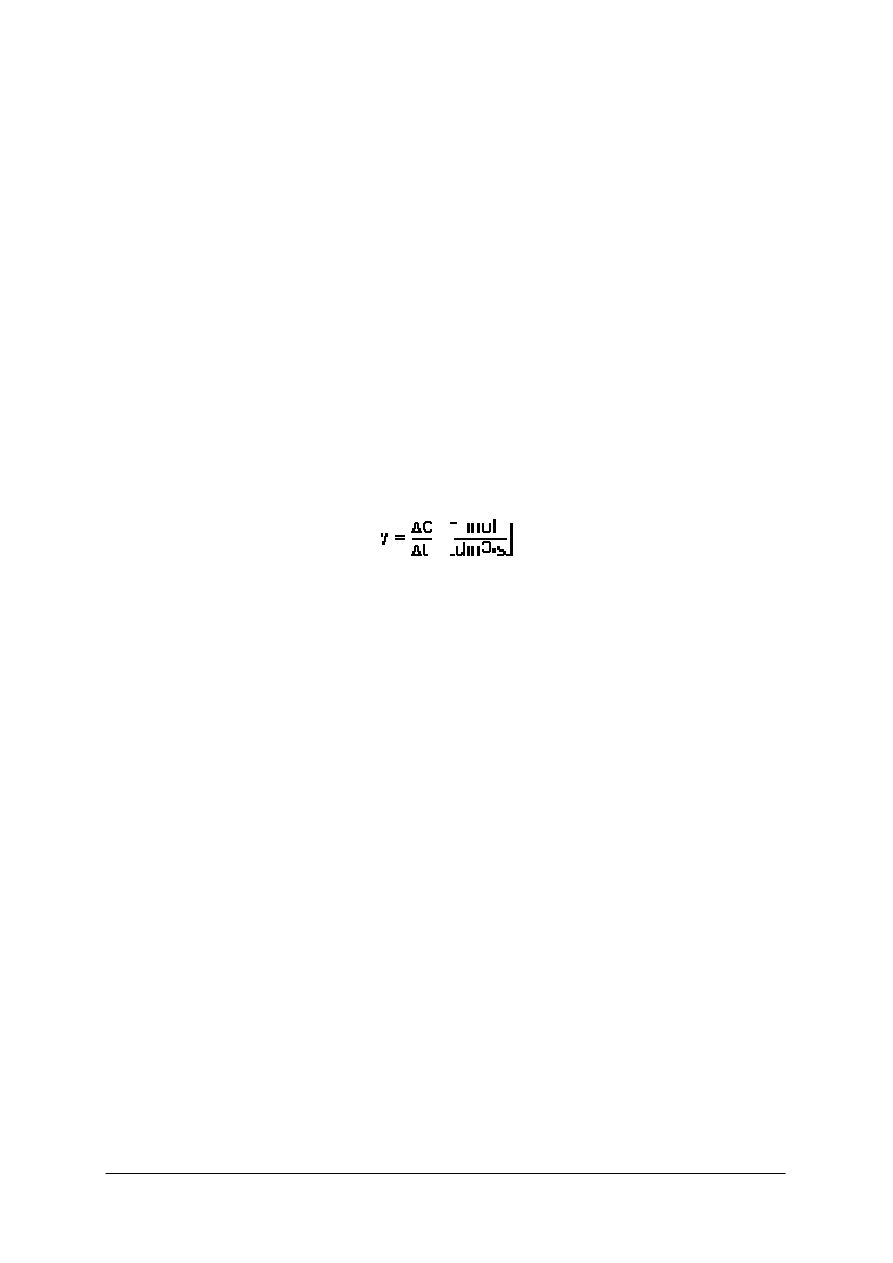
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
czynienia z reakcją egzotermiczną układ oddaje ciepło a jeżeli mamy do czynienia
z reakcją endotermiczną, układ pobiera ciepło.
−
wpływ środowiska – przebieg reakcji zależy od stanu skupienia co związane jest
z ruchliwością molekuł. Jeżeli reakcja chemiczna przebiega w fazie gazowej, to
cząsteczki mają dużą swobodę poruszania się, a w wyniku zderzeń następuje ciągłe
przemieszczanie cząsteczek i reakcja chemiczna zachodzi łatwiej W roztworach
o przebiegu reakcji decyduje charakter rozpuszczalnika i charakter budowy reagujących
związków.
−
obecność katalizatorów – stwierdzono doświadczalnie, że niektóre reakcje mogą
przebiegać szybciej w obecności substancji, które pozostają niezmienione po
zakończeniu reakcji. Tego rodzaju substancje nazywa się katalizatorami a zjawisko przez
nie wywołane katalizą. Wpływ katalizatora ogranicza się wyłącznie do zmiany szybkości
reakcji. W reakcjach odwracalnych katalizator w jednakowym stopniu zmienia szybkość
reakcji właściwej, jak i reakcji odwrotnej. Jednakowa zmiana szybkości reakcji wprost
i reakcji odwrotnej wywołana obecnością katalizatora sprawia, że iloraz stałych, tj.
wartość stałej równowagi chemicznej pozostaje niezmienione.
−
wpływ promieniowania.
Ilościowo szybkość reakcji określa się jako zmianę molowego stężenia substratu lub
produktu w jednostce czasu. Szybkość reakcji opisuje równanie:
gdzie: v – szybkość reakcji chemicznej,
∆
C – zmiana stężenia reagentów,
∆
t – jednostka
czasu.
Szybkość reakcji nie wpływa na wartość stałej równowagi, szybkość decyduje tylko
o czasie osiągania stanu równowagi. Od stałej równowagi zależy natomiast wydajność
reakcji. Duże wartości stałych równowag (K) oznaczają, że reakcja biegnie z dużą
wydajnością produktów.
Wydajność reakcji można zdefiniować jako ilość substancji na przykład substratu, który
przereagował praktycznie (rzeczywiście) do ilości tego substratu, który przereagował
całkowicie (teoretycznie).
Stechiometria reakcji chemicznych
Stechiometria to dział chemii zajmujący się stosunkami ilościowymi przemian związków
chemicznych zachodzących w czasie reakcji chemicznych. Jest to zatem dziedzina zajmująca
się ustaleniem w jakich proporcjach ilościowych reagują z sobą związki chemiczne i jakie są
proporcje substratów do produktów. Proporcje te wylicza się na podstawie równań
chemicznych analizowanych reakcji oraz znajomości mas cząsteczkowych substratów
i produktów. Stechiometria umożliwia zatem interpretację ilościową zjawisk chemicznych.
Do obliczeń stechiometrycznych niezbędne są:
−
znajomość wzorów chemicznych,
−
umiejętność uzgadniania reakcji chemicznych,
−
znajomość chemicznych jednostek masy,
−
znajomość podstawowych praw chemicznych fizycznych.
W obliczeniach chemicznych używa się zazwyczaj dwu jednostek masy: grama oraz
atomowej jednostki masy (w skrócie a.j.m., oznaczanej symbolem „u” od angielskiego
określenia unit).

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
Dla określenia masy pojedynczych atomów lub cząsteczek potrzebne są odpowiednio
„małe” jednostki. Taką jednostką jest atomowa jednostka masy, unit.
Definiując gram w systemie SI, odnosimy się do wzorca, jakim jest 1 kilogram
i mówimy, że l g odpowiada 0,001 kg. Wzorcem dla określania unitu stał się w 1961 roku
izotop węgla
12
C (czyli atom zawierający 6 protonów, 6 neutronów i 6 elektronów). Masa
pojedynczego atomu
12
C podzielona przez 12 daje masę wzorca atomowej jednostki masy.
1 u = 1/12 masy atomu węgla
12
C
1 u
≈
1,66
⋅
10
-27
kg
Zatem masa pojedynczego atomu węgla
12
C wyrażona w unitach wynosi 12 u.
Masę pojedynczego atomu wyrażoną w unitach nazywamy masą atomową. W układzie
okresowym o masie atomowej informuje nas:
Średnia masa atomowa uwzględnia obecność w materiale naturalnym (materiał
pochodzenia naturalnego, czyli istniejący w przyrodzie, a nie wytworzony przez człowieka)
różnych odmian izotopowych tego samego pierwiastka). Posługując się wartościami mas
atomowych, zaokrąglamy je zazwyczaj do najbliższych liczb całkowitych, na przykład masę
atomową sodu 22,989 u zaokrąglimy do wartości 23 u, a masę atomową neonu 20,179 u
zaokrąglimy do wartości 20 u.
Masa cząsteczkowa
Masę cząsteczkową definiuje się podobnie jak masę atomową: jest to masa pojedynczej
cząsteczki wyrażona w unitach. Masy cząsteczkowe oblicza się, sumując masy atomowe, na
przykład masa cząsteczkowa wody wynosi 18 u (2 • masa atomowa wodoru + masa atomowa
tlenu = 2 • l u + 16 u = 18 u). Symbolicznie obliczenia takie zapisujemy:
M
cz
(NH
4
)
2
SO
4
= 2 • (14 u + 4 • l u) + 32 u + 4 • 16 u = 132 u
gdzie: M
cz
to masa cząsteczkowa.
Liczba Avogadra
Ponieważ posługiwanie się pojedynczymi atomami czy cząsteczkami jest praktycznie
niemożliwe, wykorzystujemy porcje zawierające większą ich liczbę. Taką porcją atomów lub
cząsteczek jest mol.
Liczbę 6,02 • 10
23
nazywamy liczbą Avogadra i oznaczamy jako N
A
.
Aby się dowiedzieć, ilu molom odpowiada dana „porcja” elementów, należy wykonać
obliczenia według jednego z 2 poniższych sposobów.
Sposób I
Wykorzystujemy wzór:
A
N
N
n
=
,
gdzie: n oznacza liczbę moli, N – liczbę drobin (atomów, cząstek, elektronów),
N
A
– stałą Avogadra.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
Sposób II
Wykorzystujemy proporcję:
N atomów odpowiada x molom
N
A
atomów odpowiada 1 molowi
mol
x
N
N
A
1
=
Masa molowa
Liczbę Avogadra dobrano w ten sposób, aby masa 1 mola drobin substancji wyrażona
w gramach odpowiadała liczbowo masie atomowej lub cząsteczkowej.
Masa molowa to masa 1 mola drobin substancji wyrażona w gramach. Posługiwanie się
masą molową pozwala dokładnie określić liczbę atomów lub cząstek w danej porcji materii.
Możemy też swobodnie przeliczać masę substancji na liczbę moli jej drobin.
M
m
n
=
gdzie: n oznacza liczbę moli, m – masa substancji wyrażona w gramach, M – masa molowa
wyrażona w g/mol.
W obliczeniach można posługiwać się wzorami lub stosować proporcje.
Obliczenia stechiometryczne
−
równania reakcji chemicznych mają znaczenie równań matematycznych, podają bowiem
stosunki ilościowe pomiędzy reagującymi substancjami i powstającymi w reakcji
produktami. Dlatego na podstawie równań chemicznych przeprowadza się wiele
różnorodnych obliczeń o dużym praktycznym znaczeniu w wielu działach chemii. W ten
sposób oblicza się np. wydajność procesów chemicznych oraz ilości substratów
niezbędne do otrzymania pożądanych ilości produktów,
−
równania chemiczne określają nie tylko stosunki wagowe ale i objętościowe w jakich
reagują ze sobą substancje chemiczne,
−
wzór chemiczny stanowi jakościową i ilościową charakterystykę związku, gdyż podaje
z jakich pierwiastków składa się związek i w jakim stosunku wagowym są one ze sobą
połączone,
−
liczba stechiometryczna cząsteczki: Określa ilościowy skład związku chemicznego
przedstawionego w postaci wzoru; umieszcza się ja po prawej stronie u dołu symbolu
−
pierwiastka, na przykład H
2
,
−
stosunek stechiometryczny reagentów: jest to ilościowy stosunek reagentów określony
równaniem chemicznym; dla danej reakcji jest stały.
4.5.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do ćwiczeń.
1. Jakie znasz rodzaje reakcji chemicznych?
2. Jakie czynniki decydują o efektach cieplnych reakcji?
3. Jakie czynniki wpływają na stan równowagi reakcji?
4. Jakie czynniki wpływają na szybkość reakcji?
5. Co to jest i od czego zależy wydajność reakcji?
6. Co to jest masa atomowa, masa cząsteczkowa, masa molowa?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
4.5.3. Ćwiczenia
Ćwiczenie 1
Oblicz ile atomów znajduje się w 10 molach chlorku sodu.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapisać w zeszycie potrzebne wzory,
2) wykonać niezbędne obliczenia,
3) dokonać analizy ćwiczenia,
4) zaprezentować wyniki swojej pracy.
Wyposażenie stanowiska pracy:
−
zeszyt lub arkusz papieru, długopis,
−
kalkulator,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Oblicz masę cząsteczkową podanych związków: kwas siarkowy(VI), wodorotlenek sodu,
tlenek glinu.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapisać podane związki w postaci wzoru sumarycznego,
2) określić masy atomowe dla pierwiastków składowych związków,
3) wykonać niezbędne obliczenia,
4) dokonać analizy ćwiczenia,
5) zaprezentować wyniki swojej pracy.
Wyposażenie stanowiska pracy:
−
zeszyt lub arkusz papieru, długopis,
−
układ okresowy pierwiastków,
−
kalkulator,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
4.5.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) wymienić rodzaje reakcji chemicznych?
2) wymienić czynniki decydujące o efektach cieplnych reakcji?
3) określić czynniki wpływające na stan równowagi reakcji?
4) określić czynniki wpływające na szybkość zachodzenia reakcji?
5) wyjaśnić co to jest i od czego zależy wydajność reakcji?
6) wyjaśnić co to jest masa atomowa, masa cząsteczkowa, masa molowa?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
4.6. Właściwości, metody otrzymywania oraz zastosowanie
związków chemicznych
4.6.1. Materiał nauczania
Związki chemiczne można dzielić bardzo różnie w zależności od przyjętych kryteriów:
pochodzenia, składu, budowy, właściwości chemicznych i wielu innych. Najczęściej spotyka
się podział na związki organiczne i nieorganiczne, choć istnieje grupa związków pośrednich
pomiędzy nimi.
W najprostszym, a jednocześnie ścisłym podziale związków chemicznych kryterium
stanowi liczba zawartych w nich pierwiastków. Wyróżniamy wówczas następujące związki
chemiczne:
a) dwuskładnikowe,
b) trójskładnikowe,
c) czteroskładnikowe,
d) pięcioskładnikowe,
e) sześciu - i więcej składnikowe.
Większość
związków
nieorganicznych
należy
do
związków
od
dwu
do
czteroskładnikowych, tylko wyjątkowe należą do pozostałych.
Bardzo ważny jest podział związków chemicznych ze względu na rodzaj wiązań
chemicznych, jakie występują w cząsteczkach związków, oraz na oddziaływania pomiędzy
cząsteczkami.
Do najważniejszych związków należą zasady, kwasy i sole.
Wodne roztwory niektórych wodorotlenków nazywamy zasadami. Wszystkie zasady
wykazują następujące właściwości:
−
powodują zmianę zabarwienia indykatorów, czyli wskaźników – substancji organicznych
zmieniających zabarwienie pod wpływem różnych odczynów roztworów – na przykład
papierek uniwersalny w roztworze zasadowym z żółtego staje się niebieski,
a fenoloftaleina z bezbarwnej staje się malinowa (różowa),
−
neutralizują odczyn kwasowy,
−
pochłaniają CO
2
z powietrza,
−
wykazują tak zwaną śliskość roztworu (ich roztwory w dotyku przypominają roztwór
mydła) – cecha ta występuje tylko w roztworach silnie zasadowych.
Wodorotlenek tworzy roztwór zasadowy tylko wtedy, gdy ma dostatecznie dużą
rozpuszczalność w wodzie i ulega w niej rozpadowi na jony, czyli dysocjacji.
NaOH
→
Na
+
+ OH
-
Wodorotlenki powstają w wielu różnych reakcjach, z których najważniejsze to reakcje
aktywnych metali z wodą:
2Na + 2H
2
O
→
2NaOH + H
2
reakcje tlenków zasadowych z wodą:
Na
2
O + H
2
O
→
2NaOH
oraz – dla wodorotlenków nierozpuszczalnych reakcje strącania ich z roztworów soli
odpowiednich metali:
CuSO
4
+ 2KOH
→
Cu(OH)
2
↓
+ K
2
SO
4
−
kwasowo-zasadowe, określane inaczej jako reakcje zobojętnienia,
−
wymiany w roztworach wodnych, głównie w reakcjach tlenkami metali i solami,
−
z metalami i rozkładu termicznego.
Wodne roztwory kwasu barwią oranż metylowy na czerwono, papierek uniwersalny.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
Otrzymywanie kwasów:
Kwasy tlenowe w większości wypadków powstają w reakcjach bezwodników
kwasowych z wodą:
SO
3
+ H
2
O
→
H
2
SO
4
Kwasy, których tlenki nie reagują z wodą uzyskuje się zazwyczaj z ich soli. Na sól taką
działa się innym mocnym kwasem, w wyniku czego interesujący nas kwas zostaje wyparty
z soli:
K
2
Si
3
+ 2HCl
→
KCl + H
2
SiO
3
Solami nazywamy związki chemiczne, których cząsteczki zawierają jeden lub kilka
kationów i jeden lub kilka anionów reszty kwasowej. W roztworze wodnym sole mogą
reagować z innymi solami i kwasami. Kwas może reagować z solą:
−
jeżeli jest mocniejszy od kwasu, którego reszta jest zawarta w soli,
−
jeżeli powstaje bardzo trudno rozpuszczająca się sól.
Otrzymywanie soli:
metal + niemetal
→
sól beztlenowa (sól kwasu beztlenowego)
Jest najprostszy sposób otrzymywania soli beztlenowych. Należy jednak pamiętać, iż nie
wszystkie metale przereagują w powyższej reakcji. Chodzi tu głównie o metale szlachetne
jak: Au (złoto), Ag (srebro), Cu (miedź).
2Na + Cl
2
→
2NaCl
metal + kwas
→
sól + h
2
(cząsteczka wodoru w stanie gazowym)
Istota tego procesu jest reakcja atomów metalu z kationami wodoru, w czego wyniku
powstają kationy metalu oraz cząsteczki wodoru. Należy jednak pamiętać, iz aby metal
wyparł wodór z kwasu musi być od niego aktywniejszy, tzn. znajdować się powyżej wodoru
w szeregu aktywności metali. Metale, które wypierają wodór z kwasów to : K, Na, Ca, Mg,
Al, Zn, Fe, Ni, Sn, Pb.
Ca + H
2
CO
3
→
CaCO
3
(osad) + H
2
(gaz)
tlenek metalu + kwas
→
sól + woda
CaO + H
2
CO
3
→
CaCO
3
(osad) + H
2
O
zasada + kwas
→
sól + woda
Jest to reakcja zobojętniania (neutralizacji), ponieważ w wyniku reakcji kwasu (odczyn
kwaśny) z zasada (odczyn zasadowy) powstaje obojętna cząsteczka wody.
H
2
SO
4
+ 2NaOH
→
Na
2
SO
4
+ 2H
2
O
tlenek niemetalu (bezwodnik kwasowy) + tlenek metalu
→
sól tlenowa
CaO + SO
3
→
CaSO
4
tlenek niemetalu (bezwodnik kwasowy) + zasada
→
sól tlenowa + woda
SO
3
+ Ca(OH)
2
→
CaSO
4
+ H
2
O
sól + kwas
→
nowa sól (osad) + nowy kwas
Zalecane jest, aby powstała sól była osadem.
Ca(NO
3
)
2
+ H
2
CO
3
→
CaCO
3
(osad) + 2HNO
3

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
Powyższa reakcja jest przykładem reakcji straceniowej, polegającej na wytrąceniu osadu,
praktycznie nierozpuszalnego w roztworze wodnym
sól + zasada
→
nowa sól (osad) + nowa zasada
Zalecane jest, aby powstała sól była osadem.
Ca(OH)
2
+ Na
2
CO
3
→
CaCO
3
(osad) + 2 NaOH
sól + metal
→
nowa sól + nowy metal
Metal wzięty do reakcji musi być aktywniejszy od metalu znajdującego się w soli.
2Na + MgCl
2
→
2NaCl + Mg
sól + sól
→
nowa sól (osad) + nowa sól
Zalecane jest, aby powstała sól była osadem.
2BiCl
3
+ 3Pb(NO
3
)
2
→
3PbCl
2
(osad) + 2Bi(NO
3
)
3
4.6.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do ćwiczeń.
1. Jakie znasz związki chemiczne?
2. Jakimi właściwościami charakteryzują się zasady?
3. Jakie znasz sposoby otrzymywania zasad?
4. Jakie reakcje należą do najważniejszych właściwości chemicznych kwasów?
5. Jakie związki chemiczne nazywamy solami?
6. Jakie znasz sposoby otrzymywania soli?
4.6.3. Ćwiczenia
Ćwiczenie 1
Otrzymaj zasadę: wodorotlenek sodu.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zgromadzić materiały i przybory potrzebne do wykonania ćwiczenia,
2) zorganizować stanowisko pracy zgodnie z przepisami bezpieczeństwa i higieny pracy
oraz wymaganiami ergonomii,
3) zaplanować tok postępowania,
4) do zlewki zawierającej 15 cm
3
wody wrzucić kawałek sodu wielkości główki od zapałki,
5) poczekać, aż cały sód przereaguje,
6) przenieść zawartość zlewki do parowniczki i odparować wodę,
7) zaobserwować wygląd pozostałości po odparowaniu wody,
8) pozostałość tę rozpuścić ponownie w wodzie i dodać kroplę fenoloftaleiny,
9) zaobserwować na jaki kolor zabarwiła się ona w roztworze,
10) dokonać analizy ćwiczenia,
11) na podstawie spostrzeżeń wyciągnąć wnioski, porównać je z wnioskami innych uczniów.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
Wyposażenie stanowiska pracy:
−
zestaw niezbędnych materiałów i odczynników chemicznych,
−
zeszyt lub arkusz papieru, długopis,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Otrzymaj kwas siarkowy(IV)
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zgromadzić materiały i przybory potrzebne do wykonania ćwiczenia,
2) zorganizować stanowisko pracy zgodnie z przepisami bezpieczeństwa i higieny pracy
oraz wymaganiami ergonomii,
3) zaplanować tok postępowania,
4) do kolby stożkowej o pojemności 250 cm
3
nalać 30 cm
3
wody,
5) dodać parę kropli oranżu metylowego,
6) na łyżce do spaleń umieścić nieco sproszkowanej siarki,
7) trzonek łyżki zamocować w korku, tak aby można nim było zakorkować kolbę po
wprowadzeniu łyżki do wnętrza kolby,
8) zapalić siarkę na łyżce w płomieniu palnika i płonącą wprowadzić do kolby, korkując
szczelnie,
9) poczekać, aż płomień zgaśnie,
10) opisać wygląd powstającego tlenku siarki (IV) oraz zmianę zabarwienia roztworu oranżu
po rozpuszczeniu tlenku w wodzie,
11) dokonać analizy ćwiczenia,
12) na podstawie spostrzeżeń wyciągnąć wnioski, porównać je z wnioskami innych uczniów.
Wyposażenie stanowiska pracy:
−
zestaw niezbędnych materiałów i odczynników chemicznych,
−
zeszyt lub arkusz papieru, długopis,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
4.6.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) wymienić rodzaje związków chemicznych?
2) określić jakimi właściwościami charakteryzują się zasady?
3) wymienić sposoby otrzymywania zasad?
4) wymienić reakcje należące do najważniejszych właściwości
chemicznych kwasów?
5) wyjaśnić jakie związki chemiczne nazywamy solami?
6) wymienić sposoby otrzymywania soli?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
4.7. Skład
pierwiastkowy
związków
organicznych
–
węglowodory
4.7.1. Materiał nauczania
Podstawowym pierwiastkiem w połączeniach organicznych jest węgiel. Atomy węgla
posiadają zdolność łączenia się pomiędzy sobą w nawet bardzo długie łańcuchy. Te z kolei
mogą być proste lub rozgałęzione, a poza tym łańcuch może ulec zamknięciu tworząc
pierścień:
Ze zdolnością łączenia się atomów węgla pomiędzy sobą wiąże się zagadnienie
rzędowości atomu węgla:
−
atom węgla połączony tylko z jednym atomem węgla określa się jako węgiel
pierwszorzędowy,
−
połączony z dwoma atomami węgla – drugorzędowy,
−
połączony z trzema atomami węgla jako trzeciorzędowy,
−
atom węgla połączony z czterema atomami węgla nosi nazwę czwartorzędowego lub
węgla „neo”.
Podstawową grupą połączeń organicznych są związki zbudowane z atomów węgla
i wodoru, nazywane węglowodorami. Węglowodory ze względu na budowę szkieletu
węglowego dzielimy na dwie główne klasy: węglowodory alifatyczne i węglowodory
aromatyczne. Węglowodory alifatyczne z kolei dzielą się na alkany, alkeny, alkiny oraz ich
analogi pierścieniowe (cykloalkany).
Same węglowodory są substancjami macierzystymi wszystkich związków organicznych,
które nazywane są pochodnymi węglowodorów.
Pochodne są to związki, powstałe wskutek podstawienia pojedynczych atomów wodoru
przez inne atomy lub grupy atomów, które noszą nazwę podstawników. Przykład CH
3
COOH
jest pochodną CH
4
(metan). Jeden atom wodoru w CH
4
został podstawiony grupą atomów
(-COOH).
Węglowodory alifatyczne, mogą łączyć się ze sobą tworząc: struktury łańcuchowe,
struktury cykliczne. Węglowodory posiadające struktury łańcuchowe mogą mieć łańcuchy
proste lub rozgałęzione a te z kolei mogą być:
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
−
nasycone tzn. atomy węgla połączone są tylko za pomocą wiązań pojedynczych (-C-C-).
−
nienasycone tzn. atomy węgla połączone są za pomocą wiązań podwójnych (-C=C-) lub
potrójnych. Wiązania wielokrotne (podwójne i potrójne) mogą występować w różnych
ilościach.
−
połączenia cykliczne mogą być trój-, cztero-, pięcio-, sześcio-, .... wieloczłonowe, na
przykład:
Węglowodory aromatyczne
Wśród połączeń cyklicznych wyróżnia się połączenia aromatyczne o specyficznym
układzie wiązań podwójnych, sprzężonych. Są to połączenia o budowie płaskiej, zawierające
elektrony (p), których ilość obliczamy zgodnie z regułą Huckla: Układ aromatyczny ma
4n + 2 elektronów (p), gdzie n – ilość pierścieni. Przykładem jest węglowodór o nazwie
benzen, który posiada 6 elektronów p:
Najprostszym węglowodorem jest metan o wzorze CH
4
i tetraedrycznej strukturze
cząsteczki. Taka struktura jest wynikiem hybrydyzacji sp
3
w atomie węgla a powstałe orbitale
wiążące sp
3
, skierowane są ku wierzchołkom czworościanu. Takie właśnie rozmieszczenie
orbitali umożliwia maksymalne ich oddalenie i przyjęcie struktury tetraedrycznej:
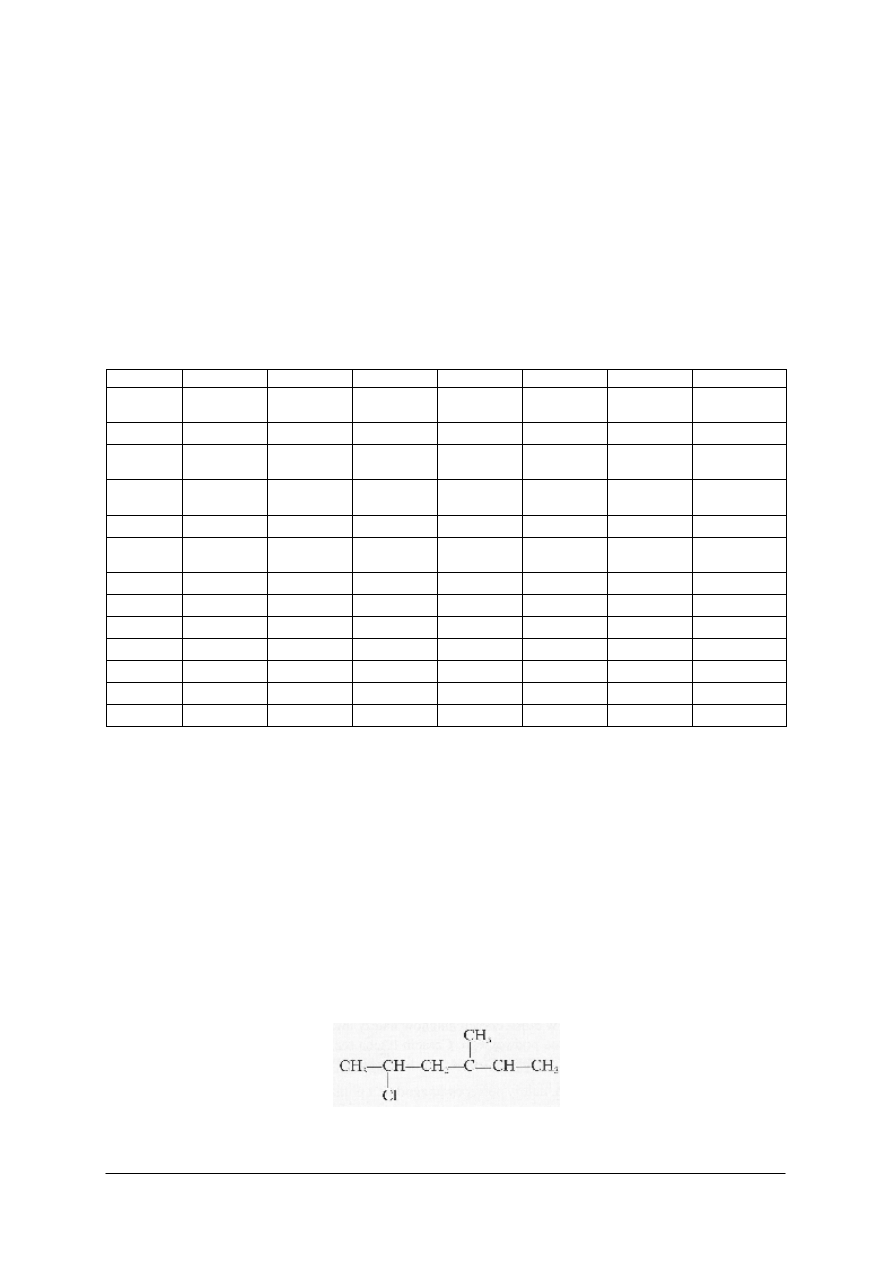
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
Aby każdy z orbitali sp
3
utworzył najmocniejsze wiązanie ze sferycznym orbitalem
s atomu wodoru, każdy atom wodoru musi znaleźć się dokładnie w wierzchołku
czworościanu. Ponieważ atomy węgla i atomy wodoru mają prawie taką samą
elektroujemność, dlatego oprócz wiązania węgiel – wodór mogą być utworzone wiązania
węgiel – węgiel. I dlatego liczba węglowodorów nie ogranicza się tylko do najprostszego
węglowodoru CH
4
, lecz jest możliwy szereg związków, jak np. C
2
H
6
(etan), C
3
H
8
(propan).
Szereg nie zatrzymuje się na propanie, lecz biegnie dalej w sposób niekończący, przy czym
każdy człon ma wzór ogólny CnH
2n+2
. Mówimy wtedy, że węglowodory tworzą szereg
homologiczny. W szeregu homologicznym węglowodory jak ich pochodne, różnią się o stałą
różnicę, zwaną różnicą homologiczną, którą jest grupa metylenowa -CH
2
-. Przykładem jest
szereg homologiczny alkanów, alkenów i alkinów (tabela):
Tabela 1. Szeregi homologiczne węglowodorów [19]
Wzór
Nazwa
Wzór
Nazwa
Wzór
Nazwa
Wzór
Nazwa
Alkany
C
n
H
2n+2
Alkile
C
n
H
2n+1
Alkeny
C
n
H
2n
Alkiny
C
n
H
2n-2
CH
4
Metan
CH
3
Metyl
C
2
H
6
Etan
C
2
H
5
Etyl
C
2
H
4
Eten,
etylen
C
2
H
2
Etyn,
acetylen
C
3
H
8
Propan
C
3
H
7
Propyl
C
3
H
6
Propen,
propylen
C
3
H
4
Propyn
C
4
H
10
Butan
C
4
H
9
Butyl
C
4
H
8
Buten
C
4
H
6
Butyn
C
5
H
12
Pentan
C
5
H
11
Amyl,
Pentyl
C
5
H
10
Penten
C
3
H
4
Pentyn
C
6
H
14
Heksan
C
6
H
13
Heksyl
C
6
H
12
Heksen
C
6
H
10
Heksyn
C
7
H
16
Heptan
C
7
H
15
Heptyn
C
7
H
14
Hepten
C
7
H
12
Heptyn
C
8
H
18
Oktan
C
8
H
17
Oktyl
C
8
H
16
Okten
C
8
H
14
Oktyn
C
9
H
20
Nonan
C
9
H
19
Nonyl
C
9
H
18
Nonen
C
9
H
16
Nonyn
C
10
H
22
Dekan
C
10
H
21
Dekyl
C
10
H
20
Deken
C
10
H
18
Dekyn
C
11
H
24
Undekan
C
12
H
26
Dodekan
4.7.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do ćwiczeń.
1. Jaki pierwiastek jest podstawowy w połączeniach organicznych?
2. Na czym polega rzędowość atomów węgla?
3. Jak brzmi reguła Huckla?
4. Jakie znasz szeregi homologiczne węglowodorów?
5. Jakie znasz przykłady związków posiadających tetraedryczną budowę?
4.7.3. Ćwiczenia
Ćwiczenie 1
Podaj nazwę związku o następującym wzorze:
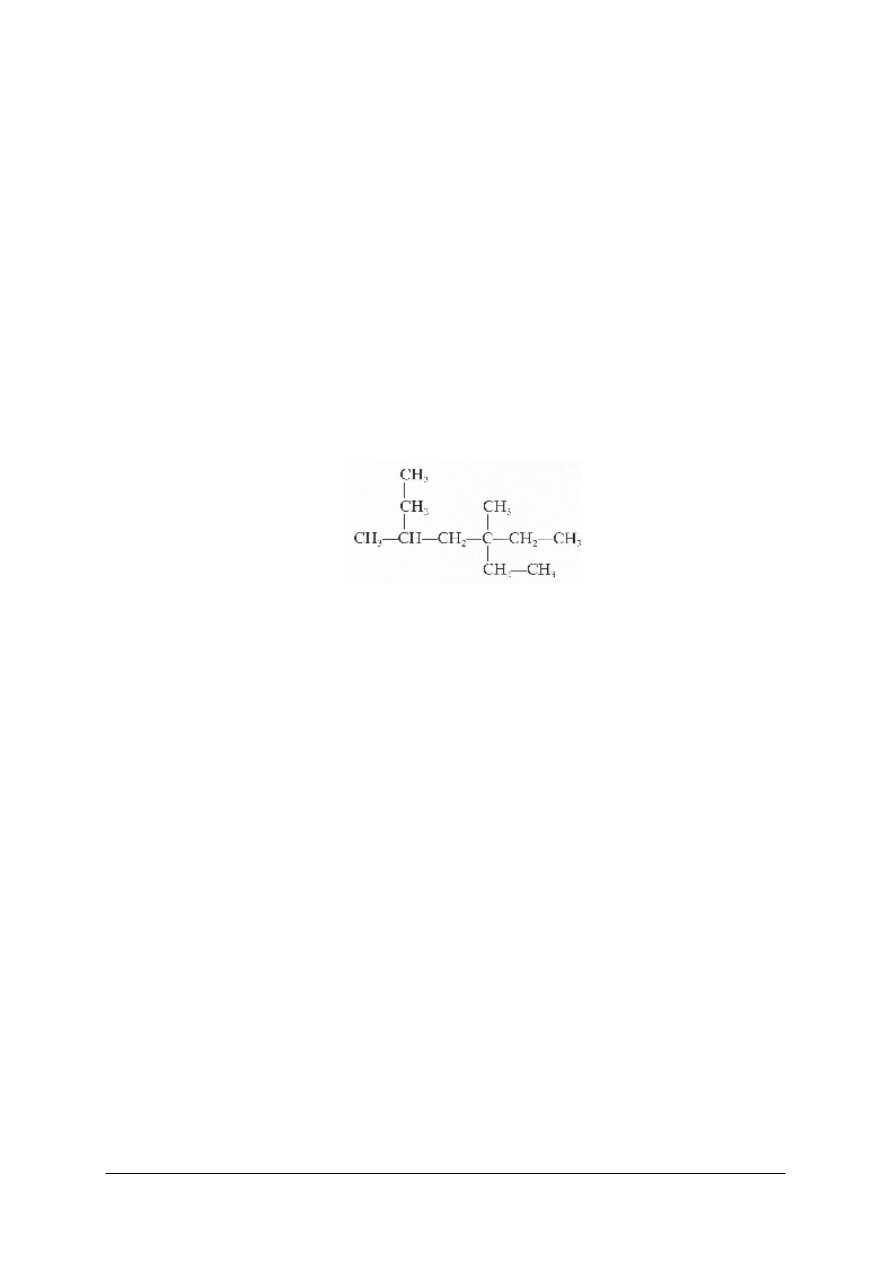
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) wybrać i główny łańcuch węglowy,
2) ponumerować atomy węgla w łańcuchu głównym i oznaczyć w nazwie położenie
wiązania podwójnego,
3) nazwać podstawniki i oznaczyć ich położenia,
4) zapisać pełną nazwę związku,
5) określić rzędowość atomów węgla,
6) przeanalizować z grupą i nauczycielem poprawność wykonania ćwiczenia.
Wyposażenie stanowiska pracy:
−
poradnik dla ucznia, literatura,
−
zeszyt lub arkusz papieru, długopis.
Ćwiczenie 2
Nazwij poniższy węglowodór i określ rzędowość atomów węgla:
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) wybrać i nazwać najdłuższy łańcuch,
2) ponumerować atomy węgla w łańcuchu głównym,
3) nazwać podstawniki,
4) zapisać nazwę związku,
5) określić rzędowość atomów węgla,
6) przeanalizować z grupą i nauczycielem poprawność wykonania ćwiczenia.
Wyposażenie stanowiska pracy:
−
zeszyt lub arkusz papieru, długopis,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
4.7.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) określić jaki pierwiastek jest podstawowy w połączeniach
organicznych?
2) wyjaśnić na czym polega rzędowość atomów węgla?
3) zdefiniować regułę Huckla?
4) wymienić szeregi homologiczne węglowodorów?
5) wymienić przykłady związków posiadających tetraedryczną budowę?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
40
4.8. Jednofunkcyjne i wielofunkcyjne związki organiczne,
związki heterocykliczne
4.8.1. Materiał nauczania
Węglowodory należą do podstawowych związków organicznych, występują powszechnie
i podlegają reakcjom chemicznym, w których powstają nowe związki organiczne. Ilość
nowych związków organicznych może być bardzo duża dzięki zjawisku izomerii oraz
zdolności do tworzenia różnorodnych łańcuchów przez atomy węgla. Grupa związków
organicznych, w których atomy wodoru w cząsteczkach węglowodorów zastąpione są
atomami lub grupami atomów innych pierwiastków to pochodne węglowodorów. Cząsteczki
tych połączeń zbudowane są z grupy węglowodorowej (alkilowej lub arylowej) oraz
podstawnika, zwanego grupą funkcyjną.
Grupa funkcyjna – jest to atom lub grupa atomów, które w połączeniu z grupą
węglowodorową tworzą cząsteczkę pochodnej węglowodorowej i nadają danej grupie
połączeń charakterystyczne właściwości. Obecność jednej grupy funkcyjnej zalicza dany
związek do jednofunkcyjnych pochodnych węglowodorów.
Tabela 2. Jednofunkcyjne związki organiczne [19]
Grupa funkcyjna
Nazwa
grupy
funkcyjnej (Z)
Nazwa pochodnych
-F, -Cl, -Br, -I
Fluorowce (halogenki)
Fluorowcopochodne węglowodorów
-OH
Hydroksylowa
Jeżeli jest połączona z grupą alkilową –
alkohole. Jeżeli jest połączona z grupą
arylową – fenole
Aldehydowa
Aldehydy
Ketonowa
Ketony
Karboksylowa
Kwasy karboksylowe
-NH
2
Aminowa
Aminy
-NO
2
Nitrowa
Związki nitrowe
Z połączenia grupy funkcyjnej (Z) z grupą alkilową lub arylową otrzymujemy
jednofunkcyjne pochodne, które przedstawiono w powyższej tabeli. Są to najważniejsze
jednofunkcyjne pochodne, które mają praktyczne zastosowanie i z którymi wielokrotnie
spotykamy się w codziennej działalności. Przykładem jest ocet, który jest kwasem
karboksylowym, alkohol – zmywacz do paznokci, który jest ketonem o nazwie aceton, itp.
Przykłady otrzymywanie jednofunkcyjnych związków organicznych
−
alkohole (jedno i wielohydroksylowe, fenol). Otrzymuje się je w wyniku: hydrolizy
chlorowcopochodnych, przyłączenia wody do alkenów, fermentacji, redukcji aldehydów
i ketonów, syntezy Grignarda. Przykład – Hydroliza chlorowcopochodnych:
R-X + HOH
→
ROH + HX
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
41
−
etery (liniowe, cykliczne) otrzymuje się przez odwodnienie alkoholi w silnie kwaśnym
środowisku:
2ROH
→
R-O-R + H
2
O
Inna metoda polega na reakcji alkoholanów lub fenolanów z halogenowęglowodorami:
RBr + R-O
-
-Na+
→
R-O-R + NaBr
−
aldehydy i ketony. Aldehydy otrzymuje się następującymi metodami: utlenianie alkoholi
I-szo rzędowych w obecności K
2
Cr
2
O
7
, utlenianie metylowych pochodnych benzenu,
redukcja chlorków kwasowych, synteza Reimera-Tlemanna (otrzymywanie fenolo-
aldehydów). Przykład – utlenianie alkoholi I-szo rzędowych:
RCH
2
OH
→
RCHO
−
ketony otrzymuje się w reakcjach: utlenianie alkoholi II-go rzędowych, acylowanie
metodą
Friedla-Craftsa,
reakcja
chlorków
kwasowych
ze
związkami
kadmoorganicznymi. Przykład – Utlenianie alkoholi II-go rzędowych:
−
kwasy karboksylowe (nasycone, nienasycone, aromatyczne). Grupa karboksylowa –
COOH w swojej strukturze zawiera grupę karbonylową (C=O) i hydroksylową (OH) przy
każdym atomie węgla. W reakcjach chemicznych może uczestniczyć jedna z nich, albo
obie jednocześnie. Ogólnie kwasy karboksylowe dzieli się na dwie grupy: kwasy
jednokarboksylowe,
kwasy
wielokarboksylowe.
Do
pochodnych
kwasów
karboksylowych należą: estry: R-CO-OR, np. CH
3
-CO-OC
2
H
5
(octan etylu), midy:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
42
R-CO-NH
2
, np. CH
3
-CO-NH
2
(acetamid), bezwodniki kwasowe (R-CO)
2
O. Kwasy
karboksylowe otrzymuje się przez utlenianie alkoholi I-szo rzędowych albo aldehydów.
Reakcja utleniania alkoholi była prezentowane wcześniej. Z innych reakcji należy
wymienić: reakcja związków Grignarda z dwutlenkiem węgla i hydrolizę nitryli. Reakcja
związków Grignarda z dwutlenkiem węgla:
RX + Mg
→
RMgX
RMgX + CO
2
→
RCOOMgX
RCOOMgX
→
RCOOH (środowisko kwasowe H+)
Hydroliza nitryli (środowisko kwasowe lub zasadowe):
R-CN + H
2
O
→
R-COOH + NH3
−
aminy. Najprostszą metodą otrzymywania amin jest alkilowanie amoniaku:
RBr + NH
3
+ NaOH --> RNH
2
+ H
2
O + NaBr
Wielofunkcyjne związki organiczne
Do wielofunkcyjnych pochodnych węglowodorów zaliczamy związki, które posiadają co
najmniej dwa rodzaje grup funkcyjnych. Do związków takich należą: cukry (sacharydy,
węglowodany).
Cukry są to wielowodorotlenowe ketony (ketozy) lub aldehydy (aldozy) oraz ich
pochodne. Węglowodany możemy podzielić na: proste (inaczej monosacharydy), które nie
ulegają hydrolizie do związków prostszych, dwucukry (disacharydy), hydrolizujące
z utworzeniem dwóch cząsteczek monosacharydów, oraz wielocukry (polisacharydy),
w wyniku ich hydrolizy otrzymujemy wiele cząsteczek monosacharydów.
Jednym z cukrów prostych, który występuje we wszystkich żywych organizmach, jest
glukoza. Jest to aldoheksoza, której wzór sumaryczny ma postać C
6
H
12
O
6
. Glukoza to
bezbarwna, słodka substancja krystaliczna, rozpuszczalna w wodzie. W środowisku
zasadowym glukoza reaguje z wodorotlenkiem miedzi, Cu(OH)
2
, tworząc związek
kompleksowy o barwie szafirowej. Jest to reakcja świadcząca o obecności grup -OH.
W reakcji glukozy z wodorotlenkiem miedzi w podwyższonej temperaturze powstaje ceglasty
tlenek miedzi(I), Cu
2
O.
Fruktoza ma taki sam wzór sumaryczny jak glukoza. Fruktoza jest ketoheksozą
występującą w miodzie, nasionach i owocach. Ma zbliżone właściwości do glukozy, ale jest
od niej o wiele słodsza. Stosuje się ją jako środek słodzący u ludzi chorych na cukrzycę.
Do disacharydów (dwucukrów) należy między innymi sacharoza. Otrzymywana jest na
skalę przemysłową z trzciny cukrowej i buraków cukrowych, stąd jego inne nazwy (cukier
trzcinowy, buraczany). W skład sacharozy wchodzi fruktoza i glukoza, a jej wzór sumaryczny
to C
12
H
22
O
11
. Tworzy ona bezbarwne, słodkie, rozpuszczalne w wodzie kryształy. Nie ma
właściwości redukujących, a w obecności kwasu ulega hydrolizie.
Skrobia (C
6
H
10
O
5
)
n
jest wielocukrem, który zawiera wiele reszt glukozy. Nie rozpuszcza
się ona w zimnej wodzie. Jest białym, nieposiadającym smaku i zapachu proszkiem.
Obecność skrobi można potwierdzić za pomocą płynu Lugola (roztwór jodu w jodku potasu).
Cukier ten jest podstawowym składnikiem pożywienia człowieka.
Innym polisacharydem, zbudowanym z około 7000 reszt celobiozy (dwucukier złożony
z dwóch reszt glukozy) jest celuloza, (C
6
H
10
O
5
)
n
. Czysty sacharyd jest białą nierozpuszczalną
w wodzie substancją. Celuloza stanowi składnik ścian komórkowych u roślin. Stosowana jest
w przemyśle papierniczym, włókienniczym, do produkcji sztucznego jedwabiu i środków
wybuchowych.
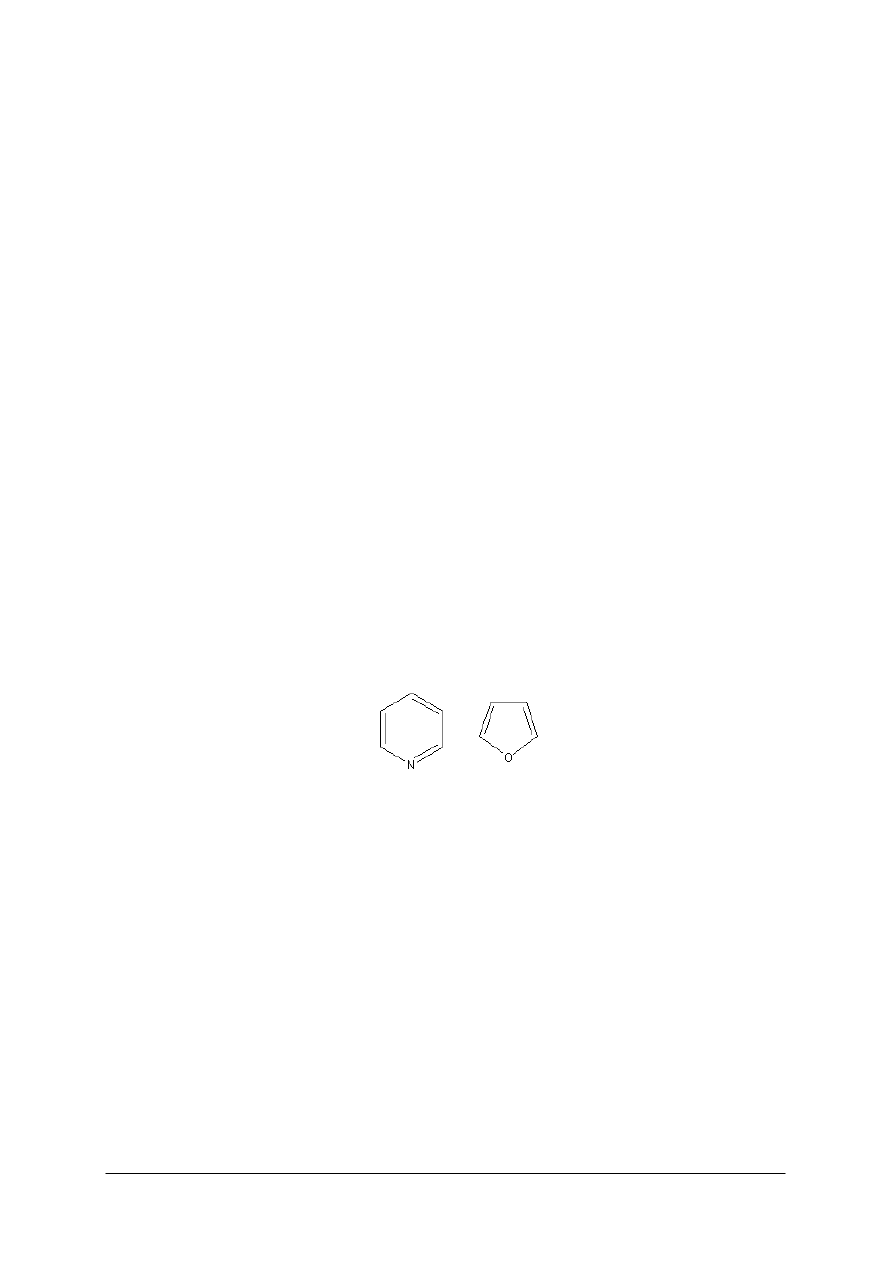
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
43
Wielofunkcyjne pochodne węglowodorów, posiadające w cząsteczce grupę aminową
(-NH
2
) i karboksylową (-COOH), zwane są aminokwasami. Wchodzą one w skład białek oraz
peptydów. Są nierozpuszczalne w wodzie i wykazują właściwości amfoteryczne.
W skład białek wchodzi dwadzieścia aminokwasów. Białka są to biopolimery,
zbudowane z reszt aminokwasów, połączonych ze sobą wiązaniem peptydowym. Pod
wpływem wysokiej temperatury, mocnych zasad i kwasów, napromieniowania, alkoholi
niskocząsteczkowych, aldehydów i soli metali ciężkich, białka ulegają nieodwracalnemu
procesowi denaturacji – zmiana struktury białka i utrata jego aktywności biologicznej. Na
ogół związki te są rozpuszczalne wodzie.
Możemy je podzielić na białka: proste i złożone. Do białek prostych (zwanych proteinami
i zbudowanych tylko z aminokwasów) zaliczane są: globuliny, albuminy, histony, prolaminy,
gluteliny, protaminy, skleroliny, natomiast do złożonych (proteidy, część białkowa połączona
jest ze składnikiem prostetycznym) należą: chromoproteidy, fosfoproteidy, nukleoproteidy,
lipoproteidy, glikoproteidy, metaloproteidy.
Związki heterocykliczne
Związki heterocykliczne – rodzaj związków chemicznych, w których pierścienie są
zbudowane z więcej niż jednego rodzaju atomu (np. siarki i węgla).
Za związek hetorocykliczny uważa się każdy związek cykliczny, który zawiera w swojej
strukturze inny, oprócz węgla, atom. Jednak nawet w obrębie chemii organicznej nie zawsze
się rozumie ten termin w ten sposób, często wyłączając z niego związki cykliczne zawierające
oprócz węgla także tlen jak np: cukry oraz etery cykliczne i koronowe.
W przypadku wielu związków chemicznych, które są „standardowo” zbudowane
z regularnie występujących dwóch rodzajów atomów (np: tlenu i węgla, z krzemu i tlenu lub
azotu i fosforu) terminu „związek heterocykliczny” używa się dopiero wtedy, gdy w cyklu
pojawiają się jeszcze jakieś inne atomy, np: azotu lub w przypadku cyklosiloksanów
i fosfazenów – paradoksalnie – węgla. Przykład: pirydyna i furan.
4.8.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do ćwiczeń.
1. Co to jest grupa funkcyjna?
2. Jak scharakteryzować pochodne węglowodorów?
3. Jakie znasz rodzaje grup funkcyjnych?
4. Jakie znasz metody otrzymywania jednofunkcyjnych związków organicznych?
5. Jakie znasz wielofunkcyjne związki organiczne?
6. Co to jest związek heterocykliczny?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
44
4.8.3. Ćwiczenia
Ćwiczenie 1
Zbadaj właściwości fizyczne glicerolu (węglowodór jednofunkcyjny).
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zgromadzić materiały i przybory potrzebne do wykonania ćwiczenia,
2) zorganizować stanowisko pracy zgodnie z przepisami bezpieczeństwa i higieny pracy
oraz wymaganiami ergonomii,
3) przygotować około 1 cm
3
glicerolu,
4) opisać jego gęstość, barwę i rozpuszczalność w wodzie,
5) dokonać analizy ćwiczenia,
6) na podstawie spostrzeżeń wyciągnąć wnioski, porównać je z wnioskami innych uczniów.
Wyposażenie stanowiska pracy:
−
zestaw niezbędnego sprzętu laboratoryjnego i odczynników chemicznych,
−
poradnik dla ucznia, literatura,
−
zeszyt lub arkusz papieru, długopis.
Ćwiczenie 2
Zbadaj właściwości redukcyjne glukozy za pomocą odczynnika Fehlinga.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zgromadzić materiały i przybory potrzebne do wykonania ćwiczenia,
2) zorganizować stanowisko pracy zgodnie z przepisami bezpieczeństwa i higieny pracy
oraz wymaganiami ergonomii,
3) przygotować w probówce 3 cm
3
siarczanu(VI)miedzi(II),
4) dodać około 5 cm
3
10% roztworu wodorotlenku sodu,
5) do powstałego osadu dodać 2
÷
3 kryształków winianu sodowego,
6) całość energicznie wymieszać,
7) do powstałego roztworu wsypać około 0,5 g glukozy,
8) całość wymieszać a następnie lekko ogrzać,
9) dokonać analizy ćwiczenia,
10) na podstawie spostrzeżeń wyciągnąć wnioski, porównać je z wnioskami innych uczniów.
Wyposażenie stanowiska pracy:
−
zestaw niezbędnego sprzętu laboratoryjnego i odczynników chemicznych,
−
zeszyt lub arkusz papieru, długopis,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
45
4.8.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) wyjaśnić co to jest grupa funkcyjna?
2) scharakteryzować pochodne węglowodorów?
3) wymienić rodzaje grup funkcyjnych?
4) wymienić
metody
otrzymywania
jednofunkcyjnych
związków
organicznych?
5) wymienić podstawowe wielofunkcyjne związki organiczne?
6) wyjaśnić co to jest związek heterocykliczny?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
46
4.9. Wielocząsteczkowe związki naturalne i syntetyczne
4.9.1. Materiał nauczania
Tworzywa sztuczne są materiałami, w których najistotniejszy składnik stanowią związki
wielkocząsteczkowe,
syntetyczne
lub
pochodzenia
naturalnego.
Oprócz
związku
wielkocząsteczkowego tworzywo sztuczne zawiera zwykle składniki dodatkowe, które nadają
mu korzystne właściwości użytkowe. Składnikami tymi mogą być napełniacze, nośniki,
zmiękczacze, pigmenty i barwniki, stabilizatory i wiele innych. Większość związków
wielkocząsteczkowych jest zbudowana z wielkiej liczby powtarzających się i połączonych
między sobą identycznych elementów podstawowych, nazywanych merami. Dlatego też
związki wielkocząsteczkowe nazywamy polimerami (poli-wiele).
Ze względu na pochodzenie można je najogólniej podzielić na trzy podstawowe grupy:
−
naturalne związki wielocząsteczkowe występujące w przyrodzie (celuloza, białko,
kauczuk ),
−
związki wielkocząsteczkowe otrzymywane z polimerów pochodzenia naturalnego
w wyniku modyfikacji polegającej na chemicznej zmianie właściwości polimerów
naturalnych,
−
syntetyczne związki wielkocząsteczkowe wytwarzane na podstawie reakcji chemicznej
ze związków małocząsteczkowych.
Związki małocząsteczkowe, które stanowią substancje wyjściowe do otrzymywania
syntetycznych związków wielkocząsteczkowych składają się z niewielkiej liczby atomów
i noszą nazwę monomerów.
Otrzymywanie syntetycznych związków wielkocząsteczkowych polega na łączeniu się
między sobą cząsteczek monomerów z wytworzeniem wielkich cząsteczek, tzw.
makrocząsteczek.
Polimery odznaczają się dużą masą cząsteczkową. Masa cząsteczkowa jest liczbą
umowną wyrażającą stosunek masy cząsteczki danej substancji do 1/12 masy atomu węgla.
Z masą cząsteczkową polimerów jest związane bezpośrednio pojęcie stopnia
polimeryzacji. Jest to niemianowana liczba wskazująca, ile razy dany element podstawowy
(mer) powtarza się w ugrupowaniu związku wielkocząsteczkowego. Stopień polimeryzacji
określa ułamek:
n = masa cząsteczkowa polimeru / masa cząsteczkowa meru
Właściwości związków wielkocząsteczkowych zależą w dużym stopniu od ich masy
cząsteczkowej. Ten sam polimer w zależności od masy cząsteczkowej może mieć na tyle
różne właściwości, że wymaga stosowania odrębnych metod przetwórczych.
Otrzymywanie polimerów
Reakcje chemiczne otrzymywania polimerów, tj. wytwarzania syntetycznych związków
wielkocząsteczkowych, nazywane są zwyczajowo polireakcjami. Rozróżnia się trzy rodzaje
polireakcji, którymi są: polimeryzacja, polikondensacja, poliaddycja.
Polimeryzacja jest procesem łączenia się wielu cząsteczek monomeru, któremu nie
towarzyszy wydzielenie małocząsteczkowych produktów ubocznych. Proces ten można
schematycznie przedstawić następująco:
nA
→
[A]n
gdzie: n – liczba cząsteczek monomeru (stopień polimeryzacji), A – cząsteczka monomeru,
Polimeryzacja przebiega bez zmian składu substancji reagujących. Powstający polimer
różni się od monomeru tylko wielkością cząsteczki. W przedstawionym uprzednio procesie
reaguje tylko jeden rodzaj monomeru. Taki proces jest nazywany homopolimeryzacją,
a otrzymany produkt – homopolimerem. Jeżeli polimeryzacji ulega natomiast więcej niż jeden

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
47
rodzaj monomeru, proces taki nazywa się kopolimeryzacją a powstający produkt –
kopolimerem.
Polikondensacja jest procesem łączenia się wielu cząsteczek substancji wyjściowych
w związek wielkocząsteczkowy z jednoczesnym wydzieleniem prostego związku
małocząsteczkowego – jako produktu ubocznego reakcji. Skład chemiczny polimeru
powstającego w wyniku polikondensacji nie jest identyczny ze składem substancji
wyjściowych. Spowodowane jest to wydzieleniem się produktów ubocznych podczas
procesu.
Poliaddycja ma charakter pośredni między polimeryzacją a polikondensacją. Podobnie
jak polikondensacja jest to reakcja przebiegająca w sposób stopniowy, lecz nie jest procesem
odwracalnym. Polimery otrzymywane w wyniku poliaddycji mają ten sam skład chemiczny
co monomery, lecz różnią się od nich budową. Mechanizm omawianej reakcji polega
najogólniej na przemieszczaniu atomu wodoru w cząsteczce monomeru, umożliwiając tym
samym wzrost łańcucha polimeru.
4.9.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do ćwiczeń.
1. Co to jest polimer?
2. Jakie znasz rodzaje polimerów?
3. Jakie znasz metody otrzymywania polimerów?
4. Jaka jest różnica pomiędzy polimeryzacją a polikondensacją?
5. Czym charakteryzuje się poliaddycja?
4.9.3. Ćwiczenia
Ćwiczenie 1
Zbadaj właściwości wybranych tworzyw sztucznych.
Problemy do rozwiązania:
1) czy badane tworzywa uległy spaleniu,
2) na jaki kolor zabarwia się zwilżony wodą destylowaną papierek wskaźnikowy w pobliżu
polichlorku winylu?
3) które z badanych tworzyw rozpuszczają się w benzynie i acetonie?
4) gdzie można wykorzystać obserwowane zjawisko zmian właściwości fizycznych pod
wpływem wysokiej temperatury?
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zgromadzić materiały i przybory potrzebne do wykonania ćwiczenia,
2) zorganizować stanowisko pracy zgodnie z przepisami bezpieczeństwa i higieny pracy
oraz wymaganiami ergonomii pracy,
3) niewielką próbkę tworzywa jak: polietylenu, polichlorku winylu PCW, polistyrenu
spróbować zapalić wprowadzając je do płomienia palnika,
4) zwrócić uwagę, czy próbka gaśnie po wyjęciu z płomienia, czy pali się nadal,
5) do świeżo wyjętej z płomienia próbki PCW zbliżyć zwilżony wodą destylowaną papierek
wskaźnikowy,
6) próbkę tworzywa zanurzyć na chwilę do wrzącej wody i spróbować wyciągnąć ją
posługując się szczypcami,
7) dokonaj analizy ćwiczenia,
8) na podstawie spostrzeżeń wyciągnąć wnioski, porównać je z wnioskami innych uczniów.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
48
Wyposażenie stanowiska pracy:
−
zestaw niezbędnego sprzętu laboratoryjnego i odczynników chemicznych,
−
zeszyt lub arkusz papieru, długopis,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Dokonaj
depolimeryzacja
poli(metakrylanu
metylu)
–
„szkła
organicznego”
i polimeryzacji otrzymanego monomeru.
Problemy do rozwiązania:
1) jakim zapachem charakteryzuje się otrzymany produkt reakcji?
2) co dzieje się z wodą bromową w obecności destylatu i o czym to świadczy?
3) co dzieje się z pozostałą częścią destylatu odstawioną do łaźni wodnej?
4) wyjaśnij na czym polega proces polimeryzacji?
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zgromadzić materiały i przybory potrzebne do wykonania ćwiczenia,
2) zorganizować stanowisko pracy zgodnie z przepisami bezpieczeństwa i higieny pracy
oraz wymaganiami ergonomii,
3) do dużej probówki wrzucić 10 g drobno pokruszonego „szkła organicznego”,
4) probówkę zamknąć korkiem z osadzoną w nim wygiętą rurką szklaną i ogrzewać
intensywnie płomieniem palnika, zbierając do probówki oddestylowany produkt,
5) ogrzewanie przerwać po zebraniu około 2 cm
3
destylatu,
6) wykonać próbę z wodą bromową: do pozostałej ilości destylatu dodać kilka małych
kawałków „szkła organicznego” i wstawić probówkę do łaźni wodnej o temperaturze
60
o
C,
7) zaobserwować zachodzące zmiany,
8) dokonać analizy ćwiczenia,
9) na podstawie spostrzeżeń wyciągnąć wnioski, porównać je z wnioskami innych uczniów.
Wyposażenie stanowiska pracy:
−
zestaw niezbędnego sprzętu laboratoryjnego i odczynników chemicznych,
−
zeszyt lub arkusz papieru, długopis,
−
poradnik dla ucznia,
literatura zgodna z punktem 6 poradnika
4.9.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) wyjaśnić co to jest polimer?
2) wymienić rodzaje polimerów?
3) wymienić metody otrzymywania polimerów?
4) określić różnicę pomiędzy polimeryzacją a polikondensacją?
5) określić czym charakteryzuje się poliaddycja?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
49
4.10. Układy wieloskładnikowe, mieszaniny i roztwory
4.10.1. Materiał nauczania
Większość procesów chemicznych jest realizowana w układach wieloskładnikowych,
w których co najmniej jeden składnik jest znacznie rozdrobniony. Układy takie stanowią,
w zależności od stopnia rozdrobnienia składników:
−
mieszaniny niejednorodne
−
mieszaniny jednorodne (układy dyspersyjne)
Mieszaniny niejednorodne (heterogeniczne) są to układy, w których fazy poszczególnych
składników zachowują swoje cechy makroskopowe (na przykład piasek + woda, piasek +
siarka, woda + olej). Mieszaniny takie można stosunkowo łatwo rozdzielić metodami
fizycznymi, takimi jak:
−
sączenie przez materiał porowaty,
−
sedymentacja w polu grawitacyjnym ziemskim,
−
dekantacja, tzn. ostrożne zlanie cieczy znad osadu,
−
segregacja mechaniczna (jeżeli ziarna poszczególnych składników są dostatecznie duże).
Mieszaninami jednorodnymi (układami dyspersyjnymi) nazywa się takie układy,
w których małe cząstki jednej substancji – fazy rozproszonej – są równomiernie
rozmieszczone w innej substancji – fazie rozpraszającej. Ogólnie taki układ nazywamy
roztworem.
W roztworach substancja znajdująca się w przewadze nazywana jest rozpuszczalnikiem
a substancja występująca w mniejszej ilości substancją rozpuszczaną.
Roztwory mogą powstać w wyniku zmieszania:
−
gazu z gazem i powstaje roztwór gazowy,
−
gazu z cieczą,
−
substancji w stanie stałym z cieczą,
−
cieczy z cieczą,
−
substancji w stanie stałym z substancją w stanie stałym i powstaje roztwór stały.
Przykładem roztworu, który powstał w wyniku zmieszania gazów jest powietrze. Jest to
mieszanina takich gazów jak; azot, tlen, dwutlenek węgla, argon i innych cząsteczek. Pod
względem kinetycznym roztwór gazowy jest podobny do czystego gazu, z tą różnicą, że
zawiera cząsteczki różnego rodzaju, które mieszają się ze sobą w dowolnych stosunkach.
Oznacza to, że roztwory gazowe zawsze powstają podczas mieszania dowolnych gazów
i w dowolnych stosunkach. Roztwory, które powstają w wyniku zmieszania dowolnych
substancji z cieczą, są cieczami. W wyniku zmieszania różnych substancji w stanie stałym
powstają roztwory, które są ciałami stałymi. Przykładem są różnego rodzaju stopy metali,
takie jak; mosiądz, brąz, stal, srebro monetarne, stopy glinu.
W zależności od stopnia rozdrobnienia fazy rozproszonej rozróżnia się:
−
roztwory właściwe (rzeczywiste) – złożone z cząsteczek lub jonów o rozmiarach
mniejszych niż 10
-9
m,
−
roztwory koloidalne – złożone z cząstek o rozmiarach 10
-7
m–10
-9
m widocznych dopiero
pod mikroskopem elektronowym. Tak małe cząstki można rozdzielić dopiero
w ultrawirówkach. Roztwory koloidalne intensywnie rozpraszają światło (efekt
Tyndalla),
−
zawiesiny – złożone z cząstek o rozmiarach 10
-6
m–10
-7
m widocznych pod mikroskopem
optycznym. Można je rozdzielić przez sedymentację pod wpływem siły ziemskiego pola
grawitacyjnego.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
50
Zawiesiny takie jak dymy (ciało stałe rozproszone w gazie), mgły (ciecz rozproszona
w gazie), emulsje (ciecz rozproszona w cieczy) oraz piany (gaz w cieczy), przy dostatecznie
dużym rozdrobnieniu stają się koloidami. Podobnie białka i polimery nawet w rozdrobnieniu
cząsteczkowym są układami koloidalnymi.
Najbardziej rozpowszechnionymi roztworami rzeczywistymi są roztwory ciekłe. Dlatego
w wąskim znaczeniu roztwór definiujemy
jako
mieszaninę
substancji ciekłej
(rozpuszczalnika) i jednej albo więcej stałych, ciekłych lub gazowych substancji
rozpuszczonych, których cząsteczki są dokładnie przemieszane z cząsteczkami
rozpuszczalnika.
Woda jest znakomitym rozpuszczalnikiem wielu substancji z którymi mamy codziennie
kontakt. Woda bardzo dobrze rozpuszcza sól kuchenną, cukier i wiele innych substancji. To,
że substancje rozpuszczają się zawdzięczamy aktywnemu oddziaływaniu drobin cząsteczek
wody na substancję, którą wprowadziliśmy do wody. Przykładem jest cukier, którego
kryształy podczas rozpuszczania znikają a roztwór staje się klarowny.
To oznacza, że substancja rozpuszczana uległa rozpadowi na tak małe drobiny, które
stają się niewidoczne dla oka. Oderwane od kryształu drobiny następnie podlegają
oddziaływaniu cząsteczek wody, które znajdują się ciągłym, bezwładnym ruchu. Samo
oddziaływanie to zderzenia aktywne w których jest przekazywana energia między drobinami
rozpuszczalnika i drobinami substancji rozpuszczonej. W wyniku zderzeń wszystkie drobiny
w sposób bezwładny przemieszczają się w roztworze.
Jeżeli rozpuścimy substancję o budowie jonowej, wtedy w roztworze oprócz cząsteczek
wody będą znajdowały jony oderwane od kryształu.
Rozpad cząsteczek substancji rozpuszczonej na jony nazywa się dysocjacją
elektrolityczną.
Większość reakcji chemicznych zachodzi w roztworach wodnych. Reakcja chemiczna
przebiega w dwóch kierunkach. Z cząsteczek substratów tworzą się produkty, a cząsteczki
produktów mogą ze sobą reagować, odtwarzając cząsteczki substratu. Czasami używa się
określenia, że reakcja jest nieodwracalna, mając na uwadze jej przebieg, aż do wyczerpania
substratów. Po zakończeniu takiej reakcji trudno jest wykryć wymierzalne ilości substratu.
W rzeczywistości i ta reakcja biegnie tylko do osiągnięcia równowagi, w której obok
produktów istnieją jeszcze cząsteczki substratów. Stan równowagi chemicznej dla reakcji
odwracalnej, na przykład:
gdzie: a; b; c; d – oznaczają liczby cząsteczek substratów (A, B) i produktów (C, D)
uczestniczących w reakcji, opisuje równanie na stałą równowagi K
eq
:
Stała równowagi równa się iloczynowi stężeń (mol/l) produktów podzielonemu przez
iloczyn stężeń (mol/l) substratów i informuje o uprzywilejowanym kierunku reakcji.
Reakcja w prawo będzie uprzywilejowana wówczas, gdy wartość K
eq
będzie większa od
jedności, natomiast, gdy uprzywilejowaną jest reakcja w lewo, wartość K
eq
jest mniejsza od
jedności.
Dla stałych równowagi większych od K=10
3
, stężenia substratów w stanie równowagi
stanowią mniej niż 1% stężeń początkowych, reakcje takie można już zaliczyć do
nieodwracalnych, w sensie potocznym. Praktycznie nieodwracalną jest reakcja, której stała
równowagi jest rzędu 1018, nie jest możliwe eksperymentalne wykrycie substratów w stanie
równowagi, jednak o ich istnieniu świadczą różne obserwacje pośrednie.
Reakcja przebiega w prawo, gdy produkty są bardziej stabilne, zatem zawierają mniej
energii niż substraty.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
51
Jeśli produkty mają mniejszą zawartość energii niż substraty, to w wyniku reakcji
wydziela się ciepło i nazywa się reakcją egzotermiczną.
Reakcja, w której energia cieplna jest pobierana z otoczenia nazywa się reakcją
endotermiczną. Reakcja, której produkty zawierają więcej energii niż substraty przebiega
w lewo, w kierunku tworzenia substratów.
Chemicznym odpowiednikiem wydzielanej lub pochłanianej energii cieplnej podczas
reakcji chemicznej jest entalpia (H). Zmiany entalpii (
∆
H) mają wpływ na położenie
równowagi, ale jej znajomość nie jest wystarczająca do dokładnego przewidzenia położenia
równowagi, ponieważ potrzebna jest również znajomość zmian entropii. Entropia (S) jest
funkcją termodynamiczną, opisującą zmiany uporządkowania cząsteczek następujące podczas
reakcji.
4.10.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do ćwiczeń.
1. Czym się charakteryzują mieszaniny niejednorodne?
2. Jak zdefiniujesz mieszaniny jednorodne?
3. Jak powstają roztwory?
4. Jakie znasz przykłady roztworów?
5. Co to jest dysocjacji elektrolityczna?
6. Co to jest stała równowagi?
4.10.3. Ćwiczenia
Ćwiczenie 1
Sporządź mieszaninę soli kamiennej, piasku, kredy i opiłków żelaza oraz przedstaw
sposoby ich rozdzielenia.
Problemy do rozwiązania:
1) dlaczego można stwierdzić, że powstała mieszanina jest mieszaniną niejednorodną?
2) wyjaśnij przyczynę opadania różnych cząstek tej mieszaniny z różną szybkością.
3) czy ciecz nad osadem jest klarowna – odpowiedź uzasadnij.
4) w jaki sposób można rozdzielić składniki mieszaniny niejednorodnej, w której część
składników ulega rozpuszczeniu w wodzie, a niektóre z nich tworzą zawiesinę lub
opadają na dno naczynia?
5) jaki proces fizyczny nazywamy sedymentacją a jaki dekantacją?
6) narysuj schemat podstawowego zestawu do sączenia zawiesin.
7) zaproponuj, jak inaczej można rozdzielić składniki tej mieszaniny.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zgromadzić materiały i przybory potrzebne do wykonania ćwiczenia,
2) zorganizować stanowisko pracy zgodnie z przepisami bezpieczeństwa i higieny pracy
oraz wymaganiami ergonomii,
3) do wysokiego cylindra pojemności 500 cm
3
wlać około 350 cm
3
wody i sporządzić
mieszaninę, sypiąc kolejno łopatką sól kamienną, drobny piasek, sproszkowaną kredę
i bardzo drobne opiłki żelaza,
4) wstrząsać zawartość cylindra, uprzednio zamykając go korkiem,
5) postawić cylinder i obserwować zachowanie się ziaren substancji zawieszonych w cieczy,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
52
6) ostrożnie zlewać ciecz znad osadu z poprzedniego ćwiczenia do dużej zlewki, osad
pozostały w cylindrze zalać kilkakrotnie małymi porcjami wody i po wymieszaniu, zlać
mętną wodę do przygotowanej zlewki. Czynność tę powtarzać tak długo, aż woda
w cylindrze po opadnięciu ziaren piasku i opiłków będzie czysta,
7) przenieść osad (mieszaninę piasku i opiłków żelaznych) z cylindra na bibułę i wysuszyć,
8) do mieszaniny piasku i opiłków żelaznych zbliżyć magnes,
9) zaobserwować zachodzące zjawisko,
10) (biała zawiesina w zlewce powoli opada – na dnie zlewki osadzają się grubsze ziarenka
kredy), lekko mleczną ciecz zlać znad osadu,
11) delikatną zawiesinę kredy przesączyć przez bibułę filtracyjną na lejku,
12) przesączyć zebrany w zlewce jest mieszaniną – wodnym roztworem soli – na bibule
pozostaje osad drobnych ziaren kredy, które po wysuszeniu bibuły (usunięciu wody)
zebrać na szkiełku zegarkowym,
13) ogrzewać w parownicy część otrzymanego roztworu soli. Rozdziel mieszaninę wody
z mułem i piaskiem za pomocą sączka z bibuły,
14) do zlewki z wodą wsypać mieszaninę bardzo drobnego piasku i żwiru, dokładnie mieszać
całość bagietką szklaną,
15) obserwować, jakie zmiany zachodzą w mieszaninie po pewnym czasie,
16) dokonać analizy ćwiczenia,
17) na podstawie spostrzeżeń wyciągnąć wnioski, porównać je z wnioskami innych uczniów.
Wyposażenie stanowiska pracy:
−
zestaw niezbędnego sprzętu laboratoryjnego i odczynników chemicznych,
−
zeszyt lub arkusz papieru, długopis.
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Przedstaw prezentację procesu egzotermicznego i endotermicznego.
Problemy do rozwiązania:
1) o czym świadczy zmiana temperatury roztworów?
2) wyjaśnij, dlaczego w pierwszej zlewce nastąpiło obniżenie, a w drugiej podwyższenie
temperatury roztworu?
3) określ, na czym polega proces egzotermiczny i endotermiczny oraz czym one się różnią?
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zgromadzić materiały i przybory potrzebne do wykonania ćwiczenia,
2) zorganizować stanowisko pracy zgodnie z przepisami bezpieczeństwa i higieny pracy
oraz wymaganiami ergonomii,
3) do zlewki (o objętości ok. 100 cm
3
) nalać 25 cm
3
wody destylowanej o temperaturze
pokojowej,
4) zmierzyć za pomocą termometru temperaturę i wsypać do wody 27 g azotanu(V)amonu
NH
4
NO
3
,
5) po wymieszaniu roztworu bagietką szklaną zmierzyć ponownie temperaturę roztworu,
6) do zlewki (o objętości ok. 500 cm
3
) nalać około 100 cm
3
wody destylowanej,
7) po zmierzeniu jej temperatury termometrem dolać powoli i ostrożnie (ciągle mieszając)
ok. 20 cm
3
stężonego kwasu siarkowego(VI),
8) zmierzyć temperaturę powstałego roztworu,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
53
9) dokonać analizy ćwiczenia,
10) na podstawie spostrzeżeń wyciągnąć wnioski, porównać je z wnioskami innych uczniów.
Wyposażenie stanowiska pracy:
−
zestaw niezbędnego sprzętu laboratoryjnego i odczynników chemicznych,
−
zeszyt lub arkusz papieru, długopis,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
4.10.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) wyjaśnić czym się charakteryzują mieszaniny niejednorodne?
2) zdefiniować mieszaniny jednorodne?
3) wyjaśnić jak powstają roztwory?
4) podać przykłady roztworów?
5) wyjaśnić co to jest dysocjacja elektrolityczna?
6) wyjaśnić co to jest stała równowagi?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
54
4.11. Termodynamika i termochemia
4.11.1. Materiał nauczania
Badaniem reakcji chemicznych oraz przemian fizykochemicznych, a także obserwacją
zachowania się układów makroskopowych w zależności od zmian ciśnienia, objętości,
temperatury i ilości składników zajmuje się termodynamika chemiczna. Jest to nauka ścisła
opierająca się na czterech aksjomatach, nazywanych zasadami termodynamiki, które stanowią
najbardziej zwięzłe uogólnienie wyników badań doświadczalnych.
Obiektem rozważań termodynamicznych jest układ, którym jest wybrany obiekt badań.
Takim obiektem może być probówka w której zachodzi reakcja chemiczna, kolba
z reagentami, naczynie kuchenne.
Wszystko co znajduje się poza układem określane jest jako otoczenie. W praktyce
rozpatruje się tylko tę część otoczenia, która sąsiaduje bezpośrednio z układem. Układ
oddzielają od otoczenia ścianki (rzeczywiste lub wyobrażone), ograniczające go i decydujące
o wymianie materii i energii między układem a otoczeniem.
Układ oddzielają od otoczenia ścianki (rzeczywiste lub wyobrażone), ograniczające go
i decydujące o wymianie materii i energii między układem a otoczeniem. Układ może być
otwarty, zamknięty lub izolowany. Układ otwarty może wymieniać z otoczeniem materię
i energię. Układ zamknięty nie wymienia z otoczeniem materii chemicznej, lecz może
wymieniać z otoczeniem energię. Układ izolowany nie wymienia z otoczeniem ani materii,
ani energii.
Stan układu, praktycznie określa się przez podanie makroskopowych wielkości, takich
jak na przykład: temperatury, ciśnienia, objętości, składu chemicznego, stężenia składników.
Układy złożone dzieli się na części nazywane fazami, które spełniają dwa wymagania:
−
makroskopowe właściwości każdego elementu objętości w obrębie fazy są identyczne,
−
istnieje wyraźna granica faz, na której następuje skokowa zmiana właściwości materii.
Najbardziej charakterystyczną wielkością termodynamiczną opisującą stan układu jest
energia wewnętrzna układu związana z wzajemnymi ruchami i oddziaływaniami
poszczególnych jego części: cząsteczek, atomów i jonów. Składa się z energii kinetycznej
(U
kin
) cząsteczek, atomów i jonów, energii potencjalnej (U
pot
) wzajemnego oddziaływania
cząsteczek oraz energii kinetycznej (U
jadr
) jąder atomowych.
U = U
kin
+ U
pot
+ U
jadr
Częścią energii wewnętrznej układu jest energia cieplna, której źródłem jest energia
kinetyczna ruchu cząsteczek, atomów i jonów a miarą przeciętnego zasobu energii jest
temperatura termodynamiczna (bezwzględna) układu. Inną wielkością związaną z energią
wewnętrzną układu jest energia chemiczna na którą składa się energia potencjalna wiązań
wewnątrz cząsteczkowych i wzajemnych oddziaływań między cząsteczkami. Ta część energii
wewnętrznej układu, nazwana energią chemiczną, podczas reakcji chemicznej w wyniku
przebudowy wiązań przekształca się w inne rodzaje energii, które mogą być wykorzystane, na
przykład jako energia cieplna, elektryczna, itp.
Badania efektów energetycznych przemian doprowadziły do sformułowania pierwszej
zasady termodynamiki, która znana jest jako zasada zachowania energii w myśl której zmiany
energii układu i otoczenia kompensują się a ich suma równa się zeru, co zapisuje się
w postaci równania:
∆
U
układ
+
∆
U
otocz
= 0
Jest i druga treść pierwszej zasady termodynamiki w myśl której energia wewnętrzna
układu jest określona przez wartości parametrów (temperatura, objętość, ciśnienie, ilość, itd.)
stanu układu. A to oznacza, że energia wewnętrzna układu jest funkcją stanu.
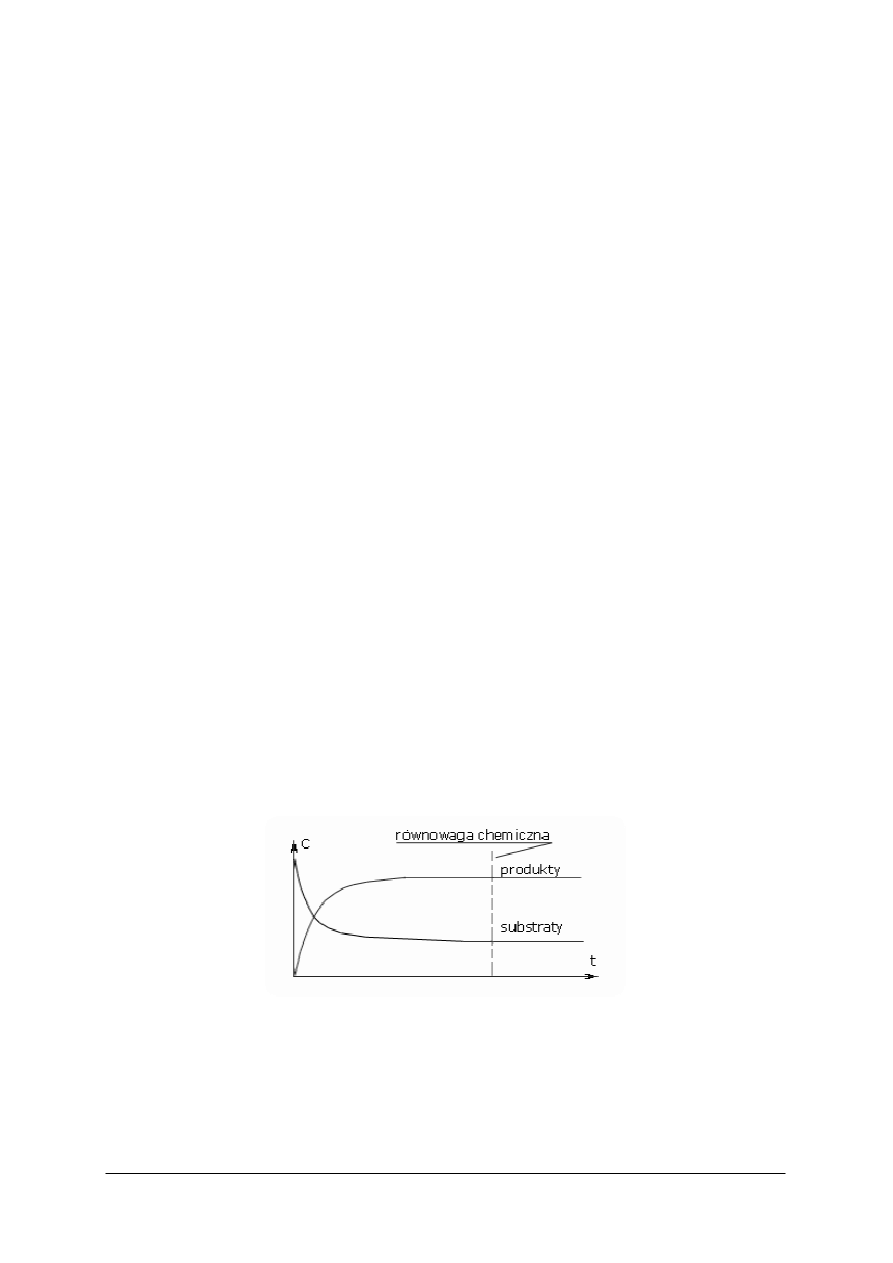
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
55
Termochemia jest działem chemii obejmującym badania efektów cieplnych reakcji
chemicznych oraz ustalanie zależności efektów cieplnych reakcji chemicznych od
parametrów fizycznych. Termochemia zajmuje się zatem badaniem wymiany ciepła między
podlegającym przemianie układem i otoczeniem.
Ciepło właściwe c jest to ilość ciepła potrzebna do ogrzania jednego kilograma substancji
o jeden kelwin (stopień Celsjusza). Inaczej, ciepło właściwe jest to pojemność cieplna
jednostki masy substancji.
Rozróżnia się ciepło właściwe pod stałym ciśnieniem – c
p
oraz ciepło właściwe w stałej
objętości – c
v
.
W rozważaniach teoretycznych i obliczeniach termochemicznych ważnym pojęciem jest
ciepło molowe C – określa iloczyn ciepła właściwego i masy molowej:
C = c
⋅
M
Stała równowagi chemicznej
Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się
produkty, a jednocześnie produkty reakcji ulęgają rozkładowi na substraty. Fakt ten
w równaniach chemicznych często zaznaczamy dwoma przeciwnie skierowanymi strzałkami
<=>. Reakcje nieodwracalne należą do wyjątków i biegną z reguły wtedy, gdy jeden
z produktów opuszcza środowisko reakcji. Rozpatrzmy ogólną reakcję w której a moli
substancji A oraz b moli substancji B tworzy e moli substancji E i d moli substancji D.
aA + bB = eE + dD
Szybkość v
1
przemiany substratów w produkty będzie zgodnie z równaniem:
v
1
= k
1
⋅
[A]
a
• [B]
b
gdzie: [A], [B] – stężenia substratów
Szybkość v
1
maleje w czasie trwania reakcji w miarę zmniejszania się stężenia
substratów A i B. Z chwilą pojawienia się pierwszych ilości produktów E i D może wystąpić
proces odwrotny, tj. produkty mogą ulegać przemianie odwrotnej z utworzeniem substratów
A i B z szybkością v
2
.
Szybkość v
2
tej odwrotnej przemiany będzie wynosiła:
v
2
= k
2
⋅
[E]
e
⋅
[D]
d
gdzie: [E], [D] – stężenia produktów
i będzie rosła w czasie trwania reakcji, wskutek nagromadzenia się coraz większych
ilości produktów E i D. Zmiany stężeń substratów i produktów reakcji chemicznej w czasie
jej trwania zilustrowane są na rys.
Rys. 9. Zmiany stężeń substratów i produktów w czasie biegu reakcji chemicznej [19]
Gdy temperatura T reagującego układu jest stała w czasie procesu, wtedy zmiany
szybkości reakcji wprost i reakcji odwrotnej spowodowane są jedynie zmianami stężeń
reagujących substancji. Po pewnym czasie trwania reakcji ustali się stan równowagi
chemicznej, w którym szybkości reakcji w obu kierunkach będą równe:
v = k
1
⋅
[A]
a
⋅
[B]
b
= k
2
⋅
[E]
e
⋅
[D]
d

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
56
Po przekształceniu równania otrzymamy:
Iloraz dwóch stałych szybkości reakcji k
1
i k
2
jest w danej temperaturze stały.
gdzie: K
c
– stała równowagi chemicznej, odniesiona do stężeń molowych reagentów
Wzór nazywa się stałą równowagi i wyraża prawo działania mas i nazywane też prawem
Guldberga-Waagego.
Stwierdza ono, że w stanie równowagi chemicznej (dla T=const) stosunek iloczynu
stężeń molowych produktów reakcji do stosunku iloczynu stężeń molowych substratów jest
wielkością stałą, przy czym wartości stężenia produktu i substratu należy podnieść do potęgi
równej współczynnikowi stechiometrycznemu danego reagentu.
4.11.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do ćwiczeń.
1. Co to jest termodynamika chemiczna?
2. Co to jest układ i otoczenie?
3. Jak dzieli się układy złożone?
4. Co to jest energia wewnętrzna układu?
5. Jak zdefiniujesz pierwszą i drugą zasadę termodynamiki?
6. Co to jest stała równowagi chemicznej?
4.11.3. Ćwiczenia
Ćwiczenie 1
Oblicz procentowy skład objętościowy mieszaniny gazów oraz stałą równowagi
mieszaniny gazów: 6 moli wodoru z 8 molami chloru, z których otrzymano 4 mole
chlorowodoru.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) napisać równanie reakcji chemicznej,
2) na podstawie równania reakcji napisać wzór na stałą równowagi,
3) obliczyć jaka liczba moli wodoru i chloru weszła w reakcję tworząc w stanie równowagi
4 mole chlorowodoru,
4) obliczyć procentowy skład mieszaniny,
5) dokonać analizy ćwiczenia,
6) zaprezentować pracę.
Wyposażenie stanowiska pracy:
−
zeszyt lub arkusz papieru, długopis,
−
kalkulator,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
57
Ćwiczenie 2
Zbadaj jak zmieni się szybkość reakcji: v = k [A] [B]
2
, jeżeli zmniejszy się dwukrotnie
objętość przestrzeni reakcyjnej?
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapisać w zeszycie potrzebne wzory obliczeniowe,
2) wykonać niezbędne obliczenia,
3) dokonać analizy ćwiczenia,
4) zaprezentować pracę.
Wyposażenie stanowiska pracy:
−
zeszyt lub arkusz papieru, długopis,
−
kalkulator,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
4.11.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) określić co to jest termodynamika chemiczna?
2) wyjaśnić co to jest układ i otoczenie?
3) dokonać podziału układów złożonych?
4) wyjaśnić co to jest energia wewnętrzna układu?
5) zdefiniować pierwszą i drugą zasadę termodynamiki?
6) wyjaśnić co to jest stała równowagi chemicznej?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
58
4.12. Zastosowanie elektrochemii i optyki w procesach kontroli
procesów technologicznych, zagrożenia ekologiczne
4.12.1. Materiał nauczania
Elektrochemia jest działem chemii, zajmującym się wykorzystaniem samorzutnych
reakcji do wytwarzania elektryczności i wykorzystaniem elektryczności do przeprowadzenia
reakcji, które nie zachodzą samorzutnie. Okazuje się, że tego typu reakcje mają bezpośredni
związek z reakcjami utleniania i redukcji. Ten rodzaj reakcji nosi nazwę reakcji
elektrochemicznej. Są to reakcje zachodzące na granicach faz w których elektrony przechodzą
z jednej fazy do drugiej fazy a atomy, które bezpośrednio uczestniczą w tym procesie
zmieniają stopień utleniania. Jeżeli na jednym z atomów zaobserwujemy wzrost stopnia
utleniania to na atomie znajdującym się w drugiej fazie będzie obserwowane zmniejszenie
stopnia utleniania. Fakt, że reakcje elektrochemiczne mogą przebiegać w różnych fazach
został wykorzystany do skonstruowania różnego rodzaju ogniw znajdujących powszechne
zastosowanie na przykład ogniwa suche często stosowane w małych przyrządach oraz ogniwa
wtórne, wielokrotnego ładowania, nazywane akumulatorami. Obecnie trudno sobie wyobrazić
brak tego typu źródeł zasilania. Praktycznie przy ich braku należałoby wyłączyć
z użytkowania wszelkiego rodzaju przenośne urządzenia takie jak; radio, telewizor, przyrządy
pomiarowe, komputery i wiele innych.
Elektroliza zachodzi w układach, w których już przed przyłożeniem do elektrod napięcia
występowały wolne jony, a zatem w elektrolitach. Związek chemiczny może stać się
elektrolitem na skutek dysocjacji elektrolitycznej wywołanej przez rozpuszczalnik, na skutek
domieszkowania jonami lub odpowiednio wysokiej temperatury.
Proces elektrolizy polega na wędrówce jonów do obojętnych chemicznie elektrod,
zanurzonych w elektrolicie, po przyłożeniu do nich odpowiedniego napięcia prądu
elektrycznego. W elektrolizie elektroda naładowana ujemnie jest nazywana katodą,
a elektroda naładowana dodatnio anodą. Każda z elektrod przyciąga do siebie przeciwnie
naładowane jony. Do katody dążą więc dodatnio naładowane kationy a do anody ujemnie
naładowane aniony. Po dotarciu do elektrod jony przekazują im swój ładunek na skutek czego
zamieniają się w obojętne elektrycznie związki chemiczne lub pierwiastki. Powstające w ten
sposób substancje zwykle albo osadzają się na elektrodach lub wydzielają się z układu
w postaci gazu. Proces elektrolizy wymaga stałego dostarczania energii elektrycznej.
Zjawisko elektrolizy zostało opisane ilościowo w dwóch prawach elektrolizy Faradaya.
Procesy elektrochemiczne znajdują szerokie zastosowanie w przemyśle,
między innymi w:
−
hydrometalurgii – otrzymywanie metali w wyniku elektrolizy wodnych roztworów ich
soli. Proces ten składa się z następujących etapów: ługowania rudy poddanej ewentualnie
wstępnemu prażeniu w atmosferze powietrza, w celu przeprowadzenia trudno
rozpuszczalnych siarczków metali w tlenki; oczyszczania otrzymanego roztworu w celu
zapewnienia wydajnej elektrolizy; katodowego wydzielania metalu w elektrolizerach;
wykorzystania elektrolitu pozostałego po elektrolizie do ługowania następnej porcji rudy,
co umożliwia cykliczne prowadzenie procesu z uzupełnianiem jedynie strat roztworu
ługującego. Przykładem jest otrzymywanie miedzi z rudy miedzi.
−
podczas elektrolizy soli i tlenków stopionych. Na skalę przemysłową metodą tą
otrzymuje się glin, sód, lit i magnez, na które istnieje ogromne zapotrzebowanie (lekkie
stopy, chemiczne źródła prądu). Pozostałe litewce i berylowce są produkowane na
mniejszą skalę. Ponieważ z powodu bardzo ujemnych wartości potencjałów
standardowych litowców i berylowców nie można katodowo wydzielić w postaci czystej
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
59
z roztworów wodnych tych metali, ma tutaj zastosowanie elektroliza stopionych soli
i tlenków. Przykładem jest produkcja glinu.
−
podczas rafinacji metali Metale otrzymane w procesie hutniczym zawierają liczne
domieszki metali bardziej „szlachetnych”. Oczyszcza się je z domieszek (rafinuje)
w elektrolizerach w których anodę stanowi blok surowego metalu, katodę – cienka
podkładka z czystego metalu rafinowanego, a elektrolitem jest sól (siarczan, azotan) tego
metalu. Na bardzo dużą skalę prowadzi się rafinację miedzi.
−
przy otrzymywaniu powłok ochronnych i ozdobnych. Pokrywanie metali cienkimi
powłokami innych metali ma na celu podniesienie ich odporności na korozje. Powłoki
muszą spełniać wiele wymogów, m. in. powinny być drobnokrystaliczne, równomiernie
pokrywać metal oraz dobrze przylegać do jego powierzchni. Przy odpowiednim doborze
składu elektrolitu, gęstości prądu i temperatury można wykonywać pokrycia
o odpowiedniej jakości niemal wszystkimi (z wyjątkiem litowców i berylowców)
metalami. metodami elektrochemicznymi można też osadzać powłoki ze stopów metali,
co stanowi dogodny sposób otrzymywania stopów „na zimno”.
−
w produkcji chloru, wodoru i ługu sodowego. Elektroliza chlorków metali alkalicznych.
Elektroliza wodnych roztworów chlorków litowców i berylowców jest podstawą
technologii chloru, ługu sosowego, chloranów(I), (V) i (VII) i jest prowadzona na dużą
skalę w związku z zapotrzebowaniem na te produkty.
Nowoczesne czujniki optyczne znajdują szerokie zastosowanie w niemal każdej
dziedzinie współczesnej analizy i diagnostyki. Do najważniejszych obszarów można tu
zaliczyć analizę kliniczną i biomedyczną, analitykę żywności, przemysłową (szczególnie
biotechnologiczną) i związaną z monitorowaniem stanu środowiska, oraz z potrzebami
obronnymi. Najważniejsze zalety optycznych sensorów to możliwość oznaczania praktycznie
każdego rodzaju substancji, wysoka czułość i selektywność, znikoma podatność na
zakłócenia, miniaturowe rozmiary, możliwość pomiarów zdalnych i wreszcie relatywnie
niskie koszty aparaturowe i eksploatacyjne. Szerokie możliwości zastosowań czujników
optycznych wynikają z faktu praktycznie nieograniczonego spektrum substancji, które można
diagnozować. Różnorodne czujniki optyczne umożliwiają specyficzne oznaczanie gazów,
prostych i złożonych substancji nieorganicznych i organicznych, a także biomolekuł
(hormony, antygeny, przeciwciała, enzymy) oraz złożonych systemów biologicznych (geny,
wirusy, makrofagi, bakterie itp.).
Zagrożenia ekologiczne
Procesy chemiczne zwykle są uważane za szczególnie szkodliwe dla środowiska i dlatego
podlegają obowiązkowi wykonania oceny ich oddziaływania na środowisko.
Fizycznym efektem zagrożeń są pożary, wybuchy, emisje substancji toksycznych,
promieniowanie radioaktywne. Warunki powstawania zagrożeń są zwykle złożone
i wymagają indywidualnej oceny, można jednak zaproponować ogólny mechanizm
powstawania zagrożeń znajdujący się na rysunek 10.
Rys. 10. Mechanizm powstawania zagrożeń w czasie eksploatacji maszyn, aparatów i urządzeń przemysłu
chemicznego [źródło własne]
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
60
Największe zagrożenia dla środowiska naturalnego występujące w procesach
chemicznych przemysłu chemicznego wiążą się z charakterystyką materiałów i substancji
niebezpiecznych, które występują w procesach technologicznych. W zależności od substancji
są to właściwości palne, utleniające lub redukujące i toksyczne. Składają się na nie:
−
zagrożenie pożarowe (związane z promieniowaniem cieplnym),
−
zagrożenie skażeniem powietrza produktami spalania związków chemicznych,
−
zagrożenie
skażenia
wód
powierzchniowych
lub
podziemnych
w
wyniku
niekontrolowanego przedostania się do tych wód związków chemicznych,
−
zagrożenie skażeniem powietrza w wyniku awaryjnej emisji związków chemicznych,
−
zagrożenie wybuchem w pomieszczeniach produkcyjnych, w których stosowany jest gaz
ziemny (zawierający metan).
Odpady procesów chemicznych powstają w dużej masie i stanowią duże zagrożenie
ekologiczne ze względu na toksyczność, palność, wybuchowość, rakotwórczość.
Ogólne zasady gospodarki odpadami określa Ustawa o odpadach (Dz. U. 2001 nr 62
poz. 628). Zasady postępowania z odpadami:
−
należy ograniczać ilości powstających odpadów poprzez zastosowanie takich sposobów
produkcji lub form usług oraz surowców i materiałów, które zapobiegają powstawaniu
odpadów lub pozwalają utrzymać na możliwie najniższym poziomie ich ilość, a także
ograniczają negatywne oddziaływanie na środowisko lub zagrożenie życia lub zdrowia
ludzi,
−
należy poddawać odzyskowi lub unieszkodliwieniu odpadów w miejscu ich wytworzenia,
−
należy przekazywać w celu zagospodarowania do najbliższego możliwego miejsca
z uwzględnieniem najlepszej dostępnej technologii,
−
należy przekazywać do unieszkodliwienia bądź składowania (tylko odpady z których
wysegregowano partie nadające się do odzysku).
Rys. 11. Potencjalne zagrożenia ekologiczne wód powierzchniowych w procesach chemicznych
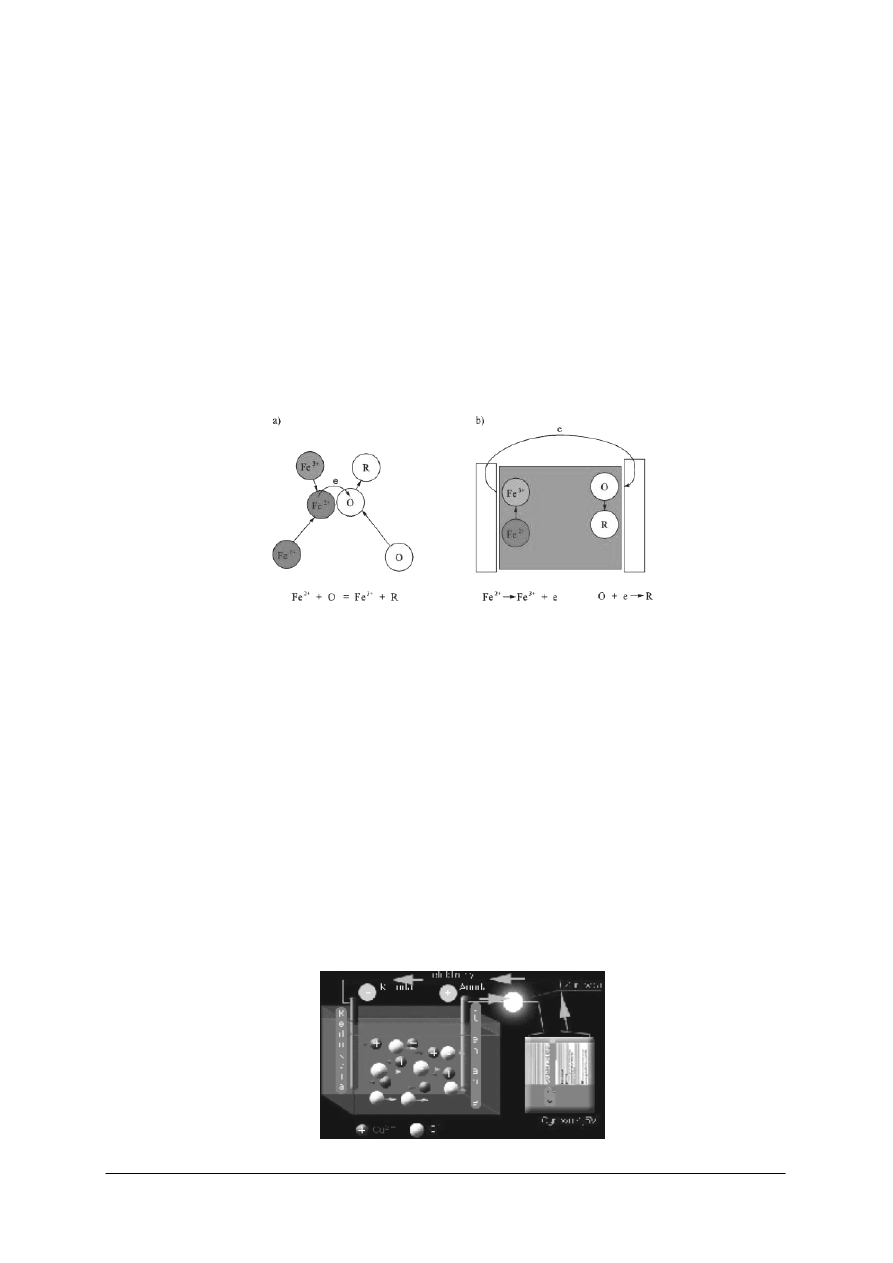
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
61
4.12.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do ćwiczeń.
1. Co to jest reakcja elektrochemiczna?
2. Gdzie wykorzystuje się reakcje elektrochemiczne?
3. Jakie znasz produkty otrzymywane metodami elektrochemicznymi?
4. Jakie znasz możliwości wykorzystania optyki chemicznej?
5. Jakie znasz zagrożenia dla środowiska naturalnego w procesach chemicznych?
6. Jakie znasz zasady postępowania z odpadami?
4.12.3. Ćwiczenia
Ćwiczenie 1
Wyjaśnij jakie procesy zachodzą na przedstawionych schematach.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się ze schematem,
2) dokonać analizy schematu,
3) sformułować wnioski z realizacji ćwiczenia i zanotować je w zeszycie,
4) zaprezentować efekty swojej pracy,
5) dokonać samooceny pracy.
Wyposażenie stanowiska pracy:
−
zeszyt lub arkusz papieru, długopis,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Wyjaśnij działanie elektrolizera na przedstawionym schemacie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
62
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się ze schematem,
2) dokonać analizy schematu,
3) sformułować wnioski z realizacji ćwiczenia i zanotować je w zeszycie,
4) zaprezentować efekty swojej pracy,
5) dokonać samooceny pracy.
Wyposażenie stanowiska pracy:
−
zeszyt lub arkusz papieru, długopis,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
4.12.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) wyjaśnić co to jest reakcja elektrochemiczna?
2) określić gdzie wykorzystuje się reakcje elektrochemiczne?
3) wymienić produkty otrzymywane metodami elektrochemicznymi?
4) określić możliwości wykorzystania optyki chemicznej?
5) określić zagrożenia dla środowiska naturalnego w procesach
chemicznych?
6) wymienić zasady postępowania z odpadami?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
63
5. SPRAWDZIAN OSIĄGNIĘĆ
INSTRUKCJA DLA UCZNIA
1. Przeczytaj uważnie instrukcję zanim rozpoczniesz rozwiązywać zadania.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem zadań testowych.
4. Odpowiedzi udzielaj tylko na załączonej karcie odpowiedzi.
5. Test składa się z 20 zadań wielokrotnego wyboru, z których tylko jedna jest poprawna.
6. Wybraną odpowiedź zaznacz na karcie odpowiedzi znakiem X.
7. Jeśli uznasz, że pomyliłeś się i wybrałeś nieprawidłową odpowiedź, to otocz wybór
kółkiem, a następnie prawidłową odpowiedź zaznacz znakiem X.
8. Pracuj samodzielnie, bo tylko wtedy będziesz mógł sprawdzić poziom swojej wiedzy
i umiejętności.
9. Jeśli jakiej zadanie sprawi Ci trudność, rozwiąż inne i ponownie spróbuj rozwiązać
poprzednie.
10. Odpowiedzi udzielaj tylko na załączonej karcie odpowiedzi.
11. Na rozwiązanie wszystkich zadań masz 45 minut.
Powodzenia!
ZESTAW ZADAŃ TESTOWYCH
1. Liczba masowa trójdodatniego jonu, którego jądro składa się z 10 neutronów i 8
protonów wynosi
a) 18.
b) 11.
c) 10.
d) 5.
2. Poprawny podział pierwiastków (Rb, Se, Ra, Po, Pb, Te) na metale i niemetale to
a) metale: Rb, Ra, Pb; niemetale: Po, Se, Te.
b) metale: Ra, Pb, Po; niemetale: Rb, Se, Te.
c) metale: Rb, Ra, Po, Pb; niemetale: Se, Te.
d) metale: Se, Te, Pb; niemetale: Rb, Ra, Po.
3. Liczba pierwiastków znajduje się w trzecim okresie układu okresowego to
a) 3.
b) 8.
c) 18.
d) 32.
4. Czwarty stan skupienia materii to
a) plazma.
b) kompozyt.
c) atom.
d) pierwiastek.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
64
5. Liczba protonów to inaczej
a) liczby masowej.
b) liczby atomowej.
c) wartościowości.
d) jądra atomu.
6. Wśród poniższych atomów wskaż grupy izotopów
a) Cl
17
35
, O
8
17
.
b) X
6
14
, X
7
14
.
c) He
2
4
, He
2
4
.
d) O
8
16
, O
8
17
.
7. Wiązaniem kowalencyjnym nazywamy
a) wspólną parę elektronową utworzoną przez elektrony niesparowane pochodzące od
dwóch rożnych atomów.
b) wspólną parę elektronową utworzoną przez elektrony niesparowane pochodzące od
dwóch takich samych atomów.
c) atomy dążące do uzyskania oktetu elektronowego.
d) wiązanie polegające na elektrostatycznym przyciąganiu się jonów.
8. Wiązanie powstające pomiędzy atomami, z których jeden ma niską energię jonizacji,
a drugi dużą elektroujemność, będzie wiązaniem
a) kowalencyjnym.
b) kowalencyjnym spolaryzowanym.
c) jonowym.
d) van der Waalsa.
9. Zjawisko fizyczne występuje wtedy
a) kiedy substancja zmienia swoje właściwości fizyczne i chemiczne.
b) kiedy substancja nie zmienia swoich właściwości fizycznych natomiast właściwości
chemiczne ulegają zmianie.
c) kiedy substancja nie zmienia swoich właściwości ale obserwujemy powstawanie
nowych substancji chemicznych.
d) kiedy substancja zmienia tylko właściwości fizyczne, natomiast właściwości
chemiczne pozostają bez zmian.
10. Roztwory nienasycone – to roztwory
a) o stężeniu większym od stężenia roztworu nasyconego przy określonej temperaturze.
b) które przy zachowaniu odpowiednich warunków termodynamicznych (temperaturze
i ciśnieniu), mogą jeszcze przyjąć pewną ilość substancji stałej.
c) które przy danych warunkach termodynamicznych osiągnęły jakby swoje
„maksimum” w możliwości rozpuszczania w sobie substancji stałej.
d) o stężeniu większym od stężenia roztworu nasyconego przy określonej temperaturze
i które przy danych warunkach termodynamicznych osiągnęły jakby swoje
„maksimum” w możliwości rozpuszczania w sobie substancji stałej.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
65
11. Dyfuzja jest procesem
a) samorzutnym, nieodwracalnym, powodującym wyrównywanie ciśnienia w całym
roztworze.
b) samorzutnym, odwracalnym, powodującym wyrównywanie stężenia w całym
roztworze.
c) samorzutnym, nieodwracalnym, powodującym wyrównywanie stężenia w całym
roztworze.
d) samorzutnym, odwracalnym, powodującym zmianę stężenia w całym roztworze.
12. Reakcje syntezy to
a) reakcja, w której z jednego związku chemicznego i jednego pierwiastka powstaje
inny związek chemiczny i inny, mniej aktywny
b) reakcja, w której z jednej substancji złożonej powstają dwie lub kilka substancji
prostszych , różniących się od substratu właściwościami fizycznymi i chemicznymi:
c) reakcja, w której z dwu lub więcej substancji prostszych powstaje jedna substancja
złożona o odmiennych właściwościach chemicznych i fizycznych.
d) reakcją, w której biorą udział dwa związki chemiczne i jako produkty powstają nowe
dwa związki.
13. Efekty cieplne reakcji chemicznych zależą
a) tylko od temperatury.
b) tylko od zaawansowania reakcji.
c) tylko od stężeń reagentów i stanu skupienia reagentów.
d) od temperatury, zaawansowanej reakcji, stężenia reagentów i stanu skupienia
reagentów.
14. Czynnikami nie decydującymi o szybkości reakcji chemicznej są
a) stan skupienia substancji.
b) temperatura.
c) obecność katalizatorów.
d) rodzaj i stężenie reagujących substancji.
15. Jeden unit to
a) 1/12 masy atomu węgla.
b) 1/24 masy atomu magnezu.
c) 1/14 masy atomu azotu.
d) 1/16 masy atomu tlenu.
16. Masa cząsteczkowa NaCl wynosi
a) 35,5.
b) 28.
c) 58,5.
d) 64.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
66
17. Polimeryzacja jest procesem
a) łączenia się wielu cząsteczek monomeru, któremu nie towarzyszy wydzielenie
małocząsteczkowych produktów ubocznych.
b) przebiegającym w sposób stopniowy, lecz nie jest procesem odwracalnym
c) łączenia
się
wielu
cząsteczek
substancji
wyjściowych
w
związek
wielkocząsteczkowy
z
jednoczesnym
wydzieleniem
prostego
związku
małocząsteczkowego – jako produktu ubocznego reakcji.
d) tylko
wtedy
gdy
łączeniu
się
monomeru
towarzyszy
wydzielanie
małocząsteczkowych produktów ubocznych.
18. Atom węgla połączony tylko z jednym atomem węgla określa się jako
a) węgiel drugorzędowy.
b) węgiel pierwszorzędowy.
c) węgiel trzeciorzędowy.
d) węgiel czwartorzędowy.
19. Elektroliza zachodzi w układach zwanych
a) elektrolitami
b) mieszaninami.
c) roztworami.
d) substancjami.
20. Ogólny wzór alkanów to
a) C
n
H
2n.
b) C
n
H
2n-2.
c) C
n
H
2n+2.
d) C
n
H
2n+1.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
67
KARTA ODPOWIEDZI
Imię i nazwisko ................................................................................................
Analizowanie procesów chemicznych
Zakreśl poprawną odpowiedź.
Nr
zadania
Odpowiedź
Punkty
1
a
b
c
d
2
a
b
c
d
3
a
b
c
d
4
a
b
c
d
5
a
b
c
d
6
a
b
c
d
7
a
b
c
d
8
a
b
c
d
9
a
b
c
d
10
a
b
c
d
11
a
b
c
d
12
a
b
c
d
13
a
b
c
d
14
a
b
c
d
15
a
b
c
d
16
a
b
c
d
17
a
b
c
d
18
a
b
c
d
19
a
b
c
d
20
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
68
6. LITERATURA
1. Dobkowska Z., Pazdro K.M.: Szkolny poradnik chemiczny. WSiP, Warszawa 1986
2. Dojlido J., Zerze J.: Instrumentalne metody badania wody i ścieków. Arkady 1999
3. Górecki A.: Technologia ogólna – Podstawy technologii mechanicznych. WSiP,
Warszawa 2005
4. Hermanowicz W. (red.): Fizyczno-chemiczne badanie wody i ścieków. Arkady 1999
5. Klepaczko – Filipiak B., Łoin J.: Pracownia chemiczna. Analiza techniczna. WSiP,
Warszawa 1994
6. Kulawik J., Kulawik T., Litwin M.: Chemia dla gimnazjum, cz. 1. WNE, Warszawa 1999
7. Kwaśnik M.: Chemia przed egzaminem na akademie medyczne. WL PZWL, Warszawa
1999
8. Lee D.J.: Zwięzła chemia nieorganiczna. PWN Warszawa 1973
9. Pazdro K.M.: Chemia dla kandydatów na wyższe uczelnie. PWN, Warszawa 1982
10. Praca zbiorowa. Tablice matematyczne, fizyczne, chemiczne i astronomiczne. Wyd.
Cykada, Warszawa 2005
11. Stanisława H., Marcinkowski R., Staruszka J.: Chemia – liceum, technikum. Seria szkoła
XXI. Operon, Gdynia 2007
12. Tomassi W., Jankowska H.: Chemia fizyczna. WNT, Warszawa 1973
13. Wasilewski Z.: Rysunek zawodowy. Instalacje sanitarne, rurociągi przemysłowe. WSiP,
Warszawa
14. Weselowsky K.: 225 doświadczeń chemicznych. WNT, Warszawa 1987
15. www.pl.wikipedia.org
16. www.tribologia.org
17. www.encyklopedia.servis.pl
18. http://www.bryk.pl/
19. http://www.dami.pl/~chemia/
20. http://www.tworzywa.pwr.wroc.pl/
21. http://www.chemart.org
Wyszukiwarka
Podobne podstrony:
07 Analizowanie procesów technologicznych produkcji leków
07 Analizowanie procesów technologicznych produkcji leków
ANALIZA PROCESU MIESZANIA CIECZY JEDNORODNYCH, Uczelnia, Semestr 6, Inżynieria Chemiczna, ANALIZA PR
Analizowanie procesow technolog Nieznany (2)
jednostkowe procesy chemiczne (2)
07 PAME W procesie przekraczania progu kwantowego
Analiza procesu produkcyjnego wnioski
07 Analiza danych
Analiza substancji chemicznej atmosferycznych aerozoli, Analiza substancji chemicznej atmosferycznyc
23[1][1][1].11, Teoria informacji - zajmuje się analizą procesów wytwarzania , przenoszenia , odbior
07 Organizowanie procesu gospod Nieznany
Lekcja 2 Analiza Procesu pracy etap pozyskiwania informacji i podejmowania decyzji
07 Analiza kofilogenetyczna
II Rok Przedsiębiorczość Analiza procesu przedsiebiorczosci na przykladzie przedsiebiorstwa
2006-07 Czarna procesja, materiały, Z PRASY
07 PAME-W procesie przekraczania progu kwantowego, ezoteryka
TPL WYK 13 01 07 Jednostkowe procesy technologiczne
PROCESY CHEMICZNE ZACHODZĄCE W ŻYWYCH UKŁADACH
więcej podobnych podstron