1.
Spośród podanych reakcji wybierz reakcję egzoenergetyczną:
a) Redukcja tlenku miedzi (II) wodorem
b)
Otrzymywanie tlenu przez rozkład chloranu (V) potasu
c)
Otrzymywanie wapna palonego w procesie prażenia wapieni
d) Spalanie fosforu w tlenie
2.
Spośród podanych reakcji wybierz reakcję endoenergetyczną:
a) Spalanie fosforu w tlenie
b) Spalanie wodoru
c)
Otrzymywanie tlenu przez rozkład tlenku rtęci (II)
d) Reakcja magnezu z kwasem solnym
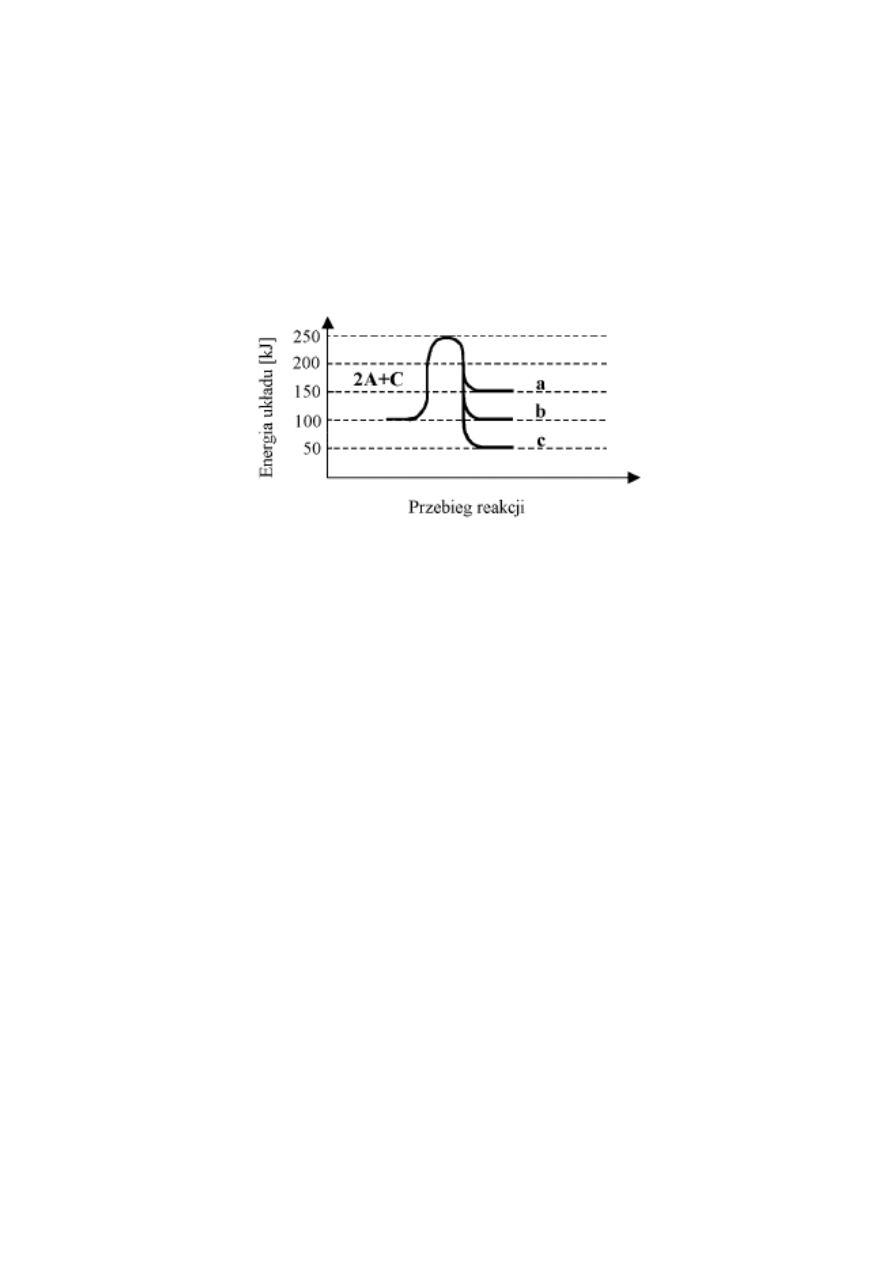
3. Przebieg reakcji: 2A + C
A
2
C
przedstawiono na wykresie:
a) jeżeli przedstawiona reakcja jest reakcją egzotermiczną, to jej prawidłowy przebieg jest
przedstawiony na wykresie za pomocą linii .......
b) energia aktywacji wynosi .......
4.
Efekt energetyczny pewnej reakcji scharakteryzowano następująco: nastąpiło przekazanie energii z
otoczenia
do układu; energia wewnętrzna układu wzrosła.
Analizując tekst określ, czy reakcja jest egzoenergetyczna czy endoenergetyczna.
Reakcja jest: ...................................................................................................................
5.
Podczas ogrzewania węglanu wapnia w probówce przebiegała reakcja chemiczna według równania:
CaCO
3
CaO + CO
2
Po pewnym czasie ogrzewanie przerwano i ochłodzono probówkę do temperatury pokojowej.
Wskaż zdanie prawdziwe korzystając z powyższej informacji.
A.
Reakcja przestała przebiegać, ponieważ jest to proces egzoenergetyczny.
B.
Reakcja przestała przebiegać, ponieważ jest to proces endoenergetyczny.
C.
Reakcja nadal przebiega, ponieważ jest to proces egzoenergetyczny.
D.
Reakcja nadal przebiega, ponieważ jest to proces endoenergetyczny.
6.
Wskaż prawidłowy zapis:
a) S + Q
P
ΔH =
Q [kJ]
b) S
P + Q
ΔH =
Q [kJ]
c) S
Q
P
ΔH = +Q [kJ]
d) S
P + Q
ΔH = +Q [kJ]
* S - substraty, P - produkty reakcji
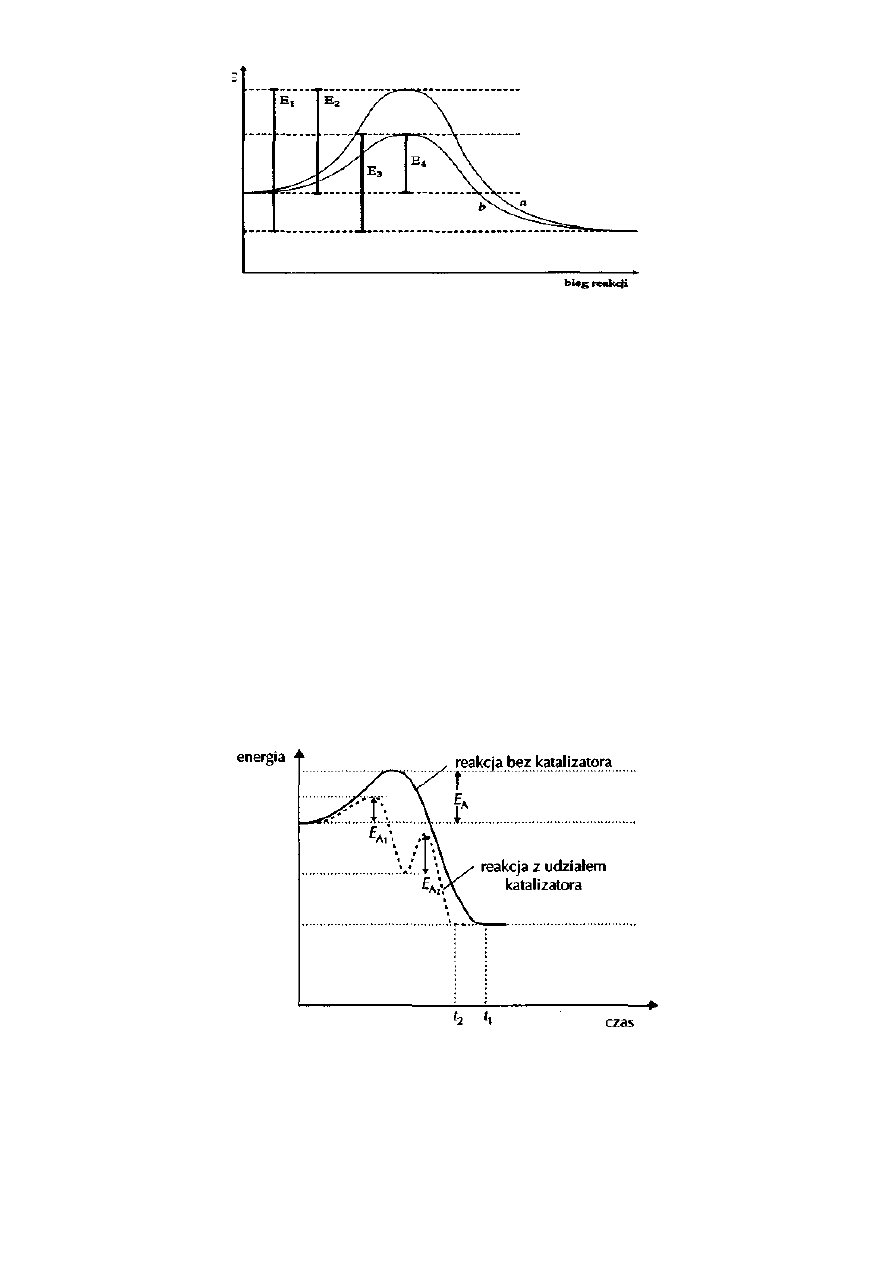
7. Wykres obrazuje przebieg reakcji: Substraty
Produkty. W
skaż symbol, określający energię aktywacji
reakcji:
a) biegnącej bez katalizatora - .................... b) biegnącej w obecności katalizatora .....................
8.
Podaj postać działania matematycznego, umożliwiającego obliczenie efektu energetycznego towa-
rzyszącego reakcji:
a) biegnącej bez katalizatora - .................... b) biegnącej w obecności katalizatora .....................
9.
Wyjaśnij dlaczego, pozornie wbrew regule Le Chateliera-Brauna, egzotermiczną reakcję spalania
węgla rozpoczynamy od lokalnego podgrzania substratów (tzw. Podpałka). Określ efekt
energetyczny reakcji spalania węgla stosując zapis ΔH<0 lub ΔH >0.
Równanie reakcji spalania węgla z uwzględnieniem ciepła „Q” powstającego w tym procesie:
Określenie efektu energetycznego reakcji:
Wyjaśnienie konieczności stosowania tzw. podpałki:
10.
Reakcję A + B
C zilustrowano za pomocą wykresu przedstawiając zmiany energii w czasie reakcji
z katalizatorem i bez katalizatora.
Napisz, jaki typ reakcji ilustruje ten wykres.
Co można powiedzieć o szybkości reakcji bez katalizatora i po jego dodaniu?
11.
W układzie zamkniętym prowadzono reakcję
2H
2
O
2(c)
2H
2
O
(c)
+ O
2(g)
Dlaczego zastosowanie katalizatora lub podwyższenie temperatury zwiększa szybkość tej
reakcji.
12.
Wykorzystując wielkość ΔH, określ, kiedy reakcja jest:
a) endoenergetyczna ............
b) egzoenergetyczna ..........
13.
Reakcja całkowitego spalania etanu przebiega według równania: 2C
2
H
6
+ 7O
2
4CO
2
+ 6H
2
O
Podczas przemiany wydziela się duża ilość energii.
Zakwalifikuj powyższą reakcję do przemian egzo- lub endotermicznych.
14.
Tlenek rtęci(II) poddano ogrzewaniu. Ogrzewany tlenek rozkłada się na rtęć i tlen. Po przerwaniu
ogrzewania nie obserwujemy jed
nak wydzielania się tlenu. Oceń na podstawie powyższego opisu, czy
reakcja rozkładu tlenku rtęci(II) jest procesem egzo- czy endoenergetycznym.
15.
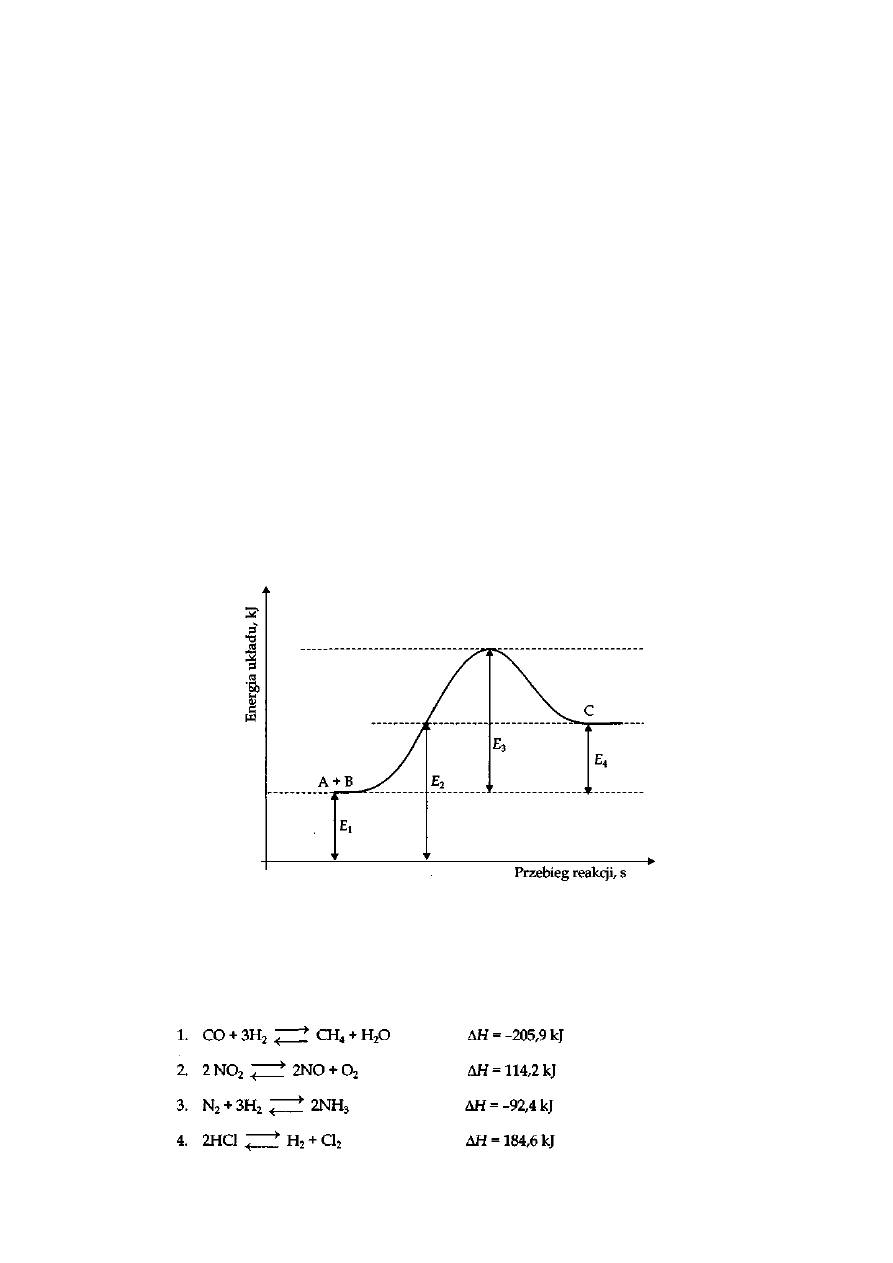
Poniżej przedstawiony jest wykres zmiany energii reagentów w reakcji A + B
C
Określ, czy powyższy wykres obrazuje zmianę energii układu w reakcji egzoenergetycznej czy
endoenergetycznej.
Napisz, który z zaznaczonych na wykresie odcinków (E
1
, E
2
, E
3
, E
4
) dotyczy energii aktywacji.
16.
Podaj numery tych równań reakcji, które możesz zaliczyć do procesów egzotermicznych.
17. Do roztworu kwasu solnego dodano magnez. W obserwacjach z przeprowadzonego
doświadczenia
zapisano:
„Po dodaniu magnezu do roztworu kwasu solnego probówka silnie się nagrzewa i wydziela
się gaz". Na podstawie powyższych informacji oceń, czy reakcja magnezu z kwasem solnym jest
procesem egzo-, czy endoenergetycznym.
18.
Poniższe wykresy ilustrują zmiany energii reagentów A + B ——> C.
Reakcja egzoenergetyczna
Reakcja endoenergetyczna
Napisz, która z dwóch grup reagentów - substraty czy produkty - mają wyższy zasób energii,
jeżeli:
a) reakcja jest egzoenergetyczna,
b) reakcja jest endoenergetyczna.
19.
Reakcję 2SO
2
+ O
2
2SO
3
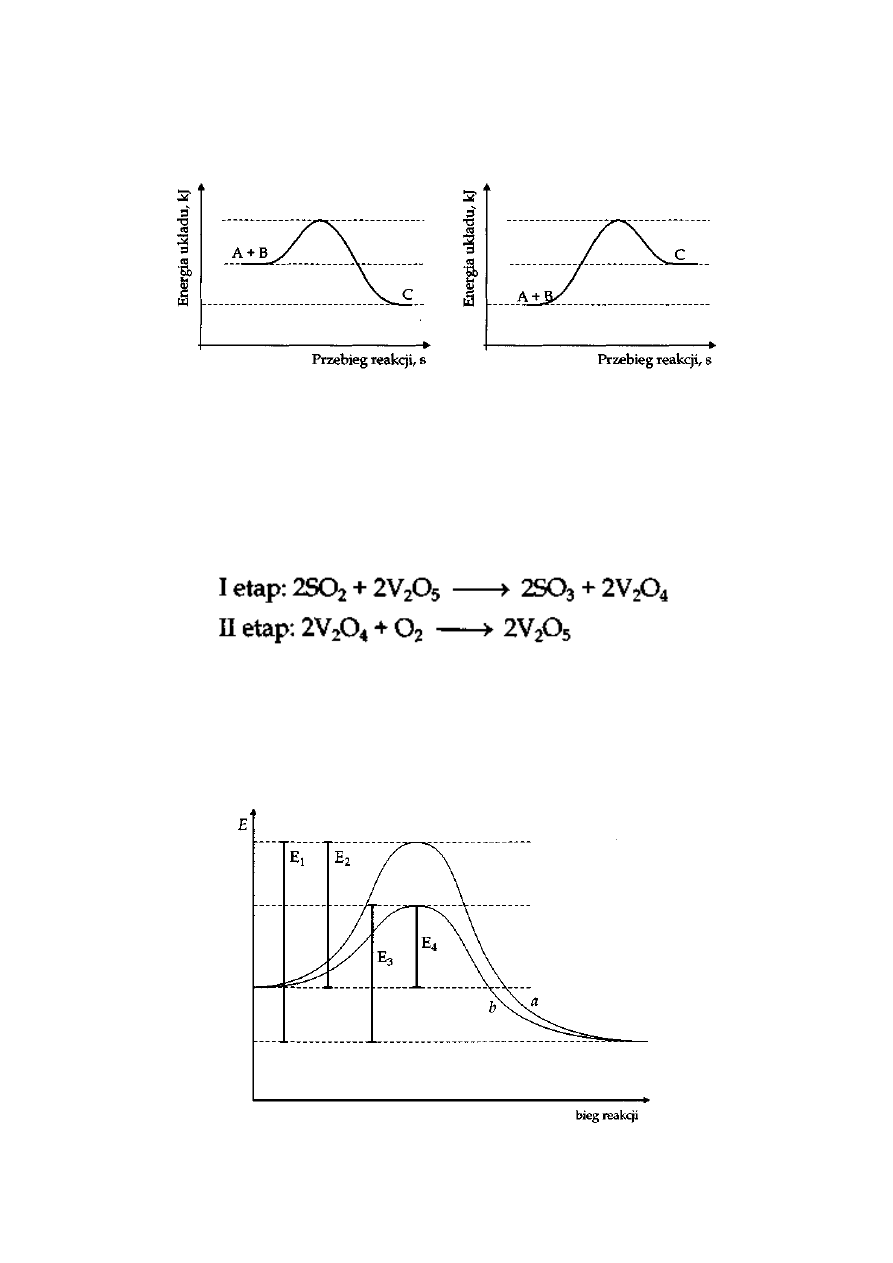
prowadzi się w obecności katalizatora.
Przyjmując, że reakcja przebiega w dwóch etapach:
Podaj wzór chemiczny związku, który pełni funkcję katalizatora tej reakcji.
20.
Wskaż, która krzywa ilustruje zmiany energii dla reakcji przebiegającej z udziałem katalizatora.
Analizując wartości energii wskaż, która wartość ilustruje wartość energii aktywacji dla reakcji
przebiegaj
ącej z katalizatorem, a która dla reakcji bez udziału katalizatora. Określ, co to jest energia
aktywacji.

21.
Dane jest równanie reakcji: A + B
C + D + Q
O tej reakcji możemy powiedzieć, że:
A. reakcja biegnąca w prawo (1) jest egzoenergetyczna, a reakcja biegnąca w lewo (2)
jest endoenergetyczna
B. dla reakcji (1) ΔH° < O, dla reakcji (2) ΔH° > O
C. odpowiedzi A i B są poprawne
D. żadna odpowiedź nie jest prawidłowa
22.
Nadtlenek wodoru wykazuje właściwości utleniające. 3% roztwór tego związku to tzw. woda
utleniona.
Napisz równanie reakcji rozkładu nadtlenku wodoru.
Określ stopień utlenienia atomu tlenu w substracie oraz produktach tej reakcji oraz określ typ
tej reakcji.
Nadtlenek wodoru szczególnie łatwo ulega rozkładowi w obecności różnych katalizatorów.
Popularnymi katalizatorami stosowanymi w reakcji rozkładu nadtlenku wodoru są MnO
2
i
FeCl
3
. Określ rodzaj katalizy, gdy jako katalizatora użyjesz:
a) stałego MnO
2
b) wodnego roztworu FeCl
3
Wyszukiwarka
Podobne podstrony:
04 4 Reakcje utleniania i redukcji zadania do lekcji nr 1
04 4 Reakcje utleniania i redukcji zadania do lekcji nr 2
05 3 Efekty energetyczne reakcji zadania do lekcji nr 1
02 3 Szybkość reakcji chemicznych zadania do lekcji nr 2
02 3 FOLIA Szybkość reakcji chemicznych zadania do lekcji nr 1
01 3 Stopień i stała dysocjacji prawo rozcieńczeń Ostwalda zadania do lekcji nr 2
01 3 Zachowanie metali w roztworach elektrolitów zadania do lekcji nr 2
01 3 FOLIA Zachowanie metali w roztworach wodnych elektrolitów zadania do lekcji nr 1
01 3 Stopnie utlenienia zadania do lekcji nr 1
06 4 Mangan i jego związki zadania do lekcji nr 2
7Izotopy i ich zastosowanie zadania do lekcji nr 1
03 4 Ogniwa galwaniczne zadania do lekcji nr 2
05 6 Stężenie procentowe roztworów zadania do lekcji nr 2
02 5 Odczyn roztworów wodnych pH zadania do lekcji nr 2
04 4 Folia Hydroliza soli zadania do lekcji nr 1
03 4 Folia Teorie kwasowo zasadowe zadania do lekcji nr 1
07 4 Chrom i jego związki zadania do lekcji nr 2
10Promieniotwórczość zadania do lekcji nr 2
9Promieniotwórczość zadania do lekcji nr 1
więcej podobnych podstron