
Zastosowanie kultur roślinnych in vitro
• Regeneracja roślin
• Klonalne namnażanie określonego genotypu
(mikropropagacja)
• Genetyczna modyfikacja roślin (GMO)
• Produkcja roślin wolnych od wirusów
• Hodowla (produkcja) haploidów
• Produkcja syntetycznych nasion
• Konserwacja zasobów genowych
• Produkcja wtórnych metabolitów
• Badania podstawowe (genetyka roślin, transformacja)

Historia kultur roślinnych
•
1902 r Haberlandt
– pierwsze próby hodowli komórek roślinnych
(nieudane).
•
1904 r
Hanning z powodzeniem prowadzi hodowlę zarodków
(zrodziny Brassicaceae
) na pożywkach sztucznych
•
W1939 r
White utrzymał przy życiu i uzyskał wzrost tkanki roślinnej
w warunkach in vitro.
•
Odkrycie wpływu
auksyn
na wzrost i podziały komórek
przyspieszyło postęp w hodowli kultur tkankowych (hormony
roślinne wytwarzane w stożkach wzrostu pędów, korzeni, w
młodych liściach)
•
W 1946 roku Ball doprowadził do odtworzenia całej rośliny tytoniu z
wierzchołka wzrostu.
•
Równocześnie prowadzono badania nad organogenezą kalusa.
•
W początkowym okresie prac badawczych do pożywek dodawano
wyciągi roślinne z bielma niedojrzałych nasion Ginko biloba
(miłorząb) lub mleczka kokosowego (wspomagało wzrost).
Histologia
roślin
Wyróżnia co najmniej kilkadziesiąt różnych typów tkanek roślinnych:
Merystemy (tkanki twórcze):
Pierwotne:
merystem wierzchołkowy (stożek wzrostu pędu i korzenia)
merystem interkalarny
– wstawowy (w węzłach)
Wtórne: merystem boczny – prokambialny
miazga
(międzywiązkowa i śródwiązkowa)
fellogen
– tkanka korkotwórcza (miazga korkorodna)
kalus
– tkanka twórcza regeneracyjna
merystem archesporialny (archespor)
Tkanki stałe
Tkanki miękiszowe:
miękisz zasadniczy
miękisz powietrzny (aerenchyma)
miękisz wodny
miękisz asymilacyjny (palisadowy, gąbczasty i
wieloramienny) - mezofil
miękisz rdzeniowy (drzewny i łykowy)
miękisz spichrzowy
Tkanki przewodzące:
drewno (ksylem)
łyko (floem)

Tkanki okrywające:
Pierwotne:
ryzoderma (epiblema)
– skórka korzenia
epiderma
– skórka pędu
endoderma
(śródskórnia)
egzoderma
(skórnia)
Wtórne: korek
Tkanki wzmacniające:
kolenchyma (zwarcica)
sklerenchyma (twardzica):
stereidy
– włókna sklerenchymatyczne
sklereidy
– twardziczki

Tkanki wydzielnicze:
włoski gruczołowe
miodniki
komórki gruczołowe
rurki mleczne (latycyfery)
Materiał roślinny
do hodowli in vitro
może być bardzo
zróżnicowany:
• Tkanki somatyczne
• Merystem (tkanka twórcza)
• Fragmenty korzeni
• Fragmenty pędów (liści, łodygi)
• Tkanki generatywne (źródło komórek haploidalnych)
• Kwiatostany i ich części
• Pylniki
• Zalążnie
• Fragment tkanki roślinnej
, który jest poddawany regeneracji
nosi nazwę
eksplantatu lub eksplantu

• Kultury pylników i mikrospor
służą do indukowania procesu
androgenezy i uzyskania roślin haploidalnych.
Kultury zarodków
- wykorzystywane do przerywania
spoczynku nasion i uzyskiwania roślin z nasion niezdolnych
w zwykłych warunkach do kiełkowania.
Mogą zapewnić rozwój zarodków mieszańcowych.
Służą również do oceny żywotności nasion głównie
gatunków drzew iglastych, liściastych i owocowych.
Stosuje się je także do badań nad przebiegiem procesów
wzrostu i rozwoju oraz wpływu różnych czynników: światła,
temperatury, substancji mutagennych i regulatorów wzrostu
na zarodki.

Komórki roślinne są totipotencjalne
Nie wszystkie komórki roślinne są jednakowo zdolne do podziałów
(totipotencja
odwrotnie proporcjonalna do stopnia zróżnicowania i
specjalizacji);
żywotne jądro,
nieuszkodzone organella,
niezbyt grube ściany
Jeżeli komórka w czasie różnicowania utraci część/całość informacji
genetycznej (utrata jądra) lub ekspresja informacji zostanie trwale
zablokowana, to taka komórka przestaje być totipotencjalna, utraci
zdolność do wytworzenia kultury i regeneracji rośliny (n.p. ksylem -
wiązki przewodzące/drewno, trichomy-włoski).

Niektóre komórki merystematyczne mogą wtórnie tracić
zdolność podziałów i przyjmować postać typową dla tkanek
stałych. Zjawisko to nazywamy
różnicowaniem.
Różnicowanie komórek zapoczątkowuje proces powstawania
tkanek stałych, zwany
histogenezą.

Warunki powodzenia hodowli komórek roślinnych
• Odróżnicowanie komórek
/ przeprogramowanie już
zróżnicowanych komórek (w normalnych warunkach
niezdolnych do podziałów; przywrócenie totipotencji komórek)
• Odróżnicowanie przywraca zdolność do podziałów; w hodowli
tworzą się kolonie (najczęściej komórek parenchymatycznych,
tzw. kalus)
• Regulatory wzrostu o silnej aktywności auksynowej
; np. kwas
2,4;dichlorofenoksyoctowy, 2,4-D (herbicyd)
– powoduje
odróżnicowanie niektórych typów komórek
(parenchymatycznych ksylemu, ziaren pyłku, komórek
jajowych, niekiedy mezofilu)

• Rozwój in vitro
struktur pre-
istniejących nie jest
przejawem totipotencji (kiełkowanie nasion, rozwój
zalążni, boczne pąki -
nie
)
• Rozwój de novo
w oparciu o totipotencję:
-
pąki przybyszowe
- ryzogeneza
- kwitnienie in vitro
- somatyczna embriogeneza

Morfogeneza
– wykształcenie się formy (organu lub komórki)
także zmiany towarzyszące powstawaniu specyficznych form
(kształtu, struktury, organizacji) w czasie rozwoju organizmu:
-
organogeneza
(wszystkie morfologiczne procesy prowadzące
do powstania nieautonomicznych organów w kulturze);
-
embriogeneza
(proces powstawania i rozwoju zarodków);
jednoczesny i synchroniczny rozwój bieguna pędowego i
korzeniowego; zarodek jest autonomiczną jednostką i nie jest
połączony z eksplantatem naczyniami
Organogeneza:
Bezpośrednia (w kulturze z eksplantatu tworzą się korzenie,
pędy liście i zarodki)
Pośrednia (poprzedzona powstaniem kalusa)
Kalus
jest tkanką twórczą/przyranną (może powstać w
dowolnym organie, komórki heterogenne morfologicznie
o nieuporządkowanej strukturze, niestabilne genetycznie)
-
tworzy tkankę luźną, rozpadającą się
-
może różnicować się we wszystkie typy komórek.
W warunkach in vivo
narośl podobna do kalusa może
tworzyć się spontanicznie w pobliżu miejsc skaleczenia
rośliny, stanowiąc tzw. tkankę przyranną, zabliźniającą
ubytek tkanki rośliny.

Organogeneza pośrednia (poprzez kalus)
W celu inicjacji kalusa
na
eksplantacie
pierwotnym
do
pożywki dodaje się
regulatory wzrostu
(auksyny, cytokininy)
Kalus jest odcinany i
przenoszony na
świeżą pożywkę i
pasażowany w
stałych odstępach
czasu (
eksplantat
wtórny
)
Po kilku pasażach z centrów
merystematycznych tworzą się
organy (pędy, korzenie, zarodki)

W hodowli in vitro
można zainicjować wytwarzanie kalusa
wykorzystując dowolny organ i tkankę.
Do kultury kalusa nadają się komórki posiadające żywotne jądro
komórkowe, nieuszkodzone błony plazmatyczne i niezbyt grubą
ścianę komórkową.
W celu inicjacji kalusa na eksplantacie do pożywki dodaje się
regulatory wzrostu.
U roślin jednoliściennych potrzebny jest zwykle
tylko dodatek auksyny, w innych przypadkach tylko cytokininy lub
równocześnie cytokininy i auksyny.
Dzięki zdolnościom totipotencjalnym komórek roślinnych możliwe
jest powstanie kalusa a następnie redyferencja czyli ponowne
różnicowanie organów roślinnych.

Zarodki somatyczne
– zarodko-podobne struktury
rozwijające się z komórek somatycznych bez udziału zygoty
(somatyczna embriogeneza, SE)
• Powstają z kalusa i w kulturach protoplastów, z komórek
i organów (w określonych warunkach
*
)
• Służą do:
-
mikropropagacji/mikrorozmnażania roślin
- produkcji sztucznych nasion
-
badań podstawowych
*
stymulacja odróżnicowania w eksplantatcie pierwotnym
(hormony)
wyzwolenie potencjału do tworzenia embrionów
(w ciemności)
namnażanie zarodków (światło czerwone)

Zarodki somatyczne
– struktury o wyraźnej biegunowości
Polaryzacja odpowiada za tworzenie pędu i korzenia
W określonych warunkach embriogenna może się stać każda
komórka uzyskana z żywego eksplantatu.
Zastosowanie; nasiennictwo, szkółkarstwo (szczególnie drzew
leśnych)

Protoplasty
Protoplast obejmuje wszystkie składniki komórki roślinnej
lub drobnoustroju oprócz ściany komórkowej.
Otoczony jest więc tylko białkowo-lipidową błoną
cytoplazmatyczną:
protoplast = komórka - ściana komórkowa
Dzięki odsłonięciu błony cytoplazmatycznej izolowane
protoplasty świetnie nadają się do:
badania struktury błony cytoplazmatycznej
Do izolowania składników komórek, np. DNA
Wprowadzanie do komórki obcych elementów, na przykład
cząsteczek DNA, białek, albo całych organelli.

Najbardziej przydane do hodowli in vitro:
-
Komórki merystemów wierzchołkowych i bocznych
(wierzchołki korzeni i pędów, zawiązki pąków bocznych)
-
Komórki kambium (miazgi) zdolne do odróżnicowania: bulwy,
kora łodygowa i korzeniowa, niektóre komórki skórki).
Ponowne zróżnicowanie się daje możliwość regeneracji
organów w hodowli
-
Komórki korzeni
-
Komórki protoplastów
-
Komórki zalążków, zalążni i zarodków

Zakładanie hodowli prowadzi się z zachowaniem zasad
aseptyki:
Wysterylizowany materiał umieszcza się na sterylnej szalce
w celu izolacji eksplantatu.
Eksplantaty pobiera się z takiego materiału w sterylnych
komorach laminarnych.
Hodowle zakłada się w sterylnych naczyniach.
Etapy zakładania hodowli
Sterylizacja eksplantu
Płukanie w jałowej wodzie destylowanej
Preparowanie
Umieszczenie w odpowiedniej pożywce

Sterylizacja roślin wyjściowych (matecznych)
• Zanurzenie eksplantantu w alkoholu 70%
• Wyjaławianie w roztworach podchlorynu sodu lub wapnia
(rozcieńczone ACE lub Domestos, 1:5, 1:10); chloramina 0,5-1%
przez 2-10 min)
• Płukanie w wodzie destylowanej wyjałowionej
Taka sterylizacja jest powierzchowna a żródłem zakażenia
mogą być mikroorganizmy znajdujące się wewnątrz
eksplantantów

Preparowanie fragmentów rośliny
Najmniej zainfekowany
przez wirusy

Zakładanie hodowli i regeneracja roślin
Wypreparowany eksplantat
przenosimy na pożywkę
(zagęszczoną agarem) w
próbówkach lub kolbach
i zamykamy folią Al lub
parafilmem i inkubujemy.
Hodowle roślin można
wyprowadzać także z
protoplastów
.
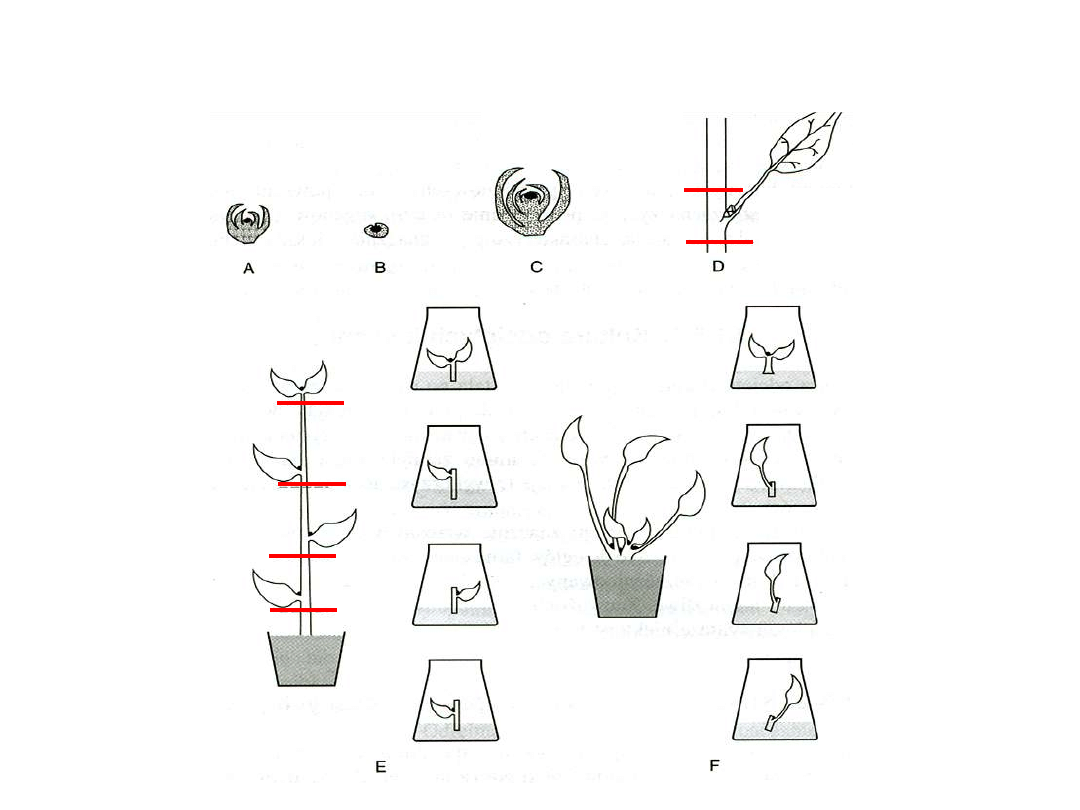
Schemat rozmnażania z wierzchołka pędu i pąka bocznego
Mikrorozmnażanie
rośliny o wzroście
wydłużonym
Mikrorozmnażanie
rośliny o wzroście
rozetowym

Kultury zawiesinowe
• Z kalusa można także inicjować kultury zawiesinowe
(pojedyncze komórki i agregaty)
• Zawiesina musi być mieszana/wytrząsana (30-180 obr/min)
• Pasażuje się co 1-3 tygodnie
• Wielkość inokulum: 10
3
-10
5
komórek/ml
• Krzywa wzrostu
wygląda podobnie jak dla komórek
zwierzęcych (kształt litery S):
-
faza opóźnionego wzrostu
-
f. wykładniczo-logarytmiczna
-
f. stacjonarna (nie ma ubytku komórek jak w hodowli
komórek zwierzęcych)
Stosowane głównie dla pozyskania biomasy

Skala kultury:
Laboratoryjna (pojemność do 10 dm
3
)
Ćwiertechniczna (wielkolaboratoryjna)
Półtechniczna (pilotażowa; do kilkudziesiąciu dm
3
)
Techniczna (przemysł biotechnologiczny; kilkadziesiąt
tysięcy dm
3
)

Badanie żywotności komórek zawiesinowych
• Barwienie
-
test TTC
, czterochlorek trifenylotetrazolowy wybarwia
żywe komórki na czerwono (przekształcenie formy
bezbarwnej do postaci barwnej), komórki martwe
bezbarwne
-
test FDA
, dioctan fluoresceiny, wchodzi do żywych
komórek

Hodowle komórek w zawiesinie
W wytrząsanych kolbach

Hodowla wielkolaboratoryjna

Kultury komórkowe w bioreaktorach
Hodowle komórek roślinnych i
organów roślinnych zakłada się w
kolbach wstrząsanych lub
w fermentorach (
bioreaktorach
);
uzyskuje się agregaty komórek, tj.
kalus lub zawiesinę komórek;
Niezbędny układ mieszania i układ
napowietrzania.
Zadaniem bioreaktora jest
zapewnienie kontaktu hodowanych
komórek z fazą abiotyczną (pożywka,
nośnik, gazy).

Warunki hodowli
• Pomieszczenia laboratoryjne:
- temperatura 17-27
o
C (optymalna 24-26
o
C)
-
światło 16 h/dobę 8-15 W/m
2
-
wilgotność powietrza 70-90% (taka jest w zamkniętych
kolbach)
-
regały z oświetleniem
• Pomieszczenia nie muszą być sterylizowane
lecz utrzymane
w idealnej czystości!

Regeneracja roślin z eksplantatów - pomieszczenia do hodowli
(oświetlenie, stała temperatura i wilgotność )

Sprzęt laboratoryjny
• Sprzęt laboratoryjny (szklany lub plastikowy):
-
kolby stożkowe
-
próbówki
-
słoiki
Zamykane oryginalnymi zakrętkami lub folią
aluminiową i parafilmem
-
skalpele, pincety, igły preparacyjne
Przed założeniem hodowli wysterylizowany
Podłoża hodowlane
• Składniki mineralne
(makroelementy: N, P, K, Na, S, Mg, Ca,
Fe; mikroelementy: Bo, Mn, Mo, Zn, Cu, ultramikroelementy:
Co, I, Al); pH 5,5-5,8
• Składniki organiczne:
- Cukry (sacharoza, fruktoza)
- Witaminy (tiamina, pirydoksyna, biotyna, kwasy:
pantotenowy, nikotynowy, askorbinowy, foliowy)
- Aminokwasy
(szczególnie ważne w produkcji zarodków
• Regulatory wzrostu i rozwoju
(tabelka)
• Substancje zagęszczające
: agar, rzadziej agaroza (0,7-1%)
• Inne substancje organiczne: mleczko kokosowe, soki
owocowe, ekstrakt ziemniaczany i drożdżowy
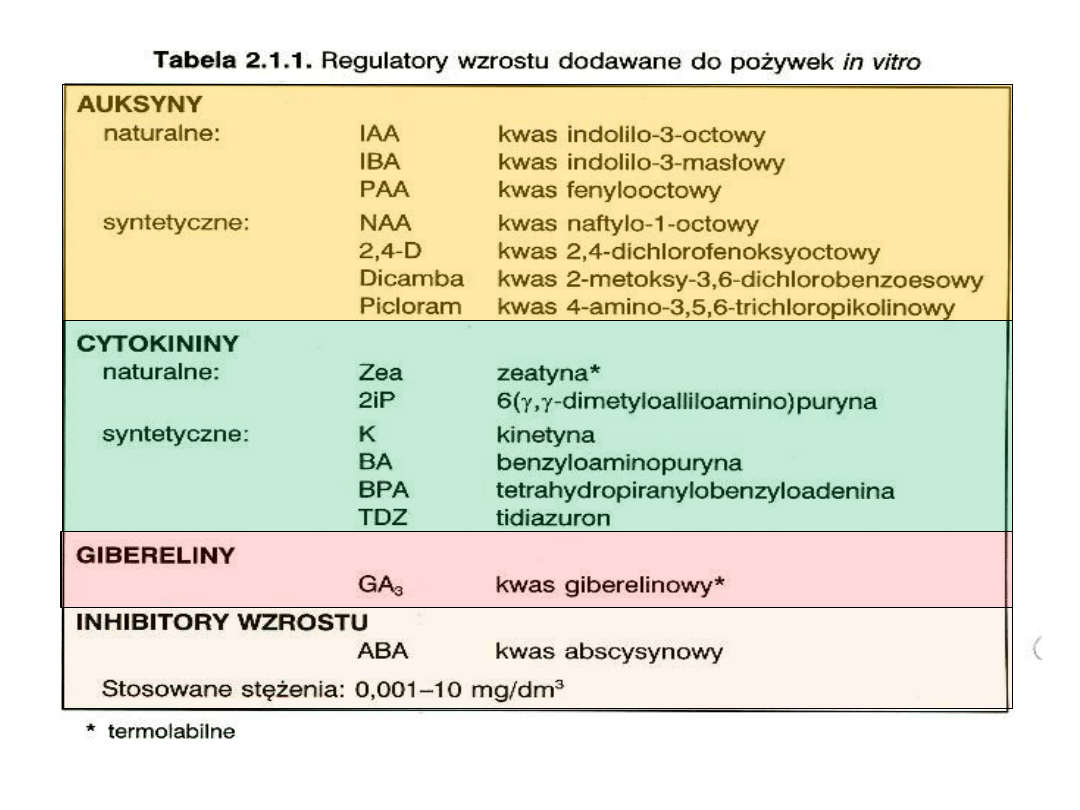
*
*
hamuje tworzenie drewna i łyka

• Cukry
mają znaczący wpływ na produkcję metabolitów
(np. paksitaksel u Taxus brevifolia
– wydajność produkcji
zależna od cukrów: fruktoza>galaktoza>sorbitol)
• Fosforany i azot
(azotany i sole amonowe) wpływają na
produkcję barwników (w obecności samych jonów NH4
nie ma produkcji antocjanów)

Hodowla protoplastów
• Komórki wyjściowe powinny być totipotencjalne
• Najczęściej izoluje się z liści, liścieni, pędów zielonych, korzeni
wcześniej wyjałowionych
• Materiał musi być całkowicie aseptyczny
• Izolowanie
: roztwór zawierający enzymy celulolityczne i
pektynolityczne trawiące ścianę komórkową, związki
zapewniające właściwe ciśnienie osmotyczne
• Dobór enzymów zależy od rodzaju ściany: celulazy,
hemicelulazy, pektynazy; np. dwuliścienne zawierają więcej
pektyn, jednoliścienne więcej celulozy, ziarna pyłków -
hemicelulozę
• Ciśnienie osmotyczne zapewnia mannitol, sorbitol, glukoza,
sacharoza (powinno wynosić 600-800 mOsm)

Izolacja protoplastów c.d.
Filtracja
przez sita (60-200
µm); oddziela się niestrawione
fragmenty.
Wirowanie w sacharozie
0,3-
0,4 M lub w mannitolu; żywe/
nieuszkodzone protoplasty flotują na powierzchni,
większe agregaty osiadają a martwe/uszkodzone są w
nadsączu).
Wydajność waha się od 10
5
-10
6
protoplastów z 1 g tkanki
roślinnej.
Zebrane protoplasty zawiesza się w pożywce ( sole
mineralne, substancje organiczne, regulatory wzrostu)
i inkubuje.

• Kulturę protoplastów
prowadzi się w pożywce płynnej lub
zestalonej (unieruchomione w całej objętości)
• Inokulum: 10
4
-5x10
5
, w mniejszym stężeniu nie dzielą się !
• Dzieląc się, tworzą kolonie (pożądane: co najmniej 20%
dzielących się, mniejszy oznacza, że warunki są nieoptymalne)
• Niekiedy wymagana jest koinkubacja z komórkami dzielącymi
się, „komórka niańka”
• Następuje regeneracja ściany komórkowej
• Kilkudziesięciokomórkowe agregaty przenosi się na nową
pożywkę w celu
regeneracji roślin

Po namnożeniu prowadzi się regenerację tkanek
z takich
komórek.
Skład pożywki do regeneracji
jest często uboższy niż do
namnażania protoplastów.
Zdolność do regeneracji silnie zależy od genotypu
(nie
wszystkie odmiany zachowują się jednakowo)
Regeneracja zależy także od intensywności i czasu oświetlenia;
standardowo -
światło białe fluorescencyjne od 1000-4000
luksów, 14-16 godz.
Regeneracja rośliny z protoplastów lub eksplantatów trwa
zwykle co najmniej 2 mies. Od izolacji do zregenerowania
rośliny (3-4 tygodnie dla rozwoju minikalusów, 4-5 tygodni do
zapoczątkowania organogenezy i rozwoju pędów)

• Protoplasty
można poddawać
fuzji
z innymi protoplastami
lub z komórkami somatycznymi. Powstają
homokariony i
heterokariony
• Fuzja chemiczna: inkubacja w 15-40% PEG
*
, odpłukanie
roztworem fizjologicznym +Ca
+2
.
• Elektrofuzja; mieszanina protoplastów pomiędzy
elektrodami, prąd zmienny 0,5-4 MHz, 40-500 V/cm.
•
*
PEG-glikol polietylenowy

Somatyczna hybrydyzacja pozwala na tworzenie roślin o
unikatowych cechach pochodzących od obu protoplastów ,
także nowych gatunków, nowych odmian.
Do protoplastów można wprowadzać same jądra, plastydy,
mitochondria (kombinacja genomów)
Raz uzyskane mieszańce somatyczne można kolejno
modyfikować, łącząc ich protoplasty z protoplastami
jednego z komponentów - hybrydyzacja somatyczna
wsteczna

Selekcja heterokarionów
Z mieszaniny hybryd należy wyselekcjonować te o pożądanych
cechach:
-
Selekcja masowa (na podstawie cech dominujących, np.
oporności na antybiotyki, herbicydy)
-
Komplementacja genetyczna (na podstawie uzupełniających
się cech), np. jeden z protoplastów był niezdolny do wzrostu na
pożywce z NO
3
-
z braku reduktazy azotanowej-
NR, drugi miał
nieaktywny koenzym NR; po fuzji heterokariony mają aktywny
enzym
-
Selekcja indywidualnych heterokarionów na podstawie
morfologii, pod mikroskopem z użyciem mikromanipulatora
-
Selekcja za pomocą cytometrii przepływowej z sorterem

Dwa kierunki działania w prowadzeniu hodowli
komórek i tkanek roślinnych znajdują
zastosowanie w praktyce
• Mikrorozmnażanie in vitro
(mikropropagacja) - powielanie
identycznych genotypów techniką klonowania
(zalety: można raz wyselekcjonowane rośliny utrzymywać przy
życiu praktycznie w nieskończoność;
z materiału roślinnego można usunąć wirusy)
• Otrzymywanie nowych genotypów metodą transferu genów
–
rośliny transgeniczne np. Digitalis lantana (naparstnica),
wytwarzająca glikozydy nasercowe
Etapy mikrorozmnażania in vitro
• Zakładanie kultur
np. z pędów (pąki pędów sterylizowane
chemicznie i pozbawione naczyń)
W pożywce: źródła węgla, azotu, sole mineralne, czynniki
wzrostowe i benzyloadenina (w małych stężeniach pobudza
rozwój pędów, zwiększone stężenie pobudza tworzenie pędów
przybyszowych)
• Rozmnażanie pędów
(merystemy boczne - benzyloadenina)
• Ukorzenianie pędów
(dodanie auksyn - kwas naftylooctowy)
• Aklimatyzacja
- adaptacja do uprawy szklarniowej i gruntowej
(do mniejszej wilgotności; trwa ~2 tygodni)
• Tworzenie kolekcji (banku) klonów
: wernalizacja (15
o
C),
głodzenie - do 2 lat)
• Zamrażanie np. wierzchołków pędów
– czas nieograniczony
(ciekły azot, -196
o
C)

Adaptacja do uprawy szklarniowej i gruntowej
• Rośliny wyhodowane in vitro mają
nieaktywne aparaty
szparkowe
(nie zamykają się przy obniżeniu turgoru i
wilgotności w szklarni)
• Adaptacja trwa 10-14 dni
• Przeżywają tylko rośliny z dobrze rozwiniętym systemem
korzeniowym

Znaczenie mikrorozmnażania in vitro
• Kwalifikowany materiał rozmnożeniowy dla ogrodnictwa,
sadownictwa i leśnictwa
• Materiał wolny od patogenów (głównie od wirusów)
• Jednorodny genotypowo (identyczne odmiany)
• Tworzenie nowych odmian
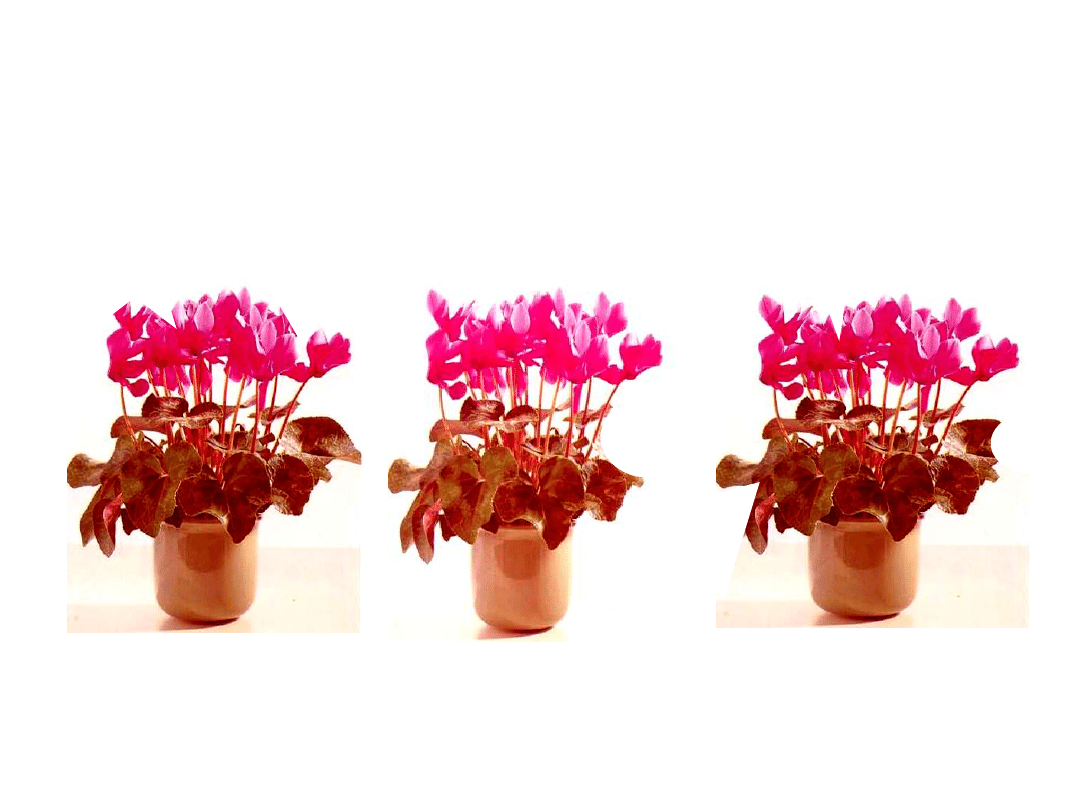
Dzięki regeneracji roślin in vitro uzyskuje się wiele prawie
identycznych roślin danej odmiany, jak na przykładzie
cyklamena

Kultury in vitro
w celu uwalniania roślin od wirusów
• Rośliny rozmnażane wegetatywnie (w naturze) są często
zainfekowane wirusami: wirus moziki tytoniowej (TMV), wirus
mozaiki czosnku (GCLV), karłowatej żółtaczki cebuli (OYDV),
karłowatości chryzantem (CSV)
• Jedynie w merystemach wierzchołkowych nie ma wirusów,
zatem
hodowla merystemów jest najpopularniejsza metodą
pozyskiwania roślin wolnych od wirusów
• Metody uzupełniające to chemo- i termoterapia in vivo przed
pobraniem merystemów lub po izolacji in vitro
• Ważne jest zwalczanie nosicieli wektorów wirusowych (owady-
mszyce, nicienie, roztocza)
• Chemoterapia:
- Antymetabolity (analogi zasad): uracyl, tiouracyl, bromouracyl, 8-
azoguanina, chloramfenikol dodawane do pożywek)
•
Termoterapia
in vivo i in vitro (26-45
o
C, noc-
dzień przez 1-3
miesięcy); w klimatyzowanych komorach szklarniowych (czy
następuje eliminacja, czy tylko supresja wirusa?)
•
Krioterapia
(np. wirus szarki śliwy);
- merystemy w medium krioprezerwacyjnym (DMSO, prolina) +4
o
C 24 h
(DMSO,glikol polietylenowy, glicerol) -40
o
C, 40 min; ciekły azot-
169
o
C
-
Niekiedy merystemy zamraża się bezpośrednio w ciekłym azocie
Do testowania obecności wirusów stosuje się metody biologii
molekularnej (elektroforezę, hybrydyzacje, PCR); metodę
immunoenzymatyczną ELISA

Produkcja sadzonek (wolnych od wirusów) z
merystemu wierzchołkowego
Roślina mateczna
Pąk liściowy
Eksplantat
na pożywce
agarowej
Zdrowe sadzonki
Merystem
wierzchołkowy
Regeneracja

Kalus poddaje się klonowaniu:
wielokrotnie powtarzane dzielenie
na mniejsze fragmenty, z których
wyprowadza się nowe kalusy,
aż
do uzyskania pojedynczej linii
komórkowej
Linie komórkowe mogą się różnić
pod względem morfologicznym i
biochemicznym (wydajnością
wytwarzania metabolitów)
Hodowlę kalusów prowadzi się na
powierzchni lub w głębi pożywek
zestalonych
Selekcja linii komórkowych z kalusa

Mikropropagacja fotoautotroficzna
- (ang. photoautotrophic
micropropagation PAM; photoautotrophic tissue culture
system PTCS)
-
jest to mikrorozmnażanie wegetatywne in vitro w warunkach
fotoautotroficznych (Teoria Toyaki Kazai).
Jeżeli środowisko zostanie tak zmodyfikowane, aby umożliwić
fotosyntezę, to zielone eksplantaty roślinne mogą rosnąć na
pożywkach nie zawierających cukru.
Wszystkie składniki pokarmowe w medium występują w formie
nieorganicznej.

Mikropropagacja fotoautotroficzna
Zmodyfikowane warunki środowiska:
wyższe natężenie światła i dostęp dwutlenku węgla.
Zaletami metody są:
-
ograniczenie zakażeń mikrobiologicznych,
-
możliwość powiększania skali (możliwość używania
większych naczyń),
-
większa odporność roślin na stres,
-
zredukowane ryzyko mutacji materiału.

Inżynieria genetyczna na komórkach roślinnych
Wprowadzenie obcego materiału genetycznego:
• Transformacja z użyciem wektorów
(bakterie z plazmidem)
• Transformacja bezwektorowa
(transgen wprowadza się
bezpośrednio do komórek biorcy)
Transformacja wektorowa
z użyciem
Agrobacterium
(tumefaciens, A. rhizogenes), Gram
-
, w warunkach
naturalnych przekazują plazmid replikujący się
niezależnie
-
wprowadza się za pomocą bakterii pojedyncze
geny lub grupy genów innych organizmów (gen
wprowadzony do plazmidu)
- A. tumefaciens
przenosi w naturze do rośliny geny
kodujące auksyny i cytokininy (hipertrofia-”crown gall
tumor”)
- A. rhizogenes przenosi w naturze jedynie geny auksyn
(powstawanie korzeni włośnikowych - „hairy roots”)

Agrobacterium tumefaciens
w
warunkach naturalnych wprowadza
swoje DNA do komórek roślinnych
tworząc narośla. Ta cecha jest
wykorzystana do tworzenia roślin
transgenicznych; bakteria jest
wektorem przenoszącym pożądane
geny.
Transformacja za pomocą
Agrobacterium jest wydajniejsza
u dwuliściennych niż
jednoliściennych.

Transformacja bezwektorowa
jest stosowana głównie
w przypadku protoplastów.
DNA zawarte w pożywce wnika do protoplastów (chwilowa
dezorganizacja błony komórkowej za pomocą PEG-u lub
elektroporacji).
Transformacja możliwa jest też przez wstrzeliwanie DNA do
komórek za pomocą mikronośników (cząstki złota, wolframu,
rzadko szklane lub z tworzyw średnicy ~0,5 um) opłaszczonych
przez DNA.
Protoplasty mogą też pobierać obce DNA na drodze endocytozy.
Po etapie transformacji następuje regeneracja roślin, a następnie
kontrola ekspresji transgenu.

Tworzenie sztucznych nasion
• Sztuczne nasiona
– zarodki somatyczne (nie powstałe z
komórek generatywnych) umieszczone w otoczce
ochronnej, zdolne do regeneracji roślin (Murashige, 1977)
• Dobry materiał siewny, wolny od patogenów, łatwy do
przechowywania i transportu
• Można dzięki tym nasionom rozmnażać rośliny
mieszańcowe, rośliny transgeniczne, gatunki tropikalne
wrażliwe na wysychanie
• System jest bardziej wydajny niż mikrorozmnażanie
i gwarantuje zachowanie cech genetycznych

Dwie główne technologie produkcji sztucznych nasion
• 1.Materiał uwodniony (zarodki kapsułkuje (otoczkuje) się w
hydrożelach – głównie alginiany)
• 2.Materiał odwodniony (zarodki po osiągnięciu stadium
dojrzałości są suszone i nie są otoczkowane; znaczny stopień
uszkodzeń)
• Obecnie kapsułkuje się także eksplantaty roślinne jak pąki
wierzchołkowe i boczne, fragmenty korzeni przybyszowych
i włośnikowych, grudki kalusa embrionalnego
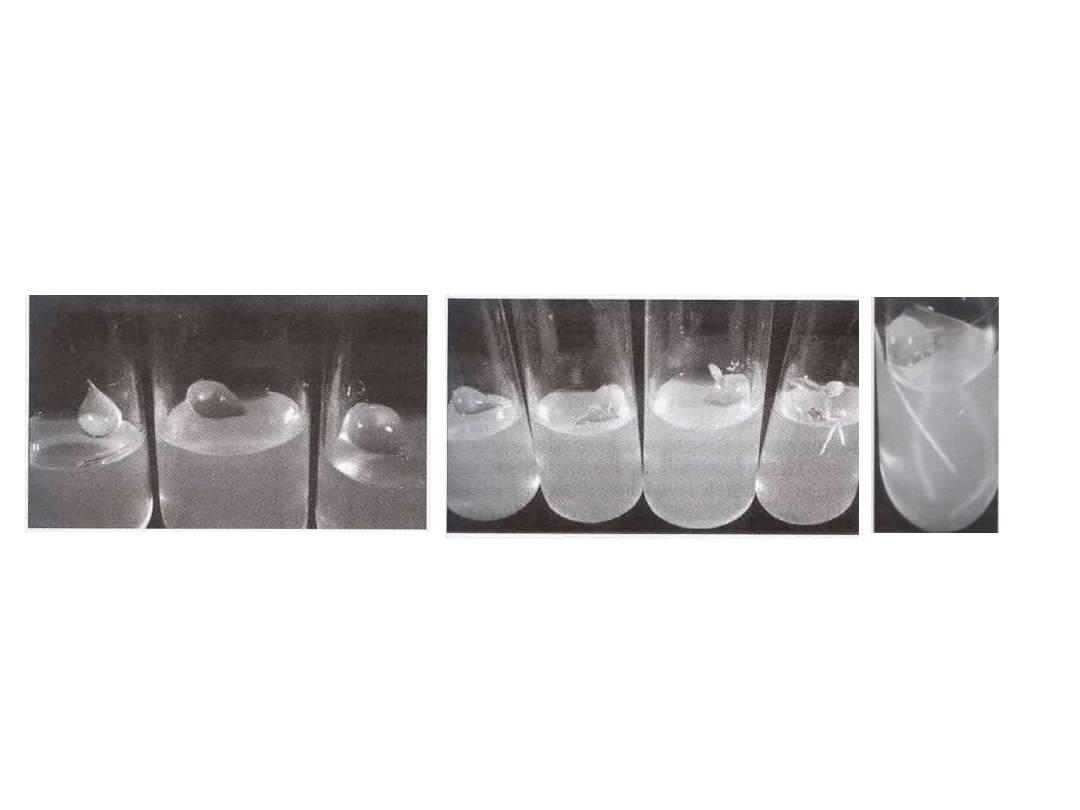
Uzyskiwanie otoczek metodą żelowania poprzez wymianę jonową
Żel alginianowy
(pozyskiwany z brunatnic kwas alginowy lub sól
sodowa w połączeniu z jonami dwu- lub wielowartościowymi
CaCl
2
, Ca(NO
3
)
2
tworzy twarde żele (15 min)
Sztuczne nasiona Rozwój korzeni Kolejne stadia kiełkowania
przybyszowych
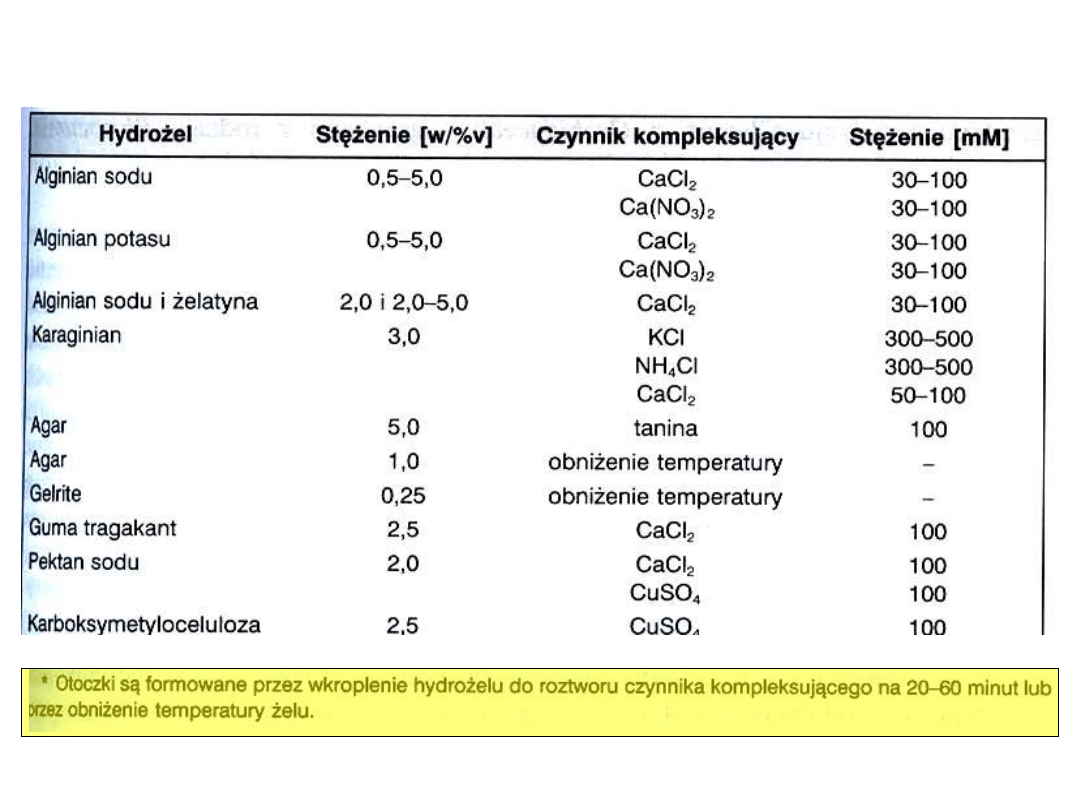
Hydrożele do otoczkowania sztucznych nasion

• Sztuczne nasiona powinny posiadać zdolność
kiełkowania i konwersji
• Kiełkowanie- wytworzenie korzonka zarodkowego
• Konwersja to zdolność jednoczesnego wytworzenia
zarówno korzonka jak i merystemu pędu rośliny o
fenotypie właściwym dla danego gatunku
• Często zarodki mają zdolność tylko kiełkowania, bez
dalszej konwersji (stopień konwersji 8-90% w zależności
od gatunku rośliny i warunków hodowli (laboratorium lub
szklarnia)

Produkcja metabolitów wtórnych z hodowli roślinnych
• Metabolity wtórne
-
substancje naturalne nie będące składnikami
produktów metabolizmu podstawowego (powstające w
odpowiedzi na stres, lub na czynniki środowiska : barwniki,
substancje lecznicze, substancje zapachowe)
• uzyskiwane z roślin leczniczych (metabolity wtórne) stanowią
poważną część wszystkich leków.
• Wiele tych substancji pozyskuje się z roślinnych linii
komórkowych hodowanych in vitro
• Teoretycznie, w odpowiednich warunkach, możliwa jest hodowla
komórek roślinnych z większości organów roślinnych (
kalus,
ksylem, miazga
), z których każdy może produkować metabolity
wtórne

• Metabolity wtórne
są produkowane przez wyspecjalizowane
części roślin, dlatego aby uzyskać je in vitro konieczne jest
zainicjowanie specjalizacji
(zarówno elementów specjalizacji
chemicznej, jak i morfologicznej):
• Wysokie stężenia auksyn powodują np. tworzenie się korzeni
(będą produkowane metabolity typowe dla tych organów).
• Można dokonać także transformacji za pomocą Agrobacterium
rhizogenes
i zmusić roślinę do produkcji odpowiednich
czynników
• Najłatwiej poddają się manipulacjom genetycznym zarodki
somatyczne wyprowadzone ze zwykłych komórek roślinnych
(nie z zapłodnionych komórek jajowych)

• Prawdopodobieństwo wytwarzania metabolitów wtórnych
jest tym większe im bardziej stopień organizacji organu
jest zbliżony do stopnia organizacji w naturze
• Niekiedy można uzyskać produkcję metabolitów wtórnych
z komórek niewyspecjalizowanych (cecha rośliny
pierwotnej, lub wynik mutacji in vitro
; „somaklonalna
zmienność”)

Wtórne metabolity:
Barwniki roślinne: karotenoidy, flawonoidy, chlorofile,
betalainy (barwniki czerwone) uzyskuje się z kultur
zawiesinowych, jak i z korzeni (stransformowanych);
Glikozydy cyjanogenne, glukozynolaty, terpenoidy, steroidy,
karotenoidy, nietypowe kwasy tłuszczowe, woski kutikularne;
Alkaloidy
: purynowe; pochodzące z kwasu nikotynowego,
ornityny, lizyny, fenyloalaniny i tyrozyny, tryptofanu,
histydyny oraz kwasu antranilowego; alkaloidy
izoprenoidowe.

Przykłady produktów uzyskiwanych z kultur roślinnych
• Szikonina
-
Korzenie włośnikowe kultur Lithospermum
erythrorizon
wytwarzają barwnik o działaniu bakteriobójczym
używany w kosmetyce (szminki); hodowla komórkowa pokrywa
zapotrzebowanie na ten związek (uprawa rośliny L. erythrorizon
zbyt kosztowna).
• Zwiazki zapachowe
(waniliowy, miętowy) uzyskuje się z hodowli
roślin (3 tys. ton/rok w USA).
• Enzymy
(proteolityczne, peroksydazy, katalazy, fosfatazy, alfa-
amylaza) produkowane przez komórki roślinne w hodowli.
• Leki
(np. przeciw-nowotworowe
– paclitaxel, winblastyna).
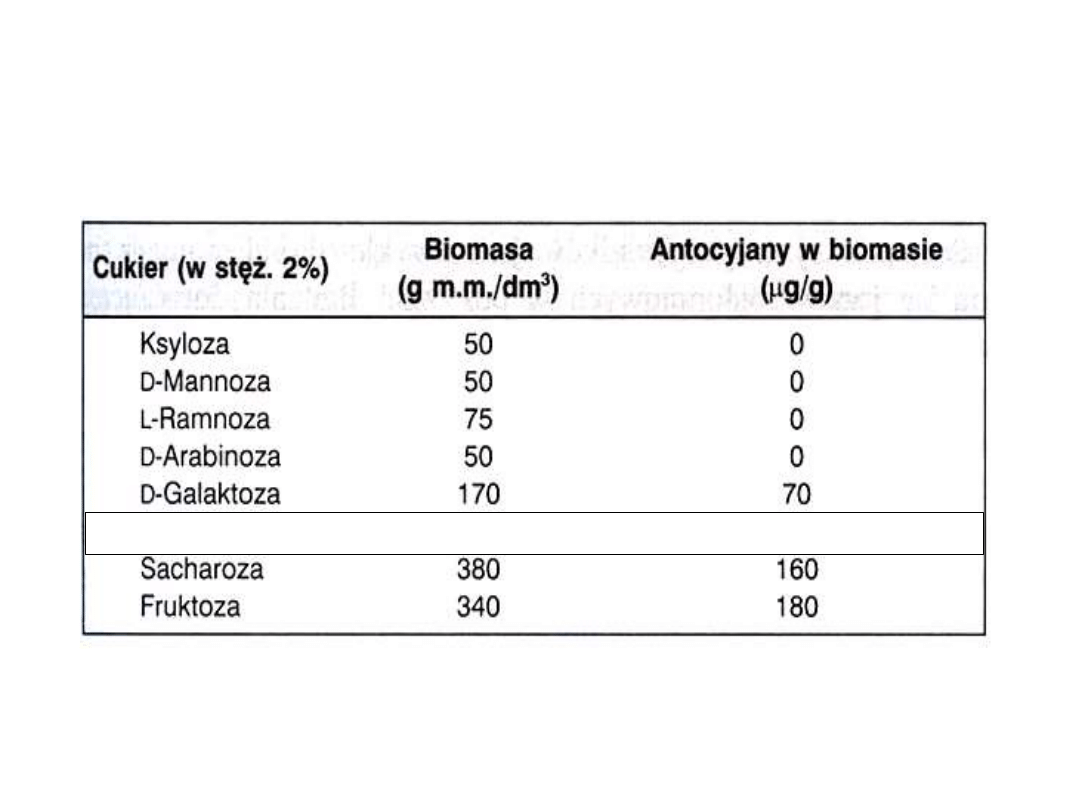
Wpływ cukrów na produkcję biomasy komórkowej i antocjanów
przez kulturę zawiesinową F.xananasa (cyt. za S.Malepszym, 2001)
D-Glukoza 360 225
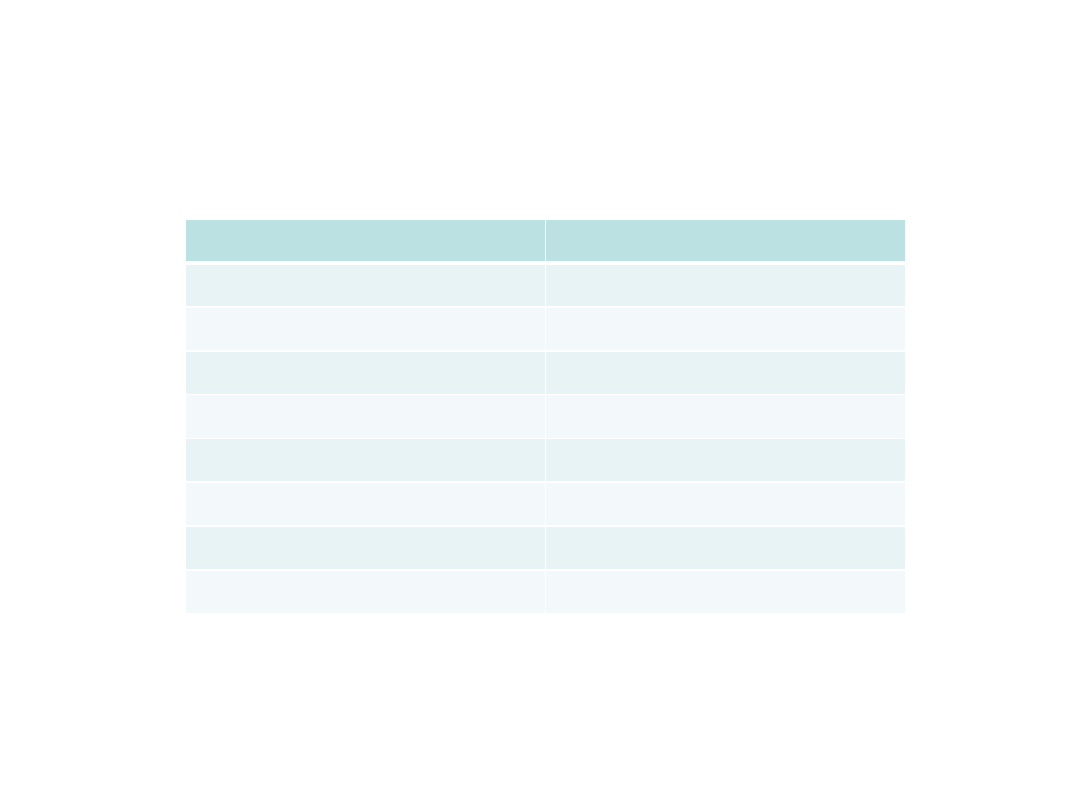
Cukier (stężenie 8%)
Paklitaksel (mg/dm
3
)
Sacharoza
0,012
Laktoza
0
Maltoza
0,01
Fruktoza
0,172
Galaktoza
0,123
Glukoza
0,0161
Sorbitol
0,135
Mannitol
0,049
Wydajność produkcji paklitakselu przez komórki Taxus
brevifolia
w zależności od rodzaju cukru w pożywce (cyt.
za Malepszy S, 2001)

W warunkach naturalnych taksany pozyskiwane są z cisu
(Taxus baccata), a winblastyna z barwinka (Vinca rosea)

Otrzymywanie szczepionek w roślinach
• Rośliny pozbawione są ludzkich i zwierzęcych patogenów,
a więc niebezpieczeństwa przeniesienia chorób poprzez
szczepionki
• Rośliny genetycznie zmodyfikowane wytwarzają wybrane
heterologiczne białka, w tym komponenty szczepionkowe,
w formie natywnej i immunogennej
• Ważną cechą roślin transgenicznych jest zdolność
przekazywania wprowadzonych genów do potomstwa

Sposoby otrzymywania szczepionek w roślinach
1.
Modyfikacja genomu jądrowego lub chloroplastowego;
uzyskuje się rośliny transgeniczne zawierające we
wszystkich komórkach fragment obcego DNA kodujący
odpowiedni antygen
Poziom ekspresji transgenu może ulegać obniżeniu w
kolejnych pokoleniach, a nawet zanikać (wyciszenie
ekspresji)

Sposoby otrzymywania szczepionek w roślinach
2.
Zakażanie roślin wirusem roślinnym*
o zmienionym genomie:
-
w określone miejsce genomu wirusa wprowadzona jest
sekwencja kodująca zdefiniowany krótki epitop białka
antygenowego (białko antygenowe eksponowane jest na
powierzchni wirionu)
-
wraz z namnażaniem się wirusa w zainfekowanej roślinie
produkowany jest również epitop antygenu
Konstrukcje takie wykazują jednak znaczną niestabilność
i rewersję do formy dzikiej, niski poziom ekspresji
wprowadzonego genu.
(
*
np. wirus mozaiki tytoniowej, TMV; wirus mozaiki lucerny,
AMV)

Nad szczepionkami pochodzenia roślinnego pracuje dziś
wiele zespołów badawczych także w Polsce:
(Instytut Genetyki PAN, Instytut Roślin i Przetworów
Zielarskich z Poznania, Warszawski Instytut Biotechnologii i
Antybiotyków, Przedsiębiorstwo Farmaceutyczne Medana
S.A).
Na przykład modyfikowany genetycznie tytoń, ziemniaki,
kukurydza, pomidory, czy szpinak wykorzystuje się w
pracach nad szczepionkami przeciwko próchnicy, biegunce
spowodowanej bakterią coli, cholerze, wściekliźnie,
pryszczycy, grypie, malarii i żółtaczce typu B.

Helicobacter pylori
Bakteria, bytująca w żołądkach ~50% populacji ludzkiej. Wiąże
się to z podwyższonym ryzykiem wystąpienia pewnych chorób
przewodu pokarmowego np. wrzodów żołądka i dwunastnicy
oraz nowotworów (raka żołądka). Większość infekcji przebiega
bezobjawowo.
Wstępne prace wielu zespołów naukowych (m.in. Instytutu
Biochemii i Biofizyki PAN) pozwoliły ustalić, że możliwe byłoby
uzyskanie szczepionki przeciwko tej bakterii, zarówno
profilaktycznej tj. zapobiegającej zakażeniu jak i terapeutycznej,
tj. leczącej istniejące zakażenie.

Potencjalnym składnikiem takiej szczepionki mogłoby być wiele
białek (antygenów) H. pylori:
najdokładniej została zbadana
ureaza
, niezbędna do przeżycia
bakterii w kwaśnym środowisku żołądka.
Dotychczas
produkcja ureazy H. pylori w roślinach jest zbyt
niska aby wywołać odporność – szczepionka wymagałaby
stosowania tzw. adiuwantów (
stymulatorów, najczęściej toksyn
bakteryjnych).
Wyszukiwarka
Podobne podstrony:
Wykł 10 Kult 2010 Hodowle kom w produkcji szczepionek
Wykł 11 Kult 2010 Terapia genowa
wykl 12 fizjo roślin, biologia, fizjologia roślin
genetyka molekularna i hodowla roślin, W7-8R04, Wykład 7-12 wersja 2001, zaoczne (a) i dzienne (doda
hodowla kolos - wyklady, sem. 4, Hodowla roślin
hodowla roslin 3
HODOWLA ROŚLIN ĆWICZENIA
Ściąga 6 z Hodowli Roślin i Nasiennictwa
genetyka molekularna i hodowla roślin, W14R03, Wykłady z genetyki i hodowli roślin ozdobnych, Sulech
TPL WYK 12 12 26 Ekstrakcja surowców roślinnych podsumowanie
Ściąga 2 z Hodowli Roślin i Nasiennictwa
DETARDANTY, sem. 4, Hodowla roślin
HODOWLA ROŚLIN ĆWICZENIA
HODOWLA ROŚLIN-test, Imię i nazwisko……………………
PCD 2010 ZADANIA roślin okrytonasiennych
PCD 2010 ZADANIA roślin okrytonasiennych
1 5 Rodowód hodowli roślinnych komórek, tkanek i organów
więcej podobnych podstron
