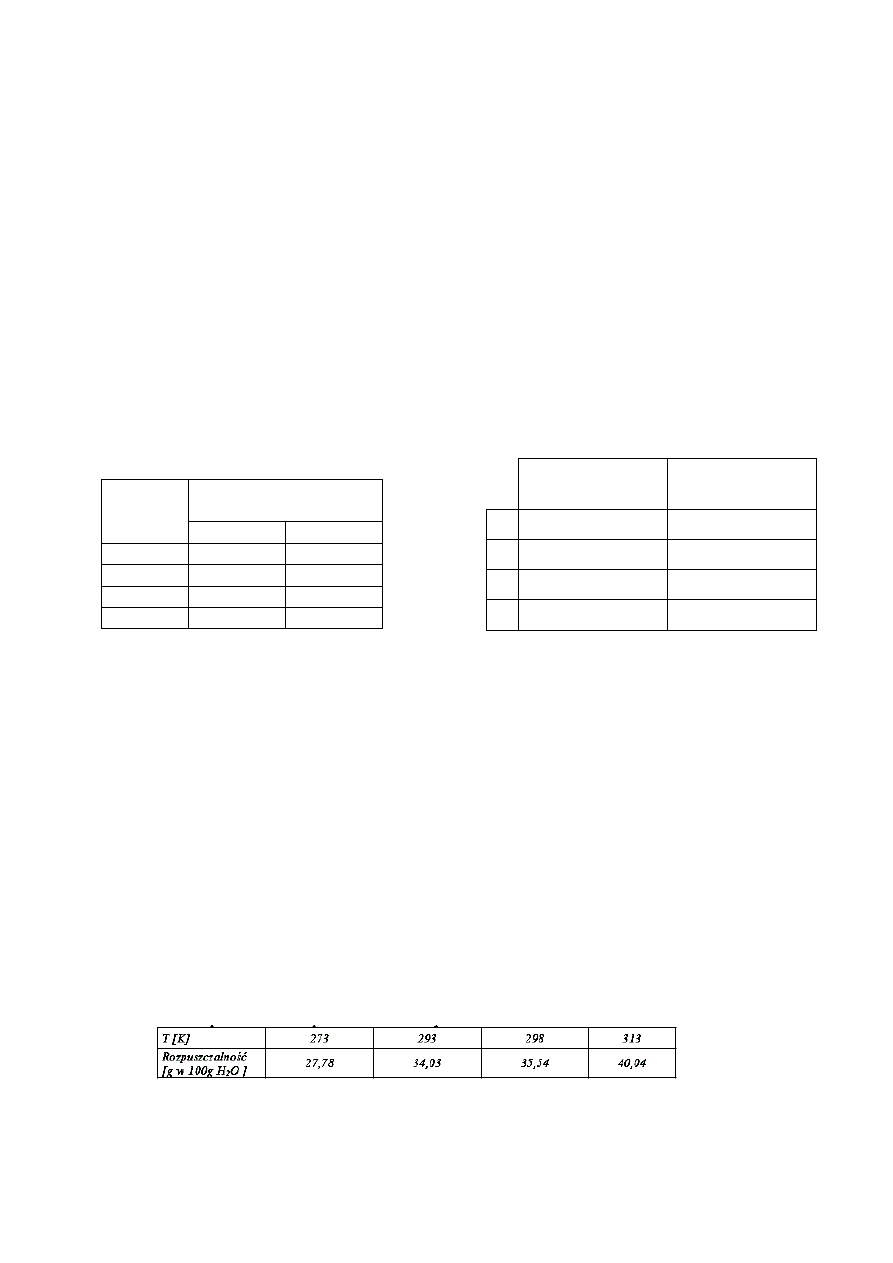
1.
Do 50 g wody wsypano 15 g octanu wapnia. Temperatura roztworu wynosi 40ºC.
Otrzymano roztwór:
A)
nasycony,
B) nienasycony,
C) przesycony,
D) nie da się określić na podstawie tych danych, jaki to roztwór
Zimą, podczas gołoledzi, oblodzoną drogę posypuje się chlorkiem sodu, w wyniku czego
lód topnieje
2.
Opisane zjawisko można wyjaśnić następująco:
A)
tworzy się roztwór, którego temperatura krzepnięcia jest wyższa niż temperatura
krzepnięcia rozpuszczalnika,
B)
powstaje roztwór, którego temperatura krzepnięcia jest niższa niż temperatura
krzepnięcia rozpuszczalnika,
C)
tworzy się roztwór nasycony,
D)
tworzy się nowy związek chemiczny.
3.
Przeanalizuj zamieszczone poniżej dane i odpowiedz na pytania:
Jakie roztwory otrzymamy po ochłodzeniu nasyconych w temp. 60°C roztworów obu
substancji do temperatury 20°C?
Temp
[°C]
Rozpuszczalność
[g / 100 g H
2
O]
Ca (OH)
2
KNO
3
0
1, 85
13, 3
20
1, 65
31, 6
40
1, 41
69, 9
60
1, 16
110, 0
Roztwór Ca
(OH)
2
roztwór KNO
3
A)
nasycony
nasycony
B)
nienasycony
nienasycony
C)
nienasycony
nasycony
D)
nasycony
nienasycony
Której z substancji: Ca (OH)
2
czy KNO
3
rozpuści się więcej w 200 g wody w
temperaturze 40°C?
4.
Podczas spalania węgla na potrzeby energetyki powstają pyły, które zaliczane są do
pierwotnych zani
eczyszczeń powietrza. Pyły nie zatrzymywane przez urządzenia
odpylające wydostają się z atmosfery i tworzą dymy zanieczyszczające środowisko
naturalne . Dym jest układem dyspersyjnym.
Określ, który składnik dymu jest fazą rozpraszającą (dyspersyjną), a który fazą
rozproszoną (zdyspergowaną)
5.
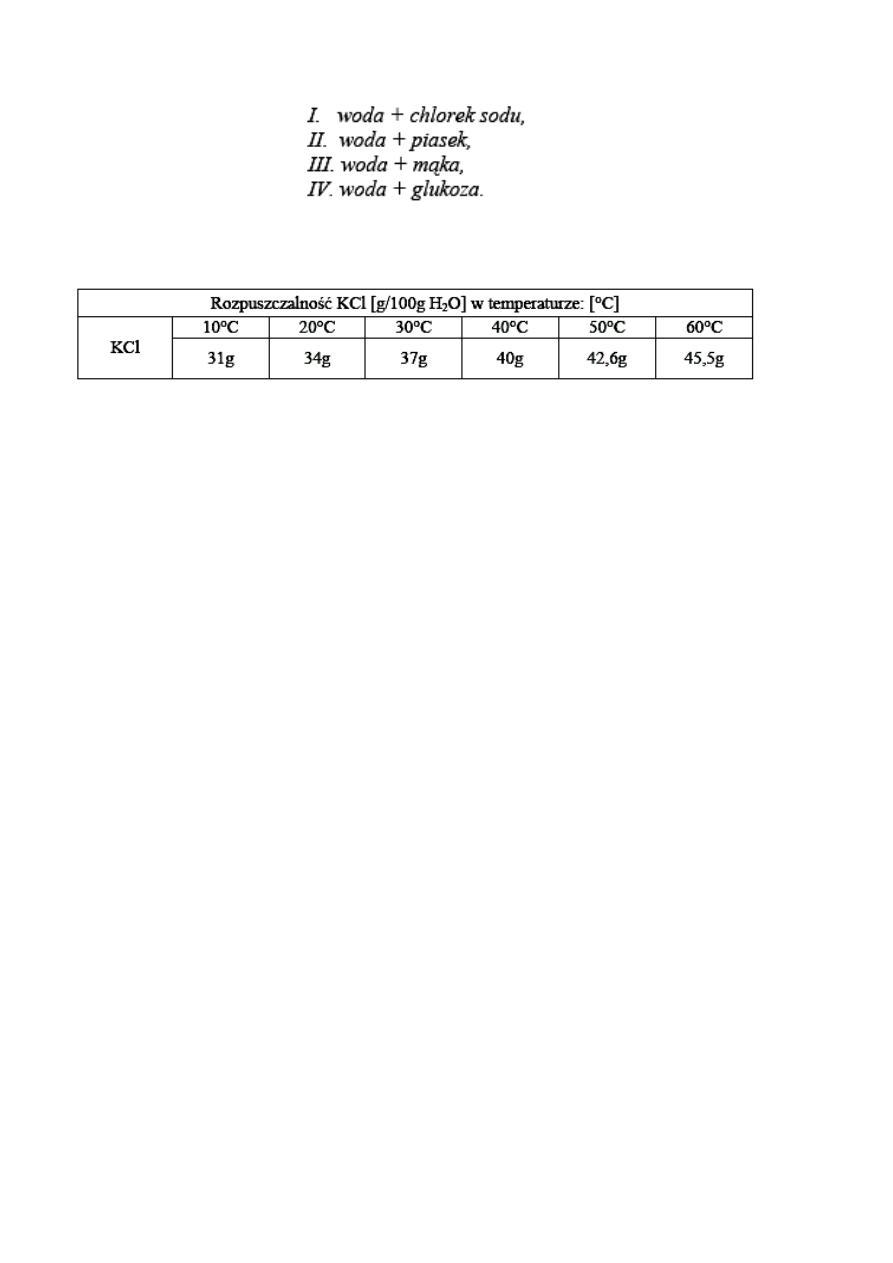
W tabeli przedstawiono rozpuszczalność chlorku potasu:
Określ, jaki roztwór (nasycony, nienasycony) powstanie jeżeli rozpuści się 16g
chlorku potasu w 50g wody w temperaturze 298K
6.
Przygotowano następujące mieszaniny. Dokonaj klasyfikacji tych układów:
7.
Poniższa tabela przedstawia zależność rozpuszczalności chlorku potasu od
temperatury.
Zaprojektuj doświadczenie prowadzące do otrzymania nasyconego roztworu
chlork
u potasu w temperaturze 20°C.
8.
Herbata jest w naszej diecie ważnym źródłem fluoru. Pierwiastek ten
A. zapobiega próchnicy zębów
B. jest potrzebny do wytwarzania
hormonów tarczycy
C.
jest składnikiem hemoglobiny
D.
przyspiesza gojenie się ran
9. Do herb
aty wsypano cukier. Wskaż zdanie informujące, kiedy cukier rozpuści się
najszybciej.
A.
Po wsypaniu do gorącej herbaty drobnoziarnistych kryształków cukru i
zamieszaniu.
B.
Po wsypaniu do gorącej herbaty grubych kryształków cukru i
zamieszaniu.
C. Podczas mieszania cukru drobnokrystalicznego w herbacie o
temperaturze pokojowej.
D. Podczas mieszania cukru grubokrystalicznego w zimnej herbacie.
10.
Szklanka herbaty posłodzona jedną łyżeczką cukru to:
A. związek chemiczny
B. roztwór nasycony
C. mieszanina
D. zawiesina
11.
W 100 g wody w temperaturze 30ºC rozpuszcza się maksymalnie:
A. 40 g KNO
3
.
B. 25 g CuSO
4
.
C. 25 g KNO
3
.
D. 40 g CuSO
4
.
12.
W jakiej najniższej temperaturze 60 g saletry potasowej rozpuści się całkowicie w
100 g wody?
A.
40ºC
B.
50ºC
C. 6
0ºC
D.
105ºC
13.
W dwóch naczyniach sporządzono dwa roztwory wodne o temperaturze 80ºC każdy.
W tym celu w pierwszym naczyniu umieszczono 40 g CuSO
4
i 100 g wody, a w drugim
naczyniu umieszczono 40 g KNO
3
i 100 g wody. W obu naczyniach składniki
wymieszano. Otrzymano:
A.
nasycony roztwór KNO
3
i nasycony roztwór CuSO
4
.
B.
nasycony roztwór KNO
3
i nienasycony roztwór CuSO
4
.
C.
nienasycony roztwór KNO
3
i nasycony roztwór CuSO
4
.
D.
nienasycony roztwór KNO
3
i nienasycony roztwór CuSO
4
.
14.
15. Po odparow
aniu niewielkiej ilości klarownej cieczy pobranej z Jeziora Wigry, na
szkiełku zegarkowym pozostał biały osad. Świadczy to o tym, że ciecz poddana
analizie jest:
A. pierwiastkiem chemicznym.
B.
związkiem chemicznym.
C.
mieszaniną jednorodną.
D. mieszanin
ą niejednorodną.
Informacje do zadań 16 – 19.
Wykres przedstawia zależność rozpuszczalności dwutlenku węgla w wodzie od
temperatury.
16.
Ile najwięcej gramów dwutlenku węgla można rozpuścić w 100 g wody o
temperaturze 10°C?
A. 50
B. 30
C. 0,3
D. 0,2
17.
100 g wody o temperaturze 5°C nasycono dwutlenkiem węgla. Ile gramów CO
2
wydzieli się w postaci gazu, gdy ten roztwór ogrzejemy do temperatury 30°C?
A. 0,1
B. 0,2
C. 0,3
D. 0,4
18.
Jeśli temperatura wody rośnie, to rozpuszczalność CO
2
:
A.
rośnie
B. maleje
C.
nie zmienia się D. jest stała
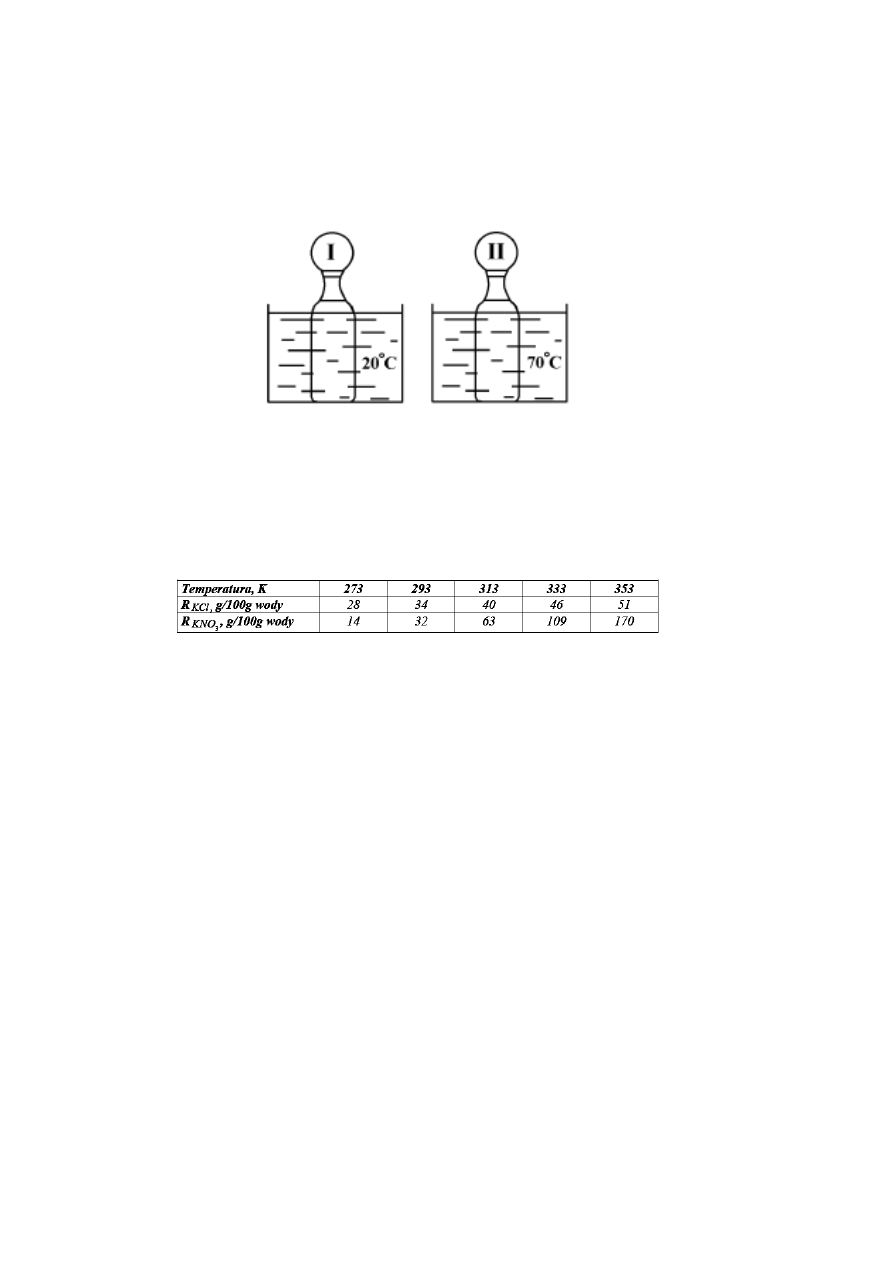
19.
Do dwóch jednakowych butelek nalano taką samą ilość gazowanej wody mineralnej
(nasyconej CO
2
), schłodzonej do temperatury 10°C. Obie butelki zamknięto
szczelnie jednakowymi balonami i zanurzono w naczyniach z wodą o różnych
temperaturach, tak jak ilustruje rysunek. Który balon bardziej zwiększy swoją
objętość?
A.
Pierwszy balon bardziej zwiększy objętość.
B.
Żaden nie zwiększy swojej objętości.
C.
Oba jednakowo zwiększą objętość.
D.
Drugi balon bardziej zwiększy objętość.
20.
W tabeli przedstawiono rozpuszczalność w wodzie dwóch soli w zależności od
temperatury.
Uzupełnij kolejne zdania I, II, III i IV, posługując się określeniami z poniższego
zbioru:
KCl,
KNO
3
,
nasycony,
nienasycony,
ochłodzić, ogrzać,
dodać sól.
I.
Solą lepiej rozpuszczalną w wodzie, w temperaturze 293 K jest
....................................
II. Rozpuszczając 60 g KNO
3
w 100 g wody o temperaturze 313 K otrzymamy
roztwór .....
III. W celu przeprowadzenia nasyconego roztworu KNO
3
w roztwór nienasycony
tej soli należy go ..........................
IV. Aby wytrącić osad KCl z nasyconego roztworu tej soli należy ten roztwór
....................
21.
Podaj, w jakiej kolejności i przy pomocy jakich metod wydzielisz chlorek sodu i
piasek z mieszaniny piasku i wodnego roztworu chlorku sodu.
Najpierw wydzielam: ...........................................
Następnie wydzielam: ........................................
Zastosowane metody: ........................................
22. W
120 g wody w temperaturze 80°C rozpuszczono 60 g chlorku amonu.
Z wykresu
rozpuszczalności odczytaj i zapisz, jaka jest rozpuszczalność chlorku
amonu w tej temperaturze oraz podaj, czy powstał roztwór nasycony czy nienasycony.
23.
Korzystając z zamieszczonego wyżej wykresu rozpuszczalności, uzupełnij poniższe
zdanie, wpisując w miejsce kropek „większa” lub „mniejsza” oraz podając nazwę
odpowiedniej substancji.
W
temperaturze
40
o
C
rozpuszczalność
chlorku
amonu
jest
..............................................
niż rozpuszczalność chlorku sodu i ............................................ niż azotanu(V)
potasu.
W tej temperaturze rozpuszczalność ......................... jest największa.
Informacja do zadań 24, 25.
Przeanalizuj zamieszczone poniżej dane.
24. Podaj,
której substancji: Ca(OH)
2
czy KCl rozpuści się więcej w temperaturze 60
0
C?
25.
Określ, jaki roztwór powstanie, nasycony czy nienasycony, jeśli w 100 gramach
wody rozpuścimy 35 gramów KCl w temperaturze 40
0
C?
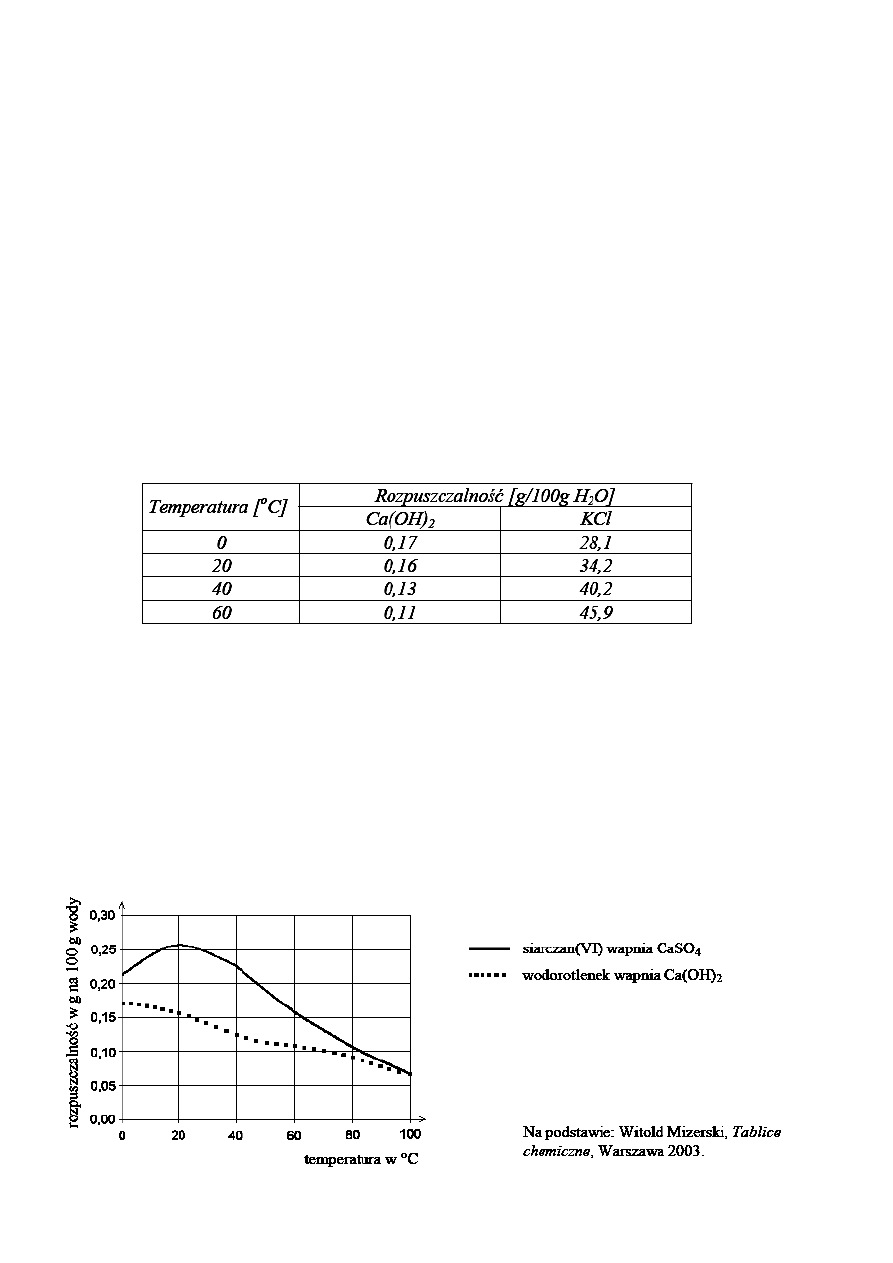
Informacje do zada
ń 26, 27.
Wykres przedstawia zale
żność rozpuszczalności wybranych związków wapnia w
wodzie od temperatury.
26. Ile co najwy
żej gramów wodorotlenku wapnia można rozpuścić w 1000 g wody
w
temperaturze 20ºC?
A. 2,6
B. 0,26
C. 0,16
D. 1,6
27.
Które zdanie jest prawdziwe?
A. Rozpuszczalno
ść związków wapnia rośnie ze wzrostem temperatury.
B. Przy podnoszeniu si
ę temperatury od 0ºC do 20ºC rozpuszczalność
siarczanu(VI) wapnia ro
śnie, a wodorotlenku wapnia maleje.
C. Rozpuszczalno
ść siarczanu(VI) wapnia w temperaturze 0ºC i 60ºC jest taka
sama.
D. Rozpuszczalno
ść wodorotlenku wapnia jest odwrotnie proporcjonalna do
temperatury.
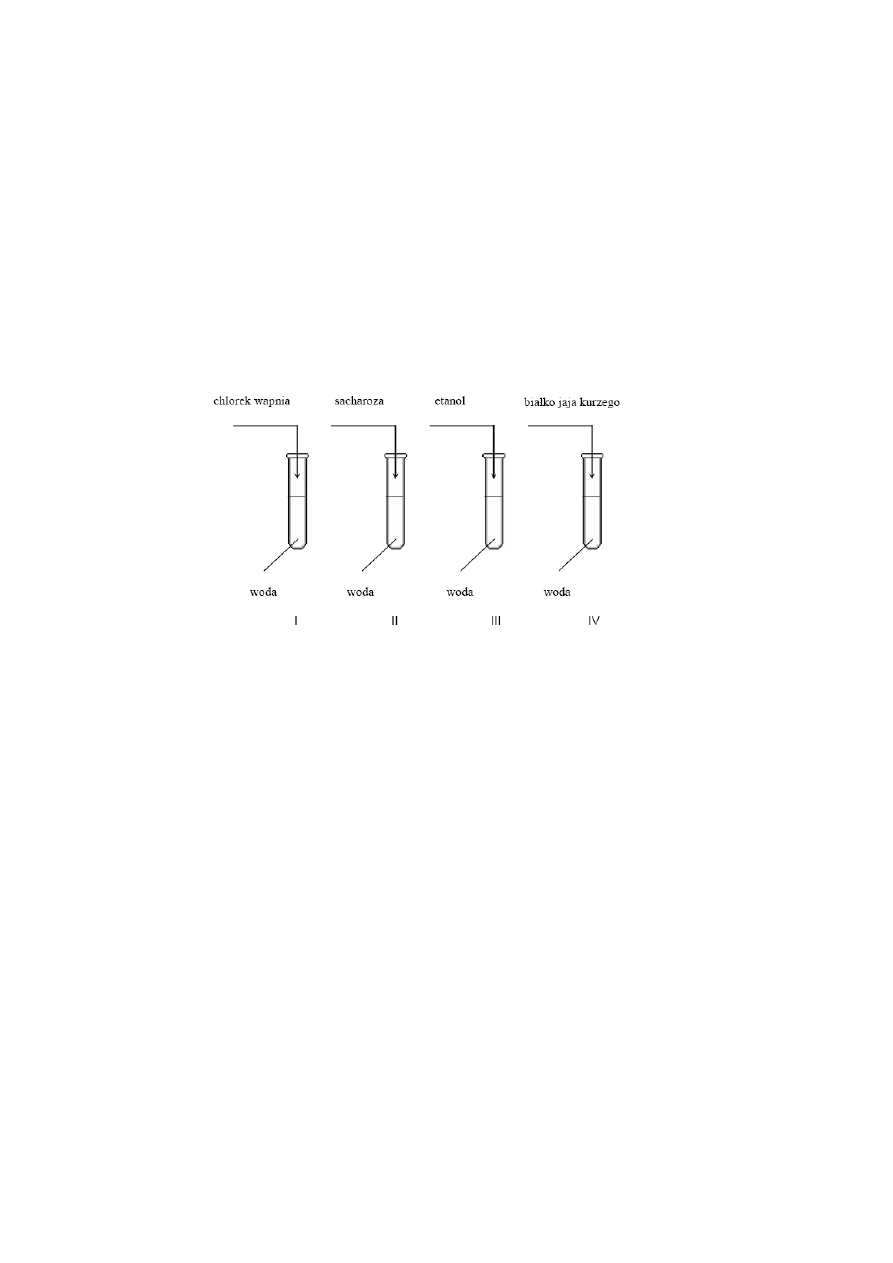
28.
Do czterech probówek wlano po kilka cm
3
wody destylowanej, a następnie do
probówki I wsypano trochę chlorku wapnia, do probówki II – kilka kryształów
sacharozy, do prob
ówki III wprowadzono trochę etanolu, a do probówki IV –
odrobinę białka jaja kurzego. Zawartość każdej probówki energicznie wymieszano.
a)
Podaj numer probówki, w której nie otrzymano roztworu właściwego.
b) Nazwij metodę, za pomocą której można wydzielić sól znajdującą się w
probówce I.
29.
Uzupełnij zdanie:
Gdy podczas rozpuszczania ciała stałego wodzie podwyższymy temperaturę,
najczęściej
rozpusz
czalność ciała .................... natomiast rozpuszczalność ciała gazowego
..............
30. Zaproponu
j sposób rozdzielenia mieszaniny soli kuchennej i piasku. Podaj kolejność
wykonywanych czynności.
Informacja do zadań 31. i 32.
Poniższa tabela zawiera dane dotyczące rozpuszczalności dwóch substancji
chemicznych w wodzie, w różnych temp.

31. Jakie roztwory
otrzymamy po ochłodzeniu nasyconych w temp. 60°C roztworów obu
substancji (Ca(OH)
2
oraz KNO
3
) do temp. 40°C.
32.
Napisz, której substancji, Ca(OH)
2
czy KNO
3
, rozpuści się więcej w 50 g wody w
temperaturze 20°C.
33.
W dwóch probówkach znajdują się substancje chemiczne: w jednej 20 g chlorku sodu
(NaCl), w drugiej 30 g azotanu(V) potasu (KNO
3
). Do obu probówek dodano po 100
gramów wody. Korzystając z wykresu rozpuszczalności, ustal, czy któraś substancja
rozpuści się całkowicie w 100 g wody w temperaturze 40°C.
34.
W czasie katastrof tankowców ropa przedostaje się do mórz i oceanów. Dlaczego nie
opada ona na dno, lecz utrzymuje się na powierzchni.
35.
W poniższej tabeli podano rozpuszczalność dwóch substancji: Li
2
CO
3
i K
2
SO
4
w
wodzie w różnych temperaturach.
Określ, jakie roztwory otrzymamy, jeśli ochłodzimy nasycone w temperaturze
60°C roztwory Li
2
CO
3
i K
2
SO
4
do temperatury 20°C.
36.
W poniższej tabeli podano wartości rozpuszczalności w wodzie różnych gazów w
przedziale temperatur od 0° do 80°C.

Cz
asami podczas upałów można zaobserwować w zbiornikach wodnych śnięte ryby.
Jaka może być tego przyczyna.
37.
Tlenek siarki(IV) oraz tlenek węgla(IV) to dwa tlenki, które przyczyniają się do
powstawania tzw. kwaśnych deszczów. Napisz i uzasadnij, który z tych gazów w
większym stopniu przyczynia się do degradacji środowiska naturalnego.
38.
Wskaż zdania prawdziwe:
I
Efekt Tyndalla to zjawisko pozwalające na odróżnienie układów koloidalnych od
roztworów właściwych.
II Ze wzrostem temperatury rozpuszczalność większości ciał stałych, cieczy i gazów
wzrasta.
III Nie istnieje taki układ koloidalny, którego fazą rozproszoną i rozpraszającą jest gaz.
IV Ze wzrostem temperatury rozpuszczalność większości ciał stałych wzrasta, a gazów
maleje.
A. tylko I
B. III i IV C. I, II, IV D. I, III, IV
39.
Uzupełnij podane zdania:
Efekt Tyndalla stanowi jedną z najbardziej charakterystycznych właściwości
roztwo
rów
..........................(1). Przykładem koloidu, w którym fazą dyspersyjną
(rozpraszającą) i
fazą
zdyspergowaną
(rozproszoną)
jest
ciecz,
może
być
.................................(2).
40.
Na podstawie wykresów rozpuszczalności gazów w wodzie podaj, ile gramów amo-
niaku rozpuści się w 100 g wody w temperaturze 313K.

41.
Na podstawie analizy wykresów krzywych rozpuszczalności napisz, który gaz w tem-
peraturze 293K charakteryzuje się większą rozpuszczalnością w wodzie - amoniak
czy chlorowodór.
42.
Na podstawie wykresu określ, jak zmienia się rozpuszczalność SO
2
(wzrasta czy ma-
leje), gdy temperaturę układu obniżymy z 323 K do 293 K.
Wyszukiwarka
Podobne podstrony:
chemiaix pl wp content uploads 2011 05 02 5 Rozpuszczalność zadania do lekcji nr 2
02 5 Rozpuszczalność zadania do lekcji nr 1
02 5 Rozpuszczalność zadania do lekcji nr 4
05 4 Iloczyn rozpuszczalności zadania do lekcji nr 1
05 4 Iloczyn rozpuszczalności zadania do lekcji nr 2
02 5 Odczyn roztworów wodnych pH zadania do lekcji nr 2
02 3 Szybkość reakcji chemicznych zadania do lekcji nr 2
02 4 Folia Odczyn roztworów wodnych pH zadania do lekcji nr 1
02 3 FOLIA Szybkość reakcji chemicznych zadania do lekcji nr 1
06 4 Mangan i jego związki zadania do lekcji nr 2
7Izotopy i ich zastosowanie zadania do lekcji nr 1
03 4 Ogniwa galwaniczne zadania do lekcji nr 2
05 6 Stężenie procentowe roztworów zadania do lekcji nr 2
04 4 Folia Hydroliza soli zadania do lekcji nr 1
03 4 Folia Teorie kwasowo zasadowe zadania do lekcji nr 1
05 3 Efekty energetyczne reakcji zadania do lekcji nr 1
07 4 Chrom i jego związki zadania do lekcji nr 2
10Promieniotwórczość zadania do lekcji nr 2
9Promieniotwórczość zadania do lekcji nr 1
więcej podobnych podstron