6
HOROBY WEWNĘTRZNE
C
WETERYNARIA
W PRAKTYCE
MARZEC-KWIECIEŃ • 2/2005
Praktycznie wszystkie psy i koty z CKK
mają względny bądź całkowity niedobór
insuliny. U niektórych psów i kotów stężenie
insuliny w osoczu jest podobne do obserwo-
wanego u normalnych, nie cierpiących na
cukrzycę zwierząt poddanych głodówce. Cu-
krzycowa kwasica ketonowa może się także
rozwinąć u psów i kotów otrzymujących zbyt
niskie dawki insuliny. Osłabione działanie
insuliny lub oporność na insulinę są także
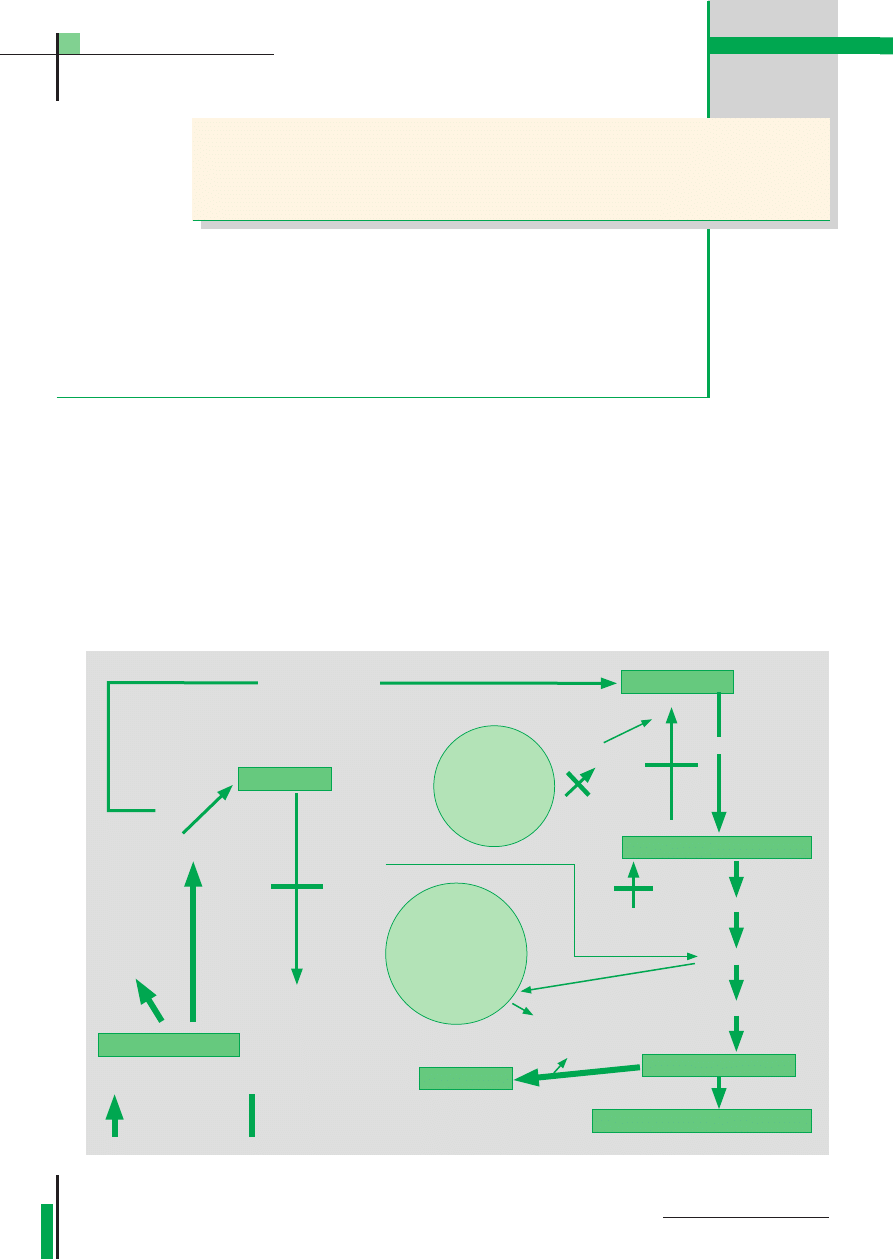
Brak lub niedobór tego hormonu pro-
wadzi do hiperglikemii i glukozurii, do
zmniejszonego spalania glukozy w cyklu
Embdena-Meyerhofa (9).
Zaburzona karboksylacja kwasu pi-
rogronowego do kwasu szczawioocto-
wego uniemożliwia dalszą przemianę
tego kwasu w cyklu kwasów trikarbok-
sylowych. Ulega on dekarboksylacji,
w wyniku czego powstaje acetylo-CoA,
istotnymi czynnikami przyczyniającymi się
do rozwoju kwasicy ketonowej.
P
ATOFIZJOLOGIA
Insulina jest hormonem stymulującym:
1) glukoneogenezę,
2) spalanie glukozy w cyklu Embdena-
-Meyerhofa oraz pentozowym,
3) anabolizm białkowy,
4) lipogenezę.
Kwasica ketonowa
w przebiegu cukrzycy
u psów i kotów
PATOGENEZA, DIAGNOZOWANIE I LECZENIE
Andrzej Depta, Andrzej Rychlik, Małgorzata Kander, Renata Nieradka, Marcin Nowicki
Zespół Diagnostyki Klinicznej, Katedra Nauk Klinicznych Wydziału Medycyny Weterynaryjnej
Uniwersytetu Warmińsko-Mazurskiego w Olsztynie
W przebiegu cukrzycy u psów i kotów może rozwinąć się cukrzycowa kwasica ketonowa
(CKK). Przyjmuje się, że cztery główne czynniki mogą powodować wzrost ketogenezy
i występowanie kwasicy ketonowej ze wszystkimi konsekwencjami w postaci zaburzeń
ogólnoustrojowych: niedobór insuliny, nadmiar hormonów diabetogennych, głodówka
i odwodnienie (3, 4, 5, 13, 15, 16).
WETERYNARIA
W PRAKTYCE
Tab. 1. Cukrzyca – patomechanizm kwasicy ketonowej
cykl
pentozowy
cykl
kwasów
trikarboksylowych
glukoza
katabolizm białek
aceton
wzrost przemian
blok metaboliczny
glukoneogeneza
kwas
pirogronowy
triglicerydy
kwasy tłuszczowe
kwasy acetooctowy
kwas beta-hydroksymasłowy
NADPH
2
Alfa-glicerofosforan
lipoliza
beta oksydacja
acetylo CoA
Ac–Ac–CoA
CO
2
2 CO
2
synteza kwasów
tłuszczowych
kwas
szczawiowo-octowy
cytrynian
amonio-
geneza

7
WETERYNARIA
W PRAKTYCE
MARZEC-KWIECIEŃ • 2/2005
CHOROBY WEWNĘTRZNE
zwiększając istotnie pulę kwasu octowe-
go, przekształcającego się w kwas aceto-
octowy (9, 10).
Niedobór insuliny jest przyczyną wzmo-
żonej lipolizy i zmniejszonej lipogenezy.
Kwasy tłuszczowe uwolnione z komórek
tłuszczowych dostają się do krwi, a na-
stępnie do wątroby, gdzie ulegają częściowo
resyntezie do triglicerydów (i wydalaniu do
krwi, gdzie są transportowane we frakcji
prebeta-lipoprotein), a częściowo spala-
niu do acetylo-CoA. Ilość powstającego
w ustroju acetylo-CoA przekracza jednak
pojemność tkanek dla spalania go w cyklu
kwasów trikarboksylowych. Do zaburzenia
gospodarki lipidowej przyczynia się jeszcze
zmniejszenie syntezy triglicerydów uwa-
runkowane niedoborem
a-glicerofosfo-
ranu (jako następstwo zaburzonej glikolizy
w cyklu Embdena-Meyerhofa).
Wyniki badań ostatnich lat dowodzą, że
w patogenezie kwasicy ketonowej u psów
i kotów chorych na cukrzycę istotną rolę
odgrywa hipersekrecja glukagonu. Hor-
mon ten, wzmagając procesy glukone-
ogenetyczne, uczestniczy w zwiększeniu
glikemii. Ponadto jego aktywność lipo-
lityczna jest przyczyną wzmożonej lipo-
lizy i ketozy. Za udziałem tego hormonu
w ketozie cukrzycowej przemawia fakt,
że stosowanie somatostatyny, hamującej
sekrecję glukagonu, w istotny sposób
zmniejsza nasilenie ketozy w cukrzycy
insulinozależnej (10, 12).
W wyniku przedstawionych zaburzeń
przemiany węglowodanowej i tłuszczo-
wej powstaje kwasica metaboliczna, uwa-
runkowana wzrostem stężenia kwasów
acetooctowego i
b-hydroksymasłowego.
Spontaniczna dekarboksylacja kwasu
acetooctowego jest z kolei źródłem ace-
tonu pojawiającego się w powietrzu wy-
dechowym i w moczu (1, 2).
Kwasica metaboliczna jest przyczyną
wzmożonego katabolizmu białkowego,
dostarczającego grup NH
2
, użytkowanych
w procesie amoniogenezy oraz meta-
bolitów szlaku glukoneogenetycznego.
W następstwie wzmożonego tworzenia
się silnych donatorów jonów wodoro-
wych dochodzi do przemieszczania tych
ostatnich do komórek oraz potasu z ko-
mórek do przestrzeni pozakomórkowej.
Prowadzi to do wzrostu stężenia potasu
w osoczu krwi oraz do zubożenia tkanek
w ten pierwiastek (9).
Wzrost glikemii jest przyczyną diurezy
osmotycznej oraz znacznego odwod-
nienia, któremu towarzyszy znaczne
zubożenie ustroju w sód wydalany
z moczem. Do znacznych strat dochodzi
też w przebiegu uporczywych wymiotów
towarzyszących kwasicy ketonowej. Od-
wodnienie ustroju jest przyczyną oligo-
wolemii i zaburzeń krążenia (hipotonia,
tendencja do zapaści, niedokrwienie
nerek z retencją związków azotowych).
Diureza osmotyczna oraz wymioty są
w końcu przyczyną zubożenia ustroju
w potas, mimo że stężenie tego pierwiast-
ka w osoczu krwi ma tendencję wzro-
stową. Ponadto stwierdza się nadmierną
ucieczkę fosforanów z moczem i ujemny
bilans fosforanowy. Zwiększenie stę-
żenia jonów wodorowych uruchamia
zarówno kompensację oddechową, jak
i nerkową. Pierwsza objawia się znaczną
hiperwentylacją (oddech Kussmaula),
druga natomiast — wzmożoną regene-
racją zasad w procesie amoniogenezy
i wytwarzania kwaśności miareczkowej.
Ponadto dochodzi do wymiany H
+
na Ca
++
w układzie kostnym (3, 16, 18).
W podsumowaniu można powiedzieć,
że kwasica ketonowa u psów i kotów
chorych na cukrzycę jest wynikiem
zaburzonego zużywania glukozy prowa-
dzącego w konsekwencji do wzmożonej
lipolizy, zmniejszonej lipogenezy, wzro-
stu katabolizmu białkowego oraz do
poważnych zaburzeń gospodarki wodno-
-elektrolitowej (odwodnienie, zubożenie
ustroju w sód i potas) i równowagi kwa-
sowo-zasadowej. Zwiększenie stężenia
związków ketonowych jest wynikiem
nadmiernego katabolizmu kwasów tłusz-
czowych, uwarunkowanego zmniejszoną
utylizacją glukozy oraz zmniejszeniem
natężenia procesów lipogenetycznych.
O
BJAWY
KLINICZNE
Dane uzyskane z wywiadu są naj-
ważniejszym elementem postępowania
diagnostycznego. Postępujące osłabienie,
brak łaknienia, bardzo silne pragnienie to
najczęściej obserwowane przez właścicieli
zwierząt objawy chorobowe. W zależności
od stopnia zaawansowania kwasicy nasile-
nie poszczególnych objawów klinicznych
może być różne. Niemniej prawie zawsze
stwierdza się zapach acetonu, znaczną
hiperwentylację płuc (oddech Kussmau-
la) oraz cechy odwodnienia (zapadnięte
gałki oczne, suchy język, mało elastyczna,
sucha skóra). Oligowolemia jest przyczyną
zaburzeń krążenia objawiających się przy-
spieszeniem czynności serca, hipotonią,
a nawet zaburzeniami świadomości (1, 2,
7, 10, 18).
B
ADANIA
LABORATORYJNE
Oprócz znacznej hiperglikemii, glu-
kozurii, ketonemii i ketonurii stwierdza
się spadek pH, pCO
2
i stężenia HCO
3
-
oraz miernego stopnia wzrost stężenia
azotu pozabiałkowego. Stężenie sodu
w osoczu jest zwykle zmniejszone,
potasu natomiast zwiększone. Ponadto
stwierdza się leukocytozę, zwiększenie
liczby hematokrytowej, liczby erytro-
cytów i stężenia Hb. W końcu wśród
badań laboratoryjnych należy wymienić
znaczny wzrost stężenia wolnych kwasów
tłuszczowych, triglicerydów oraz prebe-
ta-lipoprotein (7, 11, 12, 14, 19).
R
OZPOZNANIE
Rozpoznanie ketonowej kwasicy
cukrzycowej na ogół nie jest trudne
na podstawie anamnezy cukrzycowej,
stwierdzenia zapachu acetonu, hiper-
wentylacji, cech odwodnienia oraz wyni-
ków badań laboratoryjnych. Niezbędne
minimum testów, jakie należy wykonać
to: badanie moczu, hematokryt, poziom
glukozy we krwi, wskaźniki RKZ, za-
wartość azotu mocznikowego we krwi
lub kreatyniny w surowicy, poziom
elektrolitów w surowicy oraz elektro-
kardiogram. Te badania są potrzebne
do natychmiastowej oceny pacjenta
i podjęcia leczenia. Poznanie wyników
testów pozwala dokonać właściwego
wyboru terapii płynami, a także zaradzić
zaburzeniom elektrolitowym, kwasicy
i zmianom w czynności nerek. Inne
dane, np. uzyskane ze zdjęć rentgenow-
skich czy dalszych badań patologicz-
nych, mogą być przydatne do dokonania
pełnej oceny medycznej zwierzęcia.
Jednak tzw. „profil kwasicy ketonowej”
dostarcza informacji wystarczających do
rozpoczęcia natychmiastowej terapii.
L
ECZENIE
Leczenie
kwasicy cukrzycowej po-
lega na:
1. podaniu odpowiedniej ilości insuliny,
aby znormalizować metabolizm po-
średni,
2. uzupełnieniu straty wody i elektrolitów,
3. wyrównaniu kwasicy,
4. dostarczeniu substratu węglowodanu,
jeśli jest to wymagane przez leczenie
insuliną.
Właściwa terapia nie oznacza wymu-
szenia gwałtownego powrotu do normy,
ponieważ zaburzenia osmotyczne i bio-
chemiczne mogą zostać wywołane nie
tylko przez sam proces chorobowy, ale
także przez zbyt agresywną terapię. Gwał-
towne zmiany w szeregu parametrów
życiowych mogą być równie, a nawet
bardziej, szkodliwe niż brak zmian. Jeżeli
uda się powoli przywrócić nieprawidłowe
parametry do normy (tj. w okresie od 36
do 48 godzin), istnieje większe praw-
dopodobieństwo odniesienia sukcesu
w całej terapii (10).
P
ODAWANIE
INSULINY
W przypadku kwasicy ketonowej naj-
częściej zaleca się schemat podawania
insuliny drogą domięśniową. Zgodnie
z tym schematem zwykłą, rozpuszczalną

8
HOROBY WEWNĘTRZNE
C
WETERYNARIA
W PRAKTYCE
MARZEC-KWIECIEŃ • 2/2005
insulinę podaje się początkowo w dawce
0,25 j/kg i.m. (po rozpoczęciu płynotera-
pii). Następnie iniekcje insuliny powtarza
się co 1-2 godziny w dawce 0,2 j/kg, bada-
jąc jednocześnie stężenie glukozy w suro-
wicy. Pożądane jest obniżanie się stężenia
glukozy z prędkością od 2 do 5 mmol/l na
godzinę do chwili, gdy osiągnie ono war-
tość l4 mmol/l. Od tego momentu insulinę
podaje się podskórnie co 6 do 8 godzin
w dawce 0,5 j/kg, natomiast płyny poda-
wane dożylnie zmienia się na 5% roztwór
glukozy. Roztwór ten można uzyskać przez
dodanie 110 ml 50% roztworu glukozy do
litrowego worka z płynem krystalicznym.
Gdy ustąpi ketoza (co ocenia się na pod-
stawie pomiaru stężenia ciał ketonowych
w moczu lub surowicy krwi), a zwierzę je
i pije samodzielnie, można zacząć pod-
skórne podawanie insuliny o dłuższym
czasie działania (5, 6, 8, 17).
T
ERAPIA
PŁYNAMI
Zastąpienie i utrzymanie normalnej
równowagi płynów jest bardzo ważne,
jeśli chcemy zapewnić odpowiednią
pojemność minutową serca, ciśnienie
krwi i dopływ krwi do wszystkich tka-
nek. Polepszenie przepływu nerkowego
krwi ma szczególne znaczenie. Oprócz
ogólnych korzystnych aspektów terapii
płynami u odwodnionego pacjenta te-
rapia ta może obniżyć stężenie glukozy
w osoczu u pacjentów z CKK, nawet przy
braku podawania insuliny.
Płyny zwiększają wydalanie glukozy
przez zwiększanie przesączania kłęb-
kowego i wypływu moczu oraz obniżają
wydzielanie hormonów diabetogennych
stymulujących hiperglikemię. W odróż-
nieniu od stężenia glukozy, stężenie ace-
tooctanu i kwasu
b-hydroksymasłowego
nie spada, jeśli płyny podawane są bez
insuliny (3, 7, 9).
S
KŁAD
I
DAWKOWANIE
PŁYNÓW
Rodzaj użytych płynów zależał będzie od
stopnia zaburzeń wodno-elektrolitowych,
stężenia glukozy we krwi i jej osmomolar-
ności. Z rzadkimi wyjątkami, wszystkie psy
i koty z CKK wykazują znaczne niedobory
całkowitej zawartości sodu w organizmie,
bez względu na jego poziom w surowicy.
Uważa się, że nadmierna utrata sodu
z moczem wynika z diurezy osmotycznej
wywołanej przez cukromocz i ketonurię,
oraz z niedoboru insuliny. Insulina potęguje
nerkowe wchłanianie zwrotne sodu w dy-
stalnej części nefronu, a jej brak prowadzi
do utraty sodu. Hiperglikemia, wymioty
i biegunka także przyczyniają się do jego
strat przy CKK.
Wstępnym płynem jest 0,9% chlorek
sodowy, chyba że występuje gwałtowne
podwyższenie osmmolalności powyżej
normy (>350 mosm/kg). U pacjentów
z łagodnym nadciśnieniem (od 310 do 350
mosm/kg) ten roztwór będzie hipotonicz-
ny w stosunku do stężenia osmotycznego
osocza. Przy leczeniu płynami bardzo
pomocna może też być częsta ocena (co
cztery do sześciu godzin) stężenia sodu
i potasu w surowicy oraz stanu równo-
wagi kwasowo-zasadowej organizmu.
Głównym celem terapii płynami jest przy-
wrócenie stanu równowagi wodno-elek-
trolitowej organizmu. Po początkowych
czterech do sześciu godzinach terapii,
gdy stężenie sodu w surowicy wynosi od
140 do 155 mmol/L, 0,9% chlorek sodu
należy zastąpić roztworem Ringera, który
zawiera mniej sodu niż izotoniczny NaCl.
Jeżeli stężenie sodu w surowicy pozostaje
poniżej 140 mmol/L, pacjentowi należy
nadal podawać roztwór izotoniczny soli
kuchennej. Jeżeli stężenie sodu w suro-
wicy jest wyższe niż 155 mmol/L, należy
podać 0,45% chlorek sodowy (3, 7, 10).
Początkowa objętość i dawkowanie
płynów określa się szacując poziom
wstrząsu, odwodnienia i zapotrzebowań
pacjenta. Kolejnymi istotnymi czynnika-
mi są masa ciała pacjenta i występowanie
lub nie chorób serca. Typowy pies czy kot
z CKK jest odwodniony w 6 do 12%. Po-
dawanie płynów powinno zapewnić stop-
niowe uzupełnienie wszystkich deficytów
w okresie od 24 do 48 godzin. Gwałtowne
uzupełnienie płynów jest rzadko zalecane,
chyba że pies lub kot znajduje się w sta-
nie szoku (wstrząsu). Po wyjściu z tej
krytycznej fazy uzupełnianie płynów na-
leży zmniejszyć, tak aby wyrównać braki
równowagi w sposób powolny i równo-
mierny. Po skorygowaniu niedoborów
płynów należy rozpocząć podawanie
dawki podtrzymującej (zachowawczej)
– od 40 do 60 ml/kg/dobę. Należy do-
konywać częstej oceny zapotrzebowania
na płyny i dostosowywać dawkowanie
do zmian zachodzących w ilości moczu
wydalanego (w celu monitorowania ilości
wytwarzanego moczu zakładamy cewnik
do pęcherza moczowego) w jednostce
czasu, nasileniu i częstotliwości wymio-
tów oraz biegunki (3, 7, 10).
U
ZUPEŁNIANIE
POTASU
Podczas rozwoju CKK stężenie potasu
w surowicy zmienia się nieznacznie,
ponieważ straty nerkowe są uzupełnia-
ne z przestrzeni wewnątrzkomórkowej
organizmu, przede wszystkim z mięśni.
Kwasica metaboliczna, brak insuliny i hi-
potoniczność surowicy powodują prze-
chodzenie kationu potasowego do krwi
z komórek. Ponieważ 98% całkowitej
zawartości potasu w organizmie znajduje
się w przestrzeni wewnątrzkomórkowej,
jego duże ilości mogą ulec przesunięciu
do przestrzeni naczyniowej. Większość
psów z CKK początkowo wykazuje nor-
malne lub zmniejszone stężenie potasu.
U poszczególnych pacjentów może ono
być niskie, normalne lub podwyższone,
w zależności od czasu trwania choroby,
czynności nerek i wcześniejszego odży-
wiania. Określenie stężenia potasu w su-
rowicy ma fundamentalne znaczenie. Te-
rapia insulinowa i dwuwęglanowa może
powodować przesunięcie potasu z osocza
do przestrzeni wewnątrzkomórkowej.
Psy i koty z CKK i hipokaliemią wyma-
gają intensywnej terapii uzupełniającej
potas, celem wyrównania niedoborów
i zapobieżenia pogłębiania się hipokalie-
mii po podjęciu leczenia insuliną.
Psy i koty z normalnym stężeniem
potasu w surowicy również wymagają
natychmiastowego uzupełnienia potasu
– infuzja
0,9% chlorek sodowego,
ale
w tym przypadku początkowe dawki po-
tasu powinny być niższe (pozim K w su-
rowicy 3,0-3,5 mmol/L – dodatek K+ 5
– 7 mmol/L do 250 ml 0,9% NaCL).
Ostra
kwasica lub niewydolność nerek mogą
doprowadzić do hiperkaliemii. U takich
psów i kotów należy wstrzymać uzupeł-
nianie potasu dopóki nie przywróci się
przesączania kłębkowego i nie opanuje
hiperkaliemii (3).
Ponieważ nieprawidłowości doty-
czące poziomu potasu w surowicy są
powszechne zarówno przed terapią, jak
i w czasie jej trwania, zaleca się wyko-
nanie elektrokardiogramu. Jeżeli udało
się wykonać badanie EKG i określić
zawartość potasu w surowicy przed pod-
jęciem leczenia, to jest to ważny pośredni
wskaźnik monitorowania poziomu
potasu podczas terapii. Idealnie byłoby
kontrolować poziom potasu w surowicy
co dwie do czterech godzin. Jednakże czę-
sto nie ma takiej możliwości, ze względu
na niedostępność sprzętu laboratoryj-
nego niezbędnego do przeprowadzenia
tego typu testów. A jeśli nawet istnieje
taka możliwość, stałe monitorowanie
poziomu elektrolitów w surowicy może
okazać się niezwykle kosztowne. Z tych
powodów monitorowanie EKG można
uznać za bezpieczną, niedrogą i względ-
nie wiarygodną technikę, pozwalającą
wykryć niepokojące zmiany w stężeniu
potasu w surowicy (7, 10, 14).
U
ZUPEŁNIANIE
FOSFORANÓW
Ostatnio wiele uwagi poświęca się
stężeniu fosforu u ludzi cierpiących na
CKK. Podobnie jak potas, także fosfor
ulega przesunięciu z tkanek (włączywszy
kości) do przestrzeni pozakomórkowej
podczas CKK. W konsekwencji u pacjen-
tów rzadko rozwija się hipofosfatemia,
mimo że mają oni poważny ogólnoustro-

10
HOROBY WEWNĘTRZNE
C
WETERYNARIA
W PRAKTYCE
MARZEC-KWIECIEŃ • 2/2005
jowy niedobór fosforu, spowodowany
nadmierną jego utratą nerkową. Stężenie
fosforu u pacjentów z nie leczoną CKK
jest zazwyczaj normalne lub podwyższo-
ne. Jednakże jego stężenie w surowicy
właściwie zawsze spada stopniowo po
podjęciu leczenia, nawet do niezmiernie
niskiego poziomu, w ciągu 12 do 24 go-
dzin (3, 12, 14).
Zalecaną dawką przy uzupełnianiu
fosforanu u psów jest 0,01 do 0,03
mmol fosforanu na kg/mc. na godzinę
przez trzy do sześciu godzin, po którym
to czasie należy ponownie sprawdzić
stężenie fosforu we krwi. Fosfor jest
zazwyczaj uzupełniany poprzez poda-
wanie roztworu fosforanu potasu, naj-
lepiej w roztworze bezwapniowym (np.
roztwór fizjologiczny). Ogólnie dostępny
roztwór fosfor potasu do stosowania
pozajelitowego zawiera 224 mg KH
2
PO
4
i 236 mg K
2
HPO
4
na ml, dostarczając
4,4 mmol potasu i 3,0 mmol fosforanu
na mililitr. Niekorzystne skutki nad-
miernego podawania fosforanu obej-
mują jatrogenną hipokalcemię (nadmiar
wapnia we krwi) wraz z towarzyszącymi
jej objawami nerwowo-mięśniowymi,
hipernatremię (nadmiar sodu we krwi)
i niedociśnienie. Uzupełnianie fosforu
nie jest wskazane u psów z hiperkalce-
mią, hiperfosfatemią skąpomoczem lub
podejrzeniem martwicy tkanek.
U
ZUPEŁNIANIE
GLUKOZY
Początkowe stężenie glukozy we krwi
pozwoli określić, przynajmniej po części,
czy konieczne jest podanie płynów zawie-
rających glukozę. Nie powinno się do-
puszczać do spadku stężenia glukozy we
krwi poniżej 200 mg/dl podczas wstęp-
nych 24 do 48 godzin terapii. Łagodna
hiperglikemia pozwoli utrzymać diurezę
osmotyczną wspomagającą korektę azo-
temii i CKK. Jeżeli początkowe stężenie
glukozy we krwi zbliża się do 300 mg/dl,
konieczne będzie podanie płynu zawie-
rającego glukozę wkrótce po rozpoczęciu
terapii płynami i insuliną. Jednakże jeśli
początkowe stężenie glukozy we krwi
wynosi powyżej 700 mg/dl, nie będzie
potrzeby podawania płynów zawierają-
cych glukozę przez kilka godzin. Istotne
jest częste (cogodzinne) kontrolowanie
poziomu glukozy we krwi u wszystkich
pacjentów ze znacznie podwyższonym jej
stężeniem, celem zapewnienia powolne-
go, lecz równomiernego jej spadku. Zbyt
gwałtowny spadek poziomu glukozy we
krwi może doprowadzić do obrzęku mó-
zgu i hipoglikemii (3, 7, 10, 12).
Nagłe spadki stężenia glukozy we
krwi obserwowane podczas początko-
wych etapów terapii można przypisać,
przynajmniej częściowo, podaniu 0,9%
chlorku sodowego w formie wlewów,
które mogą prowadzić do wzrostu tempa
przesączania kłębkowego, zwiększonej
częstotliwości wydalania glukozy oraz
spadku stężenia glukozy we krwi, nieza-
leżnie od podawania insuliny. Gwałtowny
spadek stężenia glukozy we krwi u tych
zwierząt może wymagać rozpoczęcia
podawania płynów zawierających glukozę
wcześniej niż przewidywano (12).
L
ECZENIE
CKK
WODOROWĘGLANAMI
Terapia skierowana na wyrównanie
kwasicy ketonowej jest źródłem licznych
kontrowersji. Obiekcje dotyczące lecze-
nia dwuwęglanami są następujące:
a) terapia alkaliami (silnymi zasadami)
może prowadzić do zasadowicy me-
tabolicznej, która jest potencjalnie
równie poważnym zagrożeniem jak
kwasica metaboliczna,
b) wszelka alkalizacja może spowodować
przesunięcie w lewo krzywej dysocjacji
tlenu, tym samym ograniczając dopływ
tlenu do tkanek,
c) nagłemu podwyższeniu tętniczego pH
może towarzyszyć nadmierny spadek
pH płynu mózgowo-rdzeniowego, pro-
wadzący do pogorszenia funkcjonowa-
nia ośrodkowego układu nerwowego,
d) alkalizacja prowadzi do zwiększenia
częstości występowania hipokaliemii
Niektórzy autorzy uważają, że para-
doksalny spadek pH płynu mózgowo-
-rdzeniowego po leczeniu dwuwęglanami
stanowi powód do poważnego niepokoju,
gdy tymczasem inni uważają, że tak nie
jest. Jeżeli taki przypadek ma miejsce,
jest to spowodowane tym, że dwutle-
nek węgla gwałtownie dyfunduje przez
barierę krew – mózg, podczas gdy jony
wodorowe i dwuwęglan przemieszczają
się powoli przez tę barierę. Jeżeli na-
tychmiast wyrównamy kwasicę metabo-
liczną terapią dwuwęglanową, wzrośnie
stężenie dwutlenku węgla w surowicy.
Większość tego dwutlenku węgla może
zostać usunięta przez płuca (hiperwenty-
lacja), ale znaczne jego ilości także będą
dyfundować przez barierę krew – mózg,
co może powodować wzrost stężenia
jonów wodorowych w płynie mózgowo-
-rdzeniowym i obniżenie pH w obrębie
ośrodkowego układu nerwowego, prowa-
dząc do pogłębienia kwasicy (2, 3, 14).
Stopień zahamowania czynności
ośrodkowego układu nerwowego, wy-
wołany przez kwasicę metaboliczną,
zależy przede wszystkim od pH płynu
mózgowo-rdzeniowego, a nie pH krąże-
nia obwodowego. Pies czy kot z objawami
CKK w stanie czujności (czynność beta
w EKG), z bardzo obniżonym pH ob-
wodowym będzie miał prawdopodobnie
normalne lub prawie normalne pH
płynu mózgowo-rdzeniowego. Jednak
u zwierząt w stanie głęboko depresyjnym
(zahamowanie czynności ośrodkowego
układu ner wowego) może wystąpić
daleko zaawansowana (nie wyrównana)
kwasica ośrodkowego układu nerwowe-
go. Leczenie takich pacjentów jest trudne,
a jedyną bezpieczną terapią jest powolne
skorygowanie kwasicy metabolicznej
w krążeniu obwodowym, z uniknięciem
większych zmian w pH płynu mózgowo-
-rdzeniowego (9).
Pomimo tych argumentów, szkodliwe
skutki ciężkiej, nie leczonej acydemii
dalece przewyższają negatywne aspekty
terapii dwuwęglanowej. Kiedy pH krwi
spada poniżej 7,2, a zwłaszcza poniżej
7,1, wywołuje to poważne konsekwencje:
brak wiązania insuliny do receptorów,
znaczące obniżenie pojemności minu-
towej serca, zwężenie płucnego łożyska
tętniczego, arytmie, możliwość zapaści
naczyniowej obwodowej, znaczące roz-
szerzenie łożyska mózgowo-naczynio-
wego prowadzące do wzrostu ciśnienia
płynu mózgowo-rdzeniowego i śpiączki,
zwężenie naczyń nerkowych i krezko-
wych, predysponujące pacjenta do ostrej
martwicy kanalików nerkowych i choro-
by niedokrwiennej jelit oraz obniżenie
zdolności buforowej organizmu. Ten
ostatni czynnik jest głównym źródłem
niepokoju u psów i kotów chorujących
na CKK z ciężką kwasicą, ponieważ
nawet małe zmiany w pCO
2
lub stężeniu
dwuwęglanów w surowicy mogą wywo-
łać zagrażające życiu zmiany w pH krwi.
Niska zdolność buforowa u pacjenta
z nierozpoznaną i nie leczoną CKK lub
kwasicą mleczanową może prowadzić do
ciężkiej acydemii i nieodwracalnej zapa-
ści sercowo-naczyniowej (7, 9, 10).
Kwas acetylooctowy i kwas
b-hydrok-
symasłowy są przydatnymi anionami,
a 1 mmol dwuwęglanu jest generowany
z każdego 1 mmola zmetabolizowanego
kwasu ketonowego. Ponadto, terapia in-
sulinowa dramatycznie zmniejsza wytwa-
rzanie kwasów ketonowych, przywracając
normalną wartość stężenia dwuwęglanu
w surowicy, bez stosowania roztworów
zawierających alkalia. Z tych powodów
większość autorów zaleca, aby zwierząt,
u których poziom dwuwęglanów w su-
rowicy wynosi 12-15 mmol/L lub więcej,
nie leczyć dwuwęglanami.
Kiedy stężenie dwuwęglanów w osoczu
wynosi 11 mmol/L lub mniej dwuwę-
glany należy podawać podczas pierw-
szych sześciu godzin leczenia. Niedobór
dwuwęglanów (tj. mmol dwuwęglanów
potrzebny w początkowej fazie, aby
skorygować kwasicę do krytycznego
poziomu 12 mmol/L w ciągu sześciu go-

12
HOROBY WEWNĘTRZNE
C
WETERYNARIA
W PRAKTYCE
MARZEC-KWIECIEŃ • 2/2005
dzin) obliczamy jako mmol dwuwęglanu
= masa ciała (kg) x 0,4 x (12-dwuwęglan
pacjenta) x 0,5.
M
ONITOROWANIE
PACJENTA
Konieczne jest monitorowanie dawko-
wania płynów oraz wpływu ich podawa-
nia na pacjenta. Nadmierna terapia pły-
nami może doprowadzić do przeciążenia
nimi ustroju, obrzęku płucnego i innych
potencjalnie groźnych konsekwencji.
Niewłaściwe podawanie płynów może
prowadzić do przedłużonej niedostatecz-
nej perfuzji tkanek, niedotlenienia narzą-
dów i tkanek, uporczywej przednerkowej
azotemii oraz ewentualności rozwinię-
cia się pierwotnej niewydolności nerek.
Ocena terapii płynami powinna zawierać
elementy subiektywne i obiektywne. Jeśli
chodzi o elementy subiektywne, należy
monitorować czynność beta w zapisie
EKG pacjenta, częstość akcji serca, wil-
gotność błon śluzowych, czas wypełnie-
nia włośniczki (capillary refill time), tętno
i elastyczność skóry. Wśród elementów
obiektywnych powinno się uwzględnić:
ilość moczu wydalanego w jednostce
czasu i pomiar masy ciała. Chociaż po-
winno się przeprowadzić osłuchanie
płuc i serca, jednak te sposoby badania
nie są skutecznymi metodami monito-
rowania postępów leczenia płynami. Je-
żeli podczas osłuchiwania płuc badania
stwierdzamy objawy obrzęku płuc, ozna-
cza to, że terapia płynami prowadzona
była zbyt agresywnie i jest to wskazanie
do natychmiastowego jej zaprzestania
(1, 12, 14).
Dokładne określenie ilości moczu
wydalanego w jednostce czasu jest nie-
zwykle ważne u psów i kotów cierpiących
na kwasicę ketonową. Powodowana przez
cukrzycę mikroangiopatia kłębuszkowa
i skutki hemodynamiczne CKK, współ-
istniejące zapalenie trzustki powodujące
martwicę lub przedłużające się poważ-
ne odwodnienie mogą prowadzić do
skąpomoczowej bądź bezmoczowej
niewydolności nerek. Brak wytwarzania
moczu w ciągu kilku godzin od rozpo-
częcia leczenia płynami jest sygnałem
alarmowym, wymagającym natychmia-
stowego rozpoznania przyczyn i podjęcia
stosownych działań. Ponieważ jest to
dość powszechny problem, wszyscy
pacjenci z zaawansowaną CKK powinni
mieć założony cewnik, połączony z sys-
temem zamkniętym. Częste i dokładne
monitorowanie wytwarzania moczu jest
absolutną koniecznością. Po wstępnej
fazie terapii płynami pacjent powinien
wytwarzać minimum 1,0 do 2,0 ml moczu
/kg mc. na godzinę (9, 16).
Jeśli mocz nie jest produkowany lub
częstość wypływu jest minimalna, naj-
pierw należy upewnić się, czy cewnik
znajduje się w pęcherzu. Następnym py-
taniem wymagającym odpowiedzi jest to,
czy podana ilość 0,9% chlorku sodowego
była wystarczająca do przywrócenia od-
powiedniego ciśnienia krwi, koniecznego
do perfuzji nerek. Jeśli uważamy, że po-
dawana objętość płynów jest odpowied-
nia, a bezmocz lub skąpomocz nadal się
utrzymują, można podjąć próbę wywoła-
nia lub zwiększenia wytwarzania moczu
przez zastosowanie środków moczopęd-
nych (np. furosemidu lub dopaminy).
Dopamina jest użyteczna jako środek
rozszerzający naczynia w nerkach i mo-
że współdziałać z furosemidem. Należy
rozcieńczyć ją w wodnym roztworze soli
lub w roztworze Ringera, nie należy do-
dawać jej do roztworów zawierających
dwuwęglan sodu. Jeśli wytwarzanie
moczu nie zwiększy się w ciągu dwóch
do trzech godzin, można zwiększyć jej
dawkę. Pojawienie się tachykardii lub
arytmii wskazuje, że zastosowana dawka
jest zbyt wysoka i należy ją zmniejszyć.
Jeśli pojawi się znaczna diureza, wlew
dopaminy należy powoli zmniejszyć
w ciągu 6 do 12 godzin, aż do utrzyma-
nia wytwarzania moczu wyłącznie za
pomocą terapii płynami. Jeśli ten sposób
leczenia zawiedzie, jedyną alternatywą
jest dializa otrzewnowa lub hemodiali-
za (1, 3, 7, 10).
Infekcje dróg moczowych są bardzo czę-
ste przy stosowaniu cewników założonych
na stałe. Znakomitą większość infekcji
jatrogennych można skutecznie wyleczyć
przy pomocy odpowiednio dobranych
antybiotyków, po usunięciu cewnika.
Badanie palpacyjne pęcherza nie jest
dokładną metodą w ocenie ilości moczu
wydalanego w jednostce czasu, zwłaszcza
u psów otyłych, z bólami brzucha czy
małych psów, które normalnie wytwarzają
niewielkie ilości moczu (1, 4).
Piśmiennictwo
1. Brain P.M.: Urinary tract candidiasis in
a diabetic dog, Austr. Vet. Practicioner,
23, 1993, 90-91.
2. Church D.: Treating the Complicated
Diabetic Patient, World Small Animal
Veterinary Association 26th World Con-
gress Proceedings, 2001.
3. Daminet S.: Canine and Feline Diabetes
Mellitus, World Small Animal Veterinary
Association 28
th
World Congress Proce-
edings, 2003.
4. Diehl K.J.: Long-term complication of dia-
betes mellitus. Part II: Gastrointestinal and
infectious, Vet. Clin. North. Amer. Small
Animal Practice, 25, 1995, 731-751.
5. Ford S.L, Nelson R.W., Feldman E.C.,
Niwa D.: Insulin resistance in three dogs
with hypothyreoidism and diabetes mel-
litus, J. Amer. Vet. Med. Assoc., 202, 1993,
1478-1480.
6. Greco D.S., Broussard J.D., Peterson M.E.:
Insulin therapy. Vet. Clin. North. Amer.
Small Animal Practice, 25, 1995, 677-689.
7. Hoenig M., Ferguson D.C.: Diabetes
mellitus in the dog and cat, Comp. Anim.
Pract., 19, 1989, 12-16.
8. Ihle S.L, Nelson R.W.: Insulin resistance
and diabetes mellitus, Comp. Cont. Edu-
cation, 13, 1991, 197-205.
9. Kokot F., Gospodarka wodno-elektrolitowa
i kwasowo-zasadowa w stanach fizjologii
i patologii, Wydawnictwa Lekarskie 1993.
10. Lechowski R., Cukrzyca psów i kotów,
Wydawnictwo SGGW 1997.
11. Leroy J.: Le diabete sucre chez les car-
nivores domestiques, Prect. Med. Chir.
Amin. Comp. 29, 1994, 227-243.
12. Miller E.: Long-term monitoring of the
diabetic dog an cat: clinical signs, serial
blood glucose determinations, urine glu-
cose, and glycated blood parameters, Vet.
Clin North. Amer. Small Animal Practice,
25, 1995, 571-584.
13. Munana K.R.: Long-term complication of
diabetes mellitus. Part I: Retinopathy, neph-
ropathy, neuropathy, Vet. Clin, North. Amer.
Small Animal Practice, 25, 1995, 715-730.
14. Nelson R.W.: Techniques for Monitoring
Diabetes Mellitus in Dogs and Cats, World
Small Animal Veterinary Association
28 World Congress Proceedings, 2003.
15. Nelson R.W., Lewis L.D.: Nutritional
management of diabetes mellitus, Semi-
nar in Veterinary Medicine and Surgery
Small Animal, 5, 1990, 178-186.
16. Nichols R., Crenshaw K.L.: Complica-
tions and cocncuren disease associated
with diabetic ketoacidosis and other se-
vere forms of diabetes mellitus, Vet. Clin.
North. Amer. Small Animal Practice, 25,
1995, 617-624.
17. Peterson M.E.: Diagnosis and manage-
ment of insulin resistance in dogs and
cats with diabetes mellitus, Vet. Clin.
North. Amer. Small Animal Practice, 25,
1995, 691-713.
18. Plotnicka. N., Greco D.S.: Diagnosis of
diabetes mellitus in dogs and cats. Contrast
and comparisons, Vet. Clin. North. Amer.
Small Animal Practice, 25, 1995, 563-570.
19. Reusch C.E.: Experiences with Blood
Glucose Home Monitoring by Owners
of Diabetic Dogs and Cats, World Small
Animal Veterinary Association 27 World
Congress Proceedings 2002.
prof. dr hab. Andrzej Depta
Zespół Diagnostyki Klinicznej
Katedra Nauk Klinicznych,
Wydział Medycyny Weterynaryjnej
UWM w Olsztynie,
10-718 Olsztyn, ul. Oczapowskiego 14
e-mail: depta@uwm.edu.pl
Wyszukiwarka
Podobne podstrony:
Cukrzyca u psów i kotów diagnostyka i możliwości terapii
cukrzyca psów i kotów
cukrzycowa kwasica ketonowa, studia pielęgniarstwo
Kwasica ketonowa u dziec i i młodzieży z cukrzycą typu I
Zakażenia wirusowe układu nerwowego psów i kotów
PYTANIA Z INTERNY PSÓW I KOTÓW – CZERWIEC 12 r
odmiedniczkowe zapalenie nerek psów i kotów
dializa otrzewnowa u psów i kotów, Psy i koty
ENDOSKOPIA Laryngotracheobronchoskopia psów i kotów uwagi
Krwawienia z przewodu pokarmowego u psów i kotów
pytania stoma 2012, Weterynaria, ROK V, Choroby Psów i Kotów, Chirurgia, Stomatologia
Egzamin rozród psów i kotów 13
Cukrzyca u psów
Egzamin rozród psów i kotów 13 (częściowo rozwiązany)
Mikroflora przewodu pokarmowego i probiotyki stosowane u psów i kotów
Okulistyka psów i kotów 22.10.2014, weterynaria, 5 rok semestr 2, prewencja wet
więcej podobnych podstron