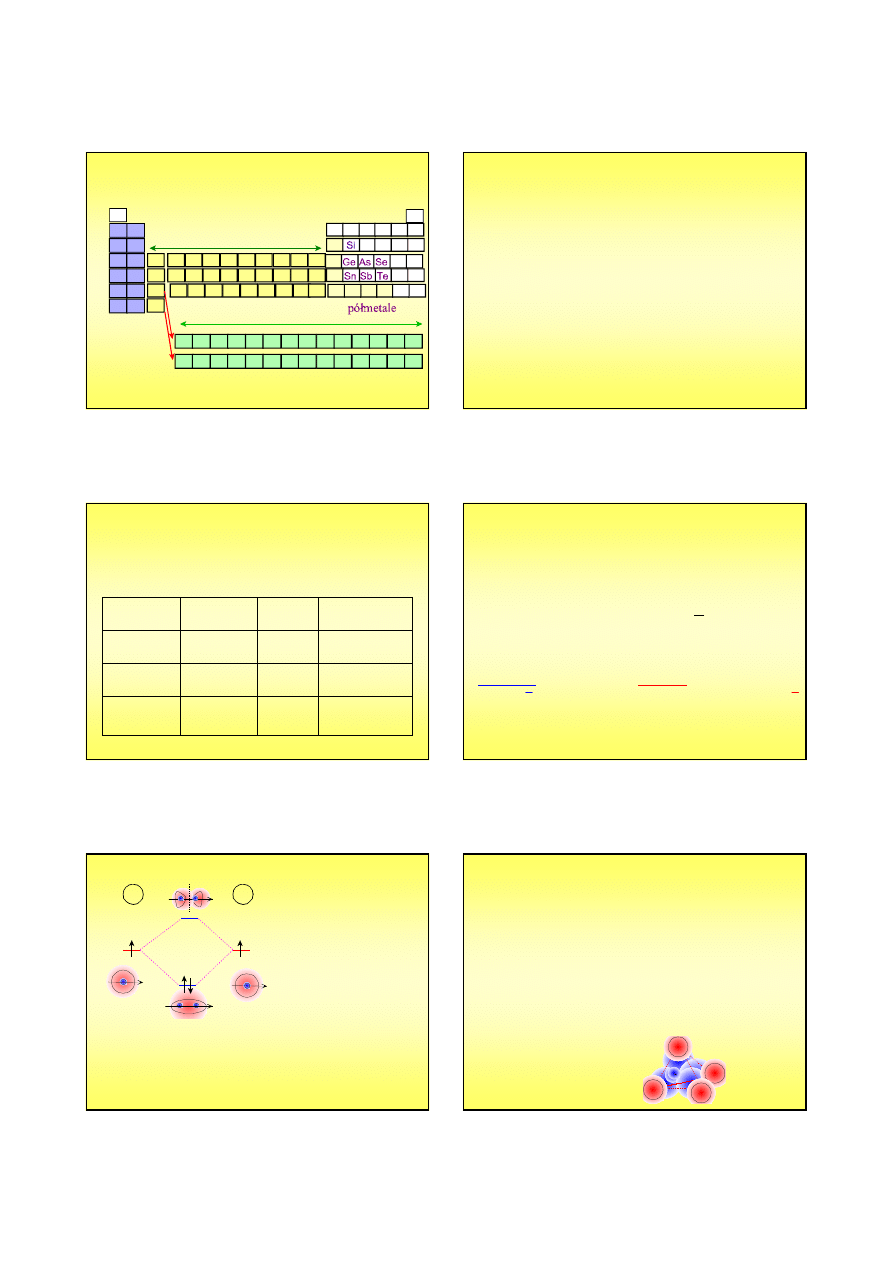
Chemia nieorganiczna
H
He
Li Be
B
B
Ne
C N O
F
Na Mg
Al
Ar
P
S Cl
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn
Ga
Kr
Br
Rb Sr
Y
Zr Nb Mo
Tc
Ru Rh Pd Ag Cd
Tl
Rn
Pb Bi Po
At
La
Hf Ta W Re Os Ir Pt Au Hg
Ce Pr
Cs Ba
In
Xe
I
Ac
Fr Ra
Nd
Pm
Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U
Np Pu Am Cm
Cf Es Fm Md No Lr
Bk
1
3
2
4
6
5
7
metale
niemetale
metale
metale
Chemia nieorganiczna (2)
Wodór
Niemetale, ich własności i najważniejsze
połączenia - pierwiastki grup 13 -18 (IIIA-VIIIA)
Metale, ich własności i najważniejsze połączenia
- pierwiastki grup 1-12 (IA-IIA oraz IB-VIIIB)
Motywem przewodnim wykładów w semestrze
letnim pozostaje wiązanie chemiczne - a przede
wszystkim przypadki
typowe
(jedna strona medalu)
i
wyjątkowe
(druga strona medalu) ...
Konsekwentnie też będziemy stosować teorię
orbitali molekularnych ...
WODÓR
۞
Jest najbardziej rozpowszechnionym
pierwiastkiem we Wszechświecie:
۞
... 91 % wszystkich atomów to atomy wodoru
ok.10
-16
%
β
-
- 12,4 lat
~3 u
tryt
ok.1,6 10
-2
%
~2 u
deuter
~1 u
prot
Zawartość
Masa
Nazwa
Izotop
H
1
1
H(D)
2
1
H(T)
3
1
Otrzymywanie wodoru
Konwersja metanu:
2
2
C
750
2
4
3H
CO
O
2H
CH
+
→
+
o
Działanie wody lub kwasów na metale:
↑
+
→
+
2
2
1
2
H
NaOH
O
H
Na
↑
+
→
+
+
+
2
2
H
Zn
2H
Zn
Elektroliza wody:
−
+
↑
→
+
2OH
H
2
O
2H
2
2
e
KATODA
e
4
4H
O
O
2H
2
2
+
+
↑
→
+
ANODA
Także elektroliza wodnych roztworów KOH, NaOH,
H
2
SO
4
, NaCl ...
Właściwości wodoru
1s
H
+
x
1s
H
+
x
+
x
F
1s
-
+
x
F
*
1s
H
- 1s
1
H
2
- σ
1s
2
Energia wiązania
434 kJ·mol
-1
H
2
- w warunkach normalnych gaz,
T
wrz
= 20,4 K
,
T
topn
= 13,9 K
Chemia wodoru
Elektroujemność wodoru - 2,2
1. Utrata elektronu:
r
H
≈≈≈≈
10 pm
H
→
H
+
+ e
r
H+
≈≈≈≈
10
-4
pm
Konfiguracja jonu
1s
0
, energia jonizacji
I = 13,6 eV
2. Przyjęcie elektronu:
H + e
→
H
-
r
H-
= 145 pm
Konfiguracja jonu
1s
2
, powinowactwo elektronowe
A=0,7 eV
3. Utworzenie wiązań
kowalencyjnych:
Cząsteczka metanu
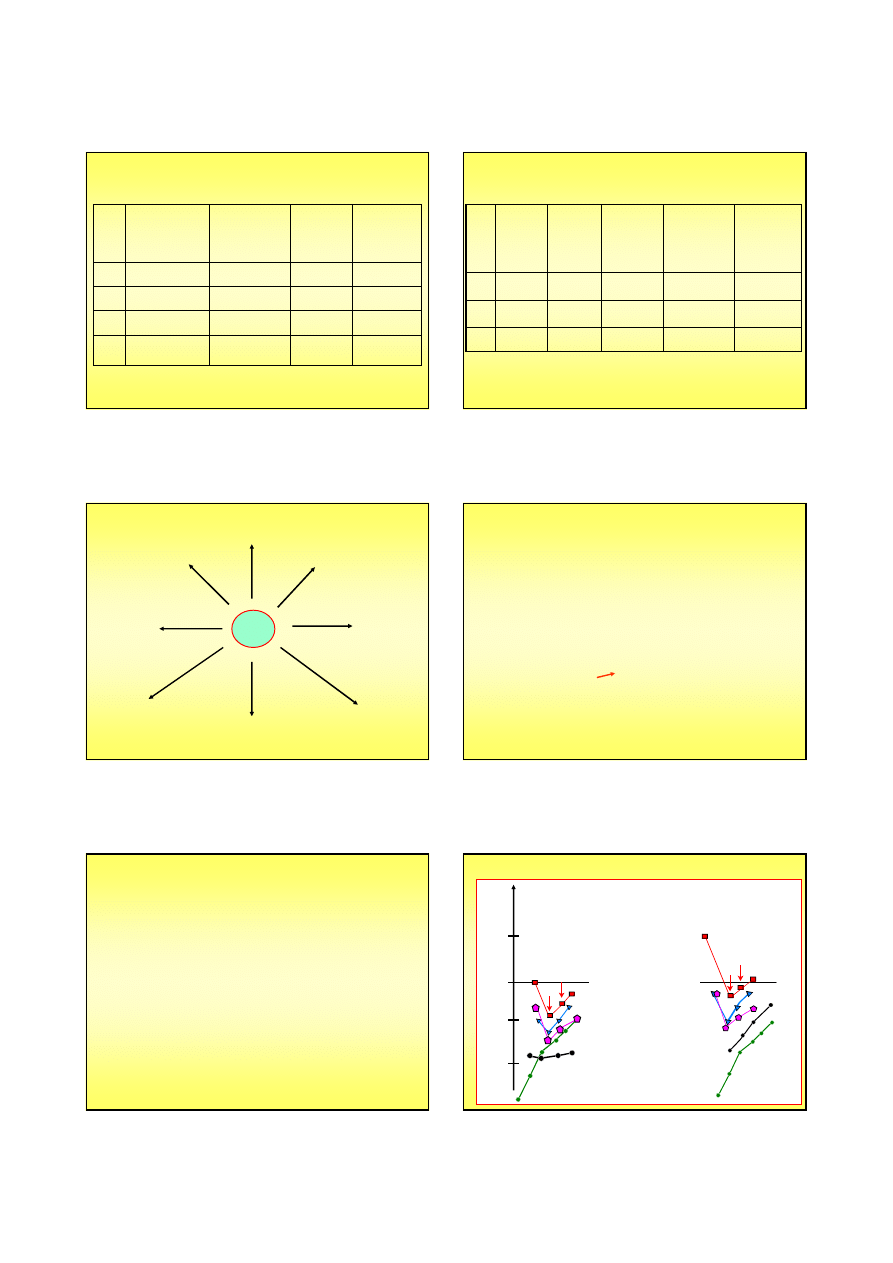
Skład izotopowy wodoru a właściwości
H
2
HD
D
2
T
2
Temperatura
topnienia
[K]
Temperatura
wrzenia
[K]
Ciepło
topnienia
[J
@
mol
-1
]
Ciepło
dysocjacji
[kJ
@
mol
-1
]
13,95
20,38
117
435,93
16,60
22,13
155
18,73
23,57
217
443,35
20,62
25,04
445,85
Skład izotopowy wodoru a właściwości wody
H
2
O
D
2
O
T
2
O
Temp.
topn.
[K]
G
ę
sto
ść
w 298 K
[g
@
cm
-3
]
Ciepło
parowania
[kJ
@
mol
-1
]
Temp.
wrz.
[K]
Iloczyn
jonowy
298 K
273,15 373,15 0,99701
40,66
1
@
10
-14
276,97 374,57
1,1044
41,67
0,16
@
10
-14
277,44 374,66
1,2138
Reakcje wodoru
H
2
O
2
H
2
O
X
2
,
flu
or
ow
ce
HX
N
2
,
ka
ta
liz
ato
r
NH
3
metale
1 i 2 grupy
wodorki
typu soli
pozostałe
metale
wodorki
metaliczne
tle
ne
k
m
eta
lu
,
og
rz
ew
an
ie
metal
CO
CH
3
OH, C
m
H
n
zależnie od warunków
C
n
H
2n
w
ęglo
wo
do
ry
nie
na
syc
on
e
C
n
H
2n+2
węglowodory
nasycone
Wodorki - związki pierwiastków z wodorem
Klasyfikacja wodorków:
1. wodorki typu soli,
2. wodorki kowalencyjne,
3. wodorki metaliczne,
Wodorki typu soli
zawierają jon
H
-
- silną zasadę (stopień
utlenienia wodoru wynosi - I); tworzą je metale 1 i 2 grupy
u.o. oraz glin i lantanowce
2
1
2
1
OH
H
O
H
H
-
2
2
Z
K
K
Z
+
→
+
−
bardzo mocna zasada,
odbiera proton wodzie
↑
+
→
+
↑
+
→
+
2
2
3
2
2
H
NaNH
NH
NaH
H
NaOH
O
H
NaH
Wodorki kowalencyjne
Tworzą je pierwiastki z grup 13-17 układu
okresowego. Wiązania atomowe spolaryzowane
(wodór jest przeważnie ‘biegunem dodatnim’).
Węglowodory C, Si, Ge tworzą szeregi
homologiczne.
Stopień utlenienia wodoru +1
Występuje w nich
wiązanie wodorowe
100
0
-100
-200
T[ºC]
Temperatura
topnienia
Temperatura
wrzenia
Skutki występowania wiązania wodorowego
He
Ne
Ar
Kr
Xe
Rn
HF
HCl
HBr
HI
H
2
O
H
2
S
H
2
S e
H
2
T e
NH
3
PH
3
CH
4
He
Ne
Ar
Kr
Xe
Rn
HF
HCl
HBr
HI
H
2
O
H
2
S
H
2
S e
H
2
T e
NH
3
PH
3
CH
4
Własności
wodorków
niektórych
pierwiastków
niemetalicznych
odpowiadają
znacznie wyższej
masie
cząsteczkowej niż
wynika to z ich
wzoru
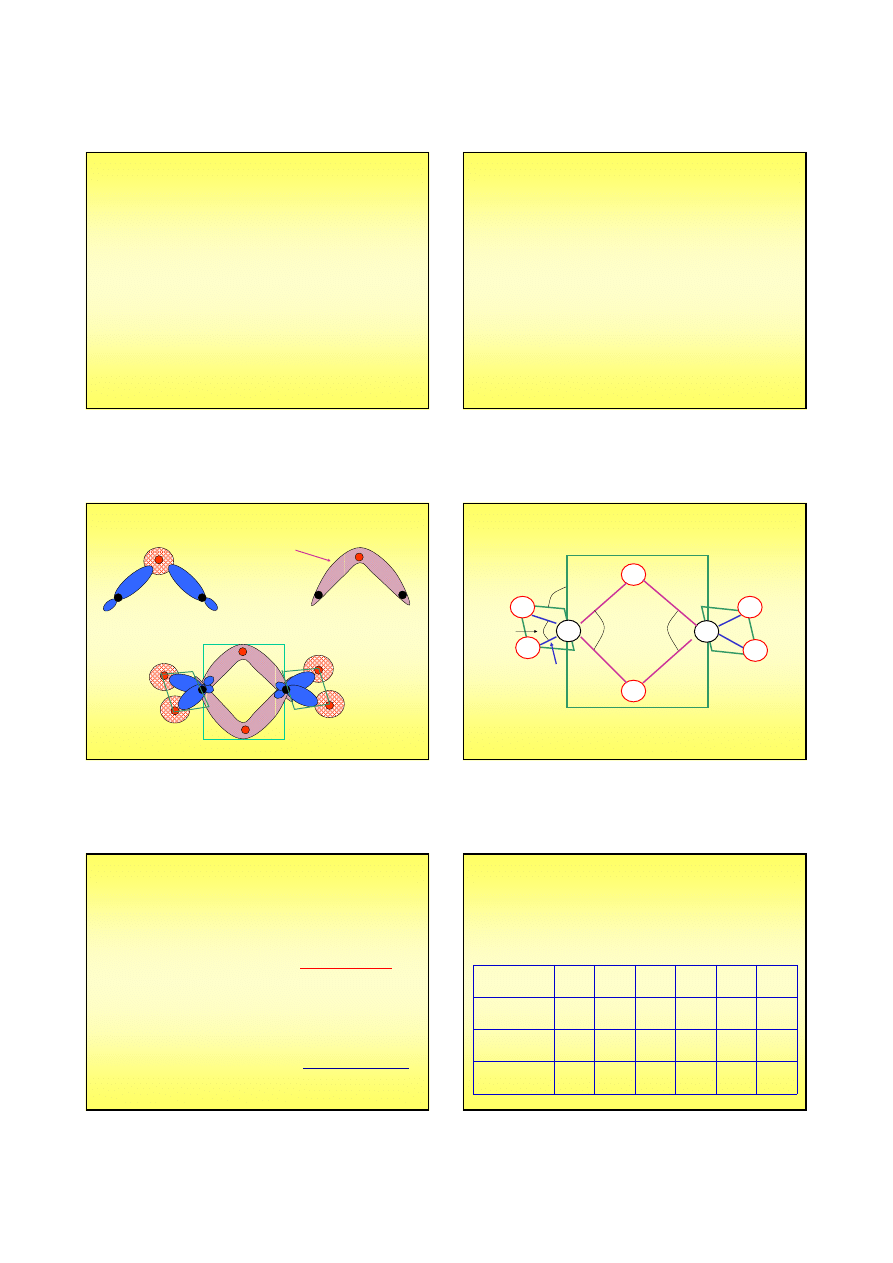
Wodorki metaliczne
Tworzą je metale grup przejściowych. Atomy
wodoru mieszczą się pomiędzy gęsto
upakowanymi atomami metalu. Często mają
skład o osobliwej stechiometrii ...
TiH
1,78
, VH
0,6
itd. Pd
2
H, PdH
0,6
Wiele pierwiastków przejściowych (metali)
pochłania wodór ...
Połączenia boru z wodorem
(coś wyjątkowego)
Borowodór o wzorze BH
3
- nie występuje
Znane są dwa szeregi homologiczne:
B
n
H
n+4
: B
2
H
6
, B
5
H
9
, B
6
H
10
, B
10
H
14
.....
B
n
H
n+6
B
4
H
10
, B
5
H
11
, B
9
H
15
.....
Bor ma tylko trzy elektrony (1s
2
2s
2
2p
1
), a
wodór tylko jeden ...
Wiązania w cząsteczce i jej niezwykły kształt
tłumaczy się hybrydyzacją sp
3
orbitali
atomów boru ...
Struktura cząsteczki B
2
H
6
B
B
H
B
B
H
B
B
H
H
H
H
H
H
orbital
trójcentrowy
zdelokalizowany
Struktura cząsteczki B
2
H
6
B
B
H
H
H
H
H
H
100
°°°°
133 pm
121,5
°°°°
119 pm
90
°°°°
Orbitale zlokalizowane i zdelokalizowane
♦
”Zwykłe” wiązanie chemiczne
opisujemy kombinacją
liniową dwóch orbitali atomowych. Efektem nakładania
się tych dwóch orbitali jest zwiększenie gęstości ładunku
pomiędzy jądrami (
σ
) lub powyżej i poniżej płaszczyzny
wiązania (
π
).
♦
Taki orbital molekularny nazywamy zlokalizowanym
.
♦
Aby opisać niektóre wiązania, musimy uwzględnić udział
w kombinacji liniowej orbitali
3 - lub więcej -
atomów).
♦
Efektem nakładanie się trzech (lub większej liczby)
orbitali atomowych jest orbital, w którym gęstość ładunku
rośnie w okolicy trzech (lub większej ilości) jąder. Może
on mieć charakter orbitalu
σ
lub
π
(najczęściej).
♦
Taki orbital molekularny nazywamy zdelokalizowanym
.
HELOWCE
o
Zwane tradycyjnie gazami szlachetnymi
o
Konfiguracja elektronowa w stanie podstawowym:
ns
2
np
6
o
Nie tworzą cząsteczek dwuatomowych i
potrafimy (?)
dowieść dlaczego ...
He
Ne
Ar
Kr
Xe
Rn
Temperatura
wrzenia [K]
4,2
27
87
120
166
211
Temperatura
topnienia [K]
0,9
24
84
116
161
202
Energia jonizacji
[MJ·mol
-1
]
2,37
2,08
1,52
1,35
1,17
1,04

Czy helowce tworzą zwiazki chemiczne ?
Helowce
- gazy szlachetne - mają
całkowicie zapełnioną
powłokę walencyjną
i nie tworzą w związku z tym
żadnych związków ... bo nie mogą (?)
Klatraty
są to kryształy zwiazków organicznych, np.
hydrochinonu, które w ‘pustych’ przestrzeniach
zawierają proste cząsteczki (np. H
2
S, HCl lub atomy
helowca). Nie są to
‘prawdziwe’ zwiazki chemiczne
(brak w nich wiązań), pomimo tego, że zawartość
helowca pozostaje często w stałym stosunku
‘stechiometrycznym’ (ilościowym) do matrycy ...
Związki chemiczne helowców ?
• PtF
6
jest związkiem silnie utleniającym, utlenia nawet
cząsteczkę tlenu (energia jonizacji
1,177 MJ · mol
-1
):
6
2
6
2
PtF
O
PtF
O
→
+
0
+VI
-1
+½
+V
-1
zwiazek jonowy
O
2
+
- kation
heksafluoroplatynian
dwuoksygenylu
6
6
XePtF
PtF
Xe
→
+
0
+VI
-1
+1
+V
-1
heksafluoroplatynian
ksenonu
czerwonopomarańczowy
związek jonowy
Neil Bartlett,
23.03.1962 !
Reakcje XePtF
6
Xe
]
Xe[PtF
2XePtF
2
6
430K
ogrzewanie
6
+
→
>
Ten związek ulega hydrolizie:
2
2
2
6
PtO
12HF
O
2Xe
O
H
2XePtF
+
+
+
→
+
Xe + nPtF
6
→
→
→
→
Xe[PtF
6
]
n
1
≤≤≤≤
n
≤≤≤≤
2
Xe + nRuF
6
→
→
→
→
Xe[RuF
6
]
n
Xe + nRhF
6
→
→
→
→
Xe[RhF
6
]
n
Fluorki ksenonu
2
K
670
2
XeF
F
Xe
→
←
+
4
2
2
XeF
F
XeF
→
←
+
6
2
4
XeF
F
XeF
→
←
+
Ksenon występuje w swoich związkach
na stopniach utlenienia od
+I
do
+VIII
Howard Claasen, John Malm i Henry Selig 1962:
Rudolf Hoppe, 1962:
Wiązania chemiczne w związkach ksenonu
Jak to w ogóle jest możliwe, że gaz szlachetny o
całkowicie
zapełnionej powłoce walencyjnej
tworzy wiązania chemiczne ?
Spróbujmy zastosować teorię orbitali
molekularnych ...
-
+
-
+
-
+
F
a
orbital 2p
x
fluoru a,
1 elektron
F
b
orbital 2p
x
fluoru b,
1 elektron
Xe
orbital 5p
x
ksenonu,
2 elektrony
x
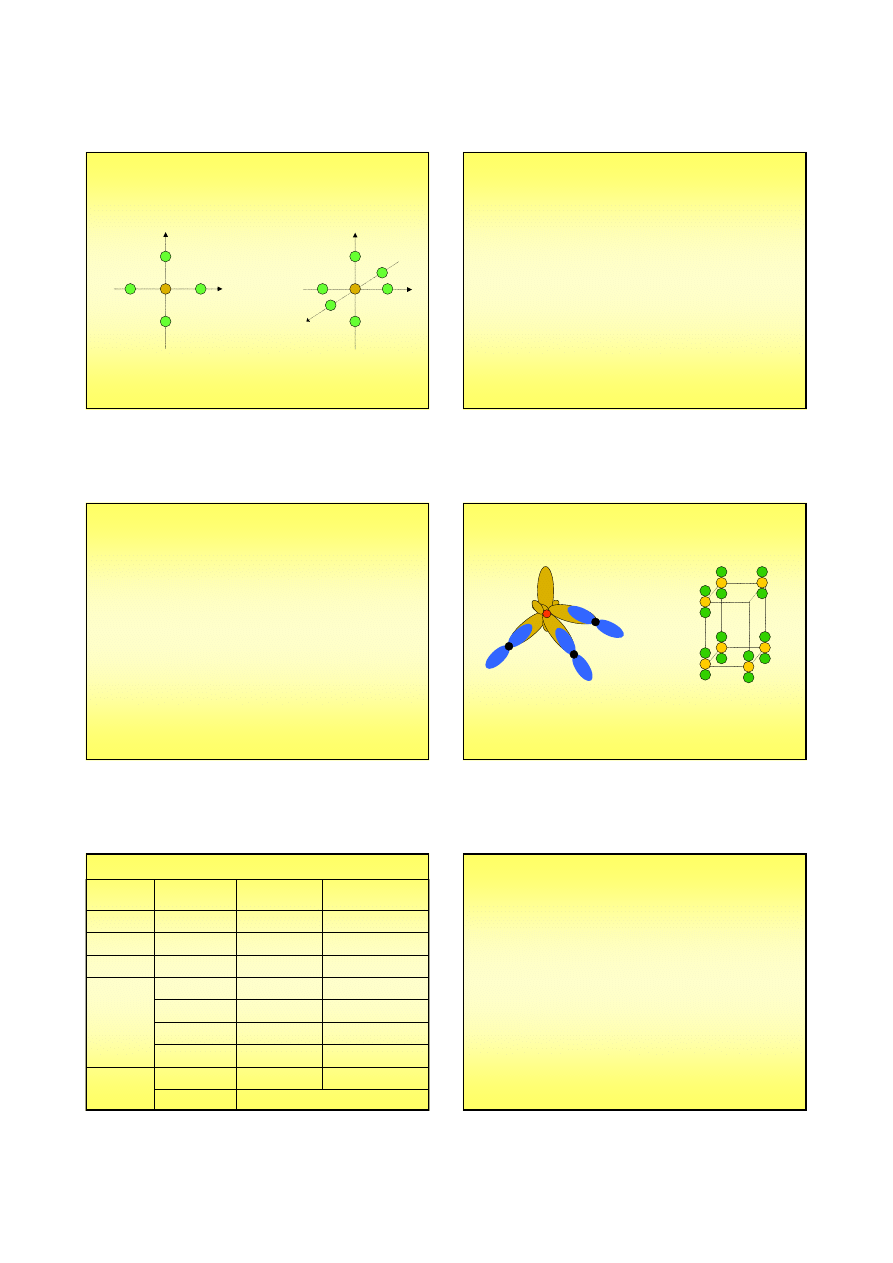
Orbitale cząsteczkowe w XeF
2
Xe
F
a
F
b
XeF
2
+
-
+
- -
+
+
-
+
-
-
+
-
+ -
+
orbital wiążący
orbital antywiążący
orbital niewiążący
x
F
Xe
F
x
z
y
Wiązania we fluorkach ksenonu
Cząsteczka
XeF
2
jest liniowa, choć nie zachodzi
hybrydyzacja sp orbitali atomu ksenonu ...
XeF
4,
kwadrat
dwa prostopadłe orbitale
zdelokalizowane
XeF
6
, oktaedr
trzy prostopadłe orbitale
zdelokalizowane
x
y
Reakcje fluorków ksenonu
−
+
+
→
+
2
5
6
HF
XeF
HF
XeF
7
6
CsXeF
XeF
CsF
→
+
↑↑↑↑
kwas
Lewisa
6
8
2
7
XeF
XeF
Cs
2CsXeF
+
→
związek
dość trwały
Hydroliza fluorków ksenonu
2HF
XeOF
O
H
XeF
4
2
6
+
→
+
4HF
F
XeO
O
H
2
XeF
2
2
2
6
+
→
+
6HF
XeO
O
H
3
XeF
3
2
6
+
→
+
XeO
3
- trójtlenek ksenonu ma własności
utleniające; ulega też dysproporcjonowaniu:
( )
O
H
O
Xe
XeO
Ba
OH
Ba
2
2XeO
2
2
6
2
2
3
+
+
+
↓
→
+
+VI
+VIII
0
0
Ksenonian (VIII) baru albo nadksenonian baru
Wiązania w związkach ksenonu
Cząsteczka XeO
3
,
hybrydyzacja sp
3
Kryształ XeF
2
typowy kryształ
molekularny
Xe
O
-
+
-
+
-
+
O
O
Chemia ksenonu – klasyfikacja związków
Stopień
utlenienia
Wzór
Postać
Struktura
+IV
XeF
4
kryst., bezb.
kwadrat
+I
XePtF
6
kryst.,
pom.
jonowy
+VI
XeF
6
kryst., bezb.
oktaedr, trwały
Cs
2
XeF
8
kryst.,
żółty
jonowy
XeO
2
F
2
bezbarwny
nietrwały
XeO
3
bezbarwny
piramida, wybuchowy
+VIII
XeO
4
bezbarwny
tetraedr,
wybuchowy
XeO
6
4-
aniony
HXeO
6
-3
, H
2
XeO
6
-2
, H
3
XeO
6
-
+II
XeF
2
kryst., bezb.
liniowa
Jeszcze o chemii helowców
♦
Obecnie znanych jest kilkaset związków ksenonu;
♦
Istnienie związków helowców przeczy ostatecznie
uprzywilejowanej „konfiguracji oktetu
elektronowego”;
♦
Innym helowcem, którego związek udało się otrzymać
jest krypton – KrF
2
(G.Pimentel, J.Turner 1963) ma
taką samą strukturę elektronową jak XeF
2
;
♦
KrF
4
– (A. Grosse ze współpr. 1963) – jak XeF
4
;
♦
Nie udało się – jak dotąd – otrzymać żadnego związku
pozostałych helowców
Wyszukiwarka
Podobne podstrony:
chemia lato 04 09 10
chemia lato 04 09 10
chemia lato 04 09 10
chemia lato 06 09 10
chemia lato 07 09 10
chemia lato 08 09 10
chemia lato 12 09 10
chemia lato 03 09 10
chemia lato 13 09 10
chemia lato 01 09 10
chemia lato 02 09 10
chemia lato 05 07 08 id 112417 Nieznany
05, 09, 10 i 11 Jerzwałd i okolice legenda do mapki
chemia lato 09 09 10
PiÂmiennictwo do FP w WSZOP 09-10-05, fizjologia pracy
31 05 2012 10 09 2012 1 06 2012
więcej podobnych podstron