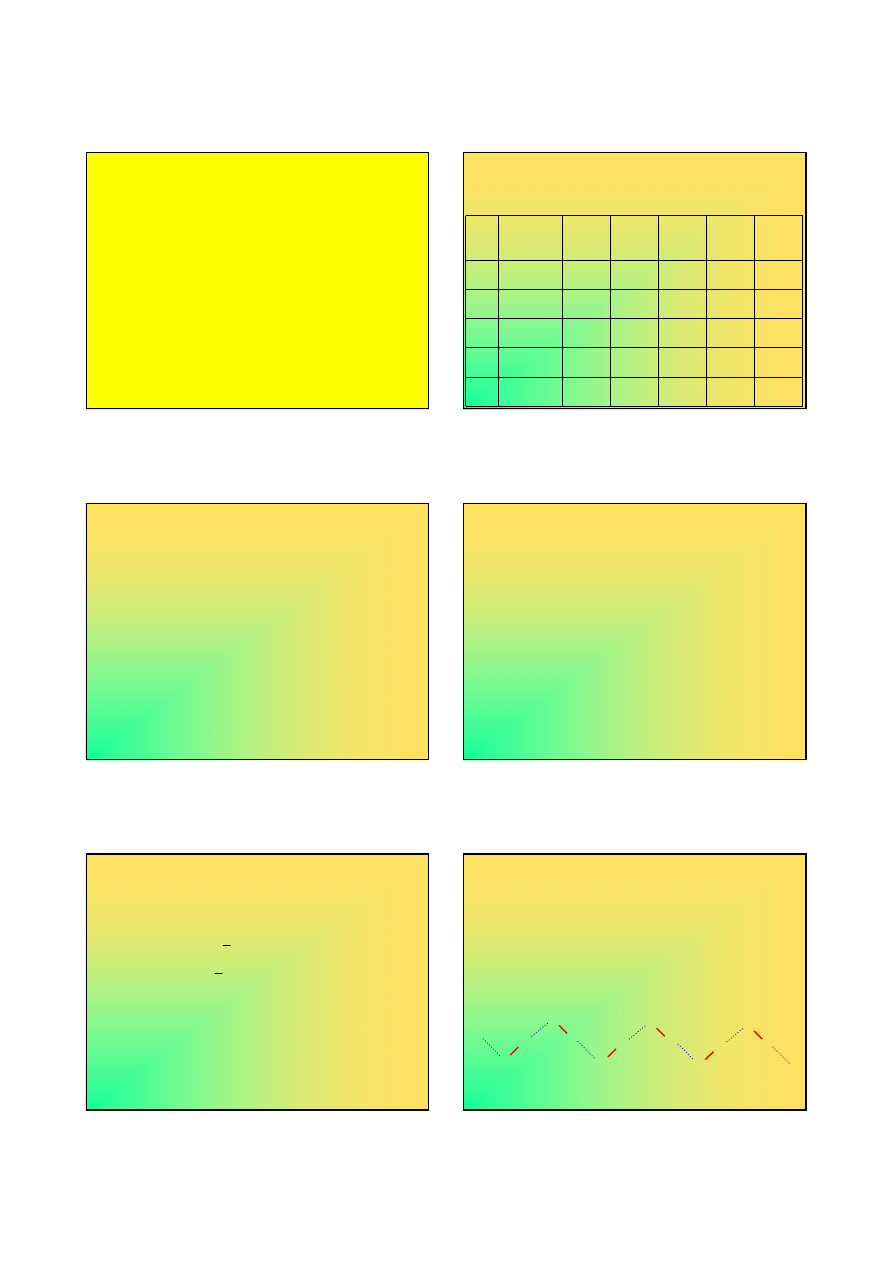
Fluorowce
Pierwiastki grupy 17
(grupy VII A – „głównej”)
Fluorowce (halogeny)
Konfiguracja elektronowa powłoki walencyjnej ns
2
np
5
, w
stanie wolnym wszystkie występują jako X
2
X
2
Elektro-
ujemność
Potencjał E
0
2X
-
↔
X
2
∆
H
D
(
X-X
)
[kJmol
-1
]
A
e
(
X
X
-
)
[kJmol
-1
]
Promień
atomowy
[pm]
Promień
jonowy
X
-
[pm]
F
2
Cl
2
Br
2
I
2
At
2
4,0
3,0
2,8
2,5
2,2
2,85
1,36
1,07
1,04
0,30
155
243
332
458
322
349
324
295
270
71
99
114
133
(140)
136
181
195
216
(230)
Charakter chemiczny fluorowców
Ze względu na dużą aktywność chemiczną fluorowce nie
występują w przyrodzie w stanie wolnym;
Otrzymuje się je przede wszystkim na drodze elektrolizy
halogenków stopionych lub rozpuszczonych w wodzie
(jony X
-
ulegają utlenieniu na anodzie):
Można je również otrzymać przy zastosowaniu utleniaczy o
wyskim potencjale redoksowym:
e
2
X
2X
:
Anoda
2
+
↑
→
−
O
8H
2MnCl
2KCl
5Cl
16HCl
2KMnO
2
2
2
4
+
+
+
↑
→
+
O
2H
MnCl
Cl
4HCl
MnO
2
2
2
2
+
+
↑
→
+
O
2H
2Cl
O
4HCl
2
2
RuO
lub
CuCl
2
2
2
+
→
+
Charakter chemiczny i wiązania
Ze względu na wysoki potencjał utleniający i duże
powinowactwo elektronowe, wszystkie fluorowce w
stanie wolnym mają charakter
utleniający
;
Wszystkie połączenia, w których atomowi fluorowca
przypisujemy dodatni stopień utlenienia maja równiez
charakter
utleniający
;
Związki, w których atom fluorowca uległ redukcji do
stopnia utlenienia –I, mają charakter slabo
redukujacy
;
Utleniający charakter pierwiastków słabnie ze wzrostem
masy molowej, co powoduje, że lżejsze pierwiastki z
grupy wypierają cięższe z ich związków (zastosowanie w
analizie anionów !):
2
2
2
2
2
2
I
2F
2I
F
Br
2F
2Br
F
Cl
2F
2Cl
F
+
→
+
+
→
+
+
→
+
−
−
−
−
−
−
2
2
2
2
I
2Cl
2I
Cl
Br
2Cl
2Br
Cl
+
→
+
+
→
+
−
−
−
−
2
2
I
2Br
2I
Br
+
→
+
−
−
Wiązania fluorowców
Ze względu na wysoki potencjał utleniający i duże
powinowactwo elektronowe, wszystkie fluorowce mogą
łatwo wytworzyć
wiązania jonowe
z pierwiastkami
elektrododatnimi (np. metalami):
Atom fluorowca przyjmuje elektron, redukuje się stając
się jonem o stopniu utlenienia
-1;
Z niemetalami fluorowce tworzą wiązania kowalencyjne
spolaryzowane;
Tylko fluor występuje wyłącznie na stopniu utlenienia
–I
,
pozostałe fluorowce na stopniach
–I
,
+I
,
+III
,
+IV
,
+V
,
+VI
,
+VII
;
W związkach o dodatnim stopniu utlenienia fluorowca,
wiązanie ma charakter kowalencyjny (spolaryzowany)
(s)
2(g)
2
1
(s)
(s)
2(g)
2
1
(s)
NaCl
Cl
Na
CsF
F
Cs
→
+
→
+
Połączenia fluorowców z wodorem
o
Wzór ogólny – HX – fluorowiec występuje na –I stopniu
utlenienia, wiązanie atomowe spolaryzowane. Tradycyjna
nazwa – fluorowcowodory lub halogenowodory, uzywa
się też nazw fluorek wodoru, chlorek wodoru, ... itp.;
o
Udział wiązania jonowego we fluorku wodoru HF wynosi
ok. 45% i spada do ok. 5% w jodku wodoru HI;
o
Ze względu na wysoki moment dipolowy we fluorku
wodoru występują wiązania wodorowe, będące przyczyną
asocjacji cząsteczek:
F
H
F
H
F
H
F
H
F
H
F
H
(HF)
n
np. H
2
F
2
Właściwości halogenków wodoru
i ich pochodnych
Halogenki wodoru są w warunkach normalnych gazami;
Rozpuszczają się w wodzie (HF bez ograniczeń, pozostałe
troszkę słabiej), a ich wodne roztwory mają charakter
słabo
kwaśny
w przypadku HF, i
kwaśny
w przypadku
pozostałych halogenków;
W roztworach wodnych dysocjują całkowicie, zgodnie z
równaniem:
Fluorki dysocjują z utworzeniem wodoroanionów:
−
+
+
↔
+
X
O
H
O
H
HX
3
2
−
+
+
↔
+
2
3
2
2
2
HF
O
H
O
H
F
H
Pochodne halogenków wodoru – sole
♦
Reakcje halogenów z metalami lub reakcje halogenków
wodoru z metalami lub ich wodorotlenkami prowadzą do
utworzenia halogenków metali o charakterze soli kwasów
beztlenowych (zawierają jon X
-
) i przy znaczącym
udziale wiązania jonowego:
♦
Najbardziej rozpowszechnione halogenki:
♦
NaCl, KCl, KF, KBr, KI, MgCl
2
, CaCl
2
itd (rozpuszczalne w
wodzie), często występujące w przyrodzie.
♦
AgCl, AgBr – światłoczułe i nierozpuszczalne w wodzie
O
H
KHF
F
H
KOH
O
H
NaI
HI
NaOH
H
ZnCl
2HCl
Zn
FeCl
Cl
Fe
2
2
2
2
2
2
2
2(s)
2(g)
(s)
+
→
+
+
→
+
↑
+
→
+
→
+
Tlenki fluorowców
Stopień
utlenienia
F
Cl
Br
I
- I
OF
2
O
2
F
2
+I
Cl
2
O
Br
2
O
+IV
ClO
2
BrO
2
+V
I
2
O
5
+VI
Cl
2
O
6
BrO
3
+VII
Cl
2
O
7
Oksykwasy fluorowców
Stopień
utlenienia
F
Cl
Br
I
- I
HOF
+I
HClO
HBrO
HIO
k. chlorowy (I)
k. bromowy (I)
k.jodowy(I)
+III
HClO
2
HBrO
2
k. chlorowy (III)
k. bromowy (III)
+V
HClO
3
HBrO
3
HIO
3
k. chlorowy (V)
k. bromowy (V)
k.jodowy(V)
+VII
HClO
4
HBrO
4
HIO
4
k. chlorowy (VII)
k. bromowy (VII)
k.jodowy(VII)
H
5
IO
6
, H
3
IO
5
,
H
4
I
2
O
9
, H
7
I
3
O
11
Właściwości oksykwasów i ich soli
Oksykwasy fluorowców i aniony pochodzące z ich soli
mają właściwości utleniające. Potencjał utleniający rośnie
ze wzrostem stopnia utlenienia fluorowca;
Trwałość oksykwasów rosnie ze stopniem utlenienia;
niektóre aniony występują wyłącznie w solach; aniony
można otrzymać na drodze dysproporcjonowania
pierwiastków w środowisku zasadowym:
O
H
X
XO
2OH
X
2
2
+
+
↔
+
−
−
−
−
−
−
+
↔
3
XO
2X
3XO
Ponieważ jony XO
-
są nietrwałe, dalsze dysproporcjono-
wanie prowadzi do bardziej trwałego stopnia utlenienia (V):
Równowaga dysproporcjonowania przesuwa się w miarę
wzrostu masy molowej:
O
3H
BrO
5Br
6OH
3Br
2
3
2
+
+
↔
+
−
−
−
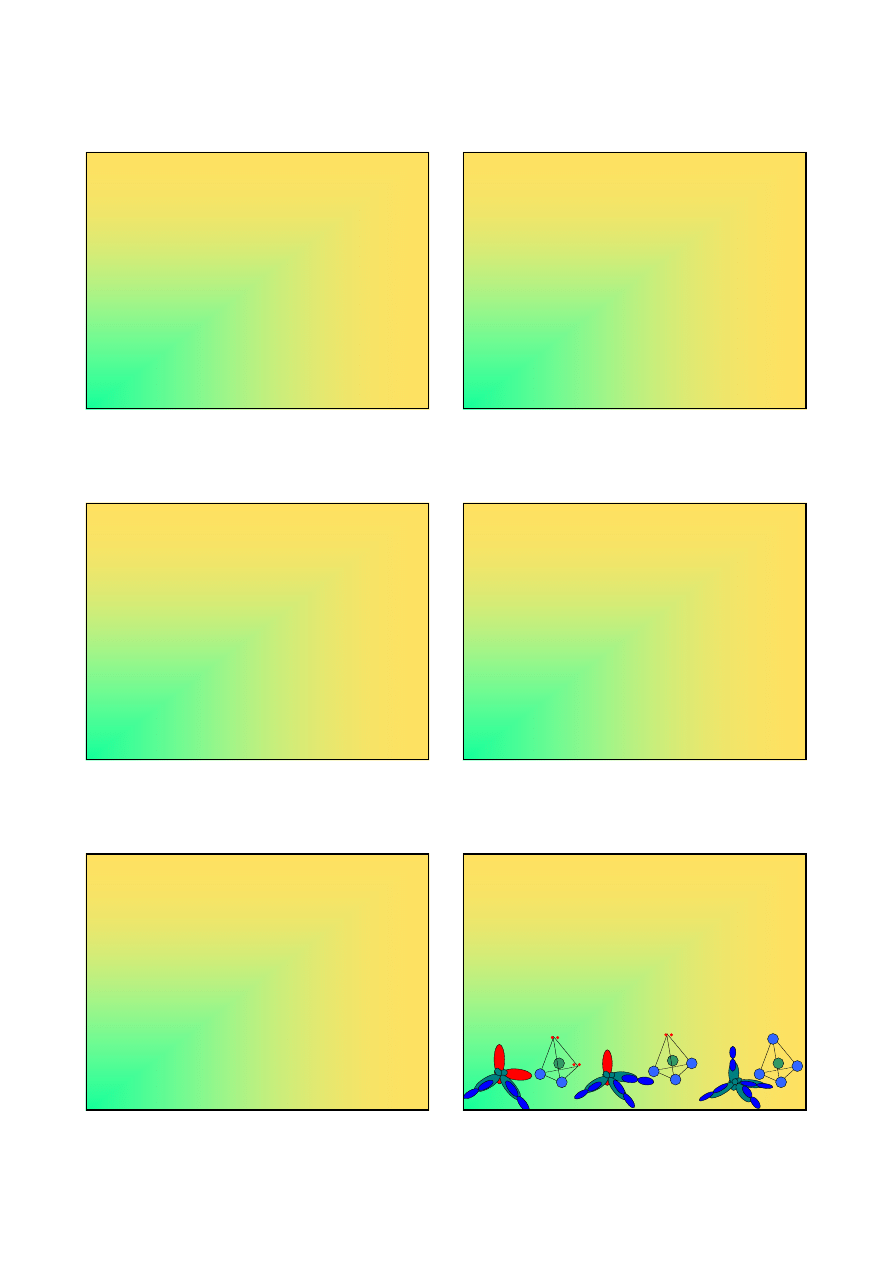
Stereochemia związków fluorowców (1)
Reguły hybrydyzacji dobrze tłumaczą kształt cząsteczek i
jonów fluorowców na wyższych stopniach utlenienia:
Typ hybr.
Liczba St. Par Kształt
Przykłady
par
utl. wiąż.
sp
3
4
+III 2
Litera V
ClO
2
-
4 +V 3
Piramida ClO
3
-
,
BrO
3
-
trygonalna
4
+VII 4
Tetraedr ClO
4
-
,
IO
4
-
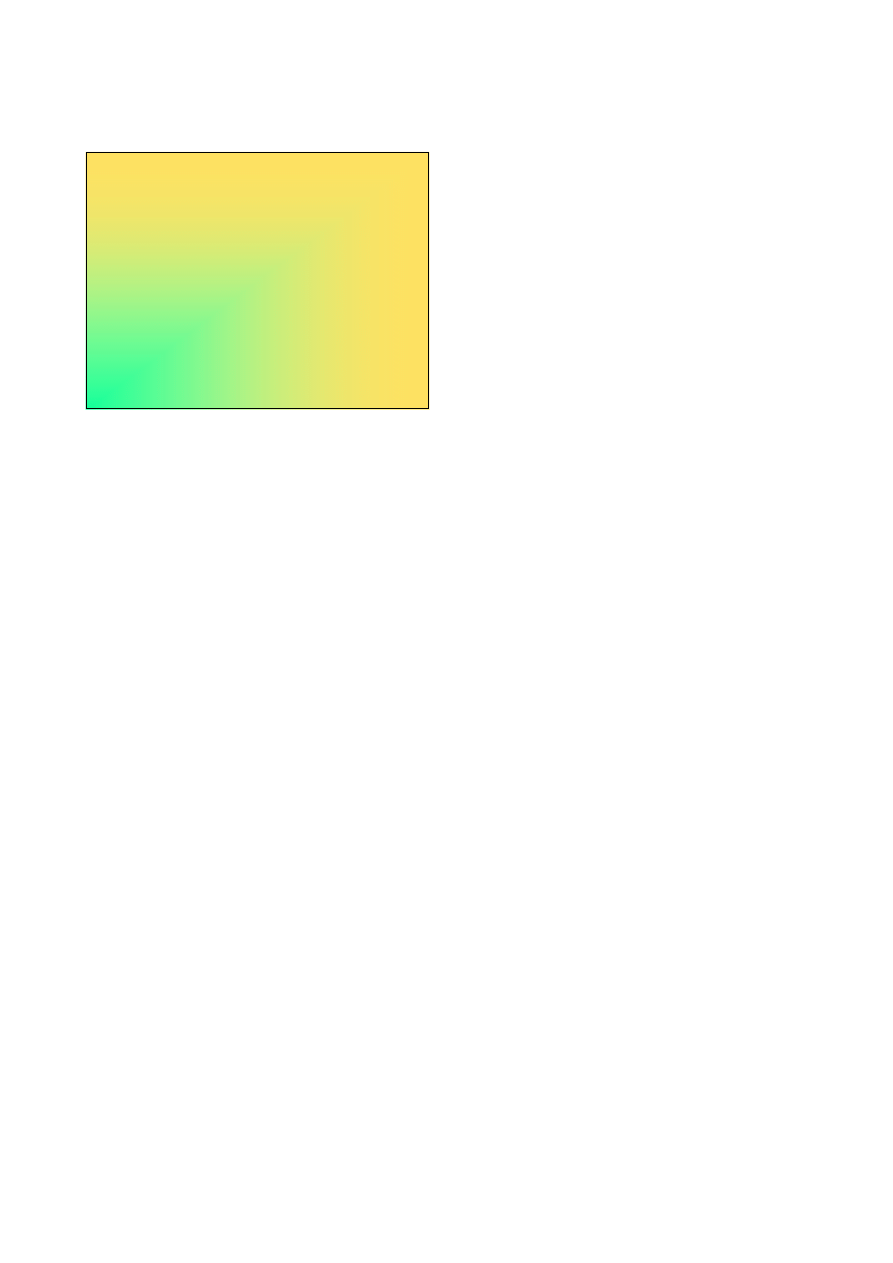
Stereochemia związków fluorowców (2)
Typ hybr.
Liczba St. Par Kształt
Przykłady
par
utl. wiąż.
sp
3
d
5
+I
2
Liniowy
I
3
-
, ICl
2
-
5 +III 3 Litera T
ClF
3
5
+VII 4
~Tetraedr
IO
2
F
2
-
sp
3
d
2
6
+IV
4
Kwadrat
ICl
4
-
6 +V 5
Piramida kw.
IF
5
6
+VII 6
Oktaedr
IO
6
5-
sp
3
d
3
7
+VII 7
Bipiramida
IF
7
pentagonalna
Wyszukiwarka
Podobne podstrony:
chemia lato 04 09 10
chemia lato 04 09 10
chemia lato 04 09 10
chemia lato 05 09 10
chemia lato 07 09 10
chemia lato 08 09 10
chemia lato 12 09 10
chemia lato 03 09 10
chemia lato 13 09 10
chemia lato 01 09 10
chemia lato 02 09 10
chemia lato 06 07 08
psio 06 09 10
chemia lato 09 09 10
chemia lato 10 07 08
chemia lato 09 07 08 id 112430 Nieznany
więcej podobnych podstron