Związki pierwiastków (metali)
„przejściowych”
Chemia pierwiastków przejściowych
Pierwiastki wewnętrznoprzejściowe (blok f), lantanowce i
aktynowce, konfiguracja elektronowa:
[g.szl.] ns
2
(n-1)d
1
(n-2) f
m
(m=1,2,.....14)
Sc Ti V Cr Mn Fe Co Ni Cu Zn
Y
Zr Nb Mo
Tc
Ru Rh Pd Ag Cd
La
Hf Ta W Re Os Ir Pt Au Hg
Ce Pr
Ac
Ac
Nd
Pm
Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U
Np Pu Am Cm
Cf Es Fm Md No Lr
Bk
Pierwiastki przejściowe – niecałkowicie zapełniona
podpowłoka d. Grupy 3-12;
pierwiastki zewnętrznoprzejściowe
konfiguracja elektronowa:
[g.szl.] ns
2
(n-1)d
n
(n=1,2,.....10)
Chemia lantanowców – pierwiastków
wewętrznoprzejściowych
Pierwiastki wewnętrznoprzejściowe w szóstym okresie
noszą nazwę
lantanowce
. Inna nazwa to:
metale ziem
rzadkich.
Ich konfiguracja elektronowa
[Xe]6s
2
5d
1
4f
m
Lu
Yb
Tm
Er
Ho
Dy
Tb
Gd
Eu
Sm
Pm
Nd
Pr
Ce
La
Prazeodym
Promet
Europ Terb Holm Tul Lutet
Lantan Cer
Neodym
Samar Gadolin Dysproz Erb Iterb
f
14
f
13
f
12
f
11
f
10
f
9
f
8
f
7
f
6
f
5
f
4
f
3
f
2
f
1
6s
2
5d
1
4
85
86
87
88
89
91
92
94
95
96
100
101
103
r
j
3+
[pm]
Pierwiastki metaliczne, tworzą sieci o symetrii
regularnej lub heksagonalnej.
Występują zazwyczaj na +3 stopniu utlenienia, tworząc
wiązania o przeważającym charakterze jonowym
Związki lantanowców
Charakter chemiczny lantanowców - podobieństwo do
glinowców i berylowców
Ln
O
2
Ln
2
O
3
LnX
3
X
2
halogeny
kwa
sy
sole + H
2
↑↑↑↑
S
2
Ln
2
S
3
N
2
, 1
00
0°
C
LnN
H
2
O
Ln(OH)
3
+ H
2
↑↑↑↑
powoli
+ C
LnC
2
metanek
Związki lantanowców (2)
o
Zastosowania lantanowców:
o
metaliczne jako dodatki do stopów (zwiększenie
wytrzymałości wysokotemperaturowej, twardości);
o
tlenki – luminofory w ekranach telewizyjnych;
o
katalizatory;
o
nadprzewodniki wysokotemperaturowe;
o
moderatory w reaktorach atomowych.
Aktynowce
Pierwiastki wewnętrznoprzejściowe w siódmym okresie
noszą nazwę
aktynowce
. Ich konfiguracja elektronowa
[Rn]7s
2
6d
1
5f
m
Lr
No
Md
Fm
Es
Cf
Bk
Cm
Am
Pu
Np
U
Pa
Th
Ac
Protaktyn Neptun
Ameryk Berkel Einstein Mendelew
Law-
Aktyn Tor Uran
Pluton Kiur Kaliforn Ferm Nobel
rans
Pierwiastki metaliczne, tworzą sieci o symetrii regularnej
lub heksagonalnej. Pierwiastki o nietrwałych izotopach,
cięższe od uranu, noszą też nazwę transuranowców, i
otrzymuje się je na drodze sztucznych przemian
promienitwórczych.
Aktynowce
Np
U
U
239
93
min
5
,
23
,
239
92
1
0
238
92
2
/
1
→
→
+
=
−
t
n
β
Pu
Np
239
94
239
93
→
−
β
Pluton, podobnie jak
235
U jest izotopem rozszczepialnym.
Aktynowce tworzą związki na +III stopniu utlenienia
(elektrony (n-1)d i ns);
U, Np, Pu na stopniach +III do +VI z udziałem
elektronów z podpowłoki f. Podobnie jak w lantanowcach
promienie jonowe maleją ze wzrostem liczby atomowej.
Pierwiastki zewnętrznoprzejściowe
Grupy 3-12 (IIIB do II B); pierwiastki
zewnętrznoprzejściowe konfiguracja elektronowa:
[g.szl.] ns
2
(n-1)d
n
(n=1,2,.....10)
Hg
5d
10
6s
2
Au
5d
10
6s
1
Pt
5d
9
6s
1
Ir
5d
7
6s
2
Os
5d
6
6s
2
Re
5d
5
6s
2
W
5d
5
6s
1
Ta
5d
3
6s
2
Hf
5d
2
6s
2
La
5d
1
6s
2
Cd
4d
10
5s
2
Ag
4d
10
5s
1
Pd
4d
10
5s
0
Rh
4d
8
5s
1
Ru
4d
7
5s
1
Te
4d
5
5s
2
Mo
4d
5
5s
1
Nb
4d
3
5s
2
Zr
4d
2
5s
2
Y
4d
1
5s
2
Zn
3d
10
4s
2
Cu
3d
10
4s
1
Ni
3d
8
4s
2
Co
3d
7
4s
2
Fe
3d
6
4s
2
Mn
3d
5
4s
2
Cr
3d
5
4s
1
V
3d
3
4s
2
Ti
3d
2
4s
2
Sc
3d
1
4s
2
II B
12
I B
11
VIII B
8 9 10
VII B
7
VI B
6
VB
5
IV B
4
III B
3
(n-1)d
4
ns
2
→
(n-1)d
5
ns
1
(n-1)d
9
ns
2
→
(n-1)d
10
ns
1
↑↑↑↑
↑↑↑↑
↑↑↑↑
↑↑↑↑
↑↓
↑↓
↑↓
↑↓
↑↑↑↑
↑↑↑↑
↑↑↑↑
↑↑↑↑
↑↑↑↑
↑↑↑↑
→
→
→
→
↑↑↑↑
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
→
→
→
→
↑↑↑↑
↓↓↓↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↑↑↑
Metale zewnętrznoprzejściowe
WŁAŚCIWOŚCI FIZYCZNE
☻
Sieci przetrzenne
regularne
lub
heksagonalne
;
☻
Temperatury topnienia
pierwiastków zmieniają
się w funkcji konfiguracji
elektronowej
☻
Promienie atomowe:
☻
są najwyższe na początku
każdego okresu (>170 pm);
☻
są najniższe w środku
każdego okresu (<130 pm);
☻
rosną w obrębie każdej
grupy
3
4
5
6
7
8
9 10 11 12
NUMER GRUPY
1000
2000
3000
4000
4
5
6
Metale zewnętrznoprzejściowe
WŁAŚCIWOŚCI FIZYCZNE I CHEMICZNE
Gęstość pierwiastków:
zwykle gęstość d > 5 gcm
-3
;
najlżejsze: Sc - 3,0 Y - 4,5 Ti - 4,5
najcięższe: Pt - 21,5 Os - 22,6 Ir - 22,7
Elektroujemność
- niska, choć znacznie wyższa niż
metali grup głównych
W związkach ten sam metal przejściowy występuje
na wielu stopniach utlenienia, od
+I
do
+VIII
. W
obrębie grupy ze wzrostem masy molowej rośnie
trwałość związków na wyższych stopniach
utlenienia, a maleje na niższych stopniach utlenienia.
W wyjątkowych przypadkach (tylko w związkach
koordynacyjnych) stopień utlenienia może wynosić
0
,
-I
lub
-II
.
Metale zewnętrznoprzejściowe
WŁAŚCIWOŚCI OPTYCZNE
Zabarwienie związków metali przejściowych
(w roztworach wodnych i w stanie stałym) –
absorpcja światła w zakresie promieniowania
widzialnego zależy od obecności elektronów d,
a więc także od stopnia utlenienia;
Zabarwienie roztworów wodnych związków
tytanu:
♦
Ti
4+
(brak elektronów d) bezbarwny
♦
Ti
3+
(1 elektron d)
ciemnoniebieski
♦
Ti
2+
(2 elektrony d)
fioletowy
Tlenki metali zewnętrznoprzejściowych
WŁAŚCIWOŚCI CHEMICZNE
Ze wzrostem stopnia utlenienia metalu przejściowego w tlenku
rośnie udział charakteru kowalencyjnego we wiązaniach
(równocześnie maleje udział wiążania jonowego).
Me
+
Me
3+
Me
+V
Me
+VII
wiązanie
jonowe
w
zr
o
st
u
d
zi
a
łu
w
ią
za
n
ia
k
o
w
a
le
n
c
y
jn
e
g
o
własności
zasadowe
własności
kwasowe
własności
amfote-
ryczne
własności
redukujące
własności
utleniające
wiązanie
kowalencyjne

Chemia związków chromu
o
Konfiguracja elektronowa: 3d
5
4s
1
kwasowe
silnie utleniające
CrO
3
CrO
4
2-
Cr
2
O
7
2-
+VI
amfoteryczne
CrO
2
+IV
amfoteryczne
Cr
2
O
3
Cr(OH)
3
+III
zasadowe
silnie redukujące
CrCl
2
+2
Właściwości
ZWIĄZEK
Stopień
utlenienia
Chemia związków chromu
Związki
Cr
2+
można otrzymać tylko na drodze
elektroredukcji. Jon
Cr
2+
jest bardzo silną zasadą:
↑
+
+
→
+
+
+
+
2
2
1
2
3
3
2
H
O
H
Cr
O
H
Cr
Cr
2+
Cr
3+
−
+
+
+
→
←
→
←
+
−
+
3
6
3OH
3
3H
2
3
Cr(OH)
Cr(OH)
O
3H
Cr
Cr
2
O
3
amfoteryczny
chromiany (III)
MgCr
2
O
4
, FeCr
2
O
4\
Cr
+VI
CrO
3
utleniacz i
bezwodnik
kwasowy
4
2
2
3
CrO
H
O
H
CrO
→
+
-
2
4
3
2
4
2
CrO
O
H
2
O
H
2
CrO
H
+
↔
+
+
O
H
OH
O
Cr
O
H
2CrO
2
-
2
7
2
3
-
2
4
+
+
↔
+
−
+
O
3H
O
Cr
N
NH
CrO
2
3
2
2
3
3
+
+
→
+
środowisko
zasadowe
środowisko
kwaśne
Chemia związków manganu
o
Konfiguracja elektronowa: 3d
5
4s
2
amfoteryczne
MnO
2
, MnO(OH)
2
+IV
amfoteryczne
Mn
2
O
3
+3
kwasowe
silnie utleniające
MnO
4
-
, KMnO
4
+VII
kwasowe,
utleniające
MnO
4
2-
, K
2
MnO
4
+VI
kwasowe,
utleniające
MnO
4
3-
, Li
3
MnO
4
+V
zasadowe
MnSO
4
, MnCl
2
+2
Właściwości
ZWIĄZEK
Stopień
utlenienia
Chemia związków manganu (2)
Mn
O
2
Mn
3
O
4
X
2
halogeny
MnX
2
S
2
MnS
kwasy
sole Mn
2+
+ H
2
↑↑↑↑
N
2
Mn
3
N
2
C
Mn
3
C
Manganiany (V,VI,VII)
−
−
−
+
+
→
+
4OH
MnO
MnO
O
2H
2MnO
2
2
4
2
3
4
O
2H
O
Mn
O
2Mn
4H
O
3Mn
2
2
IV
4
VII
2
4
VI
+
+
→
+
−
+
−
e
+
→
−
−
4
2
4
MnO
MnO
Manganiany (VI)
można otrzymać na drodze reakcji w
powietrzu pomiędzy MnO
2
i wodorotlenkami lub węglanami
litowców
Manganiany (VII)
otrzymuje się przez elektrolityczne
utlenianie
manganianów (VI)
Manganiany (V, VI) ulegają reakcji dysproporcjonowania:
Potencjał utleniający manganianu (VII)zależy od środowiska:
O
4H
Mn
5
8H
O
Mn
2
2
4
VII
+
→
+
+
+
−
−
e
−
−
+
→
+
+
4OH
O
Mn
3
O
2H
O
Mn
2
IV
2
4
VII
e
−
−
→
+
2
4
VI
4
VII
O
Mn
O
Mn
e
E=1,55 V
E=0,59 V
E=0,56 V
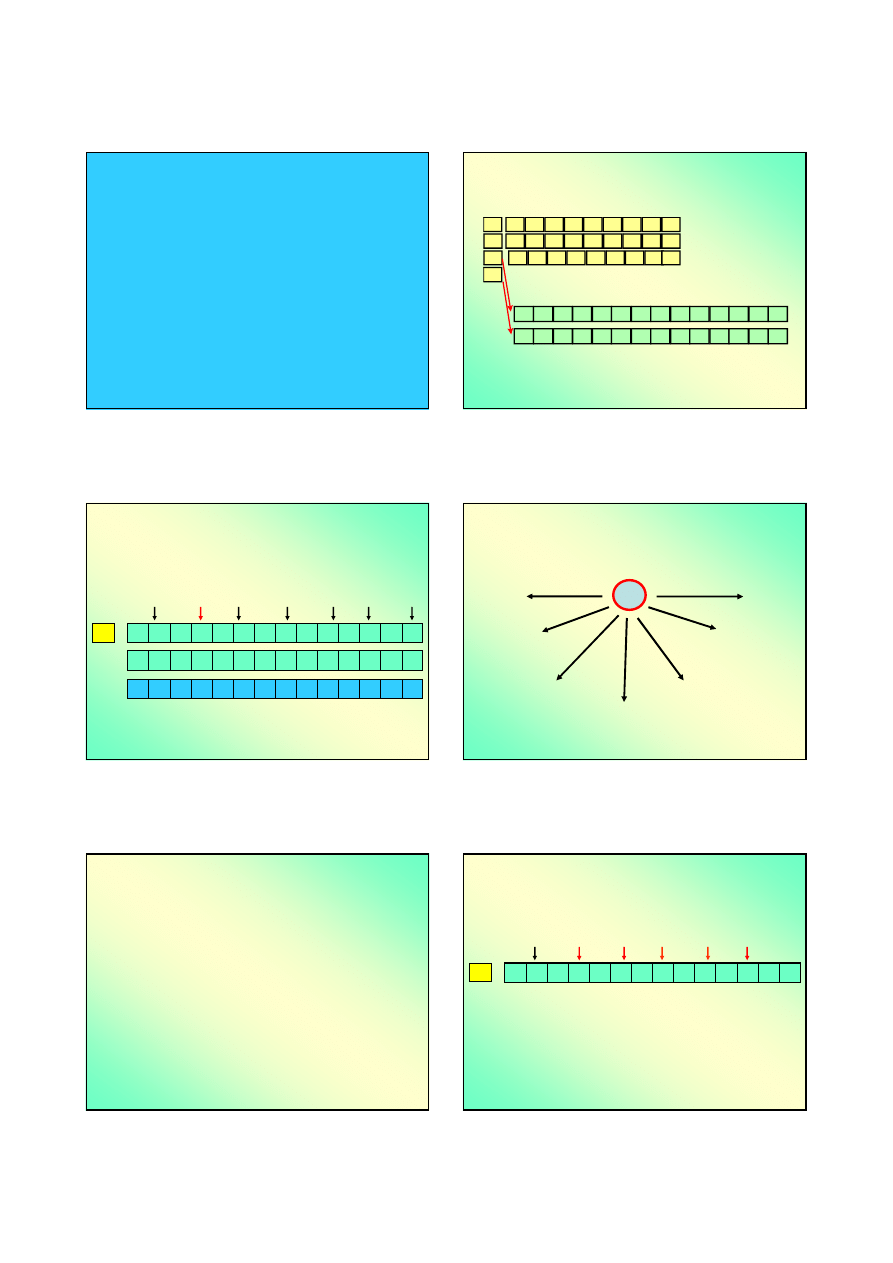
Prawo stałości składu ?
♦
Daltonidy
– związki spełniające prawo stałości
składu (nazwa pochodzi od nazwiska Johna
Daltona).
♦
Bertolidy
– związki nie spełniające prawa
stałości składu. Odstępstwo od stechiometrii
jest mierzalne (nazwa pochodzi od nazwiska
Claude’a Louisa Bertholleta).
J.L.Proust
J.Dalton
C.L.Berthollet
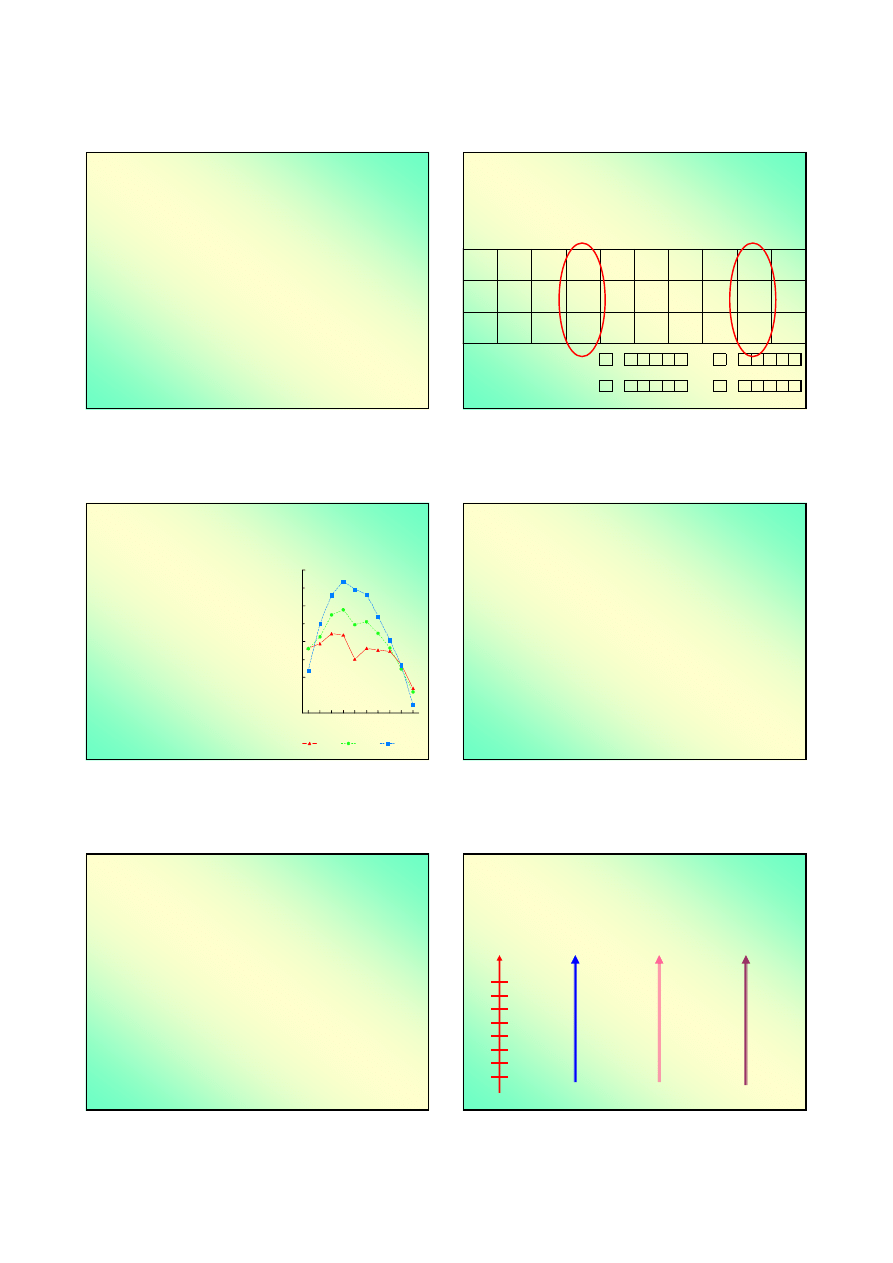
Związki niestechiometryczne (1)
Związki niestechiometryczne
wykazują odchylenia od składu
molowego w pewnym zakresie bez zmiany struktury.
Tlenki żelaza: Fe
II
O, Fe
2
III
O
3
, Fe
3
O
4
[Fe
II
Fe
2
III
O
4
];
Wustyt FeO wykazuje odstępstwa od stechiometrii – jego
prawdziwy wzór Fe
1-x
O [0 ≤ x ≤ 0,2] – jest to rzeczywisty
niedomiar metalu.
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
O
2-
FeO
Fe
3+
Fe
3+
Fe
3+
Fe
3+
Fe
1-x
O
O
Fe
Fe
III
2x
II
3x
1
+
+
−
Pojawieniu się każdej
luki kationowej
towarzyszy pojawienie się
dwóch jonów
Fe
+III
. Sumaryczny ładunek sieci nie zmienia się ...
Związki niestechiometryczne (2)
Tlenek wolframu (VI),
WO
3
,,
wykazuje luki (nieobsadzone
miejsca) w podsieci anionowej. Aniony tworzą sieć oktaedrów
ze wspólnymi wierzchołkami, kationy W
+VI
znajdują się w ich
ś
rodkach. Wzór uwzględniający niestechiometrię:
WO
3-x
Wyidealizowana (pod)sieć
anionów
O
2-
w
WO
3
O
2-
W
+VI
luka tlenowa
W
+V
WO
3-x
x
-
3
V
2x
VI
2x
1
O
W
W
+
+
−
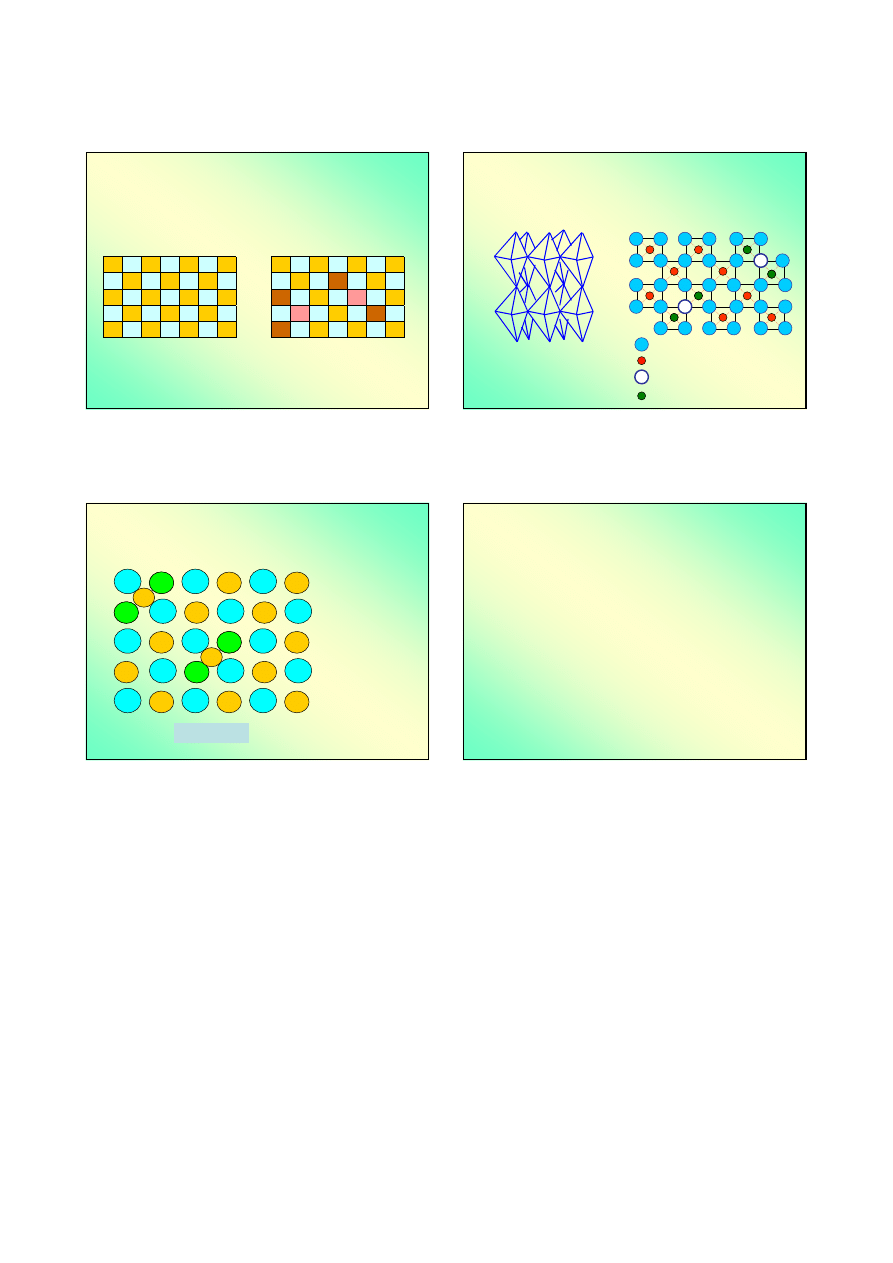
Związki niestechiometryczne (3)
Tlenek cynku (II),
ZnO
,,
przejawia odstępstwa od
stechiometrii związane z pojawieniem się nadmiarowych
atomów metalu:
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
Zn
+
Zn
2+
Zn
2+
Zn
+
Zn
+
Zn
+
W sieci
krystalicznej ZnO
pojawiają się
nadmiarowe jony
cynku, zwane
międzywęzłowymi.
Powoduje to także
obniżenie ładunku
innych jonów
cynku.
ZnO
Zn
1+x
O
Związki niestechiometryczne (4)
Występowanie odstępstwa od stechiometrii jest
charakterystyczne dla związków zawierających kationy
metali o zmiennym stopniu utlenienia (związki metali
przejściowych – tlenki, siarczki, halogenki):
rzeczywisty niedomiar metalu:
→
w sieci krystalicznej pozostają nieobsadzone miejsca kationów
(luki kationowe), a stopień utlenienia pozostałych kationów
ulega podwyższeniu
rzeczywisty niedomiar utleniacza:
→
w sieci krystalicznej pozostają nieobsadzone miejsca anionów
(luki anionowe), a stopień utlenienia kationów ulega
odpowiednio obniżeniu
rzeczywisty nadmiar metalu:
→
w sieci krystalicznej pojawiają się dodatkowe kationy metalu
(atomy międzywęzłowe), a stopień utlenienia pozostałych
kationów ulega odpowiednio obniżeniu
Wyszukiwarka
Podobne podstrony:
chemia lato 04 09 10
chemia lato 04 09 10
chemia lato 04 09 10
chemia lato 06 09 10
chemia lato 05 09 10
chemia lato 07 09 10
chemia lato 08 09 10
chemia lato 03 09 10
chemia lato 13 09 10
chemia lato 01 09 10
chemia lato 02 09 10
chemia lato 12 07 08 id 112433 Nieznany
chemia lato 12 07 08 id 112433 Nieznany
Chemia Kosmetyczna 8 12 09
chemia lato 09 09 10
AiR 11 12 wyklad 10 09 12 2011 MDW
09 10 12 ZYWIENIE W nowotworachid 7844 ppt
więcej podobnych podstron