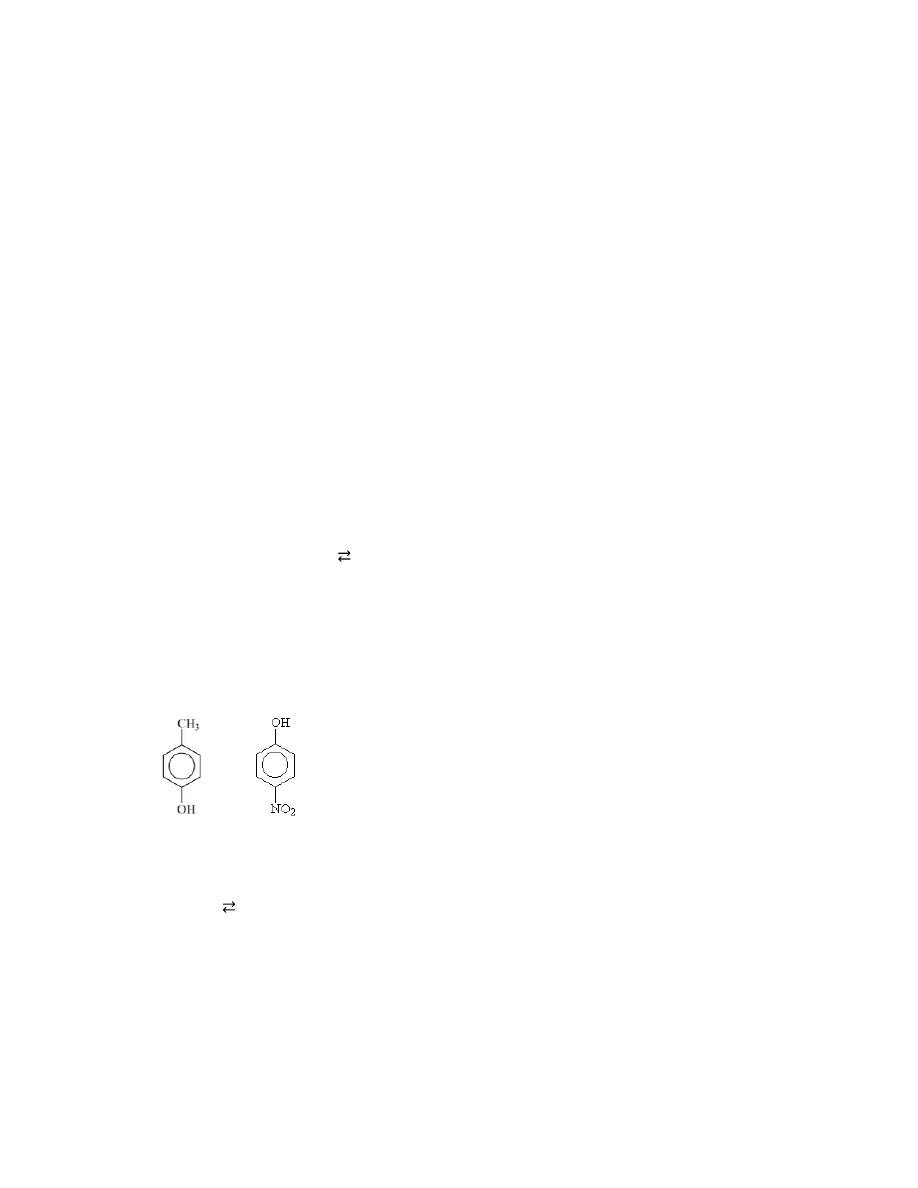
51 Ogólnopolski Konkurs Chemiczny im. prof. A. Swinarskiego
I Etap 17.01.2015 r.
ZADANIE A (20 pkt)
1. W którym zestawie cząsteczki są ułożone w kolejności ze wzrastającym kątem między wiązaniami:
a) H
2
O, CH
4
, NH
3
b) CH
4
, NH
3
, H
2
O c) H
2
O, NH
3
, CH
4
d) NH
3
, CH
4
, H
2
O
2. Próbka białego ciała stałego jest jednym z następujących związków: NaHCO
3
, AgNO
3
, Na
2
S lub CaBr
2
.
0,1 M roztwór jakiego związku można użyć do zidentyfikowania badanej próbki?
a) NH
3
(aq) b) HCl (aq)
c) NaOH (aq) d) KCl (aq)
3. CaF
2
ma iloczyn rozpuszczalności K
sp
= 3,9·10
–11
w 25°C. Jakie jest stężenie [F
–
] w nasyconym
roztworze tej soli w temperaturze 25°C?
a) 2,1·10
-4
b) 3,4·10
-4
c) 4,3·10
-4
d) 6,8·10
-4
4. Etanol reaguje z jonami Cr
2
O
7
2–
w środowisku kwaśnym zgodnie z równaniem:
C
2
H
5
OH
(c)
+ Cr
2
O
7
2–
(aq)
+ H
+
(aq)
CO
2(g)
+ Cr
3+
(aq)
+ H
2
O
(c)
Ile będzie wynosił współczynnik stechiometryczny przy H
+
(aq)
po zbilansowaniu tego równania tak,
aby uzyskać jak najmniejsze liczby całkowite?
a) 10
b) 12
c) 14
d) 16
5. W którym z podanych związków grupa –OH ma najbardziej kwasowy charakter?
a)
b)
c) CH
3
CH
2
CH
2
OH d) (CH
3
)
3
COH
6. W przemyśle chemicznym metanol, CH
3
OH, syntetyzuje się za pomocą reakcji tlenku węgla (II)
z wodorem w obecności miedzi, tlenku cynku i glinu jako katalizatorów. Reakcja ta jest odwracalna:
CO
(g)
+ 2H
2(g)
CH
3
OH
(g)
ΔH = –91 kJ mol
–1
W celu uzyskania jak największej wydajności reakcję należy prowadzić
a) przy zmniejszonym ciśnieniu i w niskiej temperaturze
b) przy zwiększonym ciśnieniu i w niskiej temperaturze
c) przy zmniejszonym ciśnieniu i w wysokiej temperaturze
d) przy zwiększonym ciśnieniu i w wysokiej temperaturze
7. Który z polimerów otrzymuj się przez reakcję polikondensacji?
a) polipropylen b) poli(tereftalan etylenu) c) poli(chlorek winylu) d) polistyren
8. Magnetyt, Fe
3
O
4
, można zredukować do żelaza ogrzewając Fe
3
O
4
z tlenkiem węgla (II):
Fe
3
O
4
+ 4CO 3Fe + 4CO
2
Jaka masa Fe
3
O
4
jest potrzebna do otrzymania 5,0 kg żelaza, jeśli proces zachodzi z wydajnością 88%?
a) 6.1 kg b) 6.9 kg c) 7.9 kg d) 18 kg
9. W reakcji opisanej równaniem 2A + B
C przebiegającej zgodnie z równaniem kinetycznym
v = k·c
A
2
·c
B
stężenia substratów zwiększyły się dwukrotnie. Szybkość tej reakcji
a) zwiększy się 3-krotnie, b) zwiększy się 6-krotnie
c) zwiększy się 8-krotnie, d) zmniejszy się 6-krotnie
10. Trzy metale, A, B i C, zanurzone w roztworach soli tych metali zostały przetestowane w ogniwach
galwanicznych. Zaobserwowano, że dla A i B: A jest katodą, dla B i C: C jest katodą, dla A i C: A jest
anodą. Jaka jest kolejność potencjałów elektrochemicznych kationów tych metali od najwyższego do
najniższego?
a) A > B > C b) B > C > A c) C> A > B d) B > A > C
ZADANIE B (20 pkt)
Analizowany związek chemiczny X jest białą substancją zwęglająca się podczas ogrzewania.
Dane dotyczące tego związku uzyskane na drodze analizy klasycznej i instrumentalnej zestawiono
poniżej.
1
Brak węgla asymetrycznego. Grupy funkcyjne położone obok siebie (grupy wicynalne).
2
Analiza elementarna - 61,31% C; 5,11% H; 10,22% N.
3
Nierozpuszczalny w wodzie.
Rozpuszczalny w etanolu.
Roztwarza się w roztworach wodorotlenku sodu i potasu, roztworze amoniaku oraz roztworach
węglanów sodu i potasu.
4
W trakcie ogrzewania z 30% roztworem NaOH wydziela gaz o ostrym przenikliwym zapachu,
który zabarwia na zielono-niebiesko zwilżony uniwersalny papierek wskaźnikowy.
5
W wyniku reakcji z wodą bromową otrzymuje się białą substancję A zawierającą 28,47% C;
1,69% H; 4,75% N i 54,24% Br.
6
Roztwór alkoholowy substancji X z 10% roztworem FeCl
3
daje fioletowe zabarwienie.
7
Po ogrzaniu z rozcieńczonym kwasem solnym i ochłodzeniu wydziela się biała krystaliczna
substancja B odbarwiająca rozcieńczony roztwór wodorotlenku sodu z dodatkiem
fenoloftaleiny.
8
Na zmiareczkowanie 0,276 g substancji B roztworem NaOH o stężeniu 0,100 mol/dm
3
wobec
fenoloftaleiny zużywa się 20,00 cm
3
roztworu wodorotlenku.

Na podstawie podanych wyżej informacji i po przeprowadzeniu stosownych obliczeń:
1. Podać wzór sumaryczny, wzór strukturalny i nazwę substancji X.
2. Określić przynależność tego związku do jednej z grup związków organicznych.
3. Wyjaśnić roztwarzanie się substancji X w podanych roztworach (tabela punkt 3) pisząc
odpowiednie jonowe skrócone równania reakcji.
4. Zapisać równanie reakcji substancji X ze stężonym roztworem wodorotlenku sodu (tabela punkt
4).
5. Obliczyć wzór sumaryczny oraz podać wzór strukturalny i nazwę systematyczną substancji A
oraz zapisać równanie reakcji tworzenia tej substancji ze związku X.
6. Podać jonowe skrócone równanie reakcji substancji X z chlorkiem żelaza(III).
7. Zapisać równanie reakcji otrzymywania substancji B oraz podać jej wzór strukturalny i nazwę.
8. Zapisać równanie reakcji substancji B z bezwodnikiem kwasu octowego, nazwać produkt i
podać jego zastosowanie.
ZADANIE C (15 pkt)
Żyletki są produkowane ze stopu żelaza z chromem. Kawałek żyletki o masie 0,1331 g poddano reakcji
z nadmiarem rozcieńczonego kwasu siarkowego (VI). Powstały roztwór o zielonkawym zabarwieniu,
zawierający jony Fe
2+
, miareczkowano zakwaszonym roztworem nadmanganianu potasu o nieznanym
stężeniu. W miareczkowaniu zużyto 20,08 cm
3
roztworu KMnO
4
. Jony Cr
3+
, powstałe w reakcji z
kwasem siarkowym nie reagują z KMnO
4
w tych warunkach.
10 cm
3
roztworu kwasu szczawiowego o stężeniu 0,0500 mol/dm
3
zakwaszono kwasem siarkowym i
roztwór ten miareczkowano tym samym roztworem KMnO
4
. Na zmiareczkowanie tej ilości kwasu
szczawiowego zużyto 9,76 cm
3
roztworu KMnO
4
.
a) Napisz zbilansowane równania reakcji:
i) pomiędzy żelazem z żyletki i kwasem siarkowym (VI)
ii) miareczkowania roztworu Fe2+ nadmanganianem potasu
iii) pomiędzy kwasem szczawiowym a nadmanganianem potasu.
b) Oblicz stężenie roztworu KMnO4, użytego w obu miareczkowaniach.
c) Oblicz zawartość procentową żelaza w żyletce.
ZADANIE D (15 pkt)
Podgrzany powyżej 100 ºC chlorek nitrozylu (NOCl) ulega częściowemu rozkładowi z wytworzeniem
tlenku azotu (II) i gazowego chloru. Reakcja ta jest odwracalna.
a) Napisz równanie reakcji rozkładu chlorku nitrozylu.
b) 2,50 mola NOCl podgrzano w zamkniętym reaktorze. Po osiągnięciu równowagi mieszanina
zawierała 0,80 mola tlenku azotu (II). Oblicz (w molach) ilość chloru i pozostałego NOCl.
c) Inna mieszanina NOCl, NO i Cl
2
osiągnęła stan równowagi w zamkniętym zbiorniku o
pojemności 15,00 dm
3
w pewnej temperaturze T. Mieszanina równowagowa zawierała 1,90 mola
NOCl i 0,86 mola NO. W tej temperaturze stężeniowa stała równowagi tej reakcji, K
c
= 7,4 10
-3
mol/dm
3
. Napisz wyrażenie na stałą równowagi tej reakcji, K
c
. Oblicz liczbę moli Cl
2
w
mieszaninie w stanie równowagi.
d) Jak wpłynie na wydajność procesu dwukrotne podwyższenie ciśnienia w układzie?

ZADANIE E (15 pkt)
Do grupy związków możliwych do otrzymania z kwasów karboksylowych (RCOOH) należą miedzy innymi:
estry - RC(O)OR’, halogenki kwasowe – RC(O)X, amidy kwasowe – RC(O)NH
2
, RC(O)NHR’, RC(O)NR’R” oraz
bezwodniki kwasowe RC(O)O(O)CR’, gdzie R, R’, R” to dowolna grupa węglowodorowa a X najczęściej Cl, Br lub
I. Wszystkie z tych pochodnych ulegają, w odpowiednich warunkach, hydrolizie do wyjściowych kwasów
karboksylowych.
Pewien 1,2-podstawiony związek aromatyczny A wykorzystywany w farmacji, jak wykazała
analiza elementarna, zawiera 61,31% węgla, 5,11% wodoru oraz 10,22% azotu. W odpowiednich
warunkach ulega on hydrolizie do słabo rozpuszczalnej w wodzie substancji B, która w postaci
rozcieńczonego roztworu wodno-etanolowego daje w reakcji z roztworem soli żelaza(III) fioletowo-
różowy roztwór. Dodatkowo substancja B reaguje z roztworem wodorowęglanu sodu z wydzieleniem
bezbarwnego, bezwonnego gazu.
1. Obliczyć wzór sumaryczny związku A.
2. Podać wzór strukturalny związku A wraz z krótkim uzasadnieniem.
3. Nazwać związek A.
4. Podać równanie hydrolizy związku A stosując wzory strukturalne.
5. Nazwać substancję B.
6. Podać równanie reakcji substancji B z wodorowęglanem sodu.
7. Podać przykład handlowego produktu zawierającego substancję B.
8. Na podstawie budowy związku B zaproponować dowolną reakcję, której może on ulegać i
krótko to uzasadnić.
9. Podać równanie reakcji związku B z bezwodnikiem kwasu octowego i nazwać produkty.
Wyszukiwarka
Podobne podstrony:
51 konkurs etap 1 odpowiedzi
51 Konkurs etap II
Zadania konkursowe, etap ustny 2009
Zadania konkursowe, etap ustny 2008, Zadanie 1
46 Olimpiada chemiczna Etap I Zadania teoretyczne
54 Olimpiada chemiczna Etap I Zadania teoretyczne
III etap zadania rozwiazania id Nieznany
III etap zadanie laboratoryjne rozwiazanie
iv test szkolny , IV Konkurs - etap szkolny
48 Olimpiada chemiczna Etap I Zadania teoretyczne
49 Olimpiada chemiczna Etap I Zadania teoretyczne
zadania konkurs Swinarskiego XLII konkurs chemiczny zadania
II etap zadania rozwiazania
53 Olimpiada chemiczna Etap I Zadania teoretyczne
2009 II etap zadania
51Olimpiada chemiczna Etap I Zadania teoretyczne
Konkurencja doskonala zadania XII-2011, Mikroekonomia I, Garbicz, mikro I Garbicz Dzierzek
I etap zadania rozwiazania2009 Nieznany
więcej podobnych podstron