KREW
Oporność erytrocytów czynniki hemolityczne.
Oporność minimalna to stężenie roztworu, w którym nie nastąpiła hemoliza, czyli 0,42-0,46% NaCl.
Oporność maksymalna to stężenie roztworu, w którym najmłodsze i najbardziej wytrzymale krwinki nie uległy jeszcze hemolizie wynosi 0,3-0,34 NaCl
I tak w 21 probówkach przygotowujemy szereg rozcieńczeń NaCl od 0,7 do o,3% z przeskokami o 0,02%NaCl. Następnie dodajemy 3 krople krwi po 15 min odczytujemy wynik, czyli szukamy stężenia soli w probówce, w której roztwór nad opadłymi krwinkami jest bezbarwny, czyli jest to minimum odporności. Następnie znajdujemy próbówkę, w której na dnie znajduje się najmniejszy osad erytrocytów niezhemolizowanych i to oznacza maksimum odporności.
Czynniki hemolityczne powodują częściowe lub całkowite przemieszczenie się, Hb do roztworu poprzez zniszczenie ich błony lub uszkodzenie.
Dzielimy je na:
A) chemiczne
Eter,
Benzyna,
Zasady,
Kwasy,
Chloroform,
Saponina (digitonina)
B)fizyczne
- rozcieranie krwi z piaskiem
- zamrażanie odmrażanie
- promieniowanie UV
- podgrzanie
C) biologiczne
- toksyny drobnoustrojów
- hemolizyny
Transport tlenu i dwutlenku węgla.
Udział hemoglobiny w transporcie gazów, odmiany hemoglobiny i jej pochodne.
Właściwości fizykochemiczne krwi oraz jej funkcja.
- pH krwi jest dość stabilne wynosi 7,34 dzięki buforowi węglanowemu, fosforanowemu, białczanowemu
- krew jest dobrym przewodnikiem prądu
- lepkość krwi jest większa od lepkości wody i przez to płynie wolniej
- napięcie pow. krwi jest mniejsze od napięcia powierzchniowego wody (w związku z tym krew lepiej się pieni)
- lepkość i napięcie pow. wpływają na transport
- ciężar elementów morfotycznych 1,095-1,101
- ciężar osocza 1,022-1,026
- ciężar właściwy pełnej krwi 1,052-1,060
- krew ma stały skład kationów (Na, K, Mg, Ca) oraz anionów białczanowych węglanowych i fosforanowych
Funkcja krwi:
- transport tlenu z płuc do tkanek
- transport CO2 z tkanek do płuc
- transport do wszystkich tkanek prod. energetycznych i budulcowych wchłoniętych z przewodu pokarmowego
- transport wchłoniętych z tkanek produktów przemiany materii do nerek skąd są wydalane z moczem
- transport hormonów syntetyzowanych w org. i witamin wchłoniętych z przewodu pokarmowego
- magazynuje hormony gruczołu tarczowego i hormony steroidowe po ich związaniu z białkami
- wyrównuje ciśnienie osmotyczne we wszystkich tkankach
- wyrównuje pH we wszystkich tkankach
- wyrównuje różnice temp.
- tworzy barierę dla drobnoustrojów, które po wniknięciu do środowiska wewnętrznego są pożerane przez leukocyty
Udział erytrocytów i osocza w systemach grupowych krwi.
Tor zewnątrz i wewnątrzpochodny krzepnięcia.
Dwa szlaki prowadzą do uformowania czopu fibrynowego. Obydwa szlaki zbiegają się na wspólnym końcowym etapie obejmującym aktywację protrombiny do trombiny
Szlak wewnątrz- pochodny obejmuje czynniki XII,XI,IX,VIII,X jak również prekalikreinę, wysokocząsteczkowy kininogen, jony Ca2+, fosfolipidy płytek. Szlak rozpoczyna się fazą „kontaktu”, w której czynniki XII,XI są eksponowane na działanie ujemnie naładowanej powierzchni aktywnej np. kolegenu. I tak:
Cz. XII-----XIIa w reakcji proteolizy katalizowanej przez kalikreine
Cz.XIIa wpływa na cz.XI---XIa
Czynnik XIa w obecności Ca2+ powoduje przejście cz.IX ---cz. IXa
Powstały cz. IXa wraz z Ca2+, cz.VIIIa(aktywowanym przez trombinę) i fosfolipidami aktywuje czX
Cz.X---cz.Xa
Na tym etapie zbiega się szlak zew- i wewnątrzpochodny
Szlak zew-pochodny obejmuje cz.VII,X,Ca2+,cz.tkankowy. tor ten jest aktywowany w miejscu uszkodzenia tkanki w chwili uwolnienia cz. tkankowego, który służy jako kofaktor w reakcji przejścia cz.VII w aktywna formę cz.VIIa
Cz.VIIa wpływa na czX (cz.X--cz.Xa)
Czyli na cz.X zbiegają się tory wew- i zewnątrzpochodny:
Następnie cz.Xa, Ca2+,Va,fosfolipidy powodują aktywację protrombiny
Protrombina---trombina
Trombina powoduje rozerwanie wiązań w cząsteczce fibrynogenu odszczepienie fibrynopeptydów z cząst. fibrynogenu i powstanie włókienek fibryny
Fibrynogen---fibryna(monomer rozszczepiony)
Utworzone w ten sposób monomery fibryny są wiotkie i słabe. Taka wiotka fibryna ulega przekształceniu pod wpływem cz.XIIIa(aktywowany przez trombine)-który jest swoistą transglutaminazą i tworzy wiązania peptydowe między cząsteczkami fibryny, przyczynia się to do wytworzenia stabilnej fibryny.
Rola płytek krwi w krzepnięciu. Koagulanty i antykoagulanty.
To najmniejsze elementy morfotyczne krwi, bezjądrzaste. Wyróżniamy 3 strefy:
Strefa zewnętrzna- obejmuje błonę, podbłonowy region z mikrowłókienkami, układ otwartych kanalików służących do ewakuowania na zew. związków przez nie wytworzonych. Błonę zew. pokrywają liczne glikoproteinowe struktury odpowiedzialne za przekazywanie bodźców, zaliczmy do nich: swoiste antygeny trombocytarne, subst. grupowe krwi AB0, receptory dla ukł ludzkich antygenów leukocytarnych. Inne rec. mają znaczenie dla procesów krzepnięcia-wykazują powinowactwo do np. koleagenu, fibronektyny, lamininy.
2. Strefa r-ru żelu zawiera mikrowłókienka i mikrorureczki odgrywające rolę w utrzymywaniu dyskoidalnego kształtu, przemieszczaniu się ich w środowisku, zmianie kształtu w procesie adhezji i agregacji-przejście z kształtu dyskoidalnego w sferyczną
3. Strefa organelli- są to mitochondria peroksysomy rurki i ziarnistości
Ziarnistości dzielimy na:
a) gęste- ATP, ADP, serotonina, adrenalina, noradrenalina, Mg2+,Ca2+,
b) ziarnistości alfa-fibrynogen, fibronektyna, czynnik von illebrada, trombospondyna, witrnektyna, czynnik V, czynnik płytkowy 4, białko S, czynnik XI.
Rola w procesie krzepnięcia
Zapoczątkowują ona proces krzepnięcia, tworząc czop trombocytarny w miejscu uszkodzenia nabłonka, przebiega w kilku etapach ten proces
Adhezja
Czyli przyleganie trombocytów do włókien kolagenu błony podstawnej z chwilą uszkodzenia ciągłości śródbłonka, odsłonięcia kolagenu i innych składowych błony kom. Wynikiem adhezji jest wypełnienie przez trombocyty ubytków śródbłonka i uszczelnienie naczyń, PGDF (płytkowy cz. wzrostu) pobudza wzrost śródbłonka, trombocyty obkurczają się powstaje pseudopodia, uwolnienie zawartości ziarnistości.
Sekrecja i uwalnianie:
Z ziarnistości gęstych uwalniane są ADP, ATP, Mg, Ca. ADP powoduje przejście trombocytów z dyskoidalnego kształtu w sferyczny
Agregacja
Jest to proces łączenia się trombocytów, odbywa się przy udziale fibrynogenu wykazującego powinowactwo do glikoprotein GPIIb/IIIa trombocytów, z którymi łączy się do tego procesu potrzebny jest Ca2+. Brak tego receptora uniemożliwia łączenie się trombocytów. Dalsza aktywacja trombocytów zachodzi przez uwolnione z ziarnistości związki takie jak ADP serotonina, odpowiedzialne są one za następną fazę agregacji z wytworzeniem trombiny, TXA2. TXA2 jest najsilniejszym stymulatorem agregacji trombocytów i zwężenie naczyń. Wytwarzanie jego jest hamowane przez aspirynę brakuje COX
Antykoagulanty - to substancje hamujące fizjologiczny proces krzepnięcia. Do antykoagulantów należy heparyna powodująca inaktywację trombiny i innych osoczowych cz. krzepnięcia oraz hamująca przemianę protrombiny w trombinę stosowane, gł. w iniekcjach leczeniu zakrzepów żylnych, tętniczych. Doustnie stosuje się pochodne kumaryny-antagonista wit. K, czyli hamują syntezę protrombiny i cz. krzepnięcia II,VII,IX,X (powstają nieaktywne cz. krzepnięcia tzw. czynniki PIVKA)
Ponadto do antykoagulantów należy cytrynian sodu 3,8%, siarczan Mg 20%. Koagulanty są to subst, które zwiększają krzepliwość krwi. Należy do nich:
- adrenalina - czas krzepnięcia ulega skróceniu poprzez wzrost agregacji płytek
- trombina - w zetknięciu z fibrynogenem tworzy rodzaj błonki hamującej dalsze krwawienie
- jady węży - na skutek zawartego w nich enzymu proteolitycznego, który zmienia protrombinę w trombine
Oporność organizmu w odczynach immunologicznych.
Odporność komórkowa swoista i nieswoista.
Pierwszorzędową rolę odgrywają limfocyty T i komórki NK, pomocniczą-makrofagi, granulocyty, eozynofile i bazofile oraz przeciwciała
Limfocyty T--2 podgrupy
- Limfocyty T CD4- pod wpływem immunogenów i mitogenów wydzielają ytokiny, które aktywują limfocyty B i T( w tym CD8). Wydzielane cytokiny to: IL-2,4,5,6,10,interferon gamma, czynnik martwicy nowotworów(TNF)
- Limfocyty T CD8- niszczą komórki zawierające obce antygeny(np. te, w których rozwijają się wirusy), hamują aktywację limfocytów B wywołaną przez limfocyty T CD4. Nadmiar limfocyty T CD8 lub niedobór CD4 prowadzi do osłabienia lub zaniku reakcji kom. Przy prawidłowym stosunku prawidłowa reakcja.
- Limfocyty NK CD16-aktywność cytotoksyczna, niszczą kom. w których rozwijają się wirusy, nowotworowe. Limfocyty NK i T CD8 (cytotoksyczne) niszcza te kom.np.perforyna (uszkadza bł. kom. tworząc otworki), IL-12 (wzmaga aktywność NK)
Limfocyty T CD8-----T cytotoksyczne
IL
Proliferacja
Limf T supresorowe hamują odp. limf B i T (także T-helperow), rozwijają się wolniej niż cytotoksyczne; współdziałają w zakończeniu odp. immunologicznej.
Przy drugim kontakcie z antygenem rozwijana jest reakcje późnej nadwrażliwości (wykazuje nadmierną siłę i może być patologiczna)
Cztery typy odp. immunolog. -mogą występować równolegle:
- typ I - u osób uczulonych na antygeny środowiskowe. Objawy - katar sienny, astma oskrzelowa
alergen (antygen)-pow. wytworzenie IgE. IgE łączy się z rec. kom. tucznej gdy dochodzi do kontaktu z alergenem ten łączy się z IgE na kom. tucznych dochodzi do degranulacji i uwolnienia mediatorów reakcji alergicznej ; jest to rodzaj odp. szybkiej
- typ II - niszczenie własnych lub obcych kom przez limf cytotoksyczne przy udziale przeciwciał.
przeciwciało + antygenfagocytoza
atak limfocytów T cytotoksycznych
- typ III - usuwanie kompleksów antygen-przeciwciało nie jest wystaczające (powstaje ich dużo)krążą we krwi (choroba uogólniona), gromadzą się w narządach(uszkodzenie ich funkcji- rózne choroby układowe)
- typ IV - nadwrażliwość kontaktowa - miejscowy wyprysk (limfocyty, makrofagi) - nadwrażliwość typu tuberkulinowego, naciek zapalny w miejscu wstrzyknięcia
Odporność humoralna swoista i nieswoista.
Organizm człowieka ma dziedzicznie wyznaczoną specyfikę struktury i bardzo dokładnego składu chemicznego, zwłaszcza w zakresie najbardziej swoistych białek. Każdy organizm musi tej tożsamości bronić przez całe życie, gdyż nieustannie narażony jest na wnikanie z zewnątrz i powstawanie w jego wnętrzu substancji obcych, szkodliwych, trujących, szczególnie pochodzenia białkowego, które zagrażają suwerenności i porządkowi wewnętrznemu. Z zewnątrz usiłują wniknąć do każdego organizmu bakterie, wirusy, grzyby, pyłki roślin, pyły organiczne i inne podobne, a wewnątrz ciągle lub w specjalnych okolicznościach pojawiają się własne komórki obumarłe, uszkodzone, nowotworowe oraz niektóre przeważnie wielkocząsteczkowe produkty przemiany materii.
Aby nie dopuścić do utraty własnej tożsamości przez wbudowywanie w swoje struktury elementów obcych, które nie utraciły resztek swoistości organizmów ich pochodzenia, i nie dać się zatruwać substancjami obcymi, z dużą sprawnością trzeba je nieustannie rozpoznawać, unieszkodliwiać, lokalizować i usuwać na zewnątrz, a także zapobiegać ich przenikaniu do środowiska wewnętrznego. Wszystko to składa się razem na odporność.
Najogólniej odporność dzieli się na nieswoistą - dziedziczną i swoistą - nabytą.
Odporność można nabyć różnymi drogami - oczywiście w odporności specyficznej.
Jeśli wykształciła się po przejściu zarażenia lub po podaniu szczepionki, wówczas nazywa się ją nabytą czynną. Ponadto u człowieka (i innych ssaków) istnieje dodatkowy mechanizm przekazywania podstawowych przeciwciał poprzez łożysko - to jest odporność nabyta naturalnie, bierna (umożliwia noworodkowi przetrwanie pierwszych dni życia). W sytuacji krytycznej można wstrzyknąć komuś gotowe przeciwciała lub uczulone limfocyty. Będzie on miał więc odporność nabytą sztucznie, bierną.
Odporność swoista lub immunologiczna.
Skierowana jest przeciwko konkretnemu antygenowi i polega na tym, że pod ich wpływem wytwarzają się wysoce swoiste substancje białkowe zwane przeciwciałami. Przeciwciała szczególnie wybiórczo łączą się z antygenami. Powodując ich neutralizację polegającą na pozbawieniu ich chorobotwórczości. Antygeny są to wielkocząsteczkowe substancje białkowe, zawierające cechy organizmu, z którego pochodzą lub są to nieswoiste mniejsze związki. Antygeny mogą pochodzić z obcych komórek lub z wnętrza własnego organizmu.
Antygeny odznaczają się:
Antygenowością - antygen posiada determinantę antygenową - epitop (elementy struktury), które swoiście łączą się z przeciwciałem.
Immunogenność - nie posiadają jej wszystkie antygeny, organizm odpowiada na wprowadzenie do jego wnętrza antygenu, poprzez wytworzenie swoistego przeciwciała
Przeciwciała (immunoglobuliny) są to swoiste gamma globuliny, wytwarzane głównie w limfocytach T i komórkach plazmatycznych. A także w limfocytach B, które selektywnie reagują z odpowiadającym im antygenem.
Przeciwciała mogą być zlokalizowane w błonie komórkowej tworząc receptory dla antygenu, głównie w limfocytach T. Mogą być również wydzielane do osocza lub płynów ustrojowych np. komórki plazmatyczne.
Przeciwciała skierowane przeciw wielu determinantom antygenowym tego samego antygenu to przeciwciała poliklonalne, natomiast skierowane przeciw jednej determinancie antygenowej to przeciwciała monoklonalne.
Każda immunoglobulina zbudowana jest z dwóch łańcuchów lekkich (istnieją ich dwa rodzaje kappa i lambda), oraz dwóch łańcuchów ciężkich. Łańcuchy w immunoglobulinach są ze sobą połączone mostkami disiarczkowymi. Ze względu na różną budowę łańcuchów ciężkich immunoglobuliny dzielą się na pięć klas.
IgA |
Występują w wydzielinach ( łzy, pot, ślina) |
IgD |
Występują na powierzchni limfocytów B, a wiążąc się z antygenem pobudzają je do produkcji przeciwciał. |
IgE |
Występują głównie w błonach śluzowych i w skórze oraz na powierzchni mastocytów |
IgG |
Jest ich najwięcej, bo aż 80% wszystkich immunoglobulin. Posiadają zdolność przechodzenia przez łożysko z krwi matki do krwi płodu. Przy pierwszym kontakcie z antygenem organizm produkuje w pierwszej kolejności przeciwciała klasy G. Po ponownym kontakcie z tym samym antygenem przeważ produkcja przeciwciał z klasy G. |
IgM |
Powstają w odpowiedzi na pierwszy kontakt z antygenem, do tej klasy należą między innymi naturalne przeciwciała przeciwko antygenom układu ABO |
Rozróżniamy odporność humoralną i komórkową.
Odporność humoralna ( z udziałem przeciwciał)
Gdy do organizmu dostaną się wirusy, bakterie lub inne obce białka oraz inne substancje to zostają pochłonięte przez makrofagi. Degradują one w swojej cytoplazmie wchłonięte antygeny oraz eksponują jego część z białkami głównego układu zgodności tkankowej MHC na swojej powierzchni. Makrofagi kontaktują się wtedy z limfocytami.
Limfocyty T4 ulegają aktywacji wtedy, gdy wiążą się równocześnie z antygenem i białkiem MHC klasy II znajdującym się na powierzchni makrofaga. Następnie limfocyty T4 oddziałują na limfocyty B, aktywując je i pobudzając do proliferacji i transformacji w komórki pamięci B i komórki plazmatyczne. Plazmocyty wydzielają dużą ilość przeciwciał do krwi krążącej. Limfocyty B mogą także wiązać wolne antygeny we krwi i chłonce, ale wówczas wymagają one kontaktu z limfocytami T4 pomagającymi, aby mogły ulec dojrzewaniu i różnicowaniu. Antygeny mogą także być prezentowane limfocytom T4 przez inne komórki. Są to komórki APCs - komórki prezentujące antygen i obejmują one komórki naskórka - dendrocyty ziarniste bezbarwnikowe, Langerhansa, komórki dendrytyczne w węzłach chłonnych i w śledzionie, komórki welonowate krążące we krwi oraz komórki mikrogleju w ośrodkowym układzie nerwowym.
Wirusy
Antygen+MHC-I Limfocyt T8 Proliferacja
Na powierzchni komórki
Limfocyty
Makrofag pomagające
( T4 )
Antygen+MHC-I
Na powierzchni komórki
Limfocyt B Proliferacja
I produkcja
Przeciwciał
Odporność komórkowa
Odporność komórkowa jest przekazywana przez limfocyty T8. Są one aktywowane wtedy, gdy są eksponowane z antygenem i białkiem MHC klasy I na powierzchni komórki prezentującej antygen. Są także aktywowane, wtedy, gdy są eksponowane na działanie interleukiny 2. Wówczas ulegają proliferacji i różnicowaniu w limfocyty T cytotoksyczne. Te zaś atakują i niszczą komórki posiadające antygen, który je zaktywował.
POBUDLIWOŚĆ I MIĘŚNIE
Potencjał spoczynkowy, depolaryzacyjny i hiperpolaryzacyjny komórki nerwowej.
Pobudliwością, określamy zdolność komórki, tkanki lub organizmu do reagowania na bodźce stanem pobudzenia. Miarą pobudzenia jest próg pobudliwości, po przekroczeniu którego komórka ulega pobudzeniu. Najsłabszy bodziec zdolny do pobudzenia komórki nazywamy jest bodźcem progowym. Pobudliwość tych samych struktur może zmieniać sil1. w zależności od wielu czynników jak np. temperatura środki znieczulające, rytmy biologiczne. Przy wzroście pobudliwości danej struktury dochodzi do obniżenia progu pobudliwości- zmniejsza się wówczas wartość bodźca progowego i odwrotnie przy spadku pobudliwości pod wpływem różnych czynników wzrasta próg pobudliwości. czyli wzrasta wartość bodźca progowego koniecznego do wywołania stanu pobudzenia.
Bodziec to odpowiednia dynamiczna, silna i długotrwała zmiana, która Wpływa na metabolizm i zmienia czynność żywej materii
Pod względem rodzaju energii bodźce dzielimy na:
Fizyczne - mechaniczne, termiczne, świetlne, dźwiękowe, elektryczne, osmotyczne, chemiczne -mineralne, organiczne kwasy, zasady sole, eter a1kohol,
2. Biologiczne- to bodźce powstające w żywym organizmie -hormony, mediatory
.
Biorąc pod uwagę charakter i miejsce działania w obrębie komórki bodźce można podzielić na:
1. Swoiste -czyli adekwatne- homologiczne, fizjologiczne
2. Nieswoiste -nieadekwatne, heterologjczne, niefizjologiczne
Bodźce swoiste to podniety przystosowane do pobudzenia danej tkanki działające na określoną część komórki. Bodźce te już jako energetycznie bardzo słabe wyjątkowo skutecznie drażnią daną strukturę. Przykładem tego typu bodźca może być energia świetlna pobudzająca narząd wzroku, fale akustyczne pobudzające narząd słuchu.
Bodźce heterologiczne nieswoiste są to z kolei podmioty niefizjologiczne; pobudzają. komórką jedynie wówczas, gdy posiadają dużą silę. Przykładem może być silny mechaniczny ucisk na gałkę oczną wywołujący wrażenie świetlne.
Pod wzglądem siły bodźce dzielimy na:
Podprogowe
Progowe
Nadprogowe
Bodźce podprogowe zbyt słabe do wywołania pobudzenia komórki, nie wywołują depolaryzacji krytycznej, powodują jedyl1ie miejscową, nie rozprzestrzeniającą się odpowiedź błony komórkowej. Jeśli działają one w wielu miejscach błony komórkowej obok siebie równocześnie mogą się sumować i wywoływać depolaryzację krytyczną (sumowanie przestrzenne). Jeśli zaś działają. w jednym miejscu błony kolejno po sobie w odpowiednio' krótkich odstępach czasu dochodzi do sumowania bodźców. W czasie, którego następstwem jest depolaryzacja.
Bodźce progowe to najsłabsze bodźce, które doprowadzają depolaryzację do wartości krytycznej, której następstwem jest potencjał czynnościowy mający zdolność rozprzestrzeniania się
Bodźce nadprogowe to wszystkie bodźce o sile większej niż progowa
Podstawową właściwością komórek pobudliwych jest prawo "wszystko albo nic", które mówi, ze bodziec progowy wywołuje w komórce pobudzenie maksymalne. Na bodźce podprogowe komórki reagują tylko depolaryzacją miejscową (nie pojawia się, potencjal czynnościowy), a na różne bodźce nadprogowe odpowiadają potencjałem czynnościowym o Jednakowej amplitudzie takiej samej jak bodziec progowy.
Potencjał spoczynkowy
Warunkiem powalania potencjału czynnościowego jest istnienie potencjału spoczynkowego. W stanie spoczynku zewnętrzna powierzchnia błony komórkowej ma pewną. przewagę kationów, czyli jest naładowana dodatnio w stosunku do jej powierzchni wewnętrznej. Nazywa się to poprzecznym spolaryzowaniem błony, potencjałem błonowym lub bioelektrycznym potencjałem spoczynkowym. Za główne mechanizmy tej spoczynkowej różnicy potencjałów uważa się:
gradienty stężeń jonów po obydwu stronach błony komórkowej
2. przepuszczalność błony dla tych jonów,
3. działanie pompy Na.. / K
Gradienty stężeń jonów w poprzek bJol1y komórkowej:
- we wnętrzu komórki podczas spoczyl1ku przeważają aniony głównie białkowe oraz kationy potasu (30 razy więcej K niż na zewnątrz)
- na zewnątrz komórki przeważają jony Na (10 razy więcej niż wewnątrz), oraz Cl (10 razy więcej niż wewnątrz).
Przyczyny przestrzennej separacji jonów:
- duże aniony białkowe są strukturalnie związane z protoplazmą komórkową i nie podlegają dyfuzji, nadają one ujemny ładunek wnętrza komórki, który jest zbliżony do potencjału równowagi (Nernsta) dla jonów potasu (-92 mV). Jony potasowe dążą do osiągnięcia wnętrza komórki. Jest to podstawą nierównomiernego rozmieszczenia jonów, przewagi jonów potasu w komórce. Potencjał równowagi dla jonów sodu wynosi +58mV, co powoduje przewagę. stężenia jonów sodu na zewnątrz komórek.
- chlor- błona komórkowa jest dla niego przepuszczalna w dużym stopniu, a1e wobec dużego stężenia anionów organicznych wewnątrz komórki jest on od niej odpychany,
- sód i potas -asymetria dystrybucji tych jonów jest wynikiem aktywnego transportu tych jonów -system pomp sodowo -potasowych ( transportująca ATPaza), oraz różnej przepuszczalności błon dla tych jonów.
Na skutek aktywności pompy dostające się do wnętrza jony sodowe Są stale usuwane na zewnątrz komórki. a do jej wnętrza dostają się jony potasowe ( 2 jony K za 3 jony Na ). ATP- aza jest aktywowana przez jony sodowe dzia1ające na wewnętrznej powierzchni błony komórkowej.
Będąca w spoczynku błona komórkowa jest najbardziej przepuszczalna dla jonów potasowych. mniej dla chlorkowych j minimalne dla jonów sodowych. Jeśli przyjmiemy przepuszczalność dla K za 2. to dla pozostałych wynosi ona 0,45 dla CI i 0.04 dla Na. Dzięki tej przestrzennej separacji wnętrze komórki jest naładowane \ujemnie. A stan taki nazywany polaryzacją komórki. Wielkość tej polaryzacji określa potencjał spoczynkowy. który jest różnicą. pomiędzy wnętrzem komórki a jej powierzchnią. Wielkość potencjału spoczynkowego jest głównie określona przez wielkość gradientu stężeń jonów potasowych i jest zbliżona do potencjału równowagi dla tego jonu. W neuronach potencjał ten wynosi ok. -70 m. Zmiana stanu spolaryzowania komór może iść w kierunku depolaryzacji (zmniejszenia spoczynkowej różnicy potencjałów) lub w kierunku hiperpolaryzacji (zwiększenia spoczynkowej różnicy potencjałów). Bodziec depolaryzacyjny wywołuje najpierw tzw. zmiany elektrotoniczne -bierne, na których szczycie pojawia się odpowiedź miejscowa -czynna, nie mająca zdolności rozprzestrzeniania się. Dopiero po osiągnięciu poziomu depolaryzacji krytycznej -progowej dochodzi do powstania potencjały czynnościowego tzw. iglicowego. Pojawia się. on zgodnie z prawem wszystko albo nic i posiada zdolność rozprzestrzeniania się.
Potencjał czynnościowy
W czasie pobudzenia komórki dochodzi do następujących zmian:
Bodziec depolaryzacyjny powoduje wzrost przepuszczalności błony komórkowej dla sodu. który wnikając do wnętrza komórki niweluje jej ujemny potencjał. Okres ten nosi nazwę aktywacji sodowej. Przepuszcza1cosć dla sodu wzrasta kilkaset razy w porównaniu do stanu spoczynkowego, aktywacja sodowa trwa ok. 0.5 ms. W wypadku niewstrzymania dyfuzji sodu. wnętrze komórki zgodnie z potencjałem równowagi sodu osiągnęłoby wartość + 58m V. a osiąga wartość tylko ok. +20 m V. Ograniczenie to jest wynikiem inaktywacji sodowej przy potencjale wnętrza ok. -50 m V oraz aktywacji potasowej, w wyl1iku której jony potasowe wędrują do środowiska zewnątrzkomórkowego. Proces inaktywacji sodowej i aktywacji potasowej odpowiedzialny jest za repolaryzację czyli powrót potencjału ujemnego komórki. Repolaryzacja kończy potencjał czynnościowy. Z chwilą i jej ukończenia w komórce znajduje się, większa ilość sodu, a mniejsza potasu w stosunku do stanu spoczynkowego -wyjściowego. Normalne stosunki jonowe przywraca pompa sodowo -potasowa. Repolaryzacja komórki odbywa się coraz wolniej I w miarę zbliżania się. potencjału do wartości wyjściowej. Tę powolną końcową fazę repolaryzacji nazywamy potencjałem następczym dodatnim. Po nim wystąpić może faza nieznacznej hyperpolaryzacji -tzw. ujemny potencjał następczy będący wynikiem dużej aktywności pompy sodowo -potasowej. usuwającej więcej jonów sodowych na zewnątrz niż dostających się do wewnątrz jonów potasowych.
Zmiany pobudliwości w trakcie trwania potencjału czynnościowego.
Zmiany depolaryzajcyjne i hiperpolaryzacyjne pojawiające się w wyniku pobudzenia komórki powodują zmiany jej pobudliwości. W czasie depolaryzacji i repolaryzacji, gdy potencjał wnętrza jest wyższy od potencjału inaktywacji sodowej (ok. -55 mV), komórka jest niepobudliwa stan ten określamy mianem refrakcji bezwzględnej. Oznacza to, że w tym czasie żaden bodziec. Bez względu na siłę nie może i wywołać pobudzeniu. Poniżej tej wartości ( -55 m V) pobudliwość komórki stopniowo powraca, ale jest jeszcze obniżona. Silne bodźce mogą w tym okresie wywołać pobudzenie. Jest to okres refrakcji względnej. W czasie, gdy w trakcie repolaryzacji potencjał błonowy znajduje się w pobliżu wartości depolaryzacji krytycznej Występuje krótki okres nadpobudliwości (nie we wszystkich komórkach pobudliwych), inaczej -egzaltacji. W kolejnej fazie -potencjału następczego ujemnego komórka przechodzi ponownie okres zmniejszonej pobudliwości, gdyż potencjał blol1owy komórki oddala się od wartości depolaryzacji krytycznej i trzeba użyć silniejszego bodźca niż w czasie całkowitego powrotu komórki do stanu spoczynkowego. Po przeminięciu ujemnego potencjału następczego pobudliwość komórki powraca do wartości wyjściowej. Zmiany pobudliwości komórki w trakcie pobudzenia tłumaczą wpływ częstości bodźców na skuteczność ich działania. Jeśli przerwy między kolejnymi bodźcami przypadają na okres refrakcji względnej lub hyperpolaryzacji, (czyli okresy zmniejszonej pobudliwości), to tylko niektóre będą w stanie pobudzić komórkę
Bodźce działające na komórkę w fazie refrakcji bezwzględnej nie wywołują oczywiście pobudzenia. Rytm takich bodźców określamy jako pessimum rytmu. Jeśli kolejne bodźce przypadają na fazę egzaltacji mówimy o optimum rytmu.
Przewodzenie informacji w obrębie neuronu.
Sprzężenie elektromechaniczne w komórkach mięśniowych.
Rodzaje skurczów mięśni.
Klasyfikacja mięśni poprzecznie prążkowanych i gładkich.
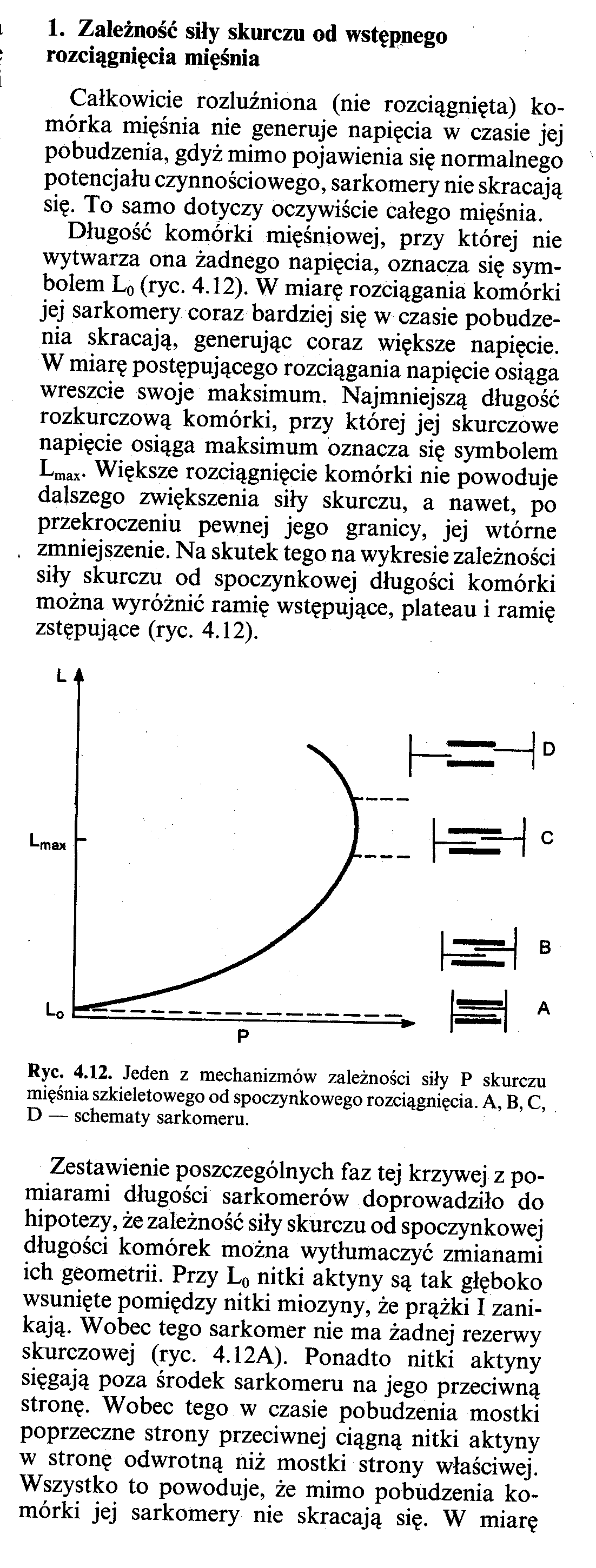
Wyróżniamy trzy typy mięsni szkieletowych:
Typ I -komórki powolne (czerwone), posiadają dużo sarkoplazmy, mioglobiny, mitochondriów oraz obfitą. ilość naczyń włosowatych. Występuje tu przewaga metabolizmu tkankowego tlenowego, skurcze narastają powoli, a skurcze tężcowe mogą utrzymywać się bardzo długo, bez narastania objawów zmęczenia (np. Miśnie grzbietu, mięśnie wykonujące prace długotrwała, a mało dokładną).
Typ II a -komórki szybkie (białe) posiadają mniej sarkoplazmy, mioglobiny, mitochondriów. W czasie W czasie skurczu napięcie narasta szybko, dlatego na skutek szybkiego zmęczenia skurcz tężcowy może utrzymywać się krótko. Występuje tu przewaga metabolizmu beztlenowego (np. mięsnie oka, palców -mięśnie wykonujące czynności szybkie, precyzyjne ale krótkotrwale).
Typ II b -grupa pośrednia komórek szybkich ale o przewadze metabolizmu tlenowego. W czasie pobudzenia rozwija się szybko, jednak skurcze tężcowe utrzymują się dłużej niz. w komórkach typu II a, lecz krócej niż w komórkach typu I.
W zależności od ilości zakończeń układu autonomicznego unerwiających komórki mięśniowe, mięśnie gładkie podzielono na trzy grupy:
Mięśnie gładkie wielojednostkowe -cechują się. bardzo obfitym unerwieniem. Nerwy wspó1czulne rozgałęziają się w pobliżu komórek mięśniowych tworząc tzw. splot podstawny z licznymi żylakowatościami, w których zmagazynowane są transmitery- noradrenalina. Żylakowatosci pozostają tu w bardzo bliskim kontakcie z miocytami co sprawia, ze odległości, które pokonuje transmiter są niewielkie i jego stężenie na receptorze komórkowym jest duże. Dlatego już niewielka częstotliwość wyładowań we włóknie odśrodkowym powoduje silną odpowiedź. W takich mięśniach pobudzenie trwa krótko i skurcz ustępuje szybko po Ustaniu dopływu impulsów nerwowych.
Mięśnie wjelojednoslkowe są poddane silnej kontroli nerwowej i nie mają automatyzmu. Przykładem są mięśnie ściany nasieniowodów, źrenicy, drobnych tętniczek.
Mięśnie gładkie jednostkowe (trzewne) -cechują się bardzo skąpym unerwieniem i dużymi odległościami pomiędzy żylakowatościami, a miocytami, wobec czego efekty drażnienia nerwów wspó1czulnych są słabe, pojawiają. się z dużym opóźnieniem i wymagają. dużej częstotliwości. W tego typu mięśniach skurcz utrzymuje się. dłużej. Mięśnie trzewne są słabo kontrolowane przez układ autonomiczny oraz charakteryzują się występowaniem licznych komórek rozruszl1ikowych. Przykładem są. Mięśnie gładkie jelita (poza zwieraczami), dużych naczyń tętniczych i ściany moczowodu.
Grupa mięśni gładkich pośrednich -cechuje się unerwieniem asymetrycznym, gdzie niektóre komórki znajdują się blisko żylakowatości, a inne położone są od nich daleko. Przykładem są ściany małych i średnich tętnic.




Układ wrzecionkowo-zwrotny


Autonomiczny Układ Nerwowy
Kryteria podziału układu wegetacyjnego
Autonomiczny układ nerwowy (wegetatywny) stanowi część układu nerwowego, która przewodzi impulsy do narządów wewnętrznych, zaopatrując ich mięśnie gładkie, naczynia krwionośne, gruczoły i inne komórki. Wraz z układem dokrewnym decyduje o homeostazie organizmu. Pozwala na dynamiczne zmiany czynności narządów zależne od działania różnych bodźców środowiskowych.
Choć teoretycznie AUN funkcjonuje niezależnie od układu somatycznego, to reaguje on bardzo silnie na stany emocjonalne, dlatego tworzy z układem somatycznym funkcjonalną całość.
W układzie autonomicznym impulsy z CNS do efektorów w narządach trzewnych przewodzone są dwoma neuronami:
Przedzwojowym- ma swe ciało komórkowe w pniu mózgu lub rogach bocznych rdzenia kręgowego
Pozazwojowym- ma swe ciało komórkowe w obwodowych zwojach autonomicznych.
Autonomiczny układ nerwowy dzielimy na:
Część parasympatyczną
Część sympatyczną
Część czuciową (aferentną) - rozpoczyna się w różnych receptorach narządów wewnętrznych, czyli enteroreceptorach. Przewodzi czucie trzewne, bierze udział w odruchach
Część enteryczna (jelitowa) jest niezależna od pozostałych części, bazuje na krótkich odruchach w narządach trzewnych
Cześć współczulna
Ciała komórkowe neuronów przedzwojowych są w rogach bocznych substancji szarej rdzenia, tworząc jądro pośrednio-boczne w odcinkach C8-L3. Ich aksony wychodzą z rdzenia jako gałązki łączące białe i kończą się jako włókna przedzwojowe jako synapsy na komórkach zwojów pnia współczulnego ciągnącego się od części szyjnej aż po krzyżową:
Część szyjna -3 zwoje
Część piersiowa - 11-12 zwojów
Część lędźwiowa 3-4 zwoje
Część krzyżowa 4-5 zwojów
Część ogonowa - 1 zwój
Pojedynczy akson przedzwojowy tworzy przeciętnie synapsy z 15 neuronami pozazwojowymi i jest to zjawisko dywergencji, ale też każdy neuron zwojowy tworzy synapsy z wieloma neuronami przedzwojowymi (konwergencja)
Aksony pozazwojowe są nizmielinizowane i poprzez gałązki łączące szare wchodzą w skład nerwów somatycznych (dzięki połączeniu z nerwami rdzeniowymi).
Neurony pozazwojowe w części szyjnej pnia wysyłają włókna do tkanek i narządów głowy, szyi i klatki piersiowej, a w części piersiowo-brzusznej do narządów jamy brzusznej i miednicy mniejszej oraz narządów płciowych.
Serce zaopatrują włókna z 3 zwojów szyjnych i 5-6 górnych piersiowych. Tworzą one nerwy piersiowe.
Mięśnie gładkie oskrzeli i naczyń płuc mają włókna sympatyczne z dolnego zwoju szyjnego i górnych piersiowych (tworzą sploty płucne)
Narządy jamy brzusznej (wraz z nerkami) są zaopatrywane przez włókna wychodzące ze zwojów przedkręgowych oraz obwodowych zwojów jamy brzusznej (trzewny i kreskowy górny), a także miednicy małej (zwój kreskowy dolny)
Te włókna pozazwojowe biegną wraz z rozgałęzieniami aorty brzusznej do wszystkich narządów, oprócz rdzenia nadnerczy, bo jego komórki stanowią modyfikacje pozazwojowych włókien współczulnych.
Włókna przedzwojowe stanowią w 70% włókna B z cienką osłonką mielinową, natomiast 30% to cinsze, bezmielinowe włókna C przewodzące wolniej niż B.
Uwalniają (zarówno B i C) one acetylocholinę działającą na receptory typy N, poza tym w zwojach neurony pośredniczące mogą uwalniać dopaminę.
Włókna pozazwojowe są głównie cienkie i bezmielinowe (typ C), które rozgałęziają się i tworzą gęstą sieć z licznymi zgrubieniami tzw. żylakowościami (zawierają one liczne pęcherzyki z noradrenaliną związane z ATP i dopaminą oraz większe pęcherzyki z neuropeptydem Y(NPY)).
Noradrenalina aktywuje receptory adrenergiczne α1 a hamuje swoje własne wydzielanie przez autoreceptory α2 w błonie presynaptycznej. Ale wydzielanie noradrenaliny może też być blokowane przez acetylocholinę, która zadziała na receptory M2, oraz przez dopaminę, serotoninę i peptydy opioidowe.
UKŁAD PRZYWSPÓŁCZULNY
Cechuje go na ogół mniejsza dywergencja niż układu sympatyczny. Przeciętnie jeden przywspółczulny neuron przedzwojowy zaopatruje tylko dwa neurony pozazwojowe, czyli jest to stosunek 1:2, w części przywspółczulnej wynosi ona 1:15.
Włókna pozazwojowe są krótkie, typ C, mają pęcherzyki z acetylkocholiną i większe pęcherzyki z kotransmiterem - VIP, dynorfiną, cholecystokininą, enkefalinami, substancją P, neurokininą A i B i peptydem pochodnym genu kalcytoninowego - CGRP.
Acetylocholina działa na receptory muskarynowe (M) lub nikotynowe (N), działa krótko gdyż jest szybko rozkładana. Działając na presynaptyczny autoreceptor M2 hamuje swoje uwalnianie
Część współczulną dzielimy na odcinki:
Głowowy - neurony ośrodkowe tego odcinka znajdują się w przywspółczulnych jądrach nerwów czaszkowych III, VII, IX i X. Włókna przedzwojowe są stosunkowo długie i kończą się synapsami w zwojach blisko lub wewnątrz unerwianych narządów: zwój rzęskowy (dla nerwu VII), klinowo podniebienny (VII) i podjęzykowy (VII), uszny (IX), a dla nerwu błędnego wiele zwojów rozrzuconych od tchawicy, oskrzeli, poprzez serce, aż do przewodu pokarmowego.
Krzyżowy - jego neurony są w słupach pośrednio-bocznych istoty szarej w segmencie S1-S3. Włókna przedzwojowe tworzą nerw miedniczny i oddają synapsy na neuronach zwojowych w narządach i naczyniach miednicy mniejszej, jelicie grubym, odbytnicy, narządach płciowych
Krótkie włókna pozazwojowe układu przywspółczulnego zawierają pęcherzyki z acetylocholiną oraz neuromodulatory.
Część jelitowa, neurony rozmieszczone są w ścianach całego przewodu pokarmowego skupiają się w dwóch splotach śródściennych:
Podśluzówkowym (reguluje czynność wydzielniczą błony śluzowej i śluzówkowy przepływ krwi)
Śródmięśniowy (kieruje motoryką mięśni gładkich)
Neurony tych dwóch splotów działają jako ośrodki lokalnych odruchów i integrują wzorce ruchowe przewodu pokarmowego, wydzielanie gruczołów trawiennych, wchłanianie i wydzielanie śluzu i soku jelitowego. Czynność tych splotów jest modulowana przez nerw X i trzewne nerwy współczulne. Te sploty (głownie śródmięśniowy) realizują zaprogramowany wzorzec ruchowy, czyli ruchy perystaltyczne zgodnie ze schematem:
Rozciągnięcie ściany przewodu pokarmowego ----impuls---> mechanoreceptory -----> neurony czuciowe -----> interneurony:
Hamują neurony eferentne, hamujące mięśnie okrężne
Pobudzają
Powstaje w rezultacie propulsywna fala perystaltyczna przesuwająca treść pokarmową. W splotach śródmięśniowych są szczególne tzw. komórki Cajala, które działają jak komórki rozrusznikowe, bo wykazują powolna spoczynkową depolaryzację niezależną od pobudzeń synaptycznych.
Synapsy splotu mięśniowego uwalniają głównie acetylocholinę i liczne neuropeptydy pobudzające:
Motylinę
Peptyd uwalniający gastrynę
VIP
Substancję P
Ale także hamujące:
Somatostatynę
Enkefaliny
Galaninę
Neuropeptyd Y
Nerw błędny poprzez cholinergiczne włókna przedzwojowe wzmaga aktywność splotów jelitowych i przyśpiesza częstość rytmu komórek Cajala, natomiast włókna pozazwojowe nerwów współczulnych ze zwojów kręgowych oraz zwoju przedkręgowego: trzewnego i kreskowego górnego, hamują te neurony w splotach poprzez noradrenalinę (działając na receptory α).
Neurony splotu podśluzówkowego pobudzane są prze chemoreceptory i mechanoreceptory błony śluzowej przewodu pokarmowego.
Błona śluzowa dwunastnicy i jelit jest obficie unerwiona przez bezmielinowe czuciowe włókna nocyceptywne typu C oraz mielinowe typu A δ, pobudzane uszkadzającymi bodźcami, jak np. HCl, sole kwasów żółciowych, duże stężenie alkoholu, kwas acetylosalicylowy.
Te odruchy nocyceptywne z błony śluzowej jelita chronią śluzówkę żołądka i jelit przed uszkodzeniem.
Głównym transmiterem uwalnianym w wyniku tych odruchów jest peptyd pochodny genu kalcytoninoweg CGRP. Działanie ochronne CGRP polega na uwalnianiu tlenku azotu (NO). NO powoduje rozszerzenie lokalnych naczyń błony śluzowej przewodu pokarmowego i zwiększa dostawę tlenu i substancji odżywczych. Podobnie działają prostaglandyny. CGRP powoduje też wydzielanie somatostatyny, która hamuje wydzielanie soku żołądkowego, zmniejszając uwalnianie histaminy, gastryny i acetylocholiny pobudzających komórki okładzinowe w żołądku.
Generalnie cechą funkcjonalną tego układu są liczne odruchy, których pętla zamyka się w obrębie jednego aksonu bez udziału ciała komórkowego, (czyli odruchy aksonalno- aksonalne) lub w obrębie zwojów autonomicznych, ale poza centralnym układem nerwowym (odruchy zwojowe). Takie odruchy należą do mechanizmów koordynujących czynności motoryczne, wydzielnicze i krążeniowe układu trawiennego.
Transmittery i kotransmisja w autonomicznym układzie nerwowym
Układ współczulny określa się jako noradrenergiczny, a układ przywspółczulny jako cholinergiczny, ale istnieją wyjątki od tej reguły, bo np. cholinergiczne są współczulne włókna zazwojowe, unerwiające gruczoły potowe, czy ślinowe. Transmiterami są też liczne neuropeptydy. Jeden i ten sam neuron wydziela z reguły więcej niż jeden transmiter, a także neuromodulatory i kotransmitery.
Pozazwojowe włókna współczulne: oprócz głównego transmitera- noradrenaliny, uwalniają jako kotransmiter ATP i neuropeptyd Y (NPY). Główna rolą NPY jest działanie troficzne na naczynia krwionośne. Powoduje on przerost mięśni gładkich ściany naczyniowej przy częstym pobudzaniu układu współczulnego. Poza tym NPY pobudza angiogenezę czyli powstawanie nowych naczyń mikrokrążenia.
Niektóre włókna współczulne unerwiające naczynia błony śluzowej żołądka i jelit są histaminergiczne a unerwiające nerki są dopaminegiczne.
Noradrenalina aktywuje postsynaptyczne receptory α1 (w mięśniu sercowym β1, a w komorach serca także β2). Powinowactwo jej do receptorów β2 jest duże w sercu, a nieznaczne w naczyniach krwionośnych. Ponadto NA działając na presynaptyczny receptor α2 hamuje swoje własne uwalnianie. Oprócz takiego sprzężenia zwrotnego ujemnego działa też sprzężenie zwrotne dodatnie, gdy w sytuacji stresowej rdzeń nadnerczy wydziela do krwi dużo adrenaliny, to ona oprócz działania na postsynaptyczny receptor β2, działa też na presynaptyczny autoreceptor β2 i zwiększa przez to wydzielanie NA.
Poza tym acetylocholina hamuje wydzielanie poprzez działanie na heteroreceptor presynaptyczny M2 w błonie zakończeń współczulnych i w ten sposób układ przywspółczulny może hamować przywspółczulny. Takie hamowanie wykazują też: dopamina, histamina, serotonina.
Po przeminięciu pobudzenia transmitery są rozkładane lub usuwane aktywnym wychwytem zwrotnym do aksoplazmy splotu podstawnego. NA rozkłada MAO (monoaminooksydaza) i tylko częściowo jest ona wykorzystywana ponownie jako transmiter. Poza tym NA eliminowana jest też enzymatycznie w otaczających tkankach przez tlenową metylotransferazę katecholową (COMT), albo w wątrobie przez MAO.
Neuropeptyd Y (NPY) i inne peptydy zakończeń współczulnych nie ulegają wychwytowi zwrotnemu i eliminowane są powoli przez swoiste peptydazy.
Natomiast w pozazwojowych włóknach przywspółczulnych oprócz głównego transmitera- acetylocholiny, wydzielany jest kotransmiter VIP (wazoaktywny peptyd jelitowy). Wraz z nim wydzielany jest NO. Uwalniają się one m.in. w oskrzelach, działają na naczynia w śliniankach, a w części krzyżowej AUN powodują skurcz mięśnia wypieracza moczu poprzez działanie na receptory M2 i M3.
Włókna przywspółczulne unerwiające podstawę i szyjkę pęcherza moczowego oraz zwieracz wewnętrzny cewki moczowej działają poprzez NO powodując rozkurcz mięśni gładkich i oddanie moczu.
Jako kotransmitery włókien przywspółczulnych, ale przedzwojowych występują:
Przysadkowy peptyd aktywujący cyklazę adenylanową (PACAP)
Hormon uwalniający gonadotropiny (GnRH)
Peptyd opioidowy (enkefalina leucynowa)
Acetylocholina działa krótko i na ograniczonym obszarze, bo jest szybko rozkładana przez esterazę cholinową. Powstaje wówczas cholina wykorzystywana do resyntezy acetylocholiny. Natomiast VIP nie ulega wychwytowi zwrotnemu. Generalnie rozszerza on oskrzela, naczynia ślinianek, naczynia końcowej części jelita grubego i odbytnicy.
Receptory komórkowe i drugie przekaźniki w UA
W autonomicznym układzie nerwowym (AUN) transmitery działają podobnie na komórki docelowe jak hormony. Są tzw. pierwszymi przekaźnikami i zapoczątkowują przenoszenie informacji do wnętrza komórki. Taki transmiter musi połączyć się z receptorem komórkowym, który jest do niego dopasowany jak zamek do klucza. Wyjątek stanowi tlenek azotu i tlenek węgla, ponieważ one dyfundują swobodnie przez błonę, a tlenek azotu łączy się bezpośrednio z cyklazą guanylową. Receptory komórkowe składają się z szeregu podjednostek, a każda podjednostka posiada swój odrębny gen i swoisty mRNA. Dla noradrenaliny i adrenaliny wyróżniamy dwa receptory α i cztery β. Transmiter współczulny NPY działa przez receptor Y a kotransmiter ATP poprzez P2x i P4y. Dopamina działa przez receptory D(1-5). W układzie przywspółczulnym zidentyfikowano sześć receptorów M dla acetylocholiny.
Receptory komórkowe dzielimy na dwie grupy:
jonotropowe
metabotropowe
Receptory jonotropowe stanowią podjednostkę kanałów jonowych, a połączenie się ich z transmiterem powoduje otwarcie lub zamknięcia białka- kanału. Takim receptorem jest np. receptor acetylocholinowy typu N pośredniczący w transmisji zwojowej neuronów zwojowych lub uwalniany z zazwojowych włókien współczulnych receptor purynergiczny P2x dla ATP.
Znaczna większość receptorów dla transmiterów AUN należy do metabotropowych. Zawierają one siedem domen transbłonowych (M1-M7), na zewnątrz wystają trzy domeny zewnątrz komórkowe (E1-E3) - mają one koniec aminowy, a domeny wewnątrzkomórkowe (C1-C3) mają koniec karboksylowy. Domeny zewnątrzkomórkowe zawierają dodatkowo reszty cukrowe. Transmiter wiąże się z domenami M2-M4, co zmienia konformację receptora i powoduje przyłączenie się go w kompleks z białkiem regulacyjnym G. Ma ono trzy podjednostki i może mieć charakter pobudzający lub hamujący. W wyniku tego połączenia dwie podjednostki białka G odłączają się, a pozostaje związana jednostka α-GTP. Podjednostka ta ma właściwości GTP-azy i szybko rozpada się, ale nim to nastąpi przekaże sygnał dalej. Receptory metabotropowe dzielą się pod względem rodzaju drugiego przekaźnika na;
receptory kaskady cAMP
receptory cyklu inozytolo- fosfolipidowego
receptory działające przez inne przekaźniki
Transmisja zwojowa
Pojedynczy neuron współczulny przedzwojowy oddaje 4-15 wypustek na neurony zazwojowe (zjawisko konwergencji), jest to konieczne, ponieważ większość neuronów zazwojowych wymaga sumowania wielu potencjałów postsynaptycznych, aby wygenerować potencjał czynnościowy. Ale są takie neurony, którym wystarczy tylko jeden neuron przedzwojowy generujący jeden duży pobudzający potencjał postsynaptyczny (EPSP). Takie neurony są bardziej pobudliwe i maja charakter fazowy. Ich przeciwieństwem są neurony toniczne charakteryzujące się wolnym, ale stałym rytmem wyładowań.
Rodzaje neuronów zwojowych:
Większe typu B
Małe typu C
Na neuronach C synapsy oddają włókna przedzwojowe typu C, stanowiące około 40% całej populacji włókien przedzwojowych.
Na neuronach B synapsy oddają głownie włókna typu B.
Acetylocholina uwalniana z zakończeń przedzwojowych działa na jonotropowe receptory N i metabotropowe M. Blokerem receptora N jest heksametonium i inne pochodne amin czwartorzędowych.
Transmisja w zwojach współczulnych przebiega w trzech fazach:
Faza wczesna- odpowiada jej krótkotrwały duży potencjał postsynaptyczny pobudzający (fEPSP), wywołany pobudzeniem receptora N. Następnie pojawia się powolny potencjał (sEPSP), trwa on kilkadziesiąt sekund, a wywołany jest przez pobudzenie przez acetylocholinę receptorów M1- zwiększa to pobudliwość neuronów.
Hamująco na neurony zwojowe działa adenozyna przez receptor A1, natomiast pobudzająco wpływa ATP (przez receptor P2x) zwiększając napływ jonów wapnia.
Faza późna- pojawia się tu postsynaptyczny potencjał hamujący (IPSP) wywołany przez małe komórki zwojowe zawierające dopaminę. Hamuje ona neurony zwojowe przez receptor D1.
Faza bardzo późna- występuje tu późny powolny potencjał postsynaptyczny (lsEPSP). Wywołują go neuropeptydy uwalniane przez włókna przedzwojowe typu C, m.in.: PACAP, czyli przysadkowy polipeptyd aktywujący cyklazę adenylanową, hormon podwzgórzowy uwalniający gonadotropiny (GnRH).
Transmisja zwojowa modulowana jest także presynaptycznie, np. niektóre włókna przedzwojowe, zarówno w zwojach współczulnych i przywspółczulnych, oddają synapsy aksono- aksonalne i uwalniają enkefalinę leucynową. Hamuje ona uwalnianie acetylocholiny z zakończeń presynaptycznych. Takie opioidowe sprzężenie zwrotne ujemne ogranicz długotrwałe pobudzenie układu współczulnego i wydzielanie z rdzenia nadnerczy w stanach stresu emocjonalnego.
Synapsa adrenergiczna i cholinergiczna
Transport aksonalny
Pęcherzyki synaptyczne powstają w perikarionie i przesuwają się do synapsy wzdłuż aksonu z prędkością 40 cm/dobę. Tj. szybki transport aksonalny z udziałem mikrotubul oraz białka kinezyny (białko z rodziny MAP).
Natomiast transport wolny (2-8 mm/dobę) i bardzo wolny (0,2-1 mm/dobę) odbywa się za pomocą ruchów aksoplazmy.
Natomiast transport wsteczny zużytych pęcherzyków do ciała komórki odbywa się dzięki dyneinie i dynaminie.
Porównanie układu sympatycznego i parasympatycznego
Pod względem fizjologicznym obie części układu autonomicznego: sympatyczny i parasympatyczny, wykazują działanie antagonistyczne.
Z reguły narządy są unerwione przez obie te części, ale w niektórych wpływ wykazuje tylko, lub głównie jedna część a w jeszcze innych- obie części AUN działają jednokierunkowo, np. w gruczołach ślinowych.
Z reguły układ sympatyczny działa przez noradrenalinę, wyjątek stanowi tylko rdzeń nadnerczy, gdzie przedzwojowe włókna współczulne uwalniają acetylocholinę, oraz w gruczołach potowych też wydzielana jest acetylocholina. Natomiast w kanalikach nerkowych oprócz NA działa też dopamina.
W układzie przywspółczulnym głównym transmiterem jest wyłącznie acetylocholina, chyba, że weźmiemy pod uwagę narządy płciowe (ciała jamiste prącia i łechtaczki) oraz mięsień zwieracz cewki moczowej wewnętrzny, których rozszerzenie i rozkurcz powoduje głównie tlenek azotu NO.
NO działa także wspólnie z VIP w mięśniach oskrzeli poprzez tzw. NANC czyli włókna nieadrenergiczne i niecholinergiczne.
HORMONY
Regulacja wydzielania hormonów
Hormon to związek chemiczny wytwarzany przez gruczoły dokrewne, przenoszony przez krew i wpływający na czynność innych gruczołów bądź tkanek. Ta stara definicja powinna być poszerzona, o neurohormony, (które są pod działaniem układu nerwowego) oraz o hormony hipofizjotropowe, (które hamują i powodują wydzielanie hormonów przysadki).
Powodują one zachowanie homeostazy przez nasz organizm i w zależności od umiejscowienia komórek, na które wpływają można ich działanie podzielić na:
działanie parakrynne - działają na sąsiednie komórki, dyfundując do nich przez przestrzeń międzykomórkową,
działanie autokrynne - regulują aktywność komórek, przez które są wydzielane,
działanie endokrynne - oddziałują na komórki odległych tkanek lub narządów docierając do nich z krwią,
działanie neurokrynne - uwalnianie neuroprzekaźników z zakończeń nerwowych i ich dyfuzja do komórek docelowych.
Hormony można podzielić na kilka grup, z jednej strony ze względu na zakres działania, z drugiej przyglądając się ich budowie chemicznej. Podział hormonów uwzględniający zakres działania:
hormony miejscowe - są to związki chemiczne wytwarzane przez różne komórki i działające w najbliższym sąsiedztwie miejsca uwalniania, przykłady: serotonina, histamina, acetylocholina, prostaglandyny,
hormony tkankowe - są to związki chemiczne wytwarzane przez komórki nie skupione w oddzielnych gruczołach dokrewnych i działające na czynność innych narządów w pobliżu uwalniania, przykłady: hormony układu pokarmowego (gastryna, sekretyna, motylina, itp.), nerek (erytropoetyna, renina, itp.), serca,
hormony o działaniu ogólnym - wydzielane przez swoiste gruczoły dokrewne i docierające do narządów docelowych dzięki prądowi krwi, przykłady: hormony przysadki, tarczycy, grasicy, trzustki, nadnerczy, jąder, jajników, przytarczyc i łożyska.
Uwzględniając natomiast budowę chemiczna hormony można podzielić na:
hormony aminokwasowe - rozpuszczalne w wodzie, z trudnością przenikają przez bariery lipidowe (wyjątek trójtyronina, tyroksyna), po podaniu doustnym mogą być skuteczne bądź nie, przykłady: tyroksyna, trójtyronina, adrenalina, noradrenalina, melatonina,
hormony polipeptydowe - w ich skład wchodzą aminokwasy, których liczba może wahać się od 3 do 191, są rozpuszczalne w wodzie, nie przenikają przez błonę białkowo-lipidową, dlatego działają przez przekaźniki wtórne, w osoczu nie wymagają żadnych białek transportowych, po podaniu doustnym są nie skuteczne, przykłady: hormony przysadki, przytarczyc, kalcytonina, trzustki,
hormony steroidowe - swą budową podobne są do cholesterolu, z łatwością przenikają przez błonę białkowo-lipidową, dlatego nie wymagają przekaźników wtórnych, w osoczu przenoszone są dzięki specjalnym białkom transportowym, po podaniu doustnym są skuteczne, przykłady: hormony jajników, jąder, kory nadnerczy, łożysko i aktywna hormonalna postać witaminy D3.
Czynności gruczołów dokrewnych są regulowane dzięki różnym mechanizmom, które można podzielić na:
kontrolę typu nerwowego - związana z regulacją wydzielania hormonów przez układ autonomiczny, niemal wszystkie gruczoły dokrewne są unerwione przez ten układ, który wpływa na ich aktywność hormonalną. Uwalnianie hormonów może być bezpośrednio związane z autonomicznym układem nerwowym, przykład uwalnianie hormonów podwzgórzowych bądź insuliny przez nerwy cholinergiczne,
kontrolę typu hormonalnego - polega na bezpośrednim działaniu pobudzającym hormonów na wydzielanie tych gruczołów i ich wpływie troficznym, przykładem mogą być hormony tropowe przysadki działające na podległe im gruczoły - ACTH działający na korę nadnerczy, dzięki czemu wzrasta uwalnianie kortyzolu,
kontrola typu metabolicznego - bezpośredni wpływ produktów lub substratów przemiany materii na uwalnianie hormonów, przykładem może być wpływ jonów Ca2+ na wydzielanie parathormonu, podwyższenie poziomu glukozy pobudzające wydzielanie insuliny.
Cały układ dokrewny działa za pośrednictwem zamkniętych pętli sprzężeń zwrotnych (ujemnych bądź dodatnich). Ujemne działają w warunkach fizjologicznych, dodatnie natomiast w patologii.
W sprzężeniach tych występują pętle krótkie i długie. W sprzężeniach tych biorą udział hormony podwzgórza (liberyny i statyny), hormony tropowe przysadki oraz właściwe hormony gruczołowe. Wydzielanie tych trzech rodzajów hormonów, jest ze sobą powiązane i nawzajem regulowane. Liberyny powodują uwolnienie hormonów tropowych przysadki, a one działają na sobie podległe gruczoły uwalniające właściwe hormony. Gdy stężenie tych właściwych hormonów osiągnie zbyt wysoki poziom wtedy wpłyną one na podwzgórze i przysadkę hamując wydzielanie hormonów przez te gruczoły (jest ta zwana długa pętla sprzężenia zwrotnego). Istnieje także pętla krótka, która umiejscowiona jest między przysadką i podwzgórzem, która nawzajem kontroluje uwalnianie hormonów przez te gruczoły.
+ - -
+ -
Regulacja za pomocą sprzężeń zwrotnych, strzałki narysowane linią ciągłą pętle długie, strzałki narysowane linią przerywaną pętle krótkie.
Hormony wykazują pewne analogie w działaniu, do których należą:
okres utajonego pobudzenia (latencji) jest zwykle dłuższy od latencji układu nerwowego może wynosić od kilku sekund, do kilku dni,
hormony zapewniają homeostazę organizmu dzięki, temu że są ich wydzielanie jest regulowane za pomocą sprzężeń zwrotnych,
kontrolują reakcję o kluczowym znaczeniu dla metabolizmu komórkowego, np. stężenie glukozy we krwi i jej dostawa do komórek,
występują w bardzo małych stężeniach, około 10-4 - 10-7 mol/L
mogą wywierać działanie na kilka tkanek bądź wiele hormon może działać na jedną tkankę,
w warunkach prawidłowych istnieje równowaga hormonalna, wytwarzanie hormonu jest ściśle połączone z jego metabolizmem.
Układ podwzgórzowo - przysadkowy
Podwzgórze jest częścią międzymózgowia koordynującą homeostazę organizmu. Ściśle współpracuje ono z przysadką mózgową, która leży w dole tureckim. Podwzgórze połączone jest przysadką, z płatem przednim dzięki naczyniom krwionośnym, z tylnym dzięki aksonom, których ciała komórkowe znajdują się w podwzgórzu. Oksytocyna i wazopresyna są hormonami syntetyzowanymi w podwzgórzu jako prohormony (jądrze przykomorowym i nadwzrokowym) i dzięki transportowi neuronalnemu są przenoszone do przysadki. Po drodze są one poddane działaniu enzymów, które przekształcają te prohormony w hormony. Dostają się one do przysadki, gdzie są łączone z odpowiednią neurofizyną (oksytocyna z neurofizyną I, a wazopresyna z neurofizyną II). Następnie pod wpływem określonego bodźca mogą zostać one uwolnione z przysadki, już jako aktywne hormony. Zachodzi to dzięki obecności jonów wapnia.
Natomiast liberyny i statyny są uwalniane przez podwzgórze do naczyń krwionośnych, gdzie razem z krwią wędrują do przysadki, która jest ich gruczołem docelowym.
Wazopresyna:
Hormon polipeptydowy,
Produkowana przez jądro nadwzrokowe podwzgórza,
Magazynowana w przysadce mózgowej, w płacie tylnym, w połączeniu z neutrofizyną II i uwalniana z niej dzięki jonom Ca2+,
Do czynników pobudzających wydzielanie z tylnego płata przysadki należą:
Wzrost ciśnienia osmotycznego osocza krwi (najważniejszy z czynników, pobudza on osmodetektory znajdujące się w okolicy jądra nadwzrokowego podwgórza, które powodują „obkurczenie” się tego jądra i uwolnienie wazopresyny z przysadki)
Zmniejszenie objętości i ciśnienia krwi,
Wzrost ciśnienia płynu mózgowo-rdzeniowego,
Działanie angiotensyny II,
Działanie prostaglandyn,
Działanie nikotyny,
Do czynników zmniejszających jej uwalnianie w przysadki należą:
Zwiększenie objętości krwi,
Wzrost ciśnienia tętniczego,
Działanie:
Wpływa hamująco na wydzielanie wody (ma działanie antydiuretyczne),
Działa poprzez receptory błonowe i cAMP
Zwiększa ilość kanałów wodnych w kanaliku dystalnym nerki, przez co zwiększa resorpcję wody w nerkach (zagęszcza mocz)
Powoduje obkurczenie naczyń krwionośnych, jedynie przy dużych krwotokach
Jest wydzielana razem z kortykoliberyną, dlatego pobudza wydzielanie ACTH, a co za tym idzie hormonów kory nadnerczy,
Zaburzenia:
Moczówka prosta - brak hormonu w organizmie, wydalanie bardzo dużej ilości, silnie rozcieńczonego moczu, może być pierwotna (bez wyraźnej przyczyny) bądź wtórna (uszkodzenie drogi podwzgórzowo-przysadkowej, w obrębie podwzgórza lub lejku).
Oksytocyna:
Hormon polipeptydowy,
Produkowana przez podwzgórze i uwalniania przez przysadkę,
Czynniki pobudzające wydzielanie:
Podrażnienie mechanoreceptorów brodawek sutków (ssanie sutka),
Podrażnienie receptorów macicy i pochwy (poród, stosunek płciowy),
Estrogeny wzmagają jej wydzielanie, a progesteron hamuje,
Działanie:
Obkurcza komórki mioepitelialne pęcherzyków gruczołów mlecznych i ich przewodów wyprowadzających, dzięki czemu w okresie laktacji powoduje wypływ mleka z przewodów mlecznych,
Powoduje silny skurcz macicy zwłaszcza ciężarnej biorąc udział w akcji porodowej,
Powoduje skurcze macicy podczas orgazmu, przez co umożliwia transport nasienia przez macicę w kierunku jajowodów i tym samym zapłodnienie, bierze dzięki temu udział w zapłodnieniu i akcie płciowym,
Hormony uwalniające (liberyny) i hamujące (statyny) wydzielane przez podwzgórze, regulują wydzielanie hormonów tropowych przez przedni płat przysadki. Należą do nich:
Hormon uwalniający tyreotropinę (TRH),
Hormon uwalniający gonadotropiny (GnRH)
Hormon uwalniający hormon wzrostu (GHRH)
Somatostatyna (SRIF)
Hormon uwalniający hormon adrenokortykotropowy (CRH)
Hormon hamujący uwalnianie prolaktyny (PIH)
Hormon uwalniający prolaktynę (PRH)
Hormon uwalniający hormon melanotropowy (MSH-RH)
Hormon hamujący uwalnianie hormonu melanotropowego (MSHIH).
Liberyny powodują uwalnianie hormonów tropowych z przysadki, natomiast statyny hamują to wydzielanie. Działają one dzięki receptorom błonowym i układowi cyklaza adenylowa - cAMP. Przez co dochodzi do aktywacji kinazy białkowej i wzrostu przepuszczalności dla jonów wapnia, który bierze udział w wydzielaniu hormonów tropowych.
Regulacja wydzielania i fizjologiczne działanie przysadki mózgowej, tarczycy, przytarczyc, trzustki i nadnerczy.
Przysadka mózgowa jest małym gruczołem znajdującym się w dole tureckim, złożonym z płata przedniego, części pośredniej i płata tylnego. Płat przedni nosi nazwę przysadki gruczołowej. Syntetyzuje ona hormony tropowe oraz prolaktynę i hormon wzrostu. Część pośrednia jest u człowieka w zaniku, produkuje ona jedynie hormon melanotropowy. Natomiast płat tylny, zwany przysadką nerwową, połączona jest w podwzgórzem przez nerwy i uwalnia oksytocynę i wazopresynę, produkowane przez podwzgórze.
Hormon wzrostu (somatotropina) - GH:
Hormon polipeptydowy,
Stężenie tego hormonu jest najwyższe u płodów i noworodków, później zmniejsza się, jednak u dzieci jest wyższy niż u dorosłych i wykazuje rytm około dobowy (jego wydzielanie jest największe w czasie snu NREM)
Jego wydzielanie rośnie:
Przy stresie związanym z głodem, bólem, zimnem, po zabiegach chirurgicznych, strachem,
Przy wysiłku fizycznym,
W stanie hipoglikemii
Dzięki środkom α - adrenergicznym
Diecie wysokobiałkowej,
Wydzielanie somatotropiny jest regulowane dzięki dwóm hormonom podwzgórzowym:
Hormonowi uwalniającymi hormon wzrostu (działa przez czynniki wymienione wyżej i powoduje wzrost wydzielania somatotropiny)
Hormon hamujący wydzielanie hormonu wzrostu (powoduje zahamowanie wydzielanie somatotropiny)
Działanie:
Działa przede wszystkim na wątrobę, mięśnie i tkankę tłuszczową,
Wpływ na metabolizm białkowy:
Pobudza syntezę białek, prowadząc do dodatniego bilansu azotowego,
Powoduje przyrost chrząstki przynasadowej, zwiększając długość kości,
Powoduje przyrost masy ciała, mózgu, tkanki chłonnej i narządów płciowych,
Działanie to jest możliwe dzięki insulino podobnym czynnikom wzrostowym (IGF-1 i IGF-2) - pobudzającym wzrost kości, chondrogenezę, transport błonowy aminokwasów i syntezę białek,
Wpływ na metabolizm lipidów:
Powoduje hydrolizę triacylogliceroli tkanki tłuszczowej uwalniając wolne kwasy tłuszczowe i glicerol do krwi
Wpływ na metabolizm węglowodanów:
Działanie antagonistyczne względem insuliny
Hamuje transport glukozy do komórek
Hamuje glikolizę
Pobudza glukoneogenezę z aminokwasów
Wpływ na gospodarkę minerałami:
Wzmaga wchłanianie wapnia w jelit
Zatrzymuje w organizmie elektrolity, między innymi sód, potas, fosforany.
Zaburzenia:
Gigantyzm - wzrost stężenia hormonu wzrostu przed dojrzewaniem, bardzo duży wzrost koło 2 metrów,
Akromegalia - wzrost stężenia hormonu wzrost w dorosłości, duże dłonie, stopy, żuchwa, łuki brwiowe,
Karłowatość przysadkowa - zmniejszona ilość hormonu, powodująca zmniejszony wzrost.
Prolaktyna (PRL):
Hormon polipeptydowy
Wydzielana przez przedni płat przysadki
Jej wydzielanie jest regulowane dzięki:
Prolaktostatynę - hormon hamujący wydzielanie prolaktyny,
Prolaktoliberynę - hormon pobudzający wydzielanie prolaktynę,
Wydzielanie prolaktyny jest pobudzane przez:
Ciąże,
Drażnienie brodawek sutkowych
Działanie:
Powoduje wydzielanie mleka,
Hamuje uwalnianie hormonu folikulotropowego (FSH) i luteinizujący (LH), przez co hamuje owulacje podczas połogu i ciąży.
Hormony tropowe przysadki są bardzo ważne. Ich wydzielanie jest regulowane dzięki liberynom i statynom produkowanym przez podwzgórze, natomiast one kontrolują wydzielanie właściwych hormonów. Wszystko to zachodzi poprzez sprzężenia zwrotne ujemne, za pomocą pętli krótkich i długich. Do hormonów tropowych zaliczyć można:
Hormon adrenokortykotropowy (ACTH) pobudzający wydzielanie hormonów kory nadnerczy,
Hormon tyreotropowy (TSH) pobudzający wydzielanie hormonów tarczycy,
Hormon folikulotropowy (FSH) pobudzający wydzielanie hormonów gonadalnych,
Hormon luteinizujący (LH) pobudzający wydzielanie hormonów gonadalnych.
Część pośrednia wydziela hormony melanotropowe (α-MSH, α-END, γ-MSH, β-MSH, CLIP). Hormony melanotropowe pobudzają melanocyty skóry do większej syntezy i odkładania melaniny. Hormony kory i rdzenia nadnerczy silnie hamują wydzielanie MSH.
Do hormonów tarczycy zaliczyć można tyroksynę, trójjodotyroninę, które są pochodnymi tyrozyny, oraz kalcytoninę, która reguluje gospodarkę wapniowo-fosforanową.
Aktywne hormony gruczołu tarczowego (tyroksyna i trójjodotyronina), są jodowanymi pochodnymi tyrozyny. Ich biosynteza jest ściśle związana z metabolizmem tyreoglobuliny (głównego magazynu jodu hormonalnego).
Tyreoglubulina jest jodowaną glikoproteiną, zawierającą jod w różnych postaciach - mono- i dijodotyroninę. Tyreoglobulina jest magazynowa w pęcherzykach tarczycy i w razie potrzeby syntetyzowana jest z niej tyrozyna i trójjodotyronina, która jest uwalniana do krwi.
Trójjodotyronina i tyroksyna:
Hormony aminokwasowe,
Wydzielanie przez tarczycę,
Regulacja wydzielania:
Zachodzi przede wszystkim przez TSH, czyli tyreotropinę, dzięki zwiększonej resorpcji koloidu przez komórki pęcherzykowe i syntezie w nich aktywnych hormonów, natomiast wydzielanie TSH jest pobudzane przez tyreoliberynę (CRH), wszystko to zachodzi dzięki sprzężeniom zwrotnym
Zimno pobudza termodetektory w ośrodku termoregulacji, dzięki czemu wzrasta uwalnianie CRH, które pobudza TSH, a ono następnie tyroksynę i trójjodotyroninę,
Wazopresyna, adrenalina powodują wydzielanie tyroksyny i trójjodotyroniny
Hamują wydzielanie:
Wzrost średniej temperatury otoczenia,
Wzrost we krwi ilości tyroksyny i trójjodotyroniny,
wzrost stężenia jodu nieorganicznego ponad fizjologiczną dawkę,
niedobór jodu nieorganicznego,
aniony jednowartościowe, takie jak chlorany, azotany, wypierające jod wychwytywany przez komórki pęcherzykowe,
związki egzogenne hamujące tworzenie MIT i DIT
Są transportowane w osoczu przez globulinę wiążącą tyroksynę (TBG) oraz prealbuminę wiążącą tyroksynę (TBPA),
Mechanizm działania:
Wpływ na metabolizm białek:
Wzmagają syntezę białka, pobudzają wydzielanie hormonu wzrostu i przyspieszają wzrost, w stężeniach fizjologicznych,
Nadmiar tych hormonów hamuje syntezę i pobudza rozpad białek, głównie mięśniowych
Wpływ na metabolizm lipidów:
Zwiększają lipolizę, powodują rozpad triacylogliceroli do wolnych kwasów tłuszczowych i glicerolu,
Zmniejsza stężenie cholesterolu we krwi, zwiększając ilość receptorów LDL w wątrobie
Wpływ na metabolizm węglowodanów:
Wzmagają wchłanianie glukozy i galaktozy z jelit i jej zużycie przez komórki (początkowe działanie synergistyczne do insuliny),
Powoduje rozpad glikogenu (glikogenolizę) - końcowe działanie antagonistyczne do insuliny,
Wpływ na metabolizm wapnia i fosforanów:
Nasilają zarówno procesy tworzenia i resorpcji kości,
Zwiększają ilość wapnia w osoczu i moczu,
Zwiększają ilość fosforanów w osoczu, a zmniejszają w moczu,
Zmniejszają masę kości, bo resorpcja przeważa nad tworzeniem kości,
Hormony gruczołu tarczowego są niezbędne do rozwoju i dojrzewania układu nerwowego
Ich działanie na narządy jest wtórne, wzmagają zużycie tlenu, nasilając przemianę materii, powodują lepsze ukrwienie szczególnie skóry, przez którą jest usuwane ciepło,
Zaburzenia:
Choroba Gravesa-Basedowa (nadczynność tarczycy) - nasilenie przemiany materii, szczupłość, wyłupiaste oczy, nerwowość, nadpobudliwość, wole
Obrzęk śluzowaty (niedoczynność tarczycy) - obniżenie przemiany materii, obrzęki, otyłość, spowolnienie
Kalcytonina, jest hormonem polipeptydowym wydzielanym przez komórki przypęcherzykowe tarczycy:
Hormon polipeptydowy
Wydzielany przez komórki przypęcherzykowe tarczycy
Wydzielanie kalcytoniny jest regulowane przez stężenie wapnia we krwi:
Wzrost stężenia tego jonu w osoczu pobudza wydzielanie tego hormonu,
Spadek stężenia tego jonu w osoczu hamuje wydzielanie tego hormonu,
Działanie:
Zmniejsza stężenia fosforanów i wapnia w osoczu, poprzez hamowanie osteoklastów kości i pobudzanie osteoblastów,
Zwiększa stężenie fosforanów nieorganicznych, wapnia, magnezu, sodu i chlorków w moczu.
Przytarczyce są to dwie pary gruczołów umieszczone na górnym i dolnym biegunie tarczycy. Produkują one bardzo ważny hormon, regulujący gospodarkę wapniowo-fosforanową - parathormon.
Parathormon:
Hormon polipeptydowy,
Wydzielany przez przytarczyce,
Czynniki pobudzające wydzielanie:
Zmniejszenie stężenia wapnia w osoczu i płynie zewnątrzkomórkowym,
Zwiększenie stężenia fosforanów w osoczu i płynie zewnątrzkomórkowym,
Działanie:
Wpływ na kości:
Pierwsza faza działania parathormonu:
Obserwowana po 3-4 h po jego podaniu
Wzmaga uwalnianie wapnia z kości - osteoliza osteocytowa
Zwiększa aktywność osteocytów, aktywując cyklazę adenylową i zwiększenie stężenia wapnia w komórce,
Następuje rozpuszczenie hydroksyapatytów kości
Druga faza działania parathormonu:
Wzrost aktywności osteoklastów w tkance kostnej,
Wzmożona resorpcja części organicznej i nieorganicznej kości,
Rozpad kolagenu i wydalanie jego produktów z moczem, głównie w postaci hydroksyproliny,
Wpływ na nerki:
Hamuje resorpcję zwrotną fosforanów i ich wydalanie z moczem,
Nasila resorpcję zwrotną jonów wapnia i zmniejsza ich wydalanie z moczem
Pobudza syntezę aktywnej witaminy D3
Wpływ na jelita:
Pobudza wchłanianie wapnia z jelit
Zaburzenia:
Tężyczka:
Zmniejszenie ilości parathormonu,
Drżenie włókienkowe mięśni z następczymi skurczami klonicznymi lub tonicznymi,
Zwiększenie pobudliwości skurczowej mięśni szkieletowych,
Przyspieszenie oddechu
Tachykardia
Wzrost temperatury
Zmniejszenie stężenia wapnia w płynie zewnątrzkomórkowym i osoczu,
Zwiększenie stężenia fosforanów w płynie zewnątrzkomórkowym i osoczu
Upośledzenia wydalania fosforanów i wapnia z moczem.
Hormony trzustki wydzielane są przez wyspy trzustkowe. Zawierają one różne grupy komórek, z których każda wydziela odpowiedni hormon:
Komórki A - glukagon
Komórki B - insulina
Komórki D - Somatostatyna (SRIF)
Komórki F - polipeptyd trzustkowy (PP).
Glukagon:
Hormon polipeptydowy wydzielany przez komórki A trzustki,
Czynniki pobudzające wydzielanie glukagonu:
Zmniejszenie stężenia glukozy w osoczu,
Hormony żołądkowo-jelitowe:
CCK, gastryna - pobudzają wydzielanie glukagonu,
Somatostatyna - hamuje wydzielanie glukagonu,
Aminokwasy wzmagają wydzielanie glukagonu,
Zmniejszenie ilości kwasów tłuszczowych może w małym stopniu wzmożyć uwalnianie glukagonu
Działanie biologiczne glukagonu:
Wpływ na metabolizm węglowodanów:
Aktywuje glukoneogenezę,
Aktywuje glikogenolizę,
Zwiększa stężenie glukozy we krwi,
Działa przeciwstawnie do insuliny
Wpływ na metabolizm lipidów:
Powoduje rozpad triacylogliceroli i powoduje wzrost stężenia glicerolu i kwasów tłuszczowych w osoczu (nasilają one glukoneogenezę)
Wpływ na układ sercowo-naczyniowy - działa on chronotropowo dodatnio
Hamuje czynność motoryczną żołądka, wydzielanie żołądkowe i trzustkowe,
Posiada działanie natriuretyczne.
Insulina:
Hormon polipeptydowy wydzielany przez komórki B tarczycy,
Czynniki powodujące wydzielanie insuliny:
Zwiększenie stężenia glukozy oraz innych monocukrów (galaktozy i fruktozy) we krwi
Pośrednie produkty cyklu Krebsa
Aminokwasy
Kwasy tłuszczowe
Ciała ketonowe
Agoniści receptorów β - adrenergicznych
Acetylocholina
Czynniki hamujące wydzielanie insuliny:
Somatostatyna
Deoksyglukoza
Adrenalina, noradrenalina
Insulina, działa także hamująco na wydzielenie samej siebie
Działanie fizjologiczne:
Wpływ na metabolizm węglowodanów:
Zwiększa transport glukozy do komórek poprzez zwiększenie transportera glukozy-GLUT4 (nie działa na komórki mózgu, nerki, jelita i erytrocyty)
Wzmaga glikolizę,
Hamuje glukoneogenezę
Powoduje glikoneogenezę
Działając na te szlaki biochemiczne powoduje ona obniżenie stężenia glukozy we krwi - hipoglikemię
Wpływ na metabolizm aminokwasów:
Zwiększa transport aminokwasów do komórki
Wzmaga syntezę białka (działa synergistycznie do hormonu wzrostu)
Hamuje rozpad białek
Wpływ na metabolizm lipidów:
Hamuje lipolizę i uwalnianie kwasów tłuszczowych i glicerolu z triacylogliceroli
Powoduje lipogenezę z octanu i glukozy (nadmiar glukozy jest w tym przypadku gromadzony w postaci triacylogliceroli tkanki tłuszczowej)
Zaburzenia:
Cukrzyca:
Niedobór insuliny,
Wzrost stężenie glukozy we krwi, która nie może przechodzić do komórek,
W komórkach nasilona jest glukoneogeneza, zwiększająca jeszcze stężenie glukozy we krwi,
Lipoliza zwiększa ilość wolnych kwasów tłuszczowych i glicerolu we krwi,
Z kwasów tłuszczowych powstaje acetyloCoA, który nie nadąża spalać się w cyklu Krebsa, przez co powstają duże ilości ciał ketonowych, powodujące powstanie kwasicy ketonowej,
Glukoza, ciała ketonowe pojawiają się w moczu,
Brak możliwości zachowania homeostazy węglowodanowej.
Nadnercza są parzystymi gruczołami w kształcie piramid umieszczonymi na górnych biegunach nerek. Składają się one z kory i rdzenia, które pochodzą z różnych embriologiczne części. Rdzeń pochodzi z komórek neuronalnych ektodermy, które się oddzieliły i powstał z nich rdzeń nadnerczy, który możemy zaliczyć do układu współczulnego. Produkuje on hormony takie jak: adrenalinę i noradrenalinę. Natomiast kora nadnerczy pochodzi z mezodermy i produkuje hormony steroidowe, takie jak: kortyzol, kortykosteron, aldosteron oraz androgeny.
Hormony rdzenia nadnerczy
Adrenalina, noradrenalina:
Hormony aminokwasowe, powstałe z tyrozyny,
Produkowane przez rdzeń nadnerczy
Są one spichrzane w komórkach w oddzielnych ziarnistościach,
Uwalnianie amin katecholowych, jest pobudzane przez:
Pobudzenie nerwowe,
Leki,
Hipoglikemia,
Czynniki stresowe
acetylocholinę
są one rozkładane dzięki oksydazie monoaminowej (MAO):
z adrenaliny powstaje kwas wanilinomigdałowy
z noradrenaliny
Działanie:
poprzez receptory α i β-adrenergiczne
na układ sercowo-naczyniowy:
przyspieszenie rytmu serca,
skurcz tętniczek krążenia skórnego, nerkowego i trzewnego, z rozkurczem tętniczek mięśniowych i wieńcowych,
zwiększenie amplitudy skurczowo-rozkurczowej
wpływ na metabolizm węglowodanów:
działa antagonistycznie do insuliny,
pobudzenie glukoneogenezy
pobudzenie glikogenolizy
wzrost stężenia glukozy we krwi
wpływ na metabolizm lipidów;
pobudza lipolizę, uwalniając kwasy tłuszczowe i glicerol do krwi
zwiększają wentylację płuc
hamują agregację płytek krwi,
biorą udział w ejakulacji
pobudzają ośrodkowy układ nerwowy,
rozluźniają mięsnie gładkie oskrzeli, przewodu pokarmowego i pęcherza moczowego, jednocześnie kurcząc mięśnie przywłosowe.
Kora nadnerczy podzielona jest na trzy warstwy - warstwę kłębkowatą (znajdującą się najbardziej zewnętrznie), która produkuje mineralokortykoidy, warstwę pasmowatą (po środku), produkującą glikokortykoidy oraz warstwę siatkowatą (wewnątrz) - androgeny. Na trzy te warstwy działa ACTH, zwiększając produkcję tych hormonów.
Hormony kory nadnerczy można podzielić na trzy grupy:
mineralokortykoidy - działające na gospodarkę elektrolitową
glikokortykoidy - wpływające na metabolizm białek, tłuszczy i węglowodanów,
androgeny - będące jednym ze źródeł testosteronu u mężczyzn, a u kobiet estrogenów w okresie pomenopauzalnym.
Mineralokortykoidy:
Najważniejszym z nich jest aldosteron, mniej ważne to kortykosteron i kortyzol
Pobudzają wydzielanie mineralokortykoidów:
angiotensyna I i II
zwiększenie stężenia jonów potasu i zmniejszenie stężenia jonów sodu
zmniejszenie objętości krwi lub płynu zewnątrzkomórkowego
wydzielanie ACTH przez przysadkę mózgową
Działanie biologiczne:
zwiększenie wchłaniania zwrotnego jonów sodu i wydzielanie jonów potasu przez komórki kanalików nerkowych,
zwiększenie wchłaniania jonów sodu przez komórki gruczołów potowych, ślinowych i nabłonka jelitowego,
zwiększenie objętości płynu zewnątrzkomórkowego, co powoduje zwiększenie objętości wyrzutowej serca i wzrost ciśnienia tętniczego
Glikokortykoidy:
Najważniejszym z nich jest kortyzol, mniej ważne to kortykosteron i kortyzon,
Transportowany one są przez α-globulinę, zwane transkortyną i częściowo albuminą
Pobudzają wydzielanie glikokortykoidów:
ACTH
Wydzielanie transkortyny
Wzrost wydzielanie występuje rano, a spadek w godzinach nocnych,
Działanie biologiczne:
Wpływ na metabolizm węglowodanów:
Działa antagonistycznie do insuliny,
Wzmaga glukoneogenezę,
Powoduje glikogenolizę,
Zmniejszają zużycie glukozy, kosztem kwasem tłuszczowych
Zmniejszają transport glukozy przez błonę komórkową
Zwiększa stężenie glukozy we krwi
Wpływ na metabolizm białek:
Zwiększenie katabolizmu białek i mobilizację aminokwasów w tkankach pozawątrobowych zwłaszcza w mięśniach i tkankach kostnej
Zwiększenie stężenia aminokwasów we krwi
Zwiększenie transportu błonowego aminokwasów w komórkach wątroby połączone ze zwiększoną syntezą w niej białek z równoczesnym zmniejszeniem tej syntezy w innych tkankach,
Zwiększenie przemian aminokwasowych w komórkach wątroby (deaminacja, transaminacja, glukoneogeneza)
Duże zwiększenie syntezy białka w tkankach przewodu pokarmowego,
Wpływ na metabolizm lipidów:
Powodują lipolizę w tkance tłuszczowej
Powodują spalanie kwasów tłuszczowych (zwiększenie ilości acetyloCoA - działanie ketogenne)
Wzmagają transport kwasów tłuszczowych do komórek
Zwiększenie całkowitą zawartość tłuszczów w organizmie kosztem białek
Zmniejsza rozmieszczenie tkanki tłuszczowej, która gromadzi się na twarzy, karku, tułowiu
Zwiększenie filtrację kłębuszkową, wzmagają diurezę
Zwiększenie reaktywności skurczowej miocytów naczyń krwionośnych
Działanie inotropowe dodatnie
Potęgują działanie amin katecholowych
Działanie przeciwzapalne:
Hamują przechodzenie białek osocza przez naczynia włosowate,
Hamują wydzielanie histaminy i pirogenów
Hamują aktywację neutrofilii,
Hamują tworzenie blizny w miejscu nacieku zapalnego
Wpływają hamująco na CRH wydzielane przez podwzgórze, oraz na ACTH wydzielane z przysadki.
Androgeny:
Kora nadnerczy stale wydziela męskie hormony płciowe zwane androgeny nadnerczowe (należą do nich przede wszystkim dehydroepiandrosteron oraz androstendiol, a w mniejszej ilości także testosteron)
Kora nadnerczy wydziela nieznaczne ilości żeńskich hormonów płciowych: estrogeny, progesteron,
Androgeny u mężczyzn powodują:
Regulacja spermatogenezy
Utrzymanie drugorzędowych męskich cech płciowych
Utrzymanie czynności dodatkowych narządów płciowych
Hormony anaboliczne (powodują syntezę białek)
Pobudzenie rozwoju narządów w obszarze zatoki moczowo-płciowych
Obniżenie brzmienia głosu
Powstanie typowego owłosienia klatki piersiowej, pach, wzgórka łonowego, zanikania włosów na głowie
Podnosi libido
Zaburzenia:
Wirylizm u kobiet - zbytnie wytwarzanie androgenów u kobiet, zarost na brodzie, pogrubienie głosu, łysienie, nadmierny rozwój łechtaczki
Rzekome przedwczesne dojrzewania płciowego - guz hormonalny u chłopców, nadmierny rozwój wtórnych cech płciowych.
Regulacja wydzielania i fizjologiczne działanie insuliny, glukagonu, tyroksyny, somatotropiny, parathormonu, oksytocyny, wazopresyny, kalcytoniny, prolaktyny, hormonów płciowych, aldosteronu i kortyzonu
Insulina, glukagon, tyroksyna, somatotropina, parathormon, kalcytonina, prolaktyna, aldosteron i kortyzol opisane są w pytaniu poprzednim.
Oksytocyna, wazopresyna opisane są w pytaniu o układ podwzgórzowo-przysadkowy.
Hormony płciowe, do których zaliczamy hormony płciowe żeńskie (estrogeny, progesteron) oraz hormony płciowe męskie (testosteron, dehydroepiandrosteron).
Estrogeny:
Hormony steroidowe produkowane przez jajniki kobiet,
Jego wydzielanie pobudzane jest przez LH,
Jego stężenie zależy od fazy cyklu miesięcznego - 7 dni przed osiągnięciem szczytu stężenie estrogenu zaczyna rosnąć (szczyt tuż przed owulacją), po czym zaczyna się zmniejszać, najmniejsze stężenie estrogenów jest w czasie miesiączki
Działanie:
pochwa - dojrzewanie komórek nabłonka z dużą ilością glikogenu (złuszczanie komórek kwasochłonnych)
szyjka macicy - otwarcie ujścia zewnętrznego, wydzielanie przejrzystego śluzu krystalicznego w postaci liści paproci
błona śluzowa macicy - wzrost gruczołów macicznych i liczne podziały komórek
sutki - rozwój przewodów mlecznych
jajnik - pobudzenie wzrostu komórek ziarnistych, pojawienie się receptorów dla LH, selekcja pęcherzyków do dalszego wzrostu jest zapewniona dostateczna ilość receptorów LH i FSH w komórkach ziarnistych wrażliwych na niskie stężeni gonadotropin w początku fazy folikularnej
Stężenie estrogenów we krwi przed owulacją jest w ścisłej korelacji ze szczytem LH, a w fazie lutealnej między estrogenem i progesteronem.
Progesteron:
Hormon steroidowy produkowany przez jajniki kobiet,
W fazie folikularnej stężenie progesteronu jest na granicy wykrywalności, począwszy od dnia owulacji jego wydzielanie jest znaczne i od dnia 5-10 dnia po owulacji, następnie dość szybko spada,
Jego wydzielanie pobudzane jest przez FSH,
Działanie:
główne - przygotowanie błony śluzowej macicy do zagnieżdżenia zapłodnionego jaja
pochwa - komórki warstwy pośredniej - zmniejszenie kwasochłonności, zwijanie, skupianie, zasado chłonność,
błona śluzowa macicy - glikogen w komórkach, poskręcanie gruczołów, naczynia spiralne, śluz w gruczołach,
mięsień macicy - hamowanie skurczów,
szyjka macicy - obkurczenie ujścia wewnętrznego, śluz gęsty nieprzepuszczalny dla plemników,
działanie ogólne - hipertermia (około 37OC), działanie znieczulające, zmniejsza stężenia sodu w osoczu, zwiększa jego wydzielanie.
Działanie męskich hormonów płciowych (testosteron, dehydroepiandrosteron) jest opisane przy androgenach kory nadnerczy.
Rola hormonów w regulacji gospodarki fosforanowo - wapniowej
Wapń jest bardzo ważnym jonem naszego organizmu. Reguluje bardzo wiele funkcji naszego organizmu między innymi:
Krzepnięcie krwi
Skurcz mięśni,
Funkcjonowanie nerwów,
Prawidłowe działanie błony komórkowej,
Tonus naczyń,
Jest wtórnym przekaźnikiem hormonalnym (kadaweryna).
W osoczu jego stężenie wynosi około 2,5 mmol/l. Około 1 % całego wapnia znajduje się w komórkach, a 0,1% w płynie zewnątrzkomórkowym. W komórce wapń występuje w największej ilość w retikulum endoplazmatycznym i mitochondrium w połączeniu z białkami wiążącymi wapń.
Najwięcej wapnia znajduje się w kościach, gdzie występuje on w dwóch głównych postaciach:
Postać łatwo wymienialna z wapniem w płynach ustrojowych (ok. 100 mmol) - bardzo ważna ze względów biologicznych, dzięki tej frakcji możliwe jest utrzymanie stałości stężenia wapnia w organizmie
Postać słabo wymienialna, związana z hydroksyapatytami kości.
W osoczu wapń występuje także pod różnymi postaciami jako:
Wapń zjonizowany (1,2 mmol/l - 4,5 mg% - 48%) - właśnie to stężenie wapnia jest bodźcem dla hormonów, które regulują jego gospodarkę,
Wapń kompleksowy (0,15 mmol/l - 0,6 mg% - 5%) - wapń połączony z cytrynianami, fosforanami i węglanami,
Wapń związany z białkiem (1,2 mmol/l - 4,8 mg% - 46%) - wapń połączony jest głównie z albuminami.
Wapń w nerkach podlega przesączaniu kłębuszkowemu i resorpcji zwrotnej, głównie w kanalikach proksymalnych w pętli Henlego. Odbywa się to w ścisłym związku z wchłanianiem jonów Na+. Tylko niewielka ilość wapnia jest wydalana z moczem (ok. 2,5mmol/dobę). Reszta wapnia jest usuwana z kałem, w połączeniu z wchłanianie, które ma postać transportu aktywnego, związanego z ATP-azą Ca2+ oraz aktywną postacią witaminy D3.
Organizm człowieka zawiera około 22 mmol/l fosforanów, z czego 80-85% znajduje się w kościach i zębach, a reszta w płynie zewnątrz- i wewnątrzkomórkowym. Fosforany w osoczu, mogą występować jako:
75% to fosforany organiczne,
25% to fosforany nieorganiczne, głównie jako PO43-, HPO42—HPO4-.
Fosforany nieorganiczne wchłaniają się w dwunastnicy i jelicie cienkim na drodze transportu czynnego i biernej dyfuzji.
W regulacji gospodarki wapniowo-fosforanowej bierze udział parathormon, kalcytonina oraz witamina D3.
Parathormon (przytarczyce) i kalcytoninę (tarczyca) opisałam już przy opisie hormonów, wydzielanych przez odpowiednie gruczoły.
Aktywna witamina D3 powstaje z cholesterolu, który w skórze pod wpływem światła zmienia w cholekalcyferol (witamina D3), który następnie idzie do wątroby, gdzie zachodzi hydroksylacja do 25-hydroksycholekalcyferolu (kalcydiolu). Związek ten podąża następnie do nerek, gdzie zachodzi końcowa reakcja z utworzeniem dwóch związków - aktywnego, który może być uznany właściwym hormonem, czyli 1,25-dihydroksycholekalcyferolu (kalcytriolu) oraz 24,25-dihydroksykalcyferolu, który jest mało aktywny. Zmiana na aktywną postać wit. D3 (kalcytriol) zachodzi jedynie przy udziale parathormonu, który pobudza odpowiednią hydroksylazę. Tak samo duże ilości kalcytriolu hamują na zasadzie sprzężenia zwrotnego swe wytwarzanie.
Kalcytriol działa na:
jelito:
pobudza wchłanianie wapnia z jelit, poprzez aktywację białka DBG (wiąże ono wapń, warunkując jego duży gradient poprzez błony, przez co ułatwia transport) oraz zwiększenie przepuszczalności brzeżka szczoteczkowego jelit dla wapnia,
pobudza wchłanianie fosforanów w jelicie cienkim,
kości:
wzmaga działanie parathormonu na kości,
poprzez zwiększenie wchłaniania wapnia i fosforanów, pośrednio zwiększa stężenie ich w kościach, co ułatwia wiązanie ich w kości (mineralizację).
Rola hormonów w regulacji gospodarki węglowodanowej
W organizmie bardzo ważne są węglowodany, a w szczególności glukoza, której stężenie powinno wynosić 80-90 mg%. Glukoza jest jedynym źródłem energii dla komórek mózgowych, które są jednymi z najważniejszych komórek naszego ciała. Właśnie, dlatego jej gospodarkę reguluje tak dużo hormonów.
Mogą one z jednej strony podnosić jej stężenie we krwi, wzmagać glukoneogenezę, glikogenolizę. Działają tak: somatotropina, końcowe działanie tyroksyny, glukagon, adrenalina, glikokortykoidy (ich szczegółowe działanie na tą gospodarkę, znajduje się przy opisie tych hormonów).
Z drugiej strony, przy podwyższonym stężeniu glukozy, muszą istnieć mechanizmy obniżające je - pobudzające glikolizę, hamujące glukoneogenezę, wzmagające transport glukozy do mięsni i wątroby, gdzie może zostać ona zmagazynowana w postaci glikogenu. W tym bierze udział, jeden z ważniejszych hormonów naszego organizmu - insulina, wspomaga ją w swym początkowym działaniu tyroksyna (szczegółowy opis, znajduje się przy opisie szczegółowym tych hormonów).
W zaburzeniach tej gospodarki, najważniejszą z chorób jest cukrzyca, która dotyka coraz więcej osób, jest tzw. chorobą cywilizacyjną. Związana jest z niedoborem insuliny (szczegółowy opis, znaleźć można przy opisie insuliny).
Rola hormonów w regulacji gospodarki białkowej
Hormony w gospodarce białkowej są bardzo ważne. Powodują one przede wszystkim wzrost syntezy białek. Hormonem, który jest bardzo ważny w tym działaniu jest somatotropina, która umożliwia wzrost dzieci. Wiele hormonów (tyroksyna, insulina, czy androgeny u mężczyzn) działają synergistycznie do tego hormonu (szczegółowo w opisie tych hormonów).
Natomiast hormonami, działającym trochę inaczej są glikokortykoidy. Powodują one katabolizm białek niewątrobowych, natomiast w wątrobie powodują tworzenie białek oraz wiele reakcji związanych z aminokwasami (szczegółowo w opisie glikokortykoidów).
Gdy zaburzone jest wydzielanie hormonów pierwszej grupy - somatotropiny, insuliny, tyroksyny, androgenów (jest ich za mało)- występuje wtedy niski wzrost, który związany jest właśnie z za niską syntezą białek. Rozróżniamy wtedy:
Karłowatość przysadkową (związaną z niskim wydzielaniem somatotropiny),
Karłowatość tarczycową (związaną z niskim wydzielaniem tyroksyny),
Niski wzrost u osób, chorujących od urodzenia na cukrzycę (związany z niskim stężeniem insuliny)
Niski wzrost u mężczyzn z niedoborem androgenów.
Zbyt duże stężenie tych hormonów, a w szczególności somatotropiny, może wywołać duży wzrost (opisane przy somatotropinie).
Rola hormonów w regulacji gospodarki lipidowej
Lipidy są bardzo ważnym materiałem zapasowym organizmu znajdującym się w tkance tłuszczowej. Przy braku glukozy są one uwalnianie i wykorzystywane jako materiał energetyczny przez większość tkanek. Uwalniani to powodują: somatotropina, tyroksyna, glukagon, adrenalina, glikokortykoidy (ich szczegółowe działanie na tą gospodarkę, znajduje się przy opisie tych hormonów).
Gdy stężenie glukozy jest podwyższone, zostają z niej syntetyzowane lipidy (triacyloglicerole), które są magazynowe z tkance tłuszczowej. Zadanie to spełnia insulina (szczegółowy opis przy insulinie).
Cykl miesięczny
Cykl miesięczny obejmuje wiele zmian zachodzących na osi podwzgórze-przysadka-jajnik-macica. Za jego początek przyjmuj się pierwszy dzień krwawienia. Każdy cykl obejmuje szereg zjawisk. Do najważniejszych należą:
Owulacja (uwolnienie komórki jajowej zdolnej do zapłodnienia)
Przygotowanie błony śluzowej macicy do zagnieżdżenia zapłodnionej komórki jajowej
Złuszczanie się błony śluzowej macicy objawiające się krwawieniem miesięcznym.
Długość cyklu wynosi około 28 dni. Stałe powtarzające się odchylenia od tej normy, są uznawane za prawidłowe. Prawidłowy cykl miesięczny można podzielić na:
Złuszczanie się błony śluzowej macicy,
Fazę folikularną cyklu trwającą zazwyczaj 14-17 dni,
Owulację, występującą w ciągu jednej doby,
Fazę lutealną cyklu, bardziej trwałą trwającą 14 dni.
W czasie cyklu następuje zmienne wydzielanie hormonów przysadkowych i jajnikowych i ścisła między nimi zależność.
Faza folikularna:
Faza ta nazwana jest od stężenia hormonu folikulotropowego, który osiąga duże wartości,
Stężenie FSH zwiększa się stopniowo, osiągając szczyt w pierwszym tygodniu cyklu, powodując w ten sposób rekrutację pęcherzyków jajnikowych do wzrostu,
Pęcherzyki pod wpływem FSH zaczynają produkować estradiol i inhibinę (wpływa ona na syntezę i uwalnianie FSH),
Współdziałanie FSH i estradiolu powoduje wzrost kilkunastu pęcherzyków z poprzednio już wybranych,
Pod koniec pierwszego tygodnia duże stężenie estradiolu powoduje spadek wydzielania FSH na zasadzie sprzężenia zwrotnego ujemnego,
W fazie tej stężenie LH osiąga stały, dość niski poziom (rośnie od pierwszego dnia cyklu, osiągając stały poziom około 3 dnia)
3-4 dni przed owulacją następuje wyraźny wzrost stężenia LH we krwi, osiągając swój szczyt podczas owulacji.
Faza lutealna:
Faza ta nazwana jest stężenia hormonu luteotropowego, który stężenie osiąga wówczas duże wartości
Od owulacji stężenie LH powoli maleje aż do wystąpienia miesiączki, osiągając jeden-dwa szczyty
Powoduje on wydzielanie progesteronu niezbędnego do utrzymania ciałka żółtego,
Duża ilość progesteronu w czasie owulacji powoli powoduje zahamowanie wydzielanie LH, na zasadzie sprzężenia zwrotnego,
Małe stężenie LH powoduje wystąpienie miesiączki,
Podczas całej fazy luternej FSH znajduje się na niskim, stałym poziomie.
Zmiany błony śluzowej macicy podczas trwania cyklu miesięcznego:
Faza folikularna:
w 4-9 dniu cyklu grubość błony śluzowej macicy wynosi zaledwie 0,5 m, komórki dzielą się
w 10 dniu gruczoły wzrastają, poszerzeniu ulega ich światło, podścielisko robi wrażenie obrzękniętego, zaczynają różnicować się naczynia włosowate,
w 14 dniu cyklu nabłonek ma grubość 3-5 mm, powierzchnia błony śluzowej jest falista, gruczoły się nadal powiększają, w komórkach gromadzą się polisacharydy, zmniejsza się obrzęk podścieliska, naczynia krwionośne się rozszerzają,
O owulacji świadczy:
zmiana śluzu szyjki macicy,
podwyższenie temperatury ciała o około 0,5 stopnia,
zwiększenie stężenia progesteronu,
Faza lutealna:
w 16-17 dniu komórki wykazują mniej mitoz, gruczoły skręcają się, w komórkach pojawia się glikogen i lipidy,
w 18-24 dniu endometrium sprawia wrażenia piły zębatej, swym wyglądem przypomina doczesną,
25-26 dzień - światło gruczołów wypełnia się glikogenem, komórki podścieliska dzielą się mitotycznie,
26-27 dzień - ustępuje obrzęk podścieliska, pojawiają się nacieki leukocytarne,
Miesiączka:
zmniejszenie stężenia hormonów steroidowych, głównie progesteronu,
obkurczenie naczyń, powstanie martwicy i złuszczenie się czynnościowej warstwy błony śluzowej macicy,
oprócz krwi, wydzielina zawiera: śluz, fragmenty złuszczającej się błony śluzowej macicy, komórek pochwowych i bakterii.
NERKA
Regulacja gospodarki wodno-elektrolitowej
Płyny ustrojowe:
Woda to główny objętościowy składnik organizmu człowieka, środowisko, w którym zachodzą procesy życiowe oraz rozpuszczalnik wielu substancji.
Całkowita woda organizmu stanowi ponad połowę masy ciała - u kobiet 52%,
u mężczyzn 63%. Różnica w zawartości wody zależą od rozwoju tkanki tłuszczowej dlatego u kobiet % wody jest mniejszy, (BO SĄ TŁUSTE). Zawartość wody zmniejsza się w otyłości. Tkanka tłuszczowa zawiera 10% wody, tkanka kostna 22%, tkanki miękkie 68-82%. Udział tkanki beztłuszczowej w tzw. beztłuszczowej masie ciała jest stały i wynosi ok.70% niezależnie od płci. Całkowita woda organizmu - TBW (total body water) występuje w różnych przedziałach - tzw. przestrzeniach wodnych. Różni je objętość, skład płynu i funkcja.
TBW (60% masy ciała) :
1.ICF - intracellurar fluid compartment - ok40%
2. ECF - extracellurar compartment 15 - 30%
ECF to pozostałość praoceanu, z którego wyszło życie. Jego skład odpowiada
praoceanowi, choć stężenia są niższe niż w wodzie morskiej,
W ECF wyróżniamy przedziały:
- przestrzeń wew. naczyniowa - osocze krwi
- przestrzeń zewnątrz naczyniowa - chłonka i płyn miąższowy który otacza wszystkie komórki, oprócz krwinek
-przestrzeń transkomórkowa - płyn mózgowo-rdzeniowy, w jamach ciała tj. opłucnej, otrzewnej, osierdziu, płyn w komorach ok, torebkach stawowych, przewodzie pokarmowym - ślina, sok żołądkowy, trzustkowy, jelitowy i żółć
Skład elektrolitowy płynów ustrojowych:
Elektrolity to 95% subst. rozpuszczonych w płynach ustrojowych. Najważniejsze elektrolity: kationy - sód, potas, wapń magnez oraz aniony:chlor, wodorowęglany, fosforany i jony organiczne.
Stężenia elektrolitów wynikają z właściwości barier rozdzielających ( błon półprzepuszczalnych). Woda zwykle przechodzi łatwo, a subst. dyfundują słabo lub wcale. Jony Na+ i Cl- są na zewn. a K+ w środku, Ca++ jest najwięcej w przestrzeni zewnątrzkomórkowej po Na+.
W płynie tkankowym jest też niewielkie stężenie anionów białkowych.
Ruch wody przez błonę półprzepuszczalną zgodny z gradientem stężeń to osmoza. Osmozę można ograniczyć przez wywarcie odpowiedniego ciśnienia na błonę od strony roztworu z większą ilością cząstek niedyfundujących. Ciśnienie to, to właśnie ciśnienie osmotyczne.
Mimo różnic w stężeniach poszczególnych składników w płynie zewn.- i wewnątrzkomórkowym ich ciśnienia osmotyczne są jednakowe.
Bilans wodny
Płyny stanowią 50% całkowitej ilości przyjmowanej wody, pozostała część wody pochodzi z pokarmów stałych oraz spalania składników pokarmowych. Najmniejsze dobowe zapotrzebowanie człowieka na wodę wynosi 1,4l, wzrasta z jej utratą
Utrata wody zachodzi przez:
- wydalanie moczu - średnio 1.5 l na dobę
- wydalanie potu - zależy od temperatury ciała, otoczenia, wilgotności powietrza
- parowania z powierzchni skóry - to samo co przy pocie
- wydalania kału - średnio 100-200ml na dobę
- wydalania powietrza - średnio 300ml na dobę
Stosunki objętościowe płynu w przestrzeniach zależą od :
- objętości wypitych płynów, ilośći przyjętych soli mineralnych,
- utraty wody przez organizm,
- kliniczne następstwa - odwodnienie - przewodnienie
Regulacja gospodarki wodnej
Zaburzenia bilansu wodnego to naruszenie równowagi między utartą płynów i ich uzupełnianiem.
Równowagę regulują dwa mechanizmy:
1. Układ pragnienia
2. Regulacja hormonalna wydalania wody
AD 1
Bodźcem pobudzającym układ pragnienia jest podwyższenie ciśnienia osmotycznego płynów ustrojowych, co pobudza receptory ośrodkowego układu nerwowego ( osmoreceptory).
AD2
Kontrola hormonalna obejmuje działanie wazopresyny ADH, hormonu antydiuretycznego. Zwiększa resorpcję wody w kanalikach nerkowych. Wazopresyna zwiększa aktywność układu pragnienia oraz hamuje sekrecję reniny. Oba układy odpowiadają za prawidłowe stężenie soli sodu w przestrzeni zewn. komórkowej
Regulacja wydalania sodu zachodzi przy udziale aldosteronu i przedsionkowego czynnika(peptydu) natriuretycznego ANP,ANF
Aldosteron jest jednym ze składników układu RAA - renina- angiotensyna-
aldosteron. Przywraca do normy objętość płynu pozakomórkowego i wyrównuje stosunek Na+ i K+ - zwiększa wchłanianie zwrotne sodu i wydzielanie potasu przez kanaliki nerkowe, zwiększa wchłanianie sodu w gruczołach potowych, ślinowych, nabłonku jelitowym.
ANP przy wzroście objętości płynów ustrojowych zwiększa wydalanie sodu przez nerki.
Filtracja kłębuszkowi.
Filtracja zachodzi w naczyniach włosowatych kłębuszków nerkowych. Podlega filtracji osocze krwi.20 % wody osocza z rozpuszczonymi małocząsteczkowymi substancjami ulega przesączeniu do światła torebki - tzw. przesącz kłębuszkowy. Pozostała część osocza ze wszystkimi białkami odpływa z kłębuszka tętniczką odprowadzającą. Siłą napędową filtracji jest ciśnienie hydrostatyczne krwi i naczyniach włosowatych kłębuszkowych
Trójwarstwowa budowa błony filtracyjnej ciałek nerkowych:
1 = komórki śródbłonka naczyń włosowatych kłębuszków z charakterystycznymi okienkami
2 = błona podstawna komórek torebki ze środkową warstwą gęstą
3 = warstwa komórek nabłonkowych torebki - podocytów - z wyrostkami stopowatymi opierającymi się na błonie podstawnej. Wyrostki stopowate łączy blaszka zamykająca.
Błona filtracyjna działa jak sito z porami 3-4mm.Cząsteczki o masie cz.5000,
promieniu 1,5nm przechodzą w 100% na co wskazują jednakowe stężenia w przesączu i osoczu. Cząsteczki mioglobiny przechodzą w 75%, 3%hemoglobiny m.cz.68000,promień 3,3nm; albuminy nie przechodzą wcale - promień 3,6nm. Charakter i budowa fizykochemiczna nie są poznane, prawdopodobnie pory mają charakter "czynnościowy", a nie są stałą budowę.
Ujemne ładunki elektryczne trwale związane z wszystkimi trzema warstwami błony istotnie hamują przechodzenie białek. Dzięki tym ładunkom na powierzchni komórek śródbłonka zatrzymywane są ujemnie naładowane albuminy osocza. Zdolność przenikania cząsteczek zależy od wielkości, kształtu i ładunków elektrycznych. Łatwiej przechodzą cząsteczki wydłużone. Białka - polianiny zatrzymywane są bardziej niż o ich wielkości.... ( nie odbite)
Siły napędowe filtracji kłębuszkowej
Filtracja zachodzi, ponieważ ciśnienie hydrostatyczne w naczyniach włosowatych kłębuszka (Pc) jest większe niż suma sił przeciwstawiających się filtracji.Należą do nich:
- ciśnienie onkotyczne - koloidoosmotyczne osocza krwi w naczyniach włosowatych kłębuszka - Cc - zależy od białek osmotycznie wiążących wodę w osoczu
- ciśnienie hydrostatyczne przesączu w torebce kłębuszka - Ptor - wobec małej ilości białek w przesączu można w analizie pominąć Ctor.
Ponieważ znaczna część Pc zużywana jest na zrównoważenie Ctor i Ptor, stąd
efektywna filtracja kłębuszkowa EFP = Pc - Cc - Ptor = 2Kpa= 15 mmHg,
co stanowi 1/4 ciśnienia hydrostatycznego w naczyniach włosowatych kłębuszka.
Średnia wartość Cc = 3,3 Kpa = 25mmHg. W rzeczywistości ciśnienie onkotyczne stopniowo wzrasta wzdłuż przebiegu naczynia włosowatego.
Zależy to od postępującego bezbiałkowego przesączu do torebki i stopniowo zagęszczania białek osocza. Przy końcu naczynia Cc=5,3 Kpa = 40mmHg, tak że Cc + Ptor zbliża się lub jest równe Pc. EFP zbliża się do zera i filtracja ustaje. Zjawisko to to równowaga ciśnień filtracyjnych - filtration pressure equilibrium. W przypadku istnienia równowagi filtracja będzie się zmieniać równolegle do zmian RBF i ten czynnik decyduje o wielkości GFR. Nie jest zbadane czy w nerce jest równowaga czy nierównowaga w końcowym odcinku naczyń włosowatych.
Wielkość filtracji kłębuszkowej zależy od EFP oraz przepuszczalności i globalnej powierzchni błony filtracyjnej: GFR = Kf * EFB (Kf złożony współczynnik charakteryzujący przepuszczalność i powierzchnię błony filtracyjnej). Obniżenie obu parametrów w wyniku zmian morfotycznych ciałek nerkowych i unieczynniania części nefronów to obniżanie się GFR w chorobach nerek.
Czynniki stabilizujące i modyfikujące filtrację
Przy zmianach ciśnienia w tętnicy nerkowek od 12 do 24 Kpa = 90-180mmHg ciśnienie hydrostatyczne w naczyniach włosowatych jest stałe Pc=7,33Kpa=55mmHg.Dzięki zmianom przystosowawczym oporu tętniczki odprowadzającej Pc oraz EFP oraz GFR podlegają autoregulacji, podobnie jak przepływ krwi przez nerki końcowym nefronie działa jeszcze jeden system stabilizacji GFR. Opiera się on na ujemnym stężeniu zwrotnym między ilością chlorku sodowego, dopływającego do tętniczki doprowadzającej kłębuszka. I tak wzrost GFR, a więc wzrost ilości NaCl dostarczanej do kanalików wyczuwany przez komórki receptorowe plamki gęstej prowadzi do zwężenia tętniczki doprowadzającej i przywrócenia równowagi RPF oraz wielkości filtracji kłębuszkowej do wartości wyjściowej. Postuluje się występowanie subst. naczyniokurczącej = humoralnego mediatora tej reakcji. Założenie, że miejscowo uwalniana jest renina i powstaje angiotensyna jest kwestionowane.
Mechanizm ten nazwany kanalikowo-kłębuszkowego sprzężenia zwrotnego, tubulu-glomerular feedback, wspomagałby i uzupełniał mechanizm miogenny autoregulacji RBF i GFR polegający na skurczu tętniczki doprowadzającej kłębuszka w odpowiedzi na jej rozciąganie i wzrost ciśnienia transmuralnego.
Z równania EFP = Pc - Cc - Ptor wynika,że wielkość filtracji kłębuszkowej zmienia się przy zmianie ciśnienia onkotycznego krwi Cc oraz ciśnienia hydrostatycznego w torebce Ptor. Ponieważ Cc jest wprost proporcjonalne do stężenia białek w osoczu znaczna hipoproteinemia powoduje wzrost filtracji. Dożylne podawanie dużej ilości NaCl, np. izotonicznego r-ru rozcieńczają białka i powodują wzrost GFR. W przypadku zamknięcia światła moczowodu przez kamień moczowy, ciśnienie hydrostatyczne w całym systemie kanalików podwyższa się, wzrośnie Port, więc zmniejsza się EFP i GFR. Częściej jednoczesne obniżenie filtracji i przepływu krwi przez kłębuszek jest następstwem spadku EFP spowodowanego zwężeniem tętniczek doprowadzających np. pobudzenie nerwowych włókien współczulnych lub działanie hormonów kurczących naczynia - amin katecholowych lub angiotensyny. W stanach pobudzenia układu współczulnego i przy wydzielaniu wymienionych hormonów GFR mniej się zmienia jak RBF. Ponieważ skurcz tętniczki doprowadzającej częściowo zapobiega spadkowi EFR zależnemu od zwężenia tętniczek doprowadzających Rozbieżność między małym spadkiem filtracji a znacznym obniżeniem przepływu krwi jest spowodowany działaniem na kłębuszek angiotensyny kurczącym w większym stopniu tętniczkę odprowadzającą. Zmiany czynności kłębuszków powodują wzrost tzw. frakcji filtracyjnej osocza ff równej stosunkowi GFR do RBF.
W prawidłowej filtracji oznacza się frakcję filtracyjną jako Cin/Cpah wynosi dla człowieka 125 ml/min / 650 ml/min = 0,19 co oznacza że 19% objętości osocza przepływającego przez kłębuszki ulega przesączeniu .Pod wpływem angiotensyny objętość przesączu może stanowić ponad 30% RPF. Zdolność kłębuszków do filtracji przy mniejszym ukrwieniu umożliwia dostarczenie zaoszczędzonej krwi do innych narządów i tkanek bez upośledzenia czynności wydalniczej i regulacyjnej nerek. Ma to znaczenie przy hipowolemii - zmniejszonej objętości krwi krążącej, np. po małym krwotoku. Pobudzenie układu współczulnego i duże stężenie hormonów kurczących naczynia występujące przy znacznej hipowolemii prowadzi do spadku RBF i GFR małe objętości przesączu resorbowane są w całości w kanalikach nerkowych tak, że wydalanie moczu ustaje. Bezmocz może nastąpić przy obniżeniu średniego ciśnienia tętniczego krwi znacznie poniżej zakresu autoregulacji RBF i GFR tj. poniżej 12 Kpa - 90 mmHg
Charakterystyka przesączu kłębuszkowego:
Błona filtracyjna zatrzymuje białka a przepuszcza inne substancje, przesącz kłębuszkowy ma charakter odbiałczonego osocza. Objętość przesączu utworzonego w czasie 1 minuty jest o 5% mniejsza niż objętość osocza oczyszczonego z inuliny w tym samym czasie Cin, bo 5% zajmują białka nie ulegające filtracji. Stężenie substancji pozbawionych ładunku elektrycznego ( glukoza, mocznik) jest jednakowe dla przesączu i wody osocza. Stężenie anionów jest w przesączu nie co większe, a kationów nie co mniejsze. Wynika to z równowagi Gibbsa-Donnana(prawo opisuje sytuacje, gdy po jednej stronie błony półprzepuszczalnej - świetle naczyń włosowatych kłębuszka - są małe jony, unieruchomione palianiony białkowe, a po drugiej stronie - w świetle torebki - wyłącznie jony przenikające przez błonę. W celu zachowania równowagi elektrycznej i zobojętniania ujemnych ładunków unieruchomionych białek część kationów zostaje zatrzymana w świetle naczyń włosowatych, nadmiar ruchomych anionów przechodzi na przeciwną stronę błony. Wtedy różnice potencjałów między światłem naczyń włosowatych kłębuszka, a światłem jego torebki=0.
Różnice w stężeniu jonów w wodzie osocza i przesączu, wynikające z prawa G-D są małe dla jonów jednowartościowych i wynoszą 5%.
W praktyce ilość dowolnej substancji X przesączonej w kłębuszkach w jednostce czasu( przesączony ładunek x, GFRx) oblicza się z iloczynu jej stężenia w osoczu P2x i GFR np. dla Na+
GFRNa+=GFR*PNa+ = 125ml/min*0,14mmol/ml = 17,5mmol/min
Transport kanalikowy-transport maksymalny, próg nerkowy
TRANSPORT KANALIKOWYELEKTROLITÓW I WODY
Z ogólnej objętości ok. 125 ml przesączu wytworzonego w ciałkach nerkowych obydwu nerek dorosłego człowieka w ciągu minuty powst. zaledwie ok.. 1 ml moczu ostatecznego. W czasie przepływu przez kanaliki nerkowe skład, osmolalność i pH przesączu ulegają zasadniczym zmianom. Jest to wynikiem wymiany wody i substancji rozpuszczonych między światłem kanalików a otaczającym je śródmiąższem i krwią naczyń włosowatych okołokanalikowych. Ruch subst. przez ściany kanalików może zachodzić w obu kierunkach i jest ogólnie określany mianem TRANSPORTU KANALIKOWEGO . Transport ze światła kanalika do tkanki otaczającej - wchłanianie zwrotne (resorpcja) - może mieć charakter biernej dyfuzji, wykorzystywać subst. przenośnikowe oraz może mieć charakter transportu czynnego. Subst. znajdujące się w środmiąższu około kanalikowym mogą także dyfundować biernie do światła kanalików , transport czynny w tym samym kierunku jest nazywany sekrecją lub wydzielaniem kanalikowym.
Tak przedstawiony podział transportu zawiera duże uproszczenia. Po pierwsze, kom. kanalika traktowana jest jak jednolita przegroda . W rzeczywistości subst. może dyfundować biernie z płynu kanalikowego do wnętrza kom. , a następnie może być czynnie wypompowywana do tkanki około kanalikowej. Po drugie, dla wielu subst. ruch zachodzi jednocześnie w obu kierunkach , np. bierna dyfuzja sodu z tkanki około kanalikowej do kom. kanalików i jego czynny transport z kom. przez bł. podstawną na zewnątrz.
Kanalik bliższy - Około 70% przesączu kłębuszkowego, czyli u dorosłego około 125 l płynu w ciągu doby ulega resorpcji w kanalikach bliższych. Ta znaczna redukcja obj. płynu kanalikowego zachodzi bez zmiany jego osmolalności (ciśnienia osmotycznego), a więc resorbowany płyn jest również izotoniczny w stosunku do osocza. Nie ulega też zmianie st., gł. kationów sodu, potasu i wapnia, podczas gdy st. chlorku nieco wzrasta (resorpcja cl- mniejsza niż resorpcja H2O lub Na+) a st. wodorowęglanów zmniejsza się (stosunkowo większa resorpcja HCO3-)
Równowaga kłębuszkowo- kanalikowa - oznacza istnienie stałego stosunku przesączonej w kłębuszkach do obj. zresorbowanej w kanaliku bliższym. Przy wzroście lub spadku GFR resorpcja wzrasta lub obniża się w sposób proporcjonalny tak, że w dalszym ciągu niemal 70% przesączu ulega wchłonięciu (stała resorpcja `procentowa' przy zmianach resorpcji wyrażonej liczbą absolutną). Zjawisko to zapobiega większym wahaniom, obj. płynu nie zresorbowanego 5 180w kanaliku bliższym i dostarczanego do kanalika dalszego (tzw. ładunek dystalny).
Ma to duże znaczenie, ponieważ utrzymanie ładunku dystlnego w wąskich granicach jest warunkiem sprawnego funkcjonowania kanalika dalszego. Wiadomo, bowiem, że ten odcinek, w przeciwieństwie do kanalika bliższego, nie jest przystosowany do resorbowania dużych ilości płynu kanalikowego i jego zalanie nie wchłoniętym przesączem spowodowałoby utratę wraz z moczem znacznych ilości wody i elektrolitów. Z drugiej strony wydatnie zmniejszony ładunek dystalny mógłby ulec w całości wchłonięciu, co byłby jednoznaczne z ustaniem czynności wydalniczej i regulacyjnej nerki.
Mechanizm resorpcji płynu w kanaliku bliższym
Resorpcja niemal 70% całej obj. przesączu w kanaliku bliższym jest procesem na wielką skalę i dość złożonym. Składają się na nią różne formy transportu, zarówno czynnego jak i biernego. Ilościowo gł. składnikiem przesączu jest Na+ i towarzyszące mu aniony. Stąd też opis resorpcji płynu w kanaliku bliższym jest głównie opisem resorpcji Na+.
W pierwszym odcinku kanalika Na+ wchodzi do kom. wspólnie z glukozą, aminokwasami, wodorowęglanami oraz resztami kwasów fosforowego, octowego , cytrynowego, mlekowego... Kation Na+ zastępuje też w kom wychodzący z niej jon wodorowy. Transport sodu do kom. może zachodzić dzięki małemu st. Na+ w cytoplazmie (ATP-aza).
Intensywna resorpcja związków organicznych i szeregu anionów (z wyjątkiem Cl-) na początku kanalika bliższego powoduje, że w dalszych jego odcinkach ich st. jest małe, natomiast st. Cl- zwiększone. W związku z tym sód jest tutaj resorbowany w powiązaniu z jonami Cl-. W proces ten zaangażowany jest zarówno transport czynny jak i bierny. Mechanizm transportu Na+ do kom. nie został jeszcze szczegółowo poznany. Wiadomo jednak, że i tutaj gł. rolę odgrywa różnica st. Na+ między światłem kanalika (st. duże)a wnętrzem kom. (st. małe), związana z aktywnością NA+-K+-ATPazy. Ocenia się, że resorpcja NaCl w tym odcinku kanalika bliższego w 30% ma char. bierny. Niewielka nadwyżka ciśnienia osmotycznego we krwi około kanalikowej naczyń włosowatych w stos do światła kanalika - wynik czynnej resorpcji zw. organicznych i anionów w początkowym odcinku kanalika - powoduje ruch osmotyczny wody ze światła w kierunku śródmiąższu i krwi. Woda ta, płynąc nie przez komórki, lecz przez boczne przestrzenie międzykomórkowe (tzw. droga paracelularna) porywa z sobą jony Na+ i Cl- (przepływ bierny konwekcyjny).Lekka elektrododatność światła kanalika sprzyja również biernej dyfuzji N+ drogą paracelularną (przepływ bierny dyfuzyjny). Wysokie ciśnienie onkotyczne białek we krwi naczyń włosowatych ułatwia ewakuację wchłoniętego płynu ze śródmiąższu do krwiobiegu.
Wydzielanie do światła kanalika jonu wodorowego, powiązane z transportem Na+ i HCO3- (patrz regulacja równowagi kw.-zas.) Podobnie jak w przypadku głównych jonów przesączu, większość przesączonego K+, Ca++ i fosforanów organicznych wchłania się także w kanaliku bliższym. Hormon przytarczyc, parathormon, hamuje resorpcję fosforanów, podczas gdy wit. D ją nasila.
Izotoniczny płyn kanalikowy wypływający z końcowego odcinka kanalika krętego bliższego ulega stopniowemu zagęszczeniu wzdłuż ramienia zstępującego pętli nefronu . Jest to wynikiem resorpcji wody do hipertonicznego śródmiąższu rdzenia nerki oraz dyfuzji mocznika i chlorku sodowego w kierunku odwrotnym. Oba te procesy zachodzą ze znaczną intensywnością ze względu na znaczną przepuszczalność ściany ramienia zstępującego.
Kanalik dalszy zbiorczy
Zdolność cienkiego odcinka ramienia wstępującego pętli do czynnego resorbowania chlorku sodowego jest wątpliwa. Proponuje się tutaj jako alternatywę dosyć złożony mechanizm biernej dyfuzji NaCl do tkanki otaczającej. Natomiast wiadomo, że ok. 20% przesączonego ładunku chlorku sodowego resorbuje się w sposób czynny z grubego wstępującego odcinka pętli. Ponieważ ramię wstępujące pętli nefronu jest praktycznie nieprzepuszczalne dla wody usuwanie soli z jego światła, powoduje, że płyn kanalikowy ulega stopniowemu rozcieńczeniu i w początkowym odcinku kanalika krętego dalszego staje się nawet hipotoniczny. Inaczej niż w ramieniu wstępującym pętli, płyn kanalikowy kanalika krętego dalszego wykazuje narastającą elektroujemność i pozostaje elektroujemny w kanaliku zbiorczym. Świadczy to o tym, że obserwowana w tych odcinkach resorpcja sodu zachodzi nie tylko przeciwko gradientom stężeń (st. Na+ w świetle kanalika mniejsze niż w śródmiąższu i krwi), ale także przy niesprzyjającej różnicy potencjałów, a więc łącznie przeciw gradientowi elektrochemicznemu. Bez wątpienia mamy tu do czynienia z czynnym tr. sodu.
Reasumując, z 17,5 mmol Na+ przesączonego w kłębuszkach w ciągu minuty niemal 70% wchłania się zwrotnie w kanaliku krętym bliższym, 20% w pętli nefronu (ramię wstępujące) i prawie 10% łącznie w kanaliku krętym dalszym oraz kanaliku zbiorczym. Tylko mniej niż 1% przesączonego ładunku sodu (GFRNa+) wydala się w moczu.
Resorpcja NaCl jest kontrolowana przez hormon kory nadnerczy - aldosteron, w przypadku jego niedoboru wydalanie sodu wzrasta wyraźnie, osiągając 3-3% przesączonego ładunku. Aldosteron pobudza transport sodu wzdłuż całego kanalika nerkowego, ale jego działanie jest najwyraźniejsze w części dalszej nefronu.
Elektroujemność wnętrza kanalika dalszego krętego i kanalika zbiorczego sprzyja dyfuzji kationów min. K+ ze śródmiąższu to płynu kanalikowego. Większość przesączonego ładunku potasu ulega resorpcji w kanaliku bliższym, jednak w warunkach zwiększonej podaży jego ilość wydalana w moczu może nawet przewyższać wartość GFRK+ (klirens potasu wyższy niż Cin). Jest to dowodem na to, że potas rzeczywiście jest wydalany do światła kanalika dalszego i zbiorczego.
Wobec nieistnienia swoistych mechanizmów transportowych dla wody, jej losy w czasie przepływu przez kanaliki nerkowe są określane głównie przez 2 czynniki: 1) transport głównych jonów, przede wszystkim Na+ i Cl-, powodujący ruch osmotyczny wody; 2) różnica przepuszczalności poszczególnych odc. dla H2O.
W moczu ostatecznym wydala się zaledwie ok. 1% dostarczonej do kanalików wody i mniej niż 1% jonów sodowych i chlorkowych. Wodorowęglany resorbowane są praktycznie w całość, a w przypadku jonu K+ ilość wydalania stanowi ok. 7% jego przesączonego ładunku.
Należy podkreślić, że taki sposób przedstawiania procesów wydalania i transportu uwzględnia tylko ich wynik ostateczny. wydalane Na+ jest bowiem z jednej strony rezultatem resorpcji tego kationu w kanaliku krętym bliższym, ramieniu wstępującym , kanaliku krętym dalszym i kanaliku zbiorczym, a z drugiej strony jego dyfuzji ze śródmiąższu do światła ramienia zstępującego . Podobnie Rzecz się ma z anionem Cl-. Wydalanie K+ jest wynikiem pierwotnej całkowitej resorpcji tego kationu w kanaliku krętym bliższym, a następnie jego transportu do światła kanalika dalszego i zbiorczego. Jedynie w przypadku wody istotna dyfuzja do światła kanalików nie zachodzi w czasie przepływu kanalikami obj. płynu systematycznie maleje. Ze 125ml przesączu dostarczanego w ciągu minuty przez kłębuszki do kanalików krętych bliższych już tylko ok. 30ml wpływa do pętli nefronu, 20 ml do kanalików krętych dalszych, 10 ml do zbiorczych, a ok. 1ml wypływa z brodawek nerkowych do kielichów i miedniczek.
Transport kanalikowy słabych elektrolitów i substancji nieelektrofilowych
W prawidłowych warunkach cały przesączony w kłębuszkach ładunek glukozy (filtracja•poziom glukozy w osoczu) ulega czynnej resorpcji już w początkowym odcinku kanalika krętego bliższego tak, że mocz ostateczny zawiera tylko ilości śladowe. Gdy stężenie glukozy w osoczu wzrasta powyżej 11 mmol/l (2g/l) np. w cukrzycy, pojawia się ona w moczu w znacznych st.
Powyżej 17 mmol/l (3g/l) dalszy wzrost Pg (st. gluk. w osoczu) - a więc i GFR•Pg - powoduje proporcjonalny wzrost wydalania , a resorpcja kanalikowa glukozy (filtracja minus wydalanie) utrzymuje się na stałym poziomie, wynoszącym u dorosłego człowieka ok. 2,1 mmol/min (0,35 g/min). Wartość ta , charakteryzująca max. zdolność transportową kanalików nerkowych w stosunku do glukozy , nosi nazwę TRANSPORTU MAXYMALNEGO ( Tm ). Poziom glukozy, przy którym osiągana jest wartość Tm, nazywa się progiem nerkowym dla glukozy.
Zakres transportu kanalikowego wielu innych substancji (np. Aa czy PAHu) ograniczony jest także pułapem ich transportu max.
MOCZNIK - st. jego w osoczu (ok. 5 mmol/l = 0,3g/l) zależy od podaży białek w diecie. Klirens mocznika wynosi ok. 75ml/min, porównanie, z klirensem inuliny wskazuje, że ok. 40% przesączonego mocznika ulega resorpcji (dyfuzja bierna). Poziom mocznika w osoczu wzrasta w miarę obniżania się GFR w przebiegu chorób nerek. Jednak objawy chorobowe mocznicy nie zależą od mocznika, który jest nietoksyczny, lecz od jednoczesnych zaburzeń gosp. elektrolitowej i równowagi kw.-zas. ustroju.
AMINOKWASY - są resorbowane w 98% w kanalikach krętych bliższych. Istnieją systemy transportujące swoiście Aa - 3 grupy:
Alanina, kw. glutaminowy
Histydyna, cystyna, arginina, lizyna
Asparaginy, glutaminy
INNE SUBSTANCJE - w kanaliku bliższym resorpcji czynnej ulegają min. kw.tłuszcz., białka i wit.C. Natomiast ok. 90% kw. moczowego resorbuje się biernie. Kreatynina jest czynnie wydalana do światła kanalików, stad jej klirens przewyższa, klirens inuliny. Innym przykładem substancji czynnie wydzielanej przez kanaliki jest PAH.
Mechanizm zagęszczania i rozcieńczania moczu
Pomimo różnej ilości pobieranej i traconej wody jej zawartość w ustroju wskazuje na optymalne stężenie. W tej stabilności poza mechanizmem pragnienia główną role odgrywa zdolność nerek do wydalania małych lub dużych ilości moczu. Pozbywanie się lub oszczędność płynów nie zakłóca pracy nerek, te same produkty przemiany materii są wydalane w małej lub dużej objętości moczu, rozcieńczonego lub stężonego. Regulacja objętości wydzielanego moczu polega na stopniu jego rozcienczenia. Minimalna objętość wody potrzebna do wydalenia moczu to 0,4l. Średnie dobowe objętość moczu wynosi 1,0-1,5 l, górny pułap około 10l.
Stan zagęszczenia moczu oznacza jego ciśnienia osmotyczne ( osmolalność, molalność) może wynosić 70 - 1200-1400 mOsm/kg H2O.Osmolalność osocza i przesączu kłębuszkowego 300mOsm.kg:
- max zagęszczenie 1300mOsm/kg
-min zagęszczenie - 70mOsm/kg
Możliwość znacznego zagęszczenia moczu wyjaśnia mechanizm tzw. wzmocnienia przeciwprądowego ( counter current multiplication).
Mechanizm gromadzi substancje osmotycznie czynne w świetle naczyń i płynie śródmiąższowym rdzenia w stężeniach wzrastających od kory do brodawek nerkowych. Stałą powolną wymianę składników płynu zapewniają naczynia proste.
Rys. zarys str. 489
układ kanalików w rdzeniu nerki umożliwiający zagęszczenie moczu ( tzw. wzmacniacz przeciwprądowy). Ściana ramienia zstępującego jest przepuszczalna dla substancji rozp. i dla wody. Ściana kanalika wstępującego i krętego dalszego jest nieprzepuszczalna dla wody, a ściana kanalika zbiorczego jest przepuszczalna dla wody tylko w obecności ADH.
Kanaliki są rozmieszczone w płynie śródmiąższowym nerki. Powolną wymianę płynu z tym zbiornikiem zapewniają naczynia proste. Z wyjątkiem ramienia wstępującego pętli osmolalność w śródmiąższu i naczyniach jest jednakowa dla danego poziomu rdzenia nerki. Gromadzenie się subst. osmotycznie czynnych (S) w rejonie brodawek nerkowych zależy od ich usuwania z ramienia wstępującego długich pętli nefronu. Ponieważ, to ramię jest nieprzepuszczalne dla wody są 2 rodzaje następstw:
1. Stałe usuwanie S bez wody z ramienia wstępującego co powoduje rozcieńczanie moczu kanalikowego w tym ramieniu.
2. Transportowanie ze światła ramienia wstępującego substancje S podwyższają osmolalność śródmiąższu dyfundując do ramienia zstępującego pętli zwiększają osmolalność płynu w jego świetle w miarę zbliżania się do zagięcia pętli.
Transport S z ramienia wstępującego powoduje na każdym poziomie rdzenia różnicę stężeń między jego światłem a śródmiąższem wynoszącą około 200mOsm/kg H2O tzw. efekt pojedynczy. W czasie przeciwkierunkowego przepływu płynu w obu ramionach pętli ciągłe usuwanie S z ramienia wstępującego i ich dodawanie do ram. zstępującego zwielokrotnia efekty pojedynczy. - tzw. wzmocnienie przeciwprądowe tj. wytworzenie wzdłuż długiej osi pętli bardzo dużej różnicy stężeń = 1000mOsm/kg H20.
Ze względu na przepuszczalność dla S i wody naczyń prostych następuje charakterystyczne uwarstwienie stężeń w rdzeniu nerki i krwi płynącej tymi naczyniami. Przy braku większej różnicy stężeń S między światłem vasa recta a śródmiąższem, przy powolnym przepływie krwi tymi naczyniami nagromadzone substancje nie są rozproszone ani wypłukane. Procesy transportu subst. S spisane przy działaniu mechanizmu przeciwprądowemu mają odpowiedniki w czynnym transporcie i biernej dyfuzji składników moczu kanalikowego. Mechanizm gromadzenia substancji osmotycznie czynnych w śródmiąższu i duże stężenie NaCl utrzymuje się a nawet narasta w obrębie rdzenia wewnętrznego aż do brodawki nerkowej, więc w strefie cienkich odcinków wstępujących pętli. Założono, że NaCl opuszcza światło cienkiego odcinka na zasadzie biernej dyfuzji podstawową rolę odgrywają ruchy mocznika. Ulega on zagęszczeniu w początkowym odcinku kanalika zbiorczego ( na poziomie rdzenia zewn.) w związku z dyfuzją wody do hipertonicznego śródmiąższu .Ściana tego odcinka jest dla mocznika nieprzepuszczalna i pozostaje on w świetle. Końcowy odcinek kanalika zbiorczego (rdzeń wew.) jest dla mocznika przepuszczalny,dyfunduje on do śródmiązszu podwyższając jego osmolalnośc. Zwiększa to wychodzenie wody z ramienia zstępujacego pętli NaCl miedzy światłem cienkiego odcinaka śródmiąższem - powstają warunki do biernej dyfuzji soli do płynu śródmiąższowego.
Rozkład stężeń S - osmolalność- w rdzeniu nerki umożliwia zagęszczanie lub rozcieńczanie moczu. Zagęszczanie w ramieniu zstępującym pętli izotonicznego płynu dostarczanego przez kanalik kręty bliższy jest zjawiskiem, przejsciowym. Płyn ulega rozcieńczeniu w ramieniu wstępujacym. Mocz kanalikowy wpływający do kanalika krętego dalszego jest zawsze rozcieńczony. Przy niskim stężeniu we krwi wazopresyny np. przy dodatnim bilansie wodnym( przewodzenie ustroju) ściana kanalika zbiorczego jest nieprzepuszczalna dla wody i rozcieńczony w ramieniu wstępującym mocz bez zmiany osmolalności płynie do dróg moczowych. Przy przepływie przez kanalik kręty dalszy i kanalik zbiorczy może ulec dalszemu rozcieńczaniu, zależnie od resorpcji chlorku sodowego.
Gdy potrzeba oszczędzania wody, przy wysokim poziomie wazopresyny we krwi, ściana kanalika zbiorczego staje się przepuszczalna dla wody. W miarę zbliżania się do szczytu brodawki nerkowej kanalik zbiorczy zanurzony jest w płynie śródmiąższowym o coraz wyższej osmolalności. Następuje dyfuzja ze światła kanalika do hipertonicznego środowiska i narasta zagęszczenie moczu. ... ...tu trochę nie widać....
o stopniu zagęszczenia moczu decyduje poziom wazopresyny i zależna od niego przepuszczalność kanalika zbiorczego. Poziom zagęszczenia w pobliżu brodawki nerkowej wynosi 1200-1400mOsm/kgH20 - górny pułap.
Ilościowe ujęcie Zagęszczenia i rozcieńczenia moczu:
Wzór służący do obliczania klirensu nerkowego można stosować do każdej substancji wydalanej przez nerki do wszystkich substancji łącznie.
Znając globalne ich stężenie = osmolalność osoczu Posm i w moczu Uosm tzw. klirens nerkowy
Cosm= Uosm * v / Posm
Średnio Cosm = 2-3ml/min tzn. w ciągu minuty nerki oczyszczają 2-3ml osocza lub wydalają taką ilość substancji rozp. jaka jest w 2-3 ml osocza.
Wielkość diurezy nie wpływa na klirens osmotyczny ( w mniejszej lub większej objętości moczu wydalone są te same ilości subst. rozpuszczonych)
Podstawiając do wzoru wyżej napisanego wartość dla moczu rozcieńczonego Uosm<Posm:
Cosm = 70mOsm/kgh2o * 10,3ml/min/ 300mOsm/kgh20 = 2,4ml/min
tzn., że ilosć subst. rozpuszczonych w 2,4 ml osocza nerki wydalają w objętości moczu 10,3ml, tzn. że objętość 2,4 ml płynu o osmolalności osocza wydalają 10,3 - 2,4=7,9ml czystej wody. Wartość 7,9ml to klirens czystej wody
Ch20 = V- Cos i jest miernikiem rozcieńczenie moczu
i znowu dla Uosm>Posm
Cosm = 1200mOsm \/kg h20 * 0,6ml/min / 300mOsm/kgh20 = 2,4ml/min
W tym przypadku ilość rozpuszczonych subst. w 2,4 ml osocza nerki wydalają w o,6 objętości moczu o osmolalności 4 razy wyższej niż Posm. Pozostała objętość czystej wody wynosi 2,4 - 0,6 =1,8ml/min jest resorbowana w kanalikach i zostaje w ustroju. Wielkość tej resorpcji ( transportu)
wolnej wody Th20 =Cosm- V jest miarą zagęszczenia moczu. Liczbowo
Th20= --Ch20, czyli w nerkach zagęszczających klirens jest ujemny wody.
Procesy rozcieńczania i zagęszczania moczu są kontrolowane przez podwzgórzowo - przysadkowy układ antydiuretyczny nie są jedynym procesem, w jaki nerki mogą zmieniać objętość wydzielanego moczu. Inny mechanizm to pierwotne zmiany resorpcji chlorku sodowego kontrolowane przez aldosteron oraz równoległe zmiany resorpcji wody. Wzrost stężenia aldosteronu we krwi zmniejsza wydalanie soli i wody, obniżenie jego stężenia działa przeciwnie,
Zmianom filtracji kłębuszkowej towarzyszą równoległe zmiany diurezy i wydalania soli. Działanie większości leków moczopędnych polega na hamowaniu resorpcji jonów sodowych i chlorkowych w różnych odcinkach kanalików zwiększenie diurezy jest wtórne w stosunku do wydalania soli zwiększonego.
W badaniach czynności nerek zwiększa się objętość wydalanego moczu przez wprowadzanie do krążenia substancji nie resorbujących się w kanalikach nerk np. mannitol lub przy dużych stężeniach we krwi i przesączu resorbowanym częściowo ( glukoza, mocznik)Substancje te wiążą wodę i w płynie kanalikowym zapobiegają jej wchłanianiu zwiększając diurezę - diureza osmotyczna.
Badania klirensowe
Metody badania czynności nerek
I Badanie poszczególnych nefronów:
Metody oparte na mikropunkcji różnych elementów nefronu (in situ)
pomiary st. subst. w płynie kanalikowym
pomiary pH płynu kanalikowego
pomiary różnic potencjałów (elektrofizjologia nefronu)
pomiary ciśnienia hydrostatycznego w kanalikach i naczyniach
technika rozszczepionej kropki (split-drop)
mikroperfuzje kanalików
Badanie fragmentów wyizolowanych nefronów
II Badanie czynności całej nerki
Pomiary klirensu nerkowego
Metoda stop-flow
Pomiary hydrodynamiki całej nerki i jej stref (kory, rdzenia zew. i wew.)
Metody badania poszczegolnych nefronów
Stosowane tylo u zwierząt doświadczalnych. Mają char. bezpośredni tzn. dostarczają konkretnych informacji na temat czynności danego nefronu. Najważniejsze zastosowanie mają techniki nakłuwania (mikropunkcji) kanalików lub naczyń nerkowych za pomocą mikro pipet. Wpobranych próbkach moczu lub krwi oznacza się skład chem. i osmolalność lub łączy pipety z manometrem (?) i mierzy ciśnienie hydrostatyczne. Wprowadzając mikroelektrody mierzy się st. H+ (pH), określa różnicę potencjału między światłem kanalika a wnętrzem kom. lub otacającym śródmiąższem.
Przykład:
Badania mikropunkcyjnego: szczurowi podano dożylnie r-r inuliny, polimeru frutozy, o m.cz. 5000. Filtruje się ona swobodnie ze światła naczyń włosowatych kłębuszka do torebki, nie przenika przez ścianę kanalika nerkowego. W próbkach krwi tętniczej i moczu z kanalika krętego bliższego oznaczono st. Na+ i inuliny. Okazało się, że st. Na+ w moczu i krwi jest jednakowe, więc stosunek [Na+] w moczu kanalikowym(tubular fluif- TF) do [Na+] w osoczu (plasma-P) jest niemal równy 1,0. TFNa+/PNa+ = 1,0
Wynik taki uzyskuje się, gdy:
do punktu nakłucia sód w przesączu kłębuszkowym nie jest resorbowany anie nie dyfunduje do światła kanalika
do światła kanalika dyfunduje poprzez jego ściany r-r sodu o tym samym st. co w przesączu kłębuszkowym
ze światła kanalika resorbowany jest r-r sodu o tym samym st.
Wybór właściwego rozwiązania umożliwia porównanie st. inuliny w osoczu (Pin) i płynie kanalikowym (TFin). Ściana kanalika nerkowego jest nieprzepuszczalna dla inuliny, wzrost jej st. w świetle kanalika np. z 0,5 - 1,5g/l musi zależeć od zagęszczenia tej subst. spowodowanego resorpcją płynu kanalikowego. St. inuliny wzrośnie, gdy ta sama jej ilość będzie rozpuszczona w zmniejszonej objętości. Stwierdzenie ubytku obj. płynu kanalikowego bez zmiany ilości rozpuszczonego w nim sodu wskazuje na prawdziwość ostatniego (trzeciego) z ww. wariantów. Występuje, więc resorpcja r-ru sodu o tym samym st.jak w przesączu kłębuszkowym.
Trzykrotny wzrost st. inuliny TF/P = 3 wskazuje, żę 1/3 rozpuszczalnika (przesączu) pozostała w świetle kanalika. Pozostałe 2/3 uległo resorpcji. Dzięki tej metodzie uzyskano informacje o f-cji nefronu - o resorpcji w kanaliku bliższum już ok. 70% obj. przesączu kłębuszkowego bez zmiany jego st. sodu i osmolalności - resorpcja iziosmotyczna.
Inna metoda - Technika rozszczepionej kropli to badanie resorpcji płynu kanalikowego.
Jednym kanałem mikropipety o podwójnym świetle wprowadzono do kanalika najpierw kroplę ciemni zabarwionego oleju . Następnie drugim kanałem wstrzyknięto r-r Ringera, który kroplę tę rozszczepił. Pomiar szybkości kurczenia się tej kropli umożliwia określenie szybkości resorpcji płynu przez ścianę kanalika .
Metoda mikroperfuzji kanalika polega na ciągłym wprowadzaniu płynu testowego do kanalika za pomocą mikropipety z pompą i pobieranie próbek do badania. Z różnic między st. badanych substancji, we wprowadzonym płynie i pobranych próbkach określa się szybkość resorpcji tej subst. w kanalikach . Analiza próbek płynu zmienionego podczas przepływu przez kanalik umożliwia ocenę resorpcji.
Opisane metody badanie in situ muszą dotyczyć struktur blisko powierzchni nerki, bądź rdzeniowych dostępnych po przygotowaniu od strony wnęki. Można również badać nefrony niezależnie od ich położenia w nerce po ich wyizolowaniu.Perfuzja wyizolowanego kanalika nerkowego królika , płynem o znanym składzie , połączona z oznaczeniem obj. i składu płynu wypływającego wyjaśnia transport wielu subst. przez ściany kanalika . Latwiej jest wyizolować nefrony po wcześniejszym wytrawieniu jej w kw. solnym.Wprawdzie są to struktury martwe, ale z położenia w świetle kanalika (bliżej lub dalej kłębuszka) subst. wskaźnikowej, podanej za życia można obliczyć ilość przesączu powst. w poszczególnych nefronach w jednostce czasu . Możliwe śą badania nefronów położonych głęboko w nerce. Tą metodą ustalono, że nefrony przyrdzeniowe mają większą filtrację niż korowe.
Metody badania całej nerki
Dostarcają informacji o operacjach wszystkich nefronów. Umożliwia ustalenie wydalniczej roli nerek i ichroli w homeostazie. Należą tu badania KLIRENSOWE (określanie wskaźnika oczyszczania osocza w nerkach). Dane uzyskane są pośrednie, oparte na założeniach.
Badania klirensowe. Oznaczanie filtracji kłębuszkowej GFR
Zmierzenie diurezy (V) czyli obj. moczu wydalonego w jednostce czasu (ml/min) oraz st. subst. X w tym moczu (Ux) w mg/ml pozwala obliczyc tempo wydalania X przez nerki (UxV) w mg/min. Iloczyn ten dobrze char. aktualne wydalanie X ale nie określa zdolności do usuwania z ustroju.
U tego samego człowieka UxV mierzone wiele razy nawet w małych odstępach czasu może mieć różne wartości. UxV zależy od ilości subst. X przesączonej w kłębuszkach w jednostce czasu i dostarczonej do kanalików. Ten tzw. przesączony ładunek substancji X czyli GFRx określony jest przez iloczyn obj. płynu przesączonego w jednostce czasu GFR oraz st. subst. X w przesączu Px
GFRx = GFR • Px
mg/min = ml/min mg/ml
Gdy subst. X będzie inulina - polisacharyd nie przenikający przez ściany kanalików - to jej przesączony ładunek będzie równy wydalanemu w moczu: GFR Pin = UinV (1)
Ponieważ subst. rozpuszczone w wodzie osocza , z wyjątkiem białek, filtrowane są prawie bez zmiany st. Pin równe jest st. inuliny w osoczu, a więc wartość którą można określić pobierając próbkę krwi. Przekształcenie równania (1) umożliwia obliczenie wielkości filtracji, kłębuszkowej, którą trudno byłoby zmierzyć w sposób bezpośredni
GFR = UinV / Pin (ml/min)
GFR u mężczyzn wynosi 125, u kobiet 110 ml/min/1,75m2 pow ciała.
Wyrażenie UxV/Px okreś;lane jest mianem KLIRENSU NERKOWEGO (Cx). Określa on zdolność nerki do wydalania dowolnej subst. X w znacznym stopniu charakteryzuje daną nerkę
Cx = UxV / Px (ml/min)
Klirens Inuliny określa wielkość filtracji kłębuszkowej (Cin = GFR) u danego osobnika.
Kliens nerkowy jest bardziej stały jak wydalanie nerkowe (UxV) bo uwzględnia st. subst X w osoczu i w przesączu kłębuszkowym (Px). Wartość Cx równe np. 100 ml/min oznacza, że w ciągu minuty nerki wydaliły taką ilość subst. X, jaka była zawarta w 100 ml osocza, czyli całkowicie oczyściły 100 ml osocza z tej subst. Oczywiście to teoretyczne, bo nerki usunęły ilość subst. X zawartą w 100 ml osocza a w rzeczywistości usunięto % ilość subst. z całej obj. osocza.
Porównanie klirensu różnych substancji z wartością filtracji kłębuszkowej (Cin) pozwala określić ich los w czsie przepływu przez kanaliki nerkowe. Jeżeli Cx = Cin to oznacza, że subst. X wydostaje się ani nie przenika do światła kanalika przez ściany, podobnie jak inulina.
Jeżeli Cx<Cin to wydalanie subst X w moczu (UxV) jest mniejsza od ładunku przesączonego w kłębuszkach (GFR•Px). Oznacza to,że część subst. X resorbowana jest ze światła kanalika do śródmiąższu i do krwi naczyn włosowatych okołókanalikowych.
UxV>GFR•Px znaczy,że subst. X jest filtrowana i dyfunduje lub jest transportowana z krwi przez ściany kanalika do moczu kanalikowego .
Wielkość filtracji kłębuszkowej jest najbardziej podstawową zmienną charakteryzującą czynność nerek Oznaczanie GFR jaki i Cin wymaga wprowadzenia inuliny do ustroju. W klinice filtrację mierzy się jako klirens KREATYNINY ENDOGENNEJ (Ckr), której st. w osoczu wynosi 10mg/l (albo ng/l???- Sprawdzic). Ckr wynosi średnio 140 ml/min tzn, że jest ona filtrowana i wydzielana do światła kanalika przez komórki jego nabłonka. Uzyskuje się wyższe wyniki niż w GFR, ale łatwość pomiaru jest bardzo ważna. Wystarczy zbiórka moczu, oznaczenie kreatyniny w moczu, osoczu aby obliczyć klirens :
Ckr = UkrV / Pkr
Badania klirensowe są proste, można je prowadzic w warunkach równowagi czynnościowej. Stężenie badanej subst. powinno być bardzo stałe , tzn. wprowadzając subst., która nie jest stałym składnikiem osocza , w infuzji dożylnej ze stała szybkością. Badany powinien wypic wcześniej sporo płynu - duże obj. moczu umożliwiają dokładność. Diureza powinna być ustabilizowana, przy jej dużych wahaniach badania są niemożliwe do interpretacji. Pomimo tych założeń błąd pomiaru może wynosić 10 %.
Metoda stop-flow - rzadko stosowana, umożliwia lokalizację transportu subst. w kanaliku nerkowym zwierząt doświadczalnych po czasowym zaciśnięciu moczowodu, unieruchomieniu słupa moczu w tkankach (stop-flow). Zródłeminformacji są próbki moczu wypoływającego po zwolnieniu zacisku moczowego.
Regulacja przepływu krwi przez nerki
Regulacja Prepływu krwi:
-Wielkosć przepływu krwi, około 1,2l krwi przez obie nerki na minute.Chociaż zużycie tlenu jest stos. duże, ogromne ukrwienie nerek nie znajduje uzasadnienia w potrzebach metabolicznych. Wskazuje na to niewielkie pochłanianie tlenu z przepływającej krwi.Znaczny nadmiar okrwienia umożliwia natomiast wytwarzanie w kłebuszkach ok 125 ml ultrafiltratu w ciągu minut,z więc zapewnia utrzymanie niabędnej f-cji wydalniczej.
-Pomiar przepływu krwi
Posługując się metodą klirensową,można oznaczyć przepływ krwi przez nerki - RPF.
Ilość dowolnej substancji x rozpuszczonej w osoczu krwi wpływjącej do nerki tętnicą nerkową określona jest przez iloczyn Ax*RPF, gdzie Ax oznacza stężenie substancji x w osoczu tętniczym. Substancja ta opuszcza nerkę z moczem i krwią żylną nerkową; te składowe ilosci śa odpowiednio opisane przez iloczyn Ux*V oraz RVx*RPF,gdzie V oznacza diurezę minutiwa,a Ux i RVx stęzenia substancji w moczu i krwi żylnej nerkowej. Jeżeli pominiemy niewielkie stęzenia subst X opuszczające nerkę naczyniami chłonnymi, to bilans nerkowy X można przedstawić:
Ax*RPF=(rVx*RPF)+(Ux*V) (1)
po przekształceniu:
RPF= Ux*V/Avx-Rvx (2)
Przepływ osocza przez nerki jest, zatem równy ilości dowolnej subst wydalonej w moczu podzielonej przez różnicę w stężeniu tej subst w krwi tętniczej i żylnej nerkowej.Określeni RPF wudług powyższego równania byłoby jednak kłopotliwe wymaga, bowiem oznaczenia stężenia w krwi żylnej nerkowej.Trudność ta ominięto znajdująć susbt,która ekstrhując przez nerki z taką intensywnością,że przy stężeniu w osoczu nie przekraczajacym 0,03-0,04g/l przedostaje sie w całości do moczu, a jej stężenie we krwi zelnej jest prawie równe 0.
Ta subst to kwas para-aminohipurowy PAH, związek nitoks, który można wprowadzić do ustroju drogą infuzji dożylnej.Posługując się PAHem można pominąc skladnik RVx z równania (2) i obliczyć przepływ osocza wg wzoru:
RPF =Upah*V/Apah=Cpah (3)
Widac ze wzoru,że RPF równy jest klirensowi nerkowemu PAH.W klinice oznacza się PAH we krwi żylnej obwodowej zamiast we krwi tętniczej,co wprowadza niewielki błąd.U dorosłego Cpah~`650ml/min.
Znajdujać Cpah i liczbę hematokrytową Ht można obliczyć przepływ krwi przez nerki RBF:
RBF= RPF/1-Ht , gdy Cpah=650ml/min i Ht=0,46, to RBF=1204ml/min
Współczynnik ekstrakcji PAH efektywnego RPF
Dokładniejsze badania wskazują na to,że nawet przy b. niskim poziomie PAH w osoczu tętniczym jego poziom w osoczu krwi żylnej nerkowej jest b. niski,ale nie równy 0.Innymi słowy ekstrakcja PAH nigdy nie jest całkowita i współczynnik ekstrakcji EPAH jest zawsze niższy od 1,0.
Dla nerek ludzkich wynosi 0,9:
Epah =Apah -RVpah/ Apah-0,9
Skoro założenie,ze Rpah=0 nie jest w pełni prawdziwe, RPF jest nieco większy od Cpah, jak to wynika z równań 2. i 3.
Dokładne wyliczenia RPF wymaga wprowadzenia poprawki zależnie od eilkości Epah.Dzileąc licznik i mianownik równania 2. przez Apah otrzymujemy:
RPF = Upah*V/Apah / Apah-RVpah/Apah = Cpah/Epah
Niezupałna ekstrakcja PAH przez nerki tłumaczy się w sposób, następujacy.Związek ten jest transportowany z krwi naczyń włosowatych okołokanalikowych do światła kanalików krętych bliższych tak intensywnie,że krew opuszczająca sieć okołokanalikową jest całkowicie z niego oczyszczona.Jednak nie cała krew płynie przez naczynia oplatające kanaliki bliższe, krew, która omija tę drogę nie jest oczyszczona z PAH.tak, więc krew żylna nerkowa zawiera domieszke PAH i dlatego Epah jest 0,9.Nie ulega oczyszczaniu krew płynąca naczyniami torebki łącznotkankowej nerki, miedniczki lub kanalików nerkowych. Ilościowo jeszcze większe znaczenie ma krew zaopatrująca kłębuszki przyrdzeniowe. Tętniczki odprowadzające prowadzą częsć tej krwi bezpośrednio do naczyń prostych rdzenia nerki, z pominięciem sieci włosowatej okołokanalikowej. Dlatego przyjmuje się,że Cpah określa tzw. Efektywny RPF, czyli przepływ przez tkankę zdolną do ekstrahowania PAH, głównie przez korę nerek.
Metody radioizotopowe
Szybka ekstrakcja PAH przez nerki jest wykorzystywana w badaniach.Rejestracja radioaktywności w ookolicach lędźwiowych nad nerkami po wstrzyknięciu dożylnym analohu PAH znakowanego izotopem I 131 tzw, renografia izotopowa umożliwia ocenę zarówno przepływu krwi jak i czynności kanalików oraz odpływu moczu do pęcherza.
Ukrwienie rdzenia nerki.
Jednoczesne określenie Cpah i całkowitego przepływu osocza np.jako Cpah/Epah,pozwala na obliczenie przepływu przez rdzeń nerki
( przepływ całkowity minus przepływ korowy). Wiadomo,że tylko kilka % całkowitego przepływu krwi przez nerkę przypada na rdzeń.To stosunkowo skromne ukrwienie zapobiega być może rozproszeniu nagromadzonych w śródmiąższu rdzeniowym subst, osmotycznie czynnych.Wysoka osmolalność tego śródmiąższu jest koniecznym warunkiem skutecznego zagęszczania moczu.
Zwraca uwagę znaczny spadek ciśnieniana przebiegu tętniczki do- i odprowadzającej, zależny od b. wys oporu w obrębie tych naczyń.Ciśnienie w naczyniachwłosowatych kłębuszków - siła napędowa filtracji - stanowi tylko ok. 50% ciśnienia w tętnicy nerkowej.Średnica tętniczki doprowadzającej i opór naczyniowy na jej przebiehu wykazują charakterystyczne zmiany zależne od zmian ciśnieniaw tętnicy nerkowej.Zjawisko to leży u podstaw tzw. autoregulacji RBF ( w zakresie ciśnienia tętnicy nerkowej w zakresie 10,6 - 23.9 Kpa - 80-180 mmHg przepływ nie zmienia się dzięki zmianom średnicy tętniczek doprowadzających kłębuszków). Przy ciśnieniu w tętnicy nerkowej poniżej 12,0 Kpa 90mmHg tętniczka jest maksymalnie rozszerzona i jej opór się nie zmienia.Wynikiem tego jest wzrost przepływu krwi proporcjonalny do wzrostu ciśnienia.Od ok 12 kPa wzrost ciśnienia powoduje postępujące zwężanie tętniczki doprpwadzającej i wzrost oporunaczyniowego,wskutek czego RBF prawie się nie zmienia - (autoreg, RBF - plateau krzywej). Jednak przy ciśnieniu ok 23.9 Kpa ( 180mmHg) tętniczka doprowadzająca jest już maksymalniezwężona, dalszy wzrost ciśnienia powoduje na nowo wzrost przepływu.
Autoreg ma charakter autonomiczny wewnątrznerkowy, zachodzi bowiem także w nerce odnerwionej lub nawet wyizolowanej.Mechanizm zmian świateł tętniczki doprowadzającej nie jest do końca wyjaśniony.Wiadomo,że błona mięśniowa tętniczek reaguje skurczem na wzrost różnicy ciśnienia między jej światłem, a otaczającym śródmiąższem ( wzrost ciśnienia transmuralnego). Dosyć powszechnie akceptowana teoria miogennatłumaczy właśnie zmiany oporu w obrebie tętniczki doprpwadzającej reakcją jej ściany na zmiany ciśnienia transmuralnego równolegle do wahań ciśnienia tętniczego.Udział w zjawisku autoregulacji także czynników humoralnych - angiotensyna,prostaglandyny - wynika z wielu badań.Autoreg RBF uniezależnia hemodynamikę od wahań ciśnienia tętniczego krwi,przy braku autoreg. każdemu wzrostowi ciśnienia towarzyszyłby wzrost nie tylko RBF,ale także filtracji oraz wydalania wody i elektrolitów.Taka labilność narażałaby organizm na zaburzenia bilansu wodno - elektrolitowego.
Autoreg. nie oznacza absolutnej stabilności RBF.Aktywacja układu wpółczulnego, np. w warunkach ciężkiego krwotoku,wstrząsu lub wysiłku fiz., prowadzi do skurczunaczyń nerkowych, spadku przepływu nerkowego,filtracji i wydalania. W tych krytycznych warunkach krew zaoszczędzona w obrębie nerek dostarczana jest do innych takanek - np. mięsni i mózgu.
Udział nerki w regulacji równowagi kwasowo-zasadowej
W przebiegu procesów przemiany materii powstaje w ustroju nadmiar jonu wodorowego (kwasów) w stosunku do zasad w ilości ok. 80 mmol/24h. Ponieważ stężenie jonów wodorowych w płynach ustrojowych wykazuje tylko minimum wahania wokół wartości prawidłowej (pH 7,35 tj. 44,7 mmol/l) , a tylko nerki mogą usuwać jon wodorowy na zewnątrz ustroju, cały nadmiar kwasów wydalany jest w moczu . Można jednak obliczyć, że pomieszczenie 80 mmol H+ w dobowej objętości moczu spowodowałoby jego zakwaszenie do pH 1,0. Z drugiej strony wiadomo, że kom. kanalików wydzielające czynnie H+ do płynu kanalikowego nie są w stanie zakwasić go poniżej pH 4,5, a najczęściej pH moczu wynosi 6,5. Pozorna sprzeczność wynika z tego, że tylko ułamek procentu całej ilości jonu wodorowego jest uwalniany w formie wolnej, a ogromna większość- w postaci zbuforowanej.
Rola nerek w utrzymaniu równowagi kwasowo-zasadowej polega, oprócz wydalania jonu wodorowego, także na regulacji poziomu w osoczu i zasobów w ustrojowych jonu HCO3- wchodzącego w skład buforu wodorowęglanowgo (HCO3-/H2CO3). Nerki współdziałają tutaj z płucami regulującymi zasób drugiego składnika tego buforu - kw. węglowego, poprzez wydalanie mniejszych lub większych ilości pozostającego z nim w równowadze, CO2. Procesy resorpcji HCO3- i sekrecji kanalikowej H+ są ściśle ze sobą powiązane, a zwłaszcza w obrębie kanalika krętego bliższego.
Resorpcja HCO3- i wydzielanie H+ w kanaliku krętym bliższym.
Przy prawidłowym stężeniu w osoczu ( ok. 26 mmol/l) prawie wszystkie jony HCO3- przesączone w kłębuszkach ulegają resorpcji gł. w kanaliku krętym bliższym. Proces ten polega na tym, że jon HCO3- przesączu wraz z czynnie wydzielonym jonem, H+ pozostają w świetle kanalika krętego bliższego w równowadze ze słabo dysocjującym kw. węglowym. W obecności anhydrazy węglanowej, znajdującej się w rąbku szczoteczkowym kom. kanalika bliższego, H2CO3 rozpada się na wodę (zawierającą wydzielany do światła H+) oraz CO2 dyfundujący do wnętrza komórki. Dzięki obecności anhydrazy węglanowej także w kom. opisany wyżej proces ulega tam odwróceniu i powstały kwas węglowy dysocjując dostarcza nowych jonów H+ przeznaczonych do wydzielania oraz jonów HCO3- dyfundujących do śródmiąższu i krwi naczyń włosowatych okołokanalikowych. Wodorowęglany są także resorbowane czynnie w formie jonowej, w procesie ściśle powiązanym z resorpcją Na+.
Przy zwiększeniu st. jonów HCO3- w osoczu pow. 28 mmol/l (próg nerkowy wodoroweglanów), czyli w warunkach zasadowicy metabolicznej, ich resorpcja pozostaje nie zmieniona i nadmiar wydala się w moczu. Wydalanie wodorowęglanów wzrasta także przy spadku pCO2 krwi (zasadowica oddechowa), a obniża się przy jego wzroście (kwasica oddechowa). Tak, więc dzięki interwencji nerek stosunek HCO3-/CO2 decydujący o pH krwi nie ulega w tych warunkach zmianie.
Wydalanie małej ilości jonów wodorowych w formie wodnej ma samo przez się niewielkie znaczenie dla utrzymania prawidłowego bilansu kwasowo-zasadowego. Natomiast obecność tych jonów w płynie kanalikowym, przejawiająca się umiarkowanym spadkiem pH dowartości6,5-4,5 jest istotnym czynnikiem mobilizującym mechanizm usuwania H+ w formie zbuforowanej, w postaci tzw. kwaśności miareczkowej lub jonu amonowego.
Wydalanie jonu wodorowego w formie zbuforowanej
Wydalanie kwasności miareczkowej
Czynne wydalanie jonu wodorowego zachodzi wzdłuż niemal całego kanalika nerkowego. Ponieważ większość wodorowęglanów ulega resorpcji w kanaliku bliższym, w dalszych odcinkach nefronu bufor HCO3 / H2CO3 znajduje się w niewielkich ilościach. Większe znaczenie dla wychwytywania wydzielonego jonu wodorowego ma tam bufor fosforanowy HPO42- / H2PO4-. Jon H+ pochodzący np. z dysocjacji kw. węglowego w kom. kanalika (H2CO3 > H+ + HCO3-) wymienia się z jednym sodem fosforanu dwusodowego (N2HPO4) tworząc fosforan jednosodowy ( NaH2PO4) i w tej formie wydalany jest w moczu. Wymieniony sód ulega jednocześnie resorpcji w połączeniu z HCO3-, obecnym wewnątrz kom. (tzw. oszczędzanie zasad ustrojowych).
Sumarycznie:, Na2HPO4 + H+ → NaH2PO4 (wydalany) + Na+(resorbowany)
Ilość wydalanego w ten sposób jonu wodorowego (a zarazem zresorbowanych wodorowęglanów) można określić miareczkując mocz silną zasadą aż do osiągnięcia pH osocza krwi (`kwaśność miareczkowa')
Wydalanie jonu wodorowego w połączeniu z amoniakiem
Amoniak (NH3) powst. w kom. kanalików gł. w wyniku enzymatycznej dezaminacji glutaminy, a następnie dyfunduje do płynu kanalikowego. Tam łączy się z czynnie wydzielonym jonem wodorowym , tworząc jon amonowy (NH4+) i w tej postaci , w połączeniu z anionami płynu kanalikowego , wydalany jest w moczu .
Tak jak w przypadku wydalania kwaśności miareczkowej, proces ten umożliwia oszczędzenie zasad ustrojowych, NH4+, bowiem zastępuje Na+ w neutralizowaniu wydalanych przez nerki mocnych kwasów, np. H2SO4 powstającego w wyniku katabolizmu aminokwasów siarkowych. Sumarycznie procesy te można opisać w sposób nast.:
Na2SO4 + 2NH4+ → (NH4)2SO4(wydalany) + 2 Na+(resorbowany)
W warunkach kwasicy wytwarzanie amoniaku w nerkach i wydalanie jonów H+ w formie jonu amonowego wzrasta wielokrotnie.
UKŁAD ODDECHOWY
Tory i tryby oddychania.
Wdech oznacza zwiększenie wszystkich wymiarów klatki piersiowej i zmianę kształtu zawartych w klatce płuc. Wzrasta wymiar pionowy na skutek skurczu przepony, wymiar przednio-tylny w wyniku przesunięcia górnych 6 żeber i mostka do przodu i ku górze, a poprzeczny na skutek skrętu i uniesienia do boku łuków żebrowych i żeber od 6 do 10, wywołanych skurczami mięśni międzyżebrowych i mięśnia przepony przyczepionego do dolnych żeber.
Tor oddychania polegający głównie na ruchach przepony i powodujący rozwinięcie głównie partii przypodstawowych płuc nosi nazwę brzusznego lub przeponowego i przeważa u mężczyzn, zwłaszcza u pracowników fizycznych, pływaków, wspinaczy i śpiewaków.
Tor górnogrzbietowy wywołany głównie skurczami mięśni międzyżebrowych zewnętrznych, zwany torem piersiowym, powoduje bardziej równomierne rozwinięcie płuc i występuje głównie u kobiet, zwłaszcza w późniejszym okresie ciąży i u osób otyłych.
Zmiany ciśnień w drogach oddechowych w trakcie wdechu i wydechu.
W cyklu oddechowym wyróżnia się fazę wdechu, w której naatępuje zwiększenie wielkości klatki piersiowej na skutek skurczu mięśni wdechowych, głównie pzrepony i odpowiednio wzrasta objętość płuc, oraz fazę wydechu, w której rozciągnięte poprzednio elementy sprężyste klatki piersiowej i płuc wracają biernie do pozycji wyjściowej i maleje objętość płuc.
Podczas wdechu Pa spada poniżej Pat i to warunkuje wypełnienie pęcherzyków powietrzem atmosferycznym, gdyż Pa < Pat ,a podczas wydechu odwrotnie Pa > Pat i dla wyrównania różnicy ciśnień gaz pęcherzykowy biernie przesuwa się na zewnątrz
W fazie wdechu ściany klatki piersiowej ulegają rozciągnięciu na skutek skurczów mięśni wdechowych, a za nimi biernie podążają płuca. Jest to uwarunkowane zwiększeniem ujemnego ciśnienia wewnątrz płucnowego, które stanowi główną siłę rozciągającą płuca. Te ostatnie podczas wydechu wskazują naturalną tendencje do biernego zapadania się („retrakcji”). W chwili ustania ruchów oddechowych pod koniec zwykłego wydechu ustala się stan równowagi pomiędzy działającymi odśrodkowymi siłami elementów sprężystych klatki piersiowej i napięcia spoczynkowego w mięśniach wdechowych z jednej strony, a przeciwnie skierowanej reakcji płuc z drugiej strony.
Siłą odpowiedzialną za rozciągnięcie płuc jest ciśnienie transpulmonalne Ptp będące różnicą pomiędzy ujemnym ciśnieniem w jamie płucnej Ppl i w pęcherzykach płucnych Pa. Ujemne (subatmosferyczne) ciśnienie w jamie opłucnej Ppl (wewnątrzpłucnowe) powstaje na skutek szybkiego wzrostu klatki piersiowej niż płuc i utrzymuje się przez całe życie, tak w fazie wdechowej jak i wydechowej cyklu oddechowego, z wyjątkiem natężonego wydechu, zwłaszcza przy zamkniętej głośni, kiedy to ciśnienie staje się dodatnie. Na wielkość ciśnienia wewnątrzpłucnego wpływa także siła ciężkości. Ciężar płuc u klatki piersiowej w pozycji pionowej pociąga żebra ku dołowi, redukując przy tym objętości i stopień rozciągnięcia dolnej partii płuc. Dlatego siły retrakcji w dolnych partiach płuc (w pozycji pionowej) są zawsze mniejsze niż w partiach górnych i, co za tym idzie, ciśn. wewnątrzopłucnowe jest mniej ujemne u podstawy płuc niż w szczytowych partiach. Ustala się gradient ujemnego ciśnienia wewnątrzpł. Pomiędzy szczytami a podstawą płuc. Z każdego cm odległości na linii od szczytu do podstawy płuca ciśń. wewnątrzpł. staje się mniej ujemne o 0,2 cm H20. podczas wdechu przyrost objętości płuc w dolnych partiach jest większy niż w górnych. Ciśnienie transpulmonalne stale równoważy siły retrakcji płuc i wynosi pod koniec zwykłego około 5 cm H2O.
Po zwykłym wydechu, tuż przed następnym wdechem, mięśnie oddechowe są rozluźnione, a ciśnienie wewnąrzpęcherzykowe jest równe ciśnieniu atmosferycznemu.ciśnienei wewnątrzpł utrzymuje się wówczas na poziomie około 5cm H2O poniżej atmosferycznego (-5 cm H2O). Zwykły wdech, będący wynikiem skórczu przepony i mięśni międzyżebrowych zewnętrznych prowadzi do wzrostu objętości klatki piersiowej. Wdechowe poszerzenie klatki piersiowej pociąga za sobą dalszą obniżkę ciśnienia wewnątrz płucnego (do -8 cm H2O) na ciśnienie pęcherzyków płucnych (do około -1cm H2O na szczycie wdechu). Na skutek różnicy ciśnień pomiędzy otaczającą atmosferą a wnętrzem pęcherzyków (zwanym ciśnieniem napędowym) odbywa się, w czasie wdechu, przepływ powietrza z zewnątrz do pęcherzyków. Przy różnicy ciśnień wynoszącej 1 cm H2O objętość powietrza jaka przy każdym wdechu przepływa z zewnątrz do płuc i jaka przy każdym wydechu odpływa z płuc na zewnątrz wynosi 400 - 500 ml i jest to tzw. objętość oddechowa.
W czasie wydechu, gdy struktury rozciągniętej klatki piersiowej i płuc wracają do stanu wyjściowego, ciśnienie gazu w pęcherzykach płucnych uciśniętych przez zapadającą się tkankę płucną, nieco zwiększają się, osiągają na szczycie wydechu wartość około +1 cm H2O ponad ciśnienie atmosferyczne. Wówczas następuje bierny odpływ gazu z pęcherzyków płucnych na zewnątrz. Pod koniec wydechu ciśnienie wewnątrzpłucne wraca do wartości wyjściowej, ale utrzymuje się nadal poniżej atmosferycznego (-5 cm H2O), a ciśnienie w pęcherzykach płucnych ulega zrównaniu z atmosferycznym.
Całkowita pojemność płuc i jej składowe.
Pojęcie objętości V - dla określenia ilości powietrza, stanowi niepodzielną fizjologicznie całość. Pojemność C - dla określenia dwu lub więcej objętości.
Nowoczesne spirometry umożliwiają zapis i określenie następujących parametrów:
Objętości oddechowe TV=600 ml;
Objętości zapasowej wdechowej IRV=3 litra
Objętości zapasowej wydechowej ERV=1,2 litra
Pojemności wdechowej IC=3,6 litra
Pojemności życiowej płuc VC=4,8 litra
Wentylacji minutowej Vt=600 x 12 = 7,2 litra
Zwykły spirometr nie pozwala na bezpośrednie określenie objętości zalegającej RV=1,2 litra i czynnościowej pojemności zalegającej FRC=2,4 litra.
Objętość powietrza, jaka przy każdym wdechu dostaje się do płuc i z każdym wydechem usuwana jest na zewnątrz, nazywa się objętością oddechową - TV. Po zakończeniu zwykłego wydechu w płucach znajduje się jeszcze pewna ilość gazu zwana czynnościową pojemnością zalegającą - FRC. Część tego gazu można z płuc usunąć podczas maksymalnego wydechu. Jest to zapasowa objętość wydechowa - ERV. Po wykonaniu takiego natężonego wydechu w płucach pozostaje pewna objętość gazu zwana objętością zalegającą - RV, która składa się z tzw. objętości zapadowej i objętości minimalnej lub resztkowej. Objętość zapadowa jest to ta część gazu, która opuszcza płuca dopiero po otwarciu jam opłucnych i zapadnięciu płuc. Niewielka objętość powietrza zalegającego w płucach nawet po ich zupełnym zapadnięciu nazywa się objętością minimalną lub resztkową. Jego obecność w płucach powoduje, że zanurzone w wodzie pływają (test w medycynie sądowej czy płód wykonał wdech i urodził się żywy).
O wykonaniu pełnego wdechu można dodatkowo wciągnąć do płuc pewną ilość powietrza, w czasie maksymalnego wdechu. Ta objętość jest określana nazwą objętości zapasowej wdechowej - IRV. Suma objętości zapasowej wdechowej IRV i objętości oddechowej TV tworzy razem pojemność wdechową - IC. Suma objętości oddechowej, objętości zapasowej wdechowej i wydechowej oraz objętości zalegającej tworzy razem całkowitą pojemność płuc -TLC
TLC = TV + IRV + ERV + RV
TLC wynosi u mężczyzn przeciętnie około 6 litrów. Z tego na pojemność życiową VC przypada 80%, a na objętość zalegającą 20%. Spoczynkowa objętość oddechowa TV stanowi tylko 10% TLC, objętość zapasowa wdechowa IRV około 50% a zapasowa wydechowa ERV - 20% a czynnościowa pojemność zalegająca FRC stanowi około 40% TLC.
TLC - 100%
IC - pojemność wdechowa - 60%
FRC - czynnościowa pojemność zalegająca - 40%
Lub
VC - pojemność życiowa płuc - 80%
RV - objętość zalegająca - 20%/
Wentylacja płuc całkowita, minutowa i pęcherzykowa.
Wentylacją nazywamy proces przepływu powietrza przez płuca.
Objętość wdychaną lub wydychaną w ciągu minuty nazywamy całkowitą wentylacją minutową V't. Przeciętnie wynosi ona (TV x f) 600 x 12 = 7,2 litra. Zależy ona od płci, masy ciała, ogólnie od metabolizmu organizmu.
Pierwsza porcja powietrza, jaka dostaje się do pęcherzyków płucnych to gaz z przestrzeni zajmującej drogi oddechowe, czyli z tzw. przestrzeni martwej anatomicznie. Przestrzeń ta zawarta jest w górnym odcinku dróg oddechowych, tchawicy i w drzewie oskrzelowym, aż do oskrzelików końcowych włącznie. Z każdych 600 ml TV wydychanego w czasie spoczynku powietrza około 150 ml. wypełnią najpierw tę przestrzeń martwą (nieużyteczną), a reszta tj. 450 ml, dopływa do pęcherzyków płucnych, oskrzelików oddechowych i przewodów pęcherzykowych, biorąc udział w wymianie gazowej z przepływającą przez płuca krwią żylną. Jest to tak zwana wentylacja pęcheżykowa Va. Minutowy przepływ świeżego powietrza przez strefę oddechową płuc wynosi w spoczynku około (450 x 12 = 5400 ml). Stanowi to około 80% wentylacji minutowej i jest określane jako całkowita wentylacja pęcherzykowa V'a.
Dyfuzja gazów w płucach.
Jedyną siła napędową wymiany gazowej przez błonę oddechową są gradienty Ptlenu i Pdwutlenku węgla pomiędzy gazem pęcherzykowym a mieszaną krwią żylną dopływającą do płuc.
Dyfuzja tlenu z pęcherzyków do krwi kapilarów płucnych jest w zasadzie procesem biernym, w którym cząsteczki tego gazu przechodzą zgodnie z gradientem ciśnień parcjalnych. Proces dyfuzji tlenu czynnie przyspiesza obecny w siateczce śródplazmatycznej pneumocytów I cytochrom C-450, który transportuje cząsteczki tlenu przez błonę pęcherzykowo-kapilarną, zapewniając transfer około 10-15% całkowitej ilości tlenu przenikającej przez tę błonę.
Tlen z gazu pęcherzykowego dyfunduje kolejno przez błonę pęcherzyko-kapilarną, przechodząc kolejno przez:
warstwę surfaktantu
cienką warstwę płynu wyścielającego pęcherzyk
nabłonek plaski wyścielający pęcherzyki plucne
błonę podstawną nabłonka płucnego
przestrzeń tkanki śródmiąższowej w przegrodzie międzypęcherzykowej
błonę podstawną śródbłonka kapilarów
śródbłonek kapilarów
osocze
błonę erytrocytów
płyn wewnątrzkomorkowy erytrocytów,
Gdzie napotyka cząsteczki Hb, z którymi ostatecznie łączy się w postaci Hbtlen. Szybkość dyfuzji tlenu między gazem pęcherzykowym a krwinkami czerwonymi w kapilarach płuc zależy od:
gradientu ciśnienia parcjalnego tlenu
grubości tkanek tworzących błonę pęcherzykowo-kapilarną
powierzchni wymiany gazowej
właściwości tkanek
odległości między ścianą kapilarów a krwinkami czerwonymi.
Ciśnienie parcjalne tlenu w powietrzu atmosferycznym wynosi 158 mmHg. W pęcherzykach płucnych wynosi około 100 mmHg. Ciśnienie tlenu w mieszanej krwi żylnej dopływającej do płuc wynosi około 40 mmHg. Stąd różnica ciśnień parcjalnych poprzez błonę pęcherzykowo-kapilarną wynosi 60mmHg, stanowiąc główną siłę napędową dyfuzji tlenu przez tę błonę
Długość drogi dyfuzyjnej jest to odległość, jaką przebywają cząsteczki tlenu od gazu e pęcherzykach do cząsteczek Hb w krwinkach czerwonych kapilarów płucnych.
Miernikiem sprawności dyfuzyjnej danego gazu w płucach jest wskaźnik zwany pojemnością dyfuzyjną DL.
Składają się na nią:
dyfuzja przez błonę pęcherzykowo-kapilarną
szybkość wiązania tlenu z Hb w postaci Hbtlen i dwutlenku węgla w postaci węglanów
Pojemnośc dyfuzyjna jest to objętość gazu dyfundująca przez błonę w ciągu 1 min (V) przy różnicy ciśnień parcjalnych wynoszącej 1 mmHg (Pa -Pc), obliczana wg. wzoru:
DL = V / (Pa - Pc)
Gdzie:
Pa - ciśnienie parcjalne gazu w gazie pęcherzykowym
Pc - uśredniona wartość prężności gazu we krwi kapilarnej pęcherzyków
Pojemność dyfuzyjna dla tlenu wynosi w spoczynku 21 ml /min/mmHg. Całkowita ilość tlenu w spoczynku, jaka w ciągu minuty powinna przechodzić z pęcherzyków do krwi, wynosi około 250 ml. Pojemność dyfuzyjna płuc dla tlenu zmienia się z wiekiem; sięga najwyższą wartość w 20-30. roku życia. Wysiłek fizyczny powoduje wybitny wzrost pojemności dyfuzyjnej u ludzi młodych, ale znacznie mniejszy u ludzi starszych.
Prędkość dyfuzji dwutlenku węgla przez tkanki jest około 21 razy większa niż dla tlenu z powodu wysokiego współczynnika rozpuszczalności tego gazu. Różnica ciśnień parcjalnych dwutlenku węgla między krwią żylną dopływającą do kapilarów płucnych (Pco2 = 45 mmHg) a gazem pęcherzykowym (Pco2 = 40 mmHg) wynosi zaledwie 5 mmHg. Przyjmuje się, że w spoczynku pojemność DL dla dwutlenku węgla wynosi około 450 ml/min/mmHg.
Względna prędkość dyfuzji dwutlenku węgla jest około 21 razy większa niż tlenu.
Dwutlenek węgla dyfunduje 21 razy szybciej z krwi kapilarów do gazu pęcherzykowego niż tlen w przeciwnym kierunku.
Chemorecepcja ośrodkowa i obwodowa.
Regulacja chemiczna dotyczy wpływu zmian ciśnieńparcjalnych gazów oddechowych i pH na oddychanie. Wzrost Pdw.węgla i spadek pH stanowią bodziec głównie dla ośrodka oddechowego, działając poprzez strefę chemowrażliwą opuszki rdzenia. Zmniejszenie Ptlenu zadrażnia natomiast naczyniowe chemoreceptory obwodowe, z których impulsy wpływają z kolei na ośrodek oddechowy.
Wzrost prężności, CO2 ponad wartość prawidłową (40 mmHg) zwiększa proporcjonalnie wentylację płuc w funkcji prostoliniowej w zakresie 40-65 mmHg. Powyżej tej ostatniej wartości przyrost wentylacji ulega „spłaszczeniu' z powodu nieswoistego działania CO2 obniżającego pobudliwość ośrodka oddechowego. Spadek Ptlenu we krwi tętniczej lub wzrost stężenia H+ wzmagają odpowiedź wentylacyjną, dla CO2, natomiast osłabienie lub zniesienie aktywności układu siatkowego (sen, narkoza, morfina) obniżają tę odpowiedź wentylacyjną na wzrost prężności dwutlenku węgla.
Wzrost CO2 i spadek pH powoduje:
pogłębienie oddechów
wzrost częstości oddychania
głównie działając poprzez obszary strefy chemowrażliwej mózgu znajdujące się na brzusznej powierzchni opuszki. Składają się one z neuronów przekazujących pobudzenia z chemowrażliwych receptorów do kompleksu oddechowego pnia mózgu (generatora wzorca oddechowego). Do niedawna uważano, że CO2 jest bodźcem działającym swoiście na strefę chemowrażliwą a nie przez swój efekt zakwaszający, ale obecnie przyjmuje się , że to wzrost stężenie jonów H+ w wyniku uwodnienia CO2 i dysocjacji H2CO3 determinuje stopień aktywności wzrostu Pco2 ale w przeciwieństwie do CO2, HCO3 - nie przenika przez barierę krew-mózg, ale przy wysokim Pco2we krwi tętniczej podnosi się także stężenie HCO3 - w płynie mózgowym, gdyż tworzy się on z dysocjacji z powstałego tu H2CO3. zatem wzrost HCO3 - podnosi pH płynu mózgowego działając pobudzająco na strefę chemowrażliwą. Udział obszaru chemowrażliwego w regulacji oddychania jako całości wynosi około 70% napędu oddechowego, wywołanego działaniem CO2. Jest to wynik działania jonów H+ na ten obszar.
Miejscowe działanie nikotyny lub acetylocholiny na okolice chemowrażliwą prowadzi do jej pobudzenia i hiperwentylacji, natomiast jej oziębienie czy znieczulenie prokainą wywołuje bezdech.
W odróżnieniu od wzrostu PCO2 i H+, spadek PO2 we krwi tętniczej nie pobudza bezpośrednio strefy chemowrażliwej, a na same neurony ośrodka oddechowego, podobnie jak na wszystkie inne neurony, działa depresyjnie.
Chemoreceptory zgrupowane są w obrębie kłębków umiejscowionych symetrycznie w pobliżu rozwidlenia tętnicy szyjnej wspólnej (kłębki szyjne) i w łuku aorty (kłębki aortalne). Zbudowane są one z komórek I i II. Na powierzchni komórek typu I znajdują się zakończenia nerwowe tworzące synapsy, poprzez które komórki te przekazują sygnały do unerwiających je, aferentnych nerwów błędnych (kłębki aortalne) i językowo-gardłowych (kłębki szyjne).
Pod wpływem hipoksji, hiperkapnii i spadku pH zwiększa się częstość wyładowań w pojedynczych włóknach aferentnych, zaopatrujących komórki kłębkowe. Komórki typu II pełnią funkcje podporowe o charakterze komórek glejowych.
W komórkach I gromadzą się aminy katecholowe, głównie dopamina, NA i serotoniana oraz substancja P,VIP i enkefaliny. Uwalnianie głównie dopaminy z komórek I zachodzi w wyniku ich pobudzenia przez hipoksję i w mniejszym stopniu hiperkapnię, przepływającej przez kłębki krwi. Komórki I posiadają wrażliwe na tlen kanały K+ i przewodność tych kanałów maleje proporcjonalnie do stopnia hipoksji. Spadek wpływu K+ z komórki I prowadzi do otwierania kanałów Ca2+ typu L, a wnikające do tych komórek Ca2+ wywołują w nich zmiany potencjału i uwalnianie neurotransmitera pobudzającego zakończenia włókien aforentnych nerwów błędnych (kłębki aortalne) i językowo-gardłowych (kłębki szyjne), unerwiających komórki I. Właściwymi, więc chemoreceptorami są swobodne zakończenia czuciowe w kłębkach szyjnych i aortalnych, dające początek włóknom aferentnym, odpowiednio: n.zatokowego (gałązka n.językowo-gardłowego) i n.aortalnego (od nn. Błędnych). Impulsacja wysyłana przez podrażnione chemoreceptory do rdzenia przedłużonego pobudza ośrodek oddechowy, przez co oddechy stają się przyspieszone i pogłębione.
Ośrodek oddechowy.
Układ kontrolny regulujący oddychanie składa się z kilku sprzężonych ze sobą komponentów, takich jak kompleks oddechowy pnia mózgu zwany także krótko ośrodkiem oddechowym, zapewniający sterowanie automatyczne oddychania, ośrodki korowe, warunkujące dowolną regulacje oddychania i dalej: mechanoreceptory i chemoreceptory centralne i obwodowe oraz motoneurony oddechowe wraz z unerwianymi przez nie mięśniami oddechowymi.
Kompleks oddechowy pnia mózgu nosi także nazwę ośrodkowego generatora wzorca oddechowego. Składa się z sieci neuronalnych w tworze siatkowatym pnia mózgu, które obejmują dwa rodzaje neuronów:
neurony wdechowe I
neurony wydechowe II
Neurony I w opuszcze rdzenia czynne w fazie wdechu, wytwarzają serię potencjałów czynnościowych, przekazywanych za pośrednictwem aksonów zstępujących do motoeuronów mięśni wdechowych w rdzeniu kręgowym. Neurony wydechowe E w opuszcze wytwarzają serie potencjału podczas wydechu, przekazywanych dalej aksonami zstępującymi do motoeuronów mięśni wydechowych.
W wydechu można wyróżnić fazę I i fazę II. W fazie wydechowej I występuje niewielka tylko aktywność wydechowa obejmująca nerwy przeponowe, podtrzymujące skórcze przepony na początku wydechu, a w fazie wydechowej II są dopiero aktywne motoneurony mięśni wydechowych.
Kompleks oddechowy pnia mózgu obejmuje 3 główne grupy neuronów oddechowych
Grzbietowa, w obrębie i na granicy jądra pasma samotnego, która zawiera głównie neurony I i jest źródłem rytmicznego napędu dla przeciwstronnych motoneuronów przeponowych znajdujących się w segmentach szyjnych rdzenia (C3-C6)
Brzuszna, w obrębie części przedniej jądra tylno-dwuznacznego nerwu błędnego, której neurony oddają długie krzyżujące się aksony do motoeuronów przeponowych i międzyżebrowych zewnętrznych (Th1-Th12) za pośrednictwem interneuronów w rdzeniu kręgowym
Dogłowowa, położona ku tyłowi od jądra zatwarzowego jako tzw. kompleks Botzingera zawiera głównie nueurony rozrusznikowe wyładowujące się rytmicznie i prawdopodobnie stanowiące zespół neuronow generujących rytm oddechowy.
Sieć neuronów wdechowych I wykazuje na początku wdechu, przez około 50 ms, narastającą na zasadzie sprzężeń zwrotnych dodatnich aktywność, przekazując swoje przebudzenie do neuronów mięśni wdechowych (przepony, międzyżebrowych zewnętrznych, mięśni wdechowych dodatkowych) i do ośrodka pneumotaksycznego mostu, działając jednocześnie na zasadzie hamowania antagonistycznego na sieć neuronów wydechowych.
Pod koniec wdechu stopniowo maleje pobudliwość i wyładowania neuronów wdechowych na zasadzie adaptacji i uwalniania się tymczasem z pod hamowania antagonistycznego sieć neuronów wydechowych, które z kolei przez okres następnych 50 ms wykazują narastające pobudzenie hamując zwrotnie sieć neuronów wdechowych. W miarę trwania wyładowań w neuronach wydechowych zaznacza się coraz bardziej ich adaptacja prowadząc do odhamowania sieci neuronów wdechowych, która z kolei rozpoczyna na nowo swoją aktywność. W ten sposób bierze górę aktywność neuronów wdechowych nad wydechowymi, a nastyępnie wdechowych nad wydechowymi tworząc rodzaj dwustabilnego oscylatora wdechowo-wydechowego w obrębie sieci neuronów wdechowych i wydechowymi, wykazujących między sobą połączenia o typie ujemnego sprzężenia zwrotnego.
Sieć neuronów wdechowych i wydechowymi wykazuje naprzemienną aktywność dzięki impulsom płynącym do sieci wdechowej z ośrodka pneumotaksycznego mostku. Te impulsy pobudzają sieć pod koniec wdechu, kiedy powoli ustaje jej aktywność, a rozpoczyna się wzmożona aktywność sieci wydechowej. Ta ostatnia trwa przez okres wydechu, aż odhamowana sieć wdechowa ponownie zwiększy swoją aktywność.
Zasadnicze znaczenie w powstawaniu rytmu oddechowego ma grupa grzbietowa neuronów oraz brzuszno-boczba, skąd przekazywane są z kolei podudzenia do motoneuronow oddechowych po przeciwnej stronie rdzenia albo bezpośrednio, albo poprzez interneurony rdzeniowe. Wśród neuronów wdechowych grupy grzbietowej wyróżnia się podgrupy:
neurony typu I α, niepobudzane przez mechanreceptory płucne
neurony typu I β, pobudzane przez mechanoreceptory płune
neurony typu P, które nie oddają aksonów do rdzenia, ale mają działanie pobudzające na neurony wyłączające wdech przez hamownie aktywności wdechowej z wolno adaptujących receptorów płuc w odruchu Heringa-Breuera.
Neurony wdechowe (I α i I β) grupy grzbietowej oddające kolaterale w kierunku mostu do ośrodka pneumotaksycznego, czyli do jąder okoloramiennych przyśrodkowych, wykazują szczególnie silną aktywność pobudzającą ośrodek pneumotaksyczny na granicy fazy wdechu i wydechu, prowadząc zmiany wdechu na wydech i jednocześnie hamując aktywny ośrodek apneustyczny w dolnej części mostu.
Rytm oddechowy utrzymuje się nawet po całkowitym przecięciu włókien nerwowych dochodzących do rdzenia przedłużonego i po przecięciu pnia mózgowego powyżej opuszki zawierającej neurony kompleksu oddechowego
Odruchy z mechanoreceptorów
ROLA RECEPTORÓW PŁUCNYCH
Pobudzenia z receptorów płucnych są przekazywane włóknami aferentnymi nerwów błędnych w czasie cyklu wdechowo-wydechowego do pnia mózgu, modyfikując ruchy oddechowe. Receptory płucne dzieli się na 4 rodzaje:
Wolno adaptujące mechanoreceptory (SAR - Slow adapting receptors) znajdujące się w tchawicy i oskrzelach, wrażliwe na rozciąganie płuc (receptory inflacyjne - rozciągowe) w czasie wdechu.
Receptory szybko adaptujące się płuc (RAR - rapid adapting receptors), zwane także podnabłonkowymi, wrażliwe na bodźce chemiczne w drogach oddechowych, czyli receptory typu I (Irritant receptors)
Receptory okołokapilarne (J-Juxtacapillary receptors) zlokalizowane w przegrodach pomiędzy kapilarami pęcherzykowymi a pneumocytami.
Receptory oskrzelowe włókien aferentnych typu C, obecne w całym drzewie oskrzelowym, wrażliwe na autokoidy płucne (np. histamina, leukotrieny, tachykininy i kapsaicyna).
Mechanoreceptory SAR (inflacyjne), zlokalizowane w obrębie mięśni gładkich, głównie mniejszych oskrzeli, są pobudzane rozciąganiem oskrzeli w czasie wdechu i przekazują impulsację do pnia mózgowego grubymi zmielinizowanymi włóknami czuciowymi nerwów błędnych typu A. Należą do receptorów wolnoadaptujących, czyli utrzymują wysoką częstość wyładowań mimo dłuższego rozciągania płuc. Wynikiem pobudzenia tych receptorów podczas wdechu jest odruchowe zahamowanie tzn. skrócenie i spłycenie wdechu oraz przyspieszenie rytmu oddechowego. Odruch z udziałem tych receptorów, zwany odruchem Heringa-Breuera lub inflacyjnym, jest najważniejszym czynnikiem regulacji oddychania przez nerwy obwodowe i po jego wyeliminowaniu przez przecięcie nerwów błędnych wdechy stają się głębsze i dłuższe. Wzrasta objętość oddechowa i rytm oddechowy staje się wolniejszy. Pobudzenie receptorów SAR w czasie wdechu powoduje odruchowe zachamowanie i skrócenie wdechu i torowania wydechu, co przyspiesza rytm oddechowy, a także przyspiesza odruchową akcję serca, rozszerza oskrzela i kurczy naczynia krwionośne. Główną rolą odruchu Heringa-Breuera jest ujemne sprzężenie zwrotne ograniczające czas trwania wdechu przez pobudzenie neuronów P w grupie neuronów grzbietowych DRG-NTS wyłączających wdech. Poza odruchem Heringa-Breuera typu inflacyjnego istnieje także deflacyjny odruch Heringa-Breuera (pobudzająco-wdechowy), inicjowany przez spadek aktywności tych samych receptorów SAR, związanych z odruchem inflacyjnym lub przez pobudzenie innych receptorów (deflacyjnych) na skutek zapadania się płuc. Informacje z tych receptorów docierają poprzez nerwy błędne do ośrodków oddechowych pnia mózgu, prowadząc do zmiany wydechu we wdech. Odruch Heringa-Breuera wydaje się mieć stosunkowo większe znaczenie u noworodków i u zwierząt. U ludzi dorosłych aktywność tego odruchu jest mała, gdyż wyzwala się dopiero wtedy, gdy objętość oddechowa przekroczy 1 litr. Jego rola u dorosłych sprowadza się raczej do dostosowania czasu trwania i głębokości wdechów do właściwości mechanicznych (podatność) płuc i klatki piersiowej.
Receptory szybko adaptujące RAR lub typu I reagują na zadrażnienia cząstkami zanieczyszczającymi powietrze, pyłami i chemikaliami (jak np. dwutlenek siarki i azotu) oraz na szybkie zapadanie tkanki płucnej, np. w wyniku odmy (stąd też inna nazwa - receptory deflacyjne) i na deformację płuc. Pobudzenie tych receptorów wywołuje odruch pobudzający aktywność oddechową z pogłębieniem i przyspieszeniem ruchów oddechowych, czyli hiperwentylację. Ponadto pobudzenie receptorów RAR wywołuje odruch kaszlu i skurcz oskrzeli. Ponieważ te receptory ulegają pobudzeniu przez histaminę i inne autokoidy uwalniane np. w astmie, przypisuje się im także rolę w mechaniźmie skórczu oskrzeli. U drosłych rola fizjologiczna receptorów RAR polega także na odruchowym przeciwdziałaniu spadkowi podatności płuc i gorszemu upowietrznianiu pęcherzyków płucnych. Przykładem odruchu powstającego w wyniku pobudzenia receptorów RAR przez zapadające się pęcherzyki płuc jest głębokie ziewnięcie lub westchnienie przywracające powietrzność i podatność płuc.
Receptory typu J to wolne zakończenia w ścianie pęcherzyków płucnych w pobliżu naczyń kapilarnych. Ulegają pobudzeniu przez odkształcenie śródmiąższowe wywołane przez nagromadzenie płynu w przestrzeni okołokapilarnej płuc i obrzęk płuc, mikrozatory płuc i niektóre substancje drażniące, jak: chlorowodór, chalotan, serotonina i inne. Efektem odruchów z receptorów J jest krótkotrwały bezdech, a następnie płytkie i częste ruchy oddechowe. Towarzyszy im odruchowe zwężenie oskrzeli i skurcz mięśni zamykających głośnię oraz pobudzenie nerwów błędnych, zwolnienie akcji serca, zmniejszenie napięcia naczynioruchowych nerwów adrenergicznych i rozszerzenie naczyń krwionośnych. Odruchy z receptorów J mają charakter obronny, gdyż ostatecznie zmniejszają napływ czynników szkodliwych (zamknięcie głośni i skurcz oskrzeli, spłycenie oddechów) do płuc. Te receptory mają być także odpowiedzialne za uczucie duszności, czyli „krótki” oddech, występujący w chorobach płuc.
W ostatnich latach pewne znaczenie w mechanizmach odruchowych przypisuje się bardzo licznym cienkim włóknom C w płucach, których zakończenie znajduje się w pobliżu kapilarów płucnych i które odpowiadają omówionym poprzednio receptorom J. Są one odpowiedzialne za odruchy wywołane autokoidami i kapsaicyną oraz biorą udział w patogenezie astmy, zapalenia i obrzęku płuc. Reakcjom odruchowym, w których pośredniczą włókna C towarzyszy bezdech a potem płytkie i częste ruchy oddechowe, bradykardia i spadek ciśnienia krwi. Informacje przekazywane włóknami C są subiektywnie odczuwane jak uczucie bólu, ucisku i palenia, które towarzyszą działaniu substancji drażniących na płuca.
UKŁAD KRĄŻENIA / FIZJOLOGIA SERCA
Właściwości fizjologiczne mięśnia sercowego.
Zasadniczą czynnością serca w ustroju jest przepompowywanie krwi z układu żylnego do układu tętniczego poprzez krążenie płucne, w którym ulega ona utlenowaniu. Zapotrzebowanie ustroju na tlen niesiony przez krew określa ilość krwi przepompowywaną w ciągu minuty. Ta czynność serca jako pompy zależy od rytmicznych zmian właściwości fizycznych mięśnia sercowego. W czasie spoczynku mięśnia staje się on bardziej podatny, wobec czego krew napływa do poszczególnych jam serca, powodując ich rozciąganie. W czasie pobudzenia mięsień wytwarza napięcie mechaniczne oraz skraca się, dzięki czemu krew może być wyrzucana do naczyń wychodzących z serca. Te okresy spoczynku i pobudzenia oraz skurczu są narzucane przez ściśle uporządkowane w czasie impulsy stanu czynnego wytwarzane w układzie przewodzącym serca. Poprzez obwodowe odgałęzienia tego układu stan czynny dociera do poszczególnych komórek mięśnia sercowego w sposób ściśle uporządkowany w czasie i przestrzeni tak, że wywołane nim skurcze są ściśle synchronizowane, zapewniając odpowiedni efekt hemodynamiczny. Zakłócenia tego uporządkowania prowadzą do zaburzeń czynności serca jako pompy.
Impulsy stanu czynnego, narzucające skurcze poszczególnym komórkom mięśnia sercowego, powstają i są przewodzone w błonach komórkowych, a ich istotą są zmiany czynnościowe błon prowadzące do przesunięć jonów pomiędzy wnętrzem komórki a środowiskiem i do wynikających z nich zjawisk elektrycznych. Podobnie jak inne komórki pobudliwe, komórki mięśnia sercowego pozostające w spoczynku są spolaryzowane ujemnie w stosunku do środowiska, a ich pobudzenie przejawia się zespołem zmian elektrycznych określanych jako potencjał czynnościowy.
Serce jest dobrze umięśnionym narządem, znajdującym się w klatce piersiowej w worku osierdziowym. Ściana serca złożona jest głównie z bogato unaczynionej masy włókien mięśniowych, które wprawdzie różnią się znacznie budową i czynnością od mięśni szkieletowych i gładkich, ale posiadają też niektóre wspólne z nimi właściwości. Mięsień sercowy zwany jest też „mięśniem gąbczastym”. Mięsień sercowy przedsionków i komór jest „przyczepiony” do szkieletu włóknistego, który tworzą cztery zespolone ze sobą pierścienie włókniste, otaczające ujścia przedsionkowo-komorowe oraz ujścia aorty i pnia płucnego. Do pierścieni włóknistych przyczepiają się zastawki serca i wielkich pni tętniczych. Zastawki przedsionkowo-komorowe pozwalają na jednokierunkowe przesuwanie się krwi z przedsionków do komór i zapobiegają jej cofaniu się do przedsionków podczas skurczu komór. Od strony komór do zastawek przyczepione są struny ścięgniste, umocowane na mięśniach brodawkowatych, zapobiegając odwracaniu i wciskaniu zastawek do przedsionków w czasie skurczu komór. Zastawki tętnicze umocowane na pierścieniach ścięgnistych przy zamykaniu stykają się wolnymi końcami, zapobiegając cofaniu się krwi z aorty i pnia płucnego, odpowiednio do komory lewej i prawej w czasie ich rozkurczu. Przy ujściu żył próżnych do przedsionka prawego brak jest zastawek i krew w czasie przedsionka może częściowo cofać się do tych żył, co objawia się tętnieniem żył szyjnych i wątroby, widocznym w stanach niewydolności prawej komory z niedomykalnością prawej zastawki trójdzielnej.
Zaopatrzenie mięśnia sercowego w O2 i środki odżywcze oraz usuwanie końcowych produktów przemiany metabolizmu i CO2 odbywa się zasadniczo za pośrednictwem krążenia wieńcowego, a nie przez krew znajdującą się w komorach serca (jak to się dzieje np. u płazów). Przepływ krwi przez naczynia wieńcowe jest ściśle uzależniony od ciśnienia w aorcie i od fazy skurczu serca. Ponadto podlega wpływom wielu miejscowych czynników nerwowych, hormonalnych i humoralnych.
Jedyną siłą napędową ruchu krwi w dużym i małym krwioobiegu są skurcze mięśnia sercowego, złożonego z szeregu ściśle ze sobą zespolonych warstw kardiomiocytów, otaczających, główni okrężnie, wypełniającą komory serca krew. Dzięki wstawkom łączącym poszczególne miocyty sercowe pobudzenie skurczowe przenosi się z jednej komórki na drugą. Mięsień sercowy stanowi rodzaj sybcytium fizjologicznego, a jego skurcz wywiera okrężny i wielokierunkowy ucisk na zawartą w komorach krew i wyciska ją jak „zaciśnięta dłoń”.
Mięsień sercowy jako całość kurczy się wyłącznie skurczem pojedynczym i odpowiada na bodziec generowany przez własne ośrodki tkanki bodźcowo-przewodzącej (rozrusznikowej) zawsze skurczem maksymalnym zgodnie z zasadą „wszystko albo nic”. Dzięki układowi bodźco-przewodzącemu w swoim obrębie, serce posiada automatyzm, dzięki któremu wytwarza samoistnie i rytmicznie sygnały elektryczne dla skurczów serca i który służy jako rozrusznik dla całego mięśnia sercowego.
Mięsień roboczy komór to miocyty o szerokości 12μm i długości 200μm, łączące się z sąsiednimi za pośrednictwem anastomoz zwanych wstawkami, tworzących pozazębiane połączenia międzykomórkowe. W obrębie tych wstawek znajdują się połączenia, do których należą też desmosomy i powięzie przylegania oraz połączenie o charakterze mechanicznym - połączenia szczelinowe. Te ostatnie są połączeniami o charakterze komunikacyjnym, umożliwiającym przepływ prądu jonowego i innych drobnocząsteczkowych substancji (np. cAMP, jonów Ca2+ i innych wtórnych przekaźników) pomiędzy stykającymi się kardiomiocytami. Te niskooporowe połączenia przypominają swoją strukturą synapsy, umożliwiając elektroniczne szerzenie się pobudzenia w mięśniu sercowym.
Poszczególne komórki mięśnia sercowego wykazują poprzeczne prążkowanie, a ich miofibryle zawierają podobnie jak mięśnie szkieletowe mofilamenty aktyny i miozyny. Od szkieletowych różnią się tym, że posiadają na swych krawędziach wyrostki i zagłębienia, którymi stykają się ze sobą, tworząc połączenia typu palczystego. W miejscu zetknięcia się dwu komórek mięśniowych wstawki tworzą wspomniane połączenia szczelinowe, w obrębie których błony komórkowe zlewają się sobą, stanowiąc tereny zmniejszonego oporu dla rozprzestrzeniania się stanu pobudzenia elektrycznego z jednej komórki mięśniowej na drugą.
Komórki kurczliwe mięśnia sercowego mają swoją strukturę wewnętrzną, przypominającą włókna mięśnia szkieletowego, ale z uwagi na ich adaptację do kurczenia się nie skurczem liniowym, jak w mięśniu szkieletowym, ale skurczem objętościowym, wykazują pewne zmiany strukturalne. Główną część miocytów sercowych stanowi aparat kurczliwy zorganizowany w sarkomery, dzięki którym miąższ sercowy wykazuje podobnie jak szkieletowy poprzeczne prążkowanie. Kanały T i siateczka sarkoplazmatyczna są słabiej rozwinięte, a ta ostatnia tworzy niewielkie tylko cysterny brzeżne. Kanały T są szeroko otwarte do sarkoplazmy i przypadają po jednym na każdą linię Z sarkomerów, ale przylega do nich tylko pojedyncza cysterna brzeżna i tworzą nie triady, jak w mięśniu szkieletowym, ale diady. Kardiomiocyty zawierają też liczne ziarna glikogenu i kropelki tłuszczowe, z których uwalniane kwasy tłuszczowe stanowią obok glukozy (tylko w okresie trawiennym) i mleczanów główny materiał pędny miocytów i źródło energii do biosyntezy ATP w procesie metabolizmu oksydacyjnego, niezbędnego do skurczów. Wprawdzie glukoza, rozpadając się na drodze glikolizy, też mogłaby stanowić źródło energii na pokrycie kosztów energetycznych skurczów w tym procesie, jest to jednak źródło nieistotne.
Mięsień sercowy w odróżnieniu od szkieletowego w zasadzie nie może zaciągać długu tlenowego i przerwa w dostawie tlenu już w ciągu 5-10 min powoduje zaburzenie aktywności mechanicznej, a po 20 min zachodzą w miocytach zmiany nieodwracalne, nawet jeśli zostanie przywrócone krążenie wieńcowe i dostawa tlenu.
Potencjał spoczynkowy i czynnościowy komórek mięśnia sercowego.
Wartość błonowego potencjału spoczynkowego w różnych kardiomiocytach roboczych waha się od -65 do -90 mV. Zależne jest to od różnic w biernej przepuszczalności błon poszczególnych rodzajów komórek dla różnych jonów. Tę zależność potencjału spoczynkowego od stosunku przepuszczalności błony dla różnych jonów opisuje równinie Goldmana. Wynika z niego, że im większa jest przepuszczalność błony dla danego jonu w stosunku do innych jonów, tym potencjał spoczynkowy będzie bliższy potencjałowi równowagi dla tego jonu. W stanie spoczynku przepuszczalność błony jest około 100 razy większa dla potasu niż dla sodu. Pomimo niekorzystnego dla jonów potasu gradientu elektrycznego ( powierzchnie sarkolemy jest elektrododatnia), wielokrotnie więcej „wycieka” z miocytów jonów potasu, niż w tym samym czasie wnika do ich wnętrza jonów sodu. Przesunięcia jonowe w mięśniu w stanie spoczynku są niewielkie i wywołane nimi prądy jonowe noszą nazwę prądów tła: odkomórkowy prąd jonów potasowych i słabszy dokomórkowy prąd jonów potasowych.
Potencjał błonowy miocytów jest zgodnie z równaniem Goldmana wypadkową potencjałów równowagi dla jonów K+ ( -95 mV) i dla jonów Na+ (+ 65mV). Spoczynkowy potencjał błonowy miocytów wynosi -90 mV, a więc jest najbliższy potencjałowi równowagi dla jonów K+, a to ze względu na większą przepuszczalność sarkolemy dla jonów K+ niż dla jonów Na+
Nawet niewielkie, ale długotrwałe zmiany przepuszczalności sarkolemy dla jonów zachodzące na drodze wspomnianych prądów jonowych przez oddzielne dla każdego jonu kanały w sarkolemie, mogłyby ostatecznie doprowadzić do poważniejszych zmian stężeń jonowych, a zatem kurczliwości miocytów, gdyby nie działająca w nich metaboliczna pompa Na+ - K+ zależna od ATP-azy, która stale usuwa nadmiar jonów Na+ z komórki, wprowadzając w ich miejsce jony K+ z zewnątrz. ATP-aza aktywowana jest przez przyrost stężenia Na+ w komórce lub obecność większego stężenia K+ w płynie zewnątrzkomórkowym, a więc pompa Na+ -K+ zapewnia utrzymanie prawidłowych gradientów stężeń jonowych i pośrednio potencjału spoczynkowego. Ponieważ pompa eliminuje z komórki nieco więcej Na+, niż wprowadza na to miejsce z zewnątrz jonów K+ (stosunek 2:3), więc działa jak pompa elektrogeniczna, przyczyniając się do podtrzymania potencjału błonowego z elektronegatywnym wnętrzem miocytu w stosunku do jego powierzchni.
Zahamowanie pompy np. przez glikozydy naparstnicy prowadzi do zmniejszenia gradientów transmembranowych dla Na+ i K+ i w następstwie tego do wzrostu wewnątrzkomórkowego stężenia jonów Ca2+ i potencjału spoczynkowego. Środki te są szeroko stosowane w praktyce klinicznej do zwiększenia kurczliwości mięśnia sercowego w stanach jego niewydolności. Zmiany stężeń jonów Na+,Ca2+ i K+ w płynie zewnątrzkomórkowym wpływają na wartość potencjału spoczynkowego i mogą prowadzić do zmian przewodnictwa w sercu i jego czynności. Hiperkaliemia może być niebezpieczna dla życia, gdyż grozi porażeniem mięśnia przedsionków, wydłużeniem czasu przewodnictwa przedsionkowo-komorowego oraz w samym mięśniu komór skłonnością do arytmii, a nawet zatrzymania serca w rozkurczu. Hipokaliemia powoduje również wydłużenie czasu przewodnictwa przedsionkowo-komorowego i zmiany w EKG, głównie w postaci odwrócenia załamka T i wydłużenia odstępu QR i poszerzenie zespołu QRS, ale nie jest tak niebezpieczna jak hiperkaliemia.
Hiperkalcemia zwiększa potencjał spoczynkowy i kurczliwość mięśnia sercowego, prowadząc przy dużym wzroście tego stężenie nawet do zatrzymania serca w skurczu.
Hipokalcemia obniża potencjał spoczynkowy, zmniejsza kurczliwość serca i zwalnia propagację, potencjału czynnościowego w sercu. Również zmiany stężeń jonów Na+ w płynie zewnątrzkomórkowym wywierają wpływ na potencjał spoczynkowy i czynnościowy w sercu, odwrotny do tego obserwowanego przy zmianach K+, ale są one mniej niebezpieczne i mniej nasilone.
Komórki robocze mięśnia sercowego reagują na działanie stosownego bodźca stanem pobudzenia, w którym następują zmiany przepuszczalności i przewodności błony komórkowej dla jonów oraz przepływ prądów jonowych prowadzący do zmiany potencjału błonowego. Ten zespół zmian nosi nazwę potencjału czynnościowego. Różni się on zasadniczo od potencjału czynnościowego włókien mięśnia szkieletowego długotrwałością potencjału (trwa 300 ms, podczas gdy w miocytach szkieletowych lub neuronach trwa tylko 1ms), wyglądem poszczególnych faz i ich mechanizmem jonowym.
Występujący w czasie pobudzenia miocytów roboczych serca potencjał czynnościowy składa się z pięciu następujących po sobie faz. Są one oznaczane jako faza: 0, 1, 2, 3, 4. Faza 0 odznacza się bardzo szybko narastającą depolaryzacją sarkolemy. Odpowiada jej w zapisie potencjału czynnościowego miocytu „wznoszenie” fali zakończone rewersją potencjału błonowego z „nadstrzałem:, czyli z pojawieniem się dodatniego potencjału powyżej 0mV. Potem już w fazie 1, następuje niewielka wstępna repolaryzacja, przechodząca w fazie 2 w charakterystyczna plateau fazowe trwające 250 ms. Następnie występuje końcowa faza repolaryzacji, czyli faza 3 i ostatecznie przywrócony zostaje potencjał błonowy do wartości spoczynkowej, utrzymującej się przez okres pomiędzy skurczami i stanowiącej fazę 4. Komórki robocze mięśnia przedsionków wykazują także typową fazę 0, ale brak jej plateau i faza 1, 2 i 3 są ze sobą scalone.
Faza 0 wywołana jest szybkim dokomórkowym prądem Na+ w wyniku aktywacji sodowej, czyli skokowego, ale krótkotrwałego wzrostu przepuszczalności sarkolemy dla tych jonów sodowych. Niewielki wpływ na powstanie fazy 0 ma też rozpoczynający się kilka milisekund później dokomórkowy wolny prąd jonów Ca2+, wywołany wzrostem ich przewodności. Potencjał czynnościowy we wstępnej depolaryzacyjnej fazie 1 i długiej fazie 2 nie zależy już od zmian przepuszczalności i przewodności dla jonów Na+, ale jest wynikiem kolejno: inaktywacji sodowej i dokomórkowego prądu jonów Ca2+ na skutek otwierania bramkowanych depolaryzacją sarkolemy kanałów wapniowych. W czasie fazy 2 zmniejsza się wyraźnie odkomórkowy prąd jonów K+ na skutek spadku przewodności dla jonów K+, który utrzymuje się przez niemal cały okres plateau. Wskazuje to, że w fazie 2 główną rolę odgrywają: wzrost dokomórkowego prądu jonów Ca2+ (które napływają do sarkoplazmy z zewnętrznej powierzchni sarkolemy, gdzie są zgromadzone w glikokaliksie) i uwalnianie tych jonów ze zbiorników siateczki sarkoplazmatycznej oraz zahamowanie odkomórkowego prądu jonów K+.
Mechanizm przewodzenia stanu czynnego wzdłuż komórek mięśnia sercowego nie różni się w zasadniczy sposób od przewodzenia w bezrdzennych włóknach nerwowych oraz we włóknach mięśni szkieletowych. Podobni jak tam, przyległe do miejsca pobudzonego odcinki błony komórkowej zostają częściowo zdepolaryzowane przez prąd jonowy płynący pomiędzy niepobudzonym. W momencie przekroczenia przez tę depolaryzację wartości progowej -65mV następuje aktywacja kanału sodowego. Szybkość przewodzenia zależy od wielkości odcinka jeszcze niepobudzonej błony, objętego przepływem prądu o sile nadprogowej. Wielkość tego odcinka zależy od natężenia prądu płynącego między miejscem pobudzonym i niepobudzonym, a to z kolei zależy od różnicy potencjałów pomiędzy miejscem pobudzonym a niepobudzonym. Wartość tej różnicy potencjałów zależna jest od szybkości narastania i amplitudy potencjału czynnościowego.
Przewodzenie stanu czynnego pomiędzy dwoma komórkami odbywa się w sposób następujący: na krańcach komórki błona komórkowa leży równolegle do krańcowego prążka Z i ściśle doń przylega. Dwie warstwy błony komórkowej i prążków Z sąsiadujących komórek tworzą tzw. wstawkę. Na większości swego przebiegu wstawka jest pofałdowana, a pomiędzy dwoma warstwami błony można wyróżnić wyraźną przestrzeń. W nieregularnych odstępach do obu dokomórkowych powierzchni błony przylegają zgrupowania zbitego materiału tworząc tzw. plamki przylegania. Odcinki pomiędzy nimi noszą nazwę obwódki przylegania. Co kilka sarkomerów wstawka przesuwa się o jeden sarkomer, przebiegając dalej na poziomie następnego prążka Z. Części wstawki biegnące na poziomie dwóch różnych prążków Z połączone są ze sobą bardzo ściśle przylegającymi do siebie 2 warstwami błony komórkowej, biegnącymi równolegle do długiej osi komórki. Te części wstawek nazywają się ścisłymi złączami.
Przewodzenie stanu czynnego przez wstawkę nie różni się w swym mechanizmie od przewodzenia w obrębie komórki. Jest to wynikiem bardzo niskiego oporu elektrycznego ścisłych złączy.
Automatyzm serca, mechanizm powolnej spoczynkowej depolaryzacji.
Mięsień sercowy jako całość kurczy się wyłącznie skurczem pojedynczym i odpowiada na bodziec generowany przez własne ośrodki tkanki bodźcowo-przewodzącej („rozrusznikowej”) zawsze skurczem maksymalnym zgodnie z zasadą „wszystko albo nic” (prawo Bowdischa). Dzięki układowi bodźco-przewodzącemu w swoim obrębie, serce posiada automatyzm, dzięki któremu wytwarza samoistne i rytmiczne sygnały elektryczne dla skurczów serca i który służy jako rozrusznik dla całego mięśnia sercowego.
Komórki układu przewodzącego różnią się znacznie od komórek pozostałego roboczego mięśnia sercowego i to zarówno pod względem właściwości morfologicznych jak i czynnościowych. Układ ten jest odpowiedzialny za automatyzm serca, a więc jak sama nazwa sugeruje, generuje on impulsy stanu czynnego w sercu bez jakichkolwiek czynników z zewnątrz. Układ bodżcowo-przewodzący leży bezpośrednio pod wsierdziem i tworzy następujące skupienia:
węzeł zatokowo-przedsionkowy (Keitha-Flacka), węzeł przedsionkowo-komorowy (Aschoffa-Tawaey), pęczek przedsionkowo-komorowy (Paladino-Hisa) dzielący się na dwie odnosi kończące się komórkami mięśniowymi przewodzącymi, czyli włóknami Purkinjego.
Pomiędzy obu węzłami istnieją trzy szlaki międzywęzłowe przewodzące pobudzenie z węzła zatokowo-przedsionkowego do węzła przedsionkowo-komorowego. Szlaki te to: szlak międzyprzedsionkowy Bochmanna, środkowy - Wenckenbacha i tylny Thorela.
W związku z pochodzeniem embrionalnym węzeł zatokowo-przedsionkowy jest zaopatrywany głównie przez nerw błędny prawy, a węzeł przedsionkowo-komorowy przez lewy.
Komórki węzła zatokowo-przedsionkowego i przedsionkowo-komorowego wykazują odmienny potencjał spoczynkowy i czynnościowy niż komórki robocze mięśnia sercowego. Potencjał tych komórek jest niższy i wynosi tylko -60 mV, w porównaniu z -90 mV w komórkach roboczych mięśnia serca. Ich potencjałom czynnościowym brak typowej, szybko narastającej fazy 0, czyli pobudzenia szybkich kanałów dla jonów Na+ bramkowanych elektrycznie. Nieco dłuższe trwanie potencjału czynnościowego w komórkach tkanki bodźcowo-przewodzącej to wynik dokomórkowego prądu jonów Ca2+ w wyniku otwierania powolnych, długoterminowych kanałów wapniowych. Brakuje też typowego dla komórek mięśni roboczych spadku przewodności dla jonów K+ w okresie potencjału czynnościowego. Najważniejsza różnica pomiędzy kardiomiocytami roboczymi a komórkami tkanki bodźcowo-przewodzącej polega na niestabilności u tych ostatnich potencjału spoczynkowego w fazie 4, czyli na powolnej spoczynkowej depolaryzacji zwanej tak że „potencjałem rozrusznikowym” lub „przedpotencjałem”, warunkowanej otwieraniem przejściowych kanałów dla Ca2+ z nieznacznym tylko wzrostem przewodności dla jonów K+.
Potencjały czynnościowe w komórkach węzła zatokowo-przedsionkowego pojawiają się spontanicznie z częstością 60-100 na min, warunkując taką właśnie częstość skurczów serca. Komórki węzła przedsionkowo-komorowego także wykazują potencjał rozrusznikowy, ale mają rzadszą częstość potencjałów, bo 40 na min, a komórki Purkinjego generują potencjały z częstością 25-40 na min. Prawidłowo najwyższą częstość generowania impulsów ma węzeł zatokowo-przedsionkowy. Pozostałe elementy układu przewodzącego o wolniejszej aktywności rozrusznikowej włączają się tylko wówczas, gdy aktywność węzła zatokowo-przeds. ustaje i stąd noszą nazwę późniejszych rozruszników. Cechują się one mniejszym i krótszym potencjałem spoczynkowym oraz powolną spoczynkową depolaryzacją rozpoczynającą się w fazie 4 i osiągającą samoistnie wartość potencjału progowego, przy którym rozpoczyna się potencjał czynnościowy. Potencjał czynnościowy w komórkach tkanki węzłowej trwa krócej niż w komórkach roboczych serca, nie wykazując typowej dla nich, nagłej depolaryzacji z nadstrzałem w fazie 0, a fazy 1 i 2 łączą się w fazę 3, co ostatecznie skraca cały okres repolaryzacji. Po końcowej repolaryzacji potencjał błonowy stopniowo się zmniejsza (faza 4), osiągając wartość progową i prowadzi do wywołania kolejnego potencjału czynnościowego. W ten sposób komórki tkanki bodźcowo-przewodzącej mają zdolność do samoistnego i rytmicznego pobudzania się, tworząc tym samym rozrusznik całego mięśnia sercowego.
Najbardziej charakterystyczną cechą jest brak stałego potencjału spoczynkowego i powolna spoczynkowa depolaryzacja, czyli potencjał rozrusznikowy.
Mechanizm potencjału rozrusznika, czyli powoli narastająca depolaryzacja spoczynkowa, wiąże się powoli wzrastającym, dokomórkowym prądem Ca2+, początkowo poprzez uruchomienie przejściowych (T), a potem długo utrzymujących się (L) kanałów wapniowych ( w fazie 0), warunkujących dokomórkowy prąd jonowy Ca2+ i wzrost stężenia tych jonów w sarkolemie komórek węzła zatokowo-przeds. i przeds.-kom. Ponieważ przepuszczalność dla jonów Na+ zmienia się tylko nieznacznie, brak jest typowej dla komórek mięśnia roboczego fazy 0 z szybkim dokomórkowym prądem jonów Na+ i w zasadzie szybka depolaryzacja z nadstrzałem to wynik dokomórkowego prądu jonów Ca2+. Faza repolaryzacji to głównie wynik szybkiego, odkomórkowego prądu K+ w wyniku wzrostu przepuszczalności i przewodności dla jonów K+. W momencie, gdy prąd potasowy ustaje, rozpoczyna się wzrost przepuszczalności dla jonów Ca2+ i cały cykl generowania potencjału czynnościowego w komórkach węzła zat.-przed. lub przeds.-kom. zaczyna się na nowo. Potencjał czynnościowy powstający w węźle zat.-przed. rozchodzi się na mięsień przedsionków z prędkością 1m/s albo bezpośrednio, albo za pośrednictwem trzech pęczków międzywęzłowych: przedniego (Bochmanna), środkowego (Wenckenbacha) i tylnego(Thorela), obejmując mięsień zarówno lewego, jak i prawego przedsionka i docierając do węzła przed.-kom. W strefie granicznej między mięśniem przedsionków i węzłem przed.-kom. zaznacza się największe zwolnienie prędkości przewodzenia do 0,05 m/s, a w samym węźle przed.-kom. do 0,1 m/s. Przewodzenie nieco przyspiesza się (do 1 m/s) w pęczku przed.-kom. i osiąga szczyt w komórkach przewodzących (Purkinjego) do 4m/s, aby znów spaść do 1m/s w komórkach roboczych mięśnia sercowego. To zwolnienie przewodzenia na odcinku węzła przed.-kom. pozwala na oddzielne skurcze najpierw przedsionków, a potem komór. Upływa bowiem sporo czasu, zanim fala depolaryzacji z węzła dotrze przez pęczek przed.-kom., odnogi tego pęczka lewą i prawą i w końcu włókna Purkinjego, do włókien roboczych mięśnia lewej i prawej komory serca. Fala depolaryzacji prawej odnogi i lewej odnogi pęczka przed.-kom. przechodzi na komórki robocze mięśnia sercowego w następującej kolejności: warstwa podwsierdziowa w dolnej 1/3 przegrody międzykomorowej po stronie lewej, od lewej do prawej warstwy przedsionkowej przegrody międzykomorowej po stronie prawej, podwsierdziowe warstwy koniuszka lewej i prawej komory serca, dalej poprzez ścianę lewej komory do nasierdzia, części przypodstawnej przegrody międzykomorowej i w końcu pozostała część lewej i prawej komory serca.
Jeżeli zablokowane jest przewodnictwo w jednej z odnóg pęczka Hisa lub we włóknach przewodzących (Purkinjego) do określonego obszaru serca, wówczas potencjał czynnościowy dociera do miejsca objętego blokadą poprzez sąsiednie włókna robocze i wstecznie wraca z opóźnieniem do miejsca blokady przewodzenia.
Pod wpływem stymulacji nerwów błędnych i cholinergicznego pobudzenia węzła zatokowo-przeds. następuje, przy udziale acetylocholiny uwalnianej z zakończeń neuronów pozazwojowych, hiperpolaryzacja błonowa komórek węzła zat.-przed. i powolniejsze niż zwykle narastanie powolnej spoczynkowej depolaryzacji. Wynika to ze wzrostu przepuszczalności i przewodności dla jonów K+, w czym uczestniczy białko G otwierające kanały dla prądu jonowego K+ oraz wzrost cGMP przy jednoczesnym spadku cAMP w komórkach węzła zat.-przed., co hamuje otwieranie wolnych kanałów dla dokomórkowego prąduCa2+ - wszystko w wyniku pobudzenia receptorów cholinergicznych M2 komórek węzła zat.-przed. Z uwagi na lateralizację unerwienia autonomicznego serca, pobudzenie prawego nerwu błędnego hamuje generowanie potencjałów czynnościowych w węźle zat.-przed., a lewego hamuje przewodnictwo w węźle przed.-kom. Przeciwnie, pobudzenie nerwów współczulnych przyspiesza narastanie potencjału błonowego w fazie powolnej spoczynkowej depolaryzacji komórek węzłowych i zwiększa częstość wyładowań węzła zat.-przed. Głównym czynnikiem przyspieszającym potencjał rozrusznikowy jest działanie noradrenaliny na β1 - receptory adrenergiczne i wzrost cAMP w komórkach węzła zat.-przed., który ułatwia otwieranie wolnych kanałów dla dokomórkowego prądu Ca2+ i zwiększa nachylenie linii depolaryzacji spoczynkowej w komórkach układu bodźcowo-przewodzącego serca tak, że kąt zawarty między linią zerową a tą biegnącą przez nachylenie potencjału spoczynkowego jest większy niż prawidłowo.
Generowanie pobudzeń w tkance bodźcowo-przewodzącej przyspiesza się w warunkach podwyższonej ciepłoty ciała i pod wpływem niektórych leków działających jak pobudzenie układu współczulnego (tzw. sympatykomimetyki) lub blokowania receptorów muskarynowych, np. atropiną i innymi antycholinergikami. Natomiast leki typu naparstnicy hamują aktywność spontaniczną tkanki węzłowej, zwłaszcza węzła przed.-kom. i zwalniają akcję serca.
Zwiększona częstość wyładowań węzła zat.-przed. pod wpływem podwyższonej ciepłoty jest wynikiem podobnego mechanizmu, jaki aktywuje wzmożona aktywność adrenergiczna, a więc wywiera wpływ chronotropowy dodatni, przyspieszając powolną spoczynkową depolaryzację, przyspieszając akcję serca i wzmagając automatyzm drugorzędowych ośrodków bodźcotwórczych. Przeciwne efekty (obniżenie fazy 4) i zwolnienie akcji serca wywołują spadek ciepłoty i oziębianie ciała stosowane np. przy zabiegach kardiochirurgicznych.
Pobudliwość mięśnia sercowego podlega cyklicznym zmianom, które zapobiegają jego skurczom tężcowym. Dzięki powolnemu szerzeniu się potencjału czynnościowego na poszczególne komórki mięśnia sercowego, wszystkie miocyty przedsionków, a potem komór, zostają objęte depolaryzacją niemal w tym samym czasie. Ponieważ wszystkie kardiomiocyty są sprzężone elektrycznie, więc ulegają w tym samym czasie depolaryzacji i kurczą się jednocześnie skurczem pojedynczym, a ponadto zawsze skurczem maksymalnym według zasady „wszystko albo nic”. Zapobiega to wprowadzeniu serca w skurcz tężcowy.
Istotnym czynnikiem zapobiegającym skurczom tężcowym mięśnia sercowego jest spadek jego pobudliwości, czyli brak wrażliwości na inne bodźce stymulujące, który zaczyna się od momentu gwałtownie rozwijającej się aktywacji sodowej i szybkiej depolaryzacji potencjału błonowego (faza 0) i trwa tak długo, jak długo komórka jest zdepolaryzowana, a więc do fazy 3 włącznie. Cały ten okres zaniku pobudliwości nosi nazwę okresu refrakcji, przy czym wyróżnia się w nim okres całkowitego zniesienia pobudliwości, czyli refrakcję bezwzględną, gdy nawet bardzo silne skurcze są nieskuteczne, oraz okres stopniowego powrotu pobudliwości do normy, czyli refrakcję względną, jaka ma miejsce w fazie 3, kiedy to silniejsze podniety są w stanie pobudzić serce do skurczu dodatkowego. Tak więc, odpowiednio silny bodziec działający w okresie tej refrakcji względnej może wywołać pobudzenie mięśnia sercowego i jego skurcz. Właśnie na ten okres refrakcji przypada główna część wzrostu napięcia skurczowego mięśnia sercowego. Całkowity powrót pobudliwości następuje z chwilą zakończenia repolaryzacji, czyli w fazie 4 i odtąd pobudliwość mięśnia sercowego utrzymuje się niezmieniona aż do następnych faz 0-1-2 kolejnego skurczu sercowego.
Okres refrakcji bezwzględnej w mięśniu sercowym trwa tak długo (250 ms), jak sam skurcz mięśnia i dlatego nie można serca pobudzić do skurczu przedwczesnego i wywołać nakładania się lub sumowania skurczów pojedynczych. Jeśli ektopiczny, tzn. znajdujący się poza obrębem układu bodźcowo-przewodzącego, ośrodek ulega pobudzeniu, wówczas serce wykazuje skurcz przedwczesny zwany dodatkowym lub ekdtrasystolą. Wówczas kolejny zwykły impuls z węzła zat.-przed. natrafia na mięsień sercowy w okresie refrakcji i staje się nieskuteczny, wywołując dłuższą przerwę w czynności serca, zwaną przerwą wyrównawczą. Następujący po tej ekstrasystoli skurcz pochodzenia zatokowego jest zawsze znacznie silniejszy i może być wyczuwalny jako nagłe „uderzenie” za mostkiem. Zjawisko to może wystąpić nawet u osób zdrowych w stanach nadmiernej emocji i stresu lub po wypiciu zbyt mocnej kawy czy herbaty, w których zawarta kofeina wzmaga pobudliwość mięśnia serca, wywołując skurcze dodatkowe.
Fazy cyklu sercowego. Rozkład ciśnień w jamach serca w poszczególnych fazach cyklu skurczowo - rozkurczowego.
W czasie pauzy serca krew płynie z żył głównej górnej i dolnej do prawego przedsionka, a z niego do prawej komory. Po lewej stronie serca krew płynie z żył płucnych do lewego przedsionka, a z niego do lewej komory. Na skutek dużej podatności mięśni komór napływ krwi do nich powoduje nieznaczny tylko wzrost komorowego ciśnienia rozkurczowego przy dużym wzroście rozkurczowej objętości. Dzięki temu w czasie całej pauzy serca ciśnienie w przedsionkach jest nieco wyższe niż w komorach, co jest warunkiem przepływu. Zmniejszenie podatności mięśnia komór spowodowane chorobowymi zmianami właściwości morfologicznych i czynnościowych miocytów i zmianami właściwości przestrzenie pozamiocytarnej sprawia, że napływ krwi do komór powoduje znaczniejszy wzrost komorowego ciśnienia. Dzięki temu różnica ciśnień pomiędzy przedsionkami a komorami maleje, co pociąga za sobą ograniczenie przepływu.
Pauza serca kończy się z początkiem skurczu przedsionków. Powoduje on zwiększenie przedsionkowego ciśnienia, w wyniku, czego następuje szybkie przesunięcie dodatkowej ilości krwi do komór. Napływ krwi z przedsionków w tym czasie ustaje, nawet występuje jej nieznaczne cofnięcie. Pojemność przedsionków jest znacznie mniejsza niż komór. Ich skurcz nie mógłby, więc spowodować ich dostatecznego wypełnienia. Dlatego tak ważne jest rozkurczowe wypełnianie komór przez przelewanie się krwi z żył do przedsionków, a z nich do komór w czasie całej pauzy. Objętość, jaką osiągają komory serca pod koniec skurczu przedsionków nazywamy objętością późno- lub końcoworozkurczową. W sercu człowieka wynosi ona 180-200 mL. Odpowiednio ciśnienie krwi w komorach osiągane pod koniec skurczu przedsionków nazywamy ciśnieniem późno- lub końcoworozkurczowym. W warunkach fizjologicznych nie przekracza ono 12 mm Hg.
Po skurczu przedsionków rozpoczyna się skurcz komór. Powoduje on zwiększenie ciśnienia komorowego powyżej ciśnienia w przedsionkach. To odwrócenie gradientu ciśnień powoduje zamknięcie zastawek przedsionkowo-komorowych. Na początku skurczu komór ciśnienie rozkurczowe w aorcie i tętnicy płucnej jest jeszcze znacznie wyższe niż w komorach. Dzięki temu w czasie całej pauzy serca, skurczu przedsionków i w początkowej fazie skurczu komór zastawki półksiężycowate są zamknięte. Tak, więc komory są w tej fazie całkowicie zamknięte. Skurcz ich mięśni powoduje wzrost ciśnienia komorowego, ale objętość komór nie ulega zmianie. Dlatego tę fazę skurczu komór nazywamy fazą skurczu izowolumetrycznego. W fazie skurczu izowolumetrycznego komór występuje następna fala wzrostu ciśnienia w przedsionkach spowodowana uwypuklaniem się do ich płatków zastawek przedsionkowo-komorowych i naciskiem na nie kurczącego się mięśnia komorowego. Faza skurczu izowolumetrycznego trwa do chwili, w której rosnące ciśnienie komorowe nieco przewyższa ciśnienie w aorcie czy tętnicy płucnej. Odwrócenie gradientu ciśnień powoduje otwarcie zastawek półksiężycowatych, co umożliwia wyrzut krwi do aorty i tętnicy płucnej. Rozpoczyna się faza wyrzutu, w której ciśnienie komorowe więcej nie rośnie lub rośnie nieznacznie, natomiast zmniejsza się objętość komór. Maksymalne ciśnienie skurczowe w lewej komorze wynosi ok. 120 mm Hg, a w prawej komorze ok. 30 mmHg. Objętość komór w końcu fazy wyrzutu nazywamy objętością późno- lub końcowoskurczową. Różnicę pomiędzy objętością późnorozkurczową i późnoskurczową nazywamy objętością wyrzutową danej komory. W ludzkim sercu w stanie spoczynku fizycznego i psychicznego wynosi ona 70-120 mL. Objętość wyrzutowa jest to ilość krwi przepompowana w fazie wyrzutu z komory do tętnicy płucnej lub aorty. Objętości wyrzutowe z prawej i lewej komory mogą się w czasie pojedynczych cykli serca nieco różnić, ale w dłuższych przedziałach czasowych ich suma musi być taka sama.
Faza wyrzutu kończy się w chwili, gdy na skutek rozpoczynającego się rozkurczu mięśni komór ciśnienie komorowe spada znów poniżej ciśnienia w aorcie i tętnicy płucnej. Na skutek ponownego odwrócenia gradientów ciśnień zamykają się zastawki półksiężycowate. Ponieważ zastawki przedsionkowo-komorowe są jeszcze zamknięte, w tej fazie rozkurczu komory są całkowicie zamknięte. Ciśnienie w nich spada, ale objętość ich nie zmienia się. Dlatego tę fazę rozkurczu komór nazywamy fazą rozkurczu izowolumetrycznego. Trwa ona do chwili, w której ciśnienie komorowe obniża się poniżej ciśnienia w przedsionkach. To odwrócenie gradientu ciśnień powoduje otwarcie zastawek przedsionkowo-komorowych, co umożliwia przepływ krwi z przedsionków do komór. Rozpoczyna się faza napełniania komór. Faza rozkurczu izowolumetrycznego trwa tym krócej, tj. napełnianie komór rozpoczyna się tym wcześniej, im szybciej spada ciśnienie komorowe. Szybkość spadku ciśnienia zależy od sprawności rozkurczu miocytów.
Fazę napełniania komór możemy podzielić na dwa podokresy: szybkiego i wolnego napełniania. Granica między nimi jest nieostra. Napełnianie komory jest tym szybsze, a całkowita ilość krwi, jaka do niej napływa tym większa, im większa jest różnica ciśnień pomiędzy jej światłem a przedsionkiem. To zaś zależy od tego jak znaczne było wypełnienie przedsionka przed otwarciem zastawek przedsionkowo-komorowych oraz w jakim stopniu i jak szybko rośnie ciśnienie rozkurczowe w komorze pod wpływem napływu do niej krwi. Wypełnianie przedsionków jest ułatwione przez to, że w fazie wyrzutu podstawa komór zbliża się do koniuszka serca rozciągając przedsionki i obniżając w nich ciśnienie. W ten sposób napływ krwi do przedsionków jest ułatwiony przez jakby czynne zasysanie z żył. W czasie rozkurczu komór podstawa serca oddala się od koniuszka, co powoduje zwiększenie ciśnienia w wypełnionych już przedsionkach. Stosunek ciśnienia w komorach do objętości napływającej z przedsionków krwi jest zależny od rozkurczowej podatności ścian komór. Opóźniony rozkurcz przyczynia się do zmniejszenia podatności rozkurczowej komór. Zmniejszenie biernej rozkurczowej podatności sarkomerów i sieci włókien kolagenowych na skutek np. nadmiernej produkcji kolagenu w przerosłym mięśniu, zmniejsza podatność rozkurczową w czasie całej pauzy serca.
Regulacja pojemności wyrzutowej i minutowej serca.
Ilość krwi przepompowanej przez serce w ciągu jednej minuty nazywamy pojemności minutowa serca, (CO). Pojemność minutowa równa się iloczynowi pojemności wyrzutowej (SV) i liczby skurczów serca na minutę. W stanie spoczynku wynosi 5,4 - 6 L/min
Pojemność minutowa serca w spoczynku jest przeliczana na 1 m2 powierzchni jako tzw. wskaźnik sercowy. Pojemność minutowa komory wynosi 3,2 L/min/m2 powierzchni ciała.
Pojemność ta zmienia się zależnie od masy, wieku i stanu metabolizmu. W stanach znacznego wysiłku fizycznego tj. zwiększonego zapotrzebowania organizmu na tlen wskaźnik sercowy może wzrastać nawet do 22 L/m2/min.
Na regulację pojemności minutowej serca składają się dwa mechanizmy:
Oparty na mechanizmie Stralinga
Regulacja nerwowa
W wyniku zwiększania dopływu krwi żylnej do serca nastąpi coraz większe jego wypełnienie rozkurczowe, co prowadzić będzie do szybkiego wzrostu pojemności minutowej do pewnego maksimum. Na tym poziomie utrzyma się ona mimo dalszego zwiększania napływu. Wzrost pojemności minutowej jest tu spowodowany głównie zwiększeniem pojemności wyrzutowej serca. Jest to wynikiem zwiększenia rozkurczowej pojemności komór i zwiększenia siły skurczu na skutek silniejszego rozciągania włókien mięśnia sercowego. Zjawisko to jest opisane prawem Stralinga, które zakłada ze energia skurczu jest w pewnym zakresie wprost proporcjonalna do spoczynkowej długości komórek mięśnia sercowego, objętość wyrzutowa serca zależy od stopnia wypełnienia komór krwią w końcu rozkurczu.
Wzrost aktywności włókien współczulnych, zwiększy tym samym kurczliwość mięśnia sercowego i zwiększy częstość rytmu serca, co sprawi ze przyrostom ciśnienia w prawym przedsionku będą odpowiadały większe przyrosty pojemności minutowej. Noradrenalina uwalniana z zakończeń nerwów współczulnych ma, więc dodatnie działanie inotropowe, chronotropowe, dromotropowe i batmotropowe zwiększając objętość wyrzutową i pojemność minutową serca. Działa ona za pośrednictwem receptora beta-adrenergicznego i cyklazy adenylanowej. Działanie przeciwne ma acetylocholina uwalniana z zakończeń neuronów przywspółczulnych.
Te dwa podstawowej mechanizmy regulacji czynności serca współdziałają ściśle ze sobą i w warunkach fizjologicznych nie można ich oddzielić od siebie
Serce posiada do dyspozycji zawsze tyle krwi ile zdoła przepompować. Jednakże w rzeczywistości ilość krwi żylnej dopływającej do serca jest ograniczona. Jest ona zależna od różnicy ciśnień pomiędzy obwodową częścią układu żylnego a żylnym ciśnieniem centralnym tj. panującym w prawej części serca. Ciśnienie w obwodowej części układu żylnego zależy od stosunku objętości krwi krążącej do pojemności układu naczyniowego.
Wielkość powrotu żylnego ogranicza możliwość zwiększenia pojemności minutowej serca. Zatem jeżeli zwiększymy kurczliwość mięśnia sercowego i przyspieszymy jego rytm przez pobudzenie układu współczulnego to potencjalna pojemność minutowa przy danym ciśnieniu w przedsionku ogromnie wzrośnie. Jeżeli jednak nie wzrośnie jednocześnie powrót żylny to zwiększone możliwości mięśnia sercowego nie zostaną wykorzystane i pojemność minutowa nie ulegnie żadnym zmianom. Krótkofalowa regulacja powrotu żylnego z sekundy na sekundę odbywa się dzięki regulacji pojemności układu żylnego przez unerwiające go włókna współczulne. Uogólnione pobudzenie układu współczulnego nie tylko pobudza serce, ale również powoduje skurcz naczyń. Długofalowa regulacja powrotu żylnego polega na regulacji objętości krążącej. Zwiększenie objętości krwi krążącej, obniżenie ujemnego ciśnienia wewnątrz klatki piersiowej w czasie pogłębiania oddechów, praca mięśni szkieletowych uciskających żyły to czynniki zwiększające dopływ do prawego przedsionka.
Wzrost ciśnienia w zbiorniku tętniczym dużym w wyniku wzrostu całkowitego obwodowego oporu naczyniowego, początkowo zmniejsza objętość wyrzutową, zwiększa objętość zalegającą, co końcu skurczu powoduje większe rozciąganie komórek mięśniowych i w wyniku tego zwiększenie objętości wyrzutowej i pojemności minutowej serca.
We wszystkich stanach załamania krążenia na skutek zmniejszenia objętości krwi krążącej (wstrząs pokrwiotoczny urazowy, późny okres wstrząsu kardiogennego) pierwszą czynnością leczniczą musi być uzupełnienie tej pojemności.
Objętość wyrzutowa serca zależy od siły skurczu mięśnia komór, która z kolei jest uwarunkowana: początkowym rozciągnięciem komórek mięśniowych (objętością krwi zalegającej) ciśnieniem panującym w zbiornikach tętniczych, transmiterami układu autonomicznego uwalnianymi z zakończeń nerwowych w mięśniu sercowym. W czasie intensywnego wysiłku fizycznego pojemność minutowa serca wzrasta kilkakrotnie w stosunku do pojemności minutowej w czasie spoczynku.
Wpływ układu wegetatywnego na serce.
Serce jest unerwione przez pozazwojowe włókna układu współczulnego pochodzące przede wszystkim ze zwojów gwiaździstych oraz ze zwojów szyjnych, włókna te docierają zwykle bezpośrednio do serca wchodząc w skład splotu sercowego. Część z nich dociera do szyjnej i górnej piersiowej części nerwów błednych, a z nimi do serca. Włókna te wydzielają noradrenalinę, a ich zakończenia znajdują się we wszystkich strukturach serca, szczególnie w okolicy węzła zatokowo-przedsionkowego i przedsionkowo-komorowego.
Serce jest także unerwione przez przez zwojowe włókna przywspółczulne pochodzące z obu pni nerwów błędnych. Włókna te wydzielają w swoich zakończeniach acetylocholinę, tworząc synapsy z komórkami zwojów przywspółczulnych znajdujących się w samym sercu, szczególnie w okolicy węzła zatokowo-przedsionkowego, przedsionkowo-komorowego i prawego przedsionka.
Układ współczulny:
Pobudzenie włókien współczulnych oraz podanie noradrenaliny (lub adrenaliny) powoduje
Zwiększenie częstości rytmu zatokowego
Zwiększenie szybkości przewodzenia, a w przypadku istnienia bloku usprawnienie przewodznia przedsionkowo-komorowego, przez działanie na komórki strefy przedsionkowo-węzłowej
Zwiększenie kurczliwości mięśnia przedsionków komór - dodatnie działanie inotropowe
W stanach patologicznych lub przy bardzo silnym pobudzeniu tych włókien występowanie dodatkowych pobudzeń przedsionkowych i komorowych aż do arytmii komorowej i migotania komór włącznie
Wywołana działaniem mediatorów arytmia spowodowana jest pobudzeniem automatyzmu obwodowych (pozazatokowych) ośrodków. Aminy biogenne mogą nasilać patologiczny automatyzm przez aktywację powolnego prądu wapniowego oraz pogłębiać zaburzenia przewodzenia międzykomórkowego dzięki ułatwieniu nadmiernego obładowywania wapniem niedokrwionych oraz inaczej uszkodzonych komórek.
Noradrenalina i adrenalina zwiększają w komórkach węzła zatokowo-przedsionkowego szybkość narastania powolnej spoczynkowej depolaryzacji, która osiąga poziom progowy w krótszym czasie. Związki te pobudzają dokomórkowy prąd tła niesiony przez jony Ca2+, przez co równowaga między depolaryzującym prądem dokomórkowym a hiperpolaryzującym prądem odkomórkowym Ix1 zostaje znacznie szybciej przesunięta na korzyść tego pierwszego. Pobudzenie włókien współczulnych pobudza również przebieg powolnej spoczynkowej depolaryzacji w komórkach komorowego układu przewodzącego. Noradrenalina i adrenalina zwiększają częstotliwość rytmu węzła przedsionkowo-komorowego przez zwiększenie aktywacji kanału wapniowego, wapniowego tym samym amplituda i szybkość narastania potencjałów czynnościowych strefy przedsionkowe-węzłowej zwiększają się. Powoduje to zwiększenie szybkości przewodzenia oraz usprawnienie w przypadku istnienia bloku z lokalizacją w tej strefie.
Wszystkie efekty działania amin katecholowych w stosunku do serca są znoszone przez beta-adrenolityki, a więc są wynikiem pobudzenia przez te związki receptorów beta-adrenergicznych. Pobudzenie tych receptorów jest związane z aktywacją zlokalizowanej w błonie cyklazy adenylanowej, co prowadzi do powstania cyklicznego AMP. W wyniku aktywacji przez niego kinaz fosfoproteinowych dochodzi do fosforyzacji białek sarkolemy, co pociąga za sobą aktywację kanałów wapniowych. Jest to przyczyna nasilenia automatyzmu zatokowego oraz usprawnienia przewodzenia w węźle przedsionkowo-komorowym. Ponad to cykliczny AMP pobudza pompę wapniową w siateczce śródplazmatycznej, co ułatwia magazynowanie zwiększonych ilości wapnia oraz pobudza glikogenolizę i lipolizę w mięśniu sercowym, zwiększając w komórkach zawartość wolnej glukozy i wolnych kwasów tłuszczowych, które stanowią podstawowy materiał energetyczny serca.
Impulsacja współczulna zmienia przepływ wieńcowy działając bezpośrednio na błonę mięśniową tętnic wieńcowych i pośrednio wpływając na częstość i siłę skurczów serca powodując ich zwiększenie. Po zablokowaniu beta receptorów i zniesieniu dodatnich efektów ino- i chronotropowych zarówno impulsacja współczulna i krążące we krwi adrenalina i noradrenalina zmniejszają wieńcowy przepływ krwi poprzez receptory alfa adrenergiczne.
Układ przywspółczulny:
Wpływ tego układu jest jednoznaczny z wpływem wydzielanej na zakończeniu włókien pozazwojowych tego układu acetylocholiny. Wywołuje on następujące zmiany:
Zwalnia lub całkowicie hamuje rytm zatokowy oraz rytm węzła przedsionkowo-komorowego- ujemne działanie chronotropowe
Zmniejsza szybkość przewodzenia aż do całkowitego bloku w strefie przedsionkowo- węzłowej- ujemne działanie dromotropowe
Zmniejsza kurczliwość aż do całkowitego zniesienia skurczów w mięśniu przedsionków - ujemne działanie inotropwe. Nie wywiera bezpośredniego wpływu na kurczliwość komór, hamuje izotropowy wpływ amin katecholowych
Nie ma wpływu na automatyzm komorowych komórek przewodzących, hamuje wpływ amin katecholowych na przebieg ich powolnej spoczynkowej depolaryzacji
Acetylocholina zwiększa przewodność kanału potasowego K1. Skutkiem tego jest zwolnienie lub całkowite zahamowanie powolnej spoczynkowej depolaryzacji w węźle zatokowo-przedsionkowym oraz skrócenie czasu trwania plateau i całego czasu trwania potencjału czynnościowego mięśnia przedsionków. Skrócenie potencjału powoduje inaktywację kanałów wapniowych. Pośrednie i bezpośrednie hamownie kanałów wapniowych jest głównym mechanizmem ujemnego izotropowego działania acetylocholiny.
W komórkach sfery przedsionkowo-węzłowej pobudzenie K1 i zahamowanie prądu wapniowego powoduje zmniejszenie amplitudy i szybkości narastania komórkowych potencjałów czynnościowych- szybkość przewodzenia w tej strefie zostaje zmniejszona lub przewodzenie ulega całkowitemu zahamowaniu.
Wpływ acetylocholiny na przewodność kanału K1 realizowany jest przez wiązanie się jej z receptorem muskarynowym M1. ACh powoduje rozprężenie receptorów beta1 adrenergicznych i cyklazy adenylanowej przez aktywację białka Gi tego kompleksu. Wobec tego hamuje ona syntezę cAMP pobudzaną przez agonistów z receptorami beta1. Pobudza ona syntezę cGMP, który we wnętrzu komórki hamuje działanie cAMp przez pobudzenie rozkładającej go fosfodiesterazy. ACh wiąże się dodatkowo z receptorem M2 w zakończeniach włókien współczulnych hamuje wydzielanie noradrenaliny w odpowiedzi na ich pobudznie.
Acetylocholina działając na te same struktury, co adrenalina czy noradrenalina powoduje zwiększenie przepływu wieńcowego.
W ostatecznym efekcie pobudzenie układu przywspółczulnego lub podanie ACh poza wpływem bezpośrednim na kanał K1 i ewentualnie na kanał wapniowy działa na serce podobnie jak podanie brokera receptorów beta1 mimo odmiennego mechanizmu działania.
Czynnościowy podział układu krążenia.
Zróżnicowanie strukturalne układu naczyniowego warunkuje różnice czynnościowe pomiędzy poszczególnymi jego odcinkami. Główną funkcją aorty, tętnic i tętniczek jest transport krwi pod dużym ciśnieniem do tkanek, zamiana fazowego charaktery jego przepływu w ciągły i ochrona naczyń tętniczych przed uderzeniami krwi pulsowo wtłaczanej do zbiornika tętniczego. Zawierają one 14% całkowitej ilości krwi w organizmie. Arteriole, dzięki swej silnej warstwie mięśniowej, tworzą rodzaj kurków przepływowych stawiających znaczny opór dla przepływu krwi przez naczynia włosowate.
Zasadniczą funkcją kapilar, w których znajduje się _ 6% krwi, jest wymiana odżywcza pomiędzy krwią, a płynem tkankowym. Żyłki zbierają krew z naczyń włosowatych i kierują do żył, które funkcjonują jako drogi transportu krwi z tkanek do serca. Powrót krwi żylnej z tkanek odbywa się pod bardzo niskim ciśnieniem ze względu na dużą cienkość i rozciągliwość żył. Mimo to żyły zawierają komórki mięśniowe i w pewnych warunkach mogą się obkurczać, opróżniając swoje zbiorniki (w których prawidłowo mieści się - 60% krwi ) do pozostałych odcinków krążeniowych .
Dzięki rozgałęzieniom całkowita powierzchnia przekroju dużego układu krążenia, a także prędkość przepływu krwi, zmienia profil przepływu krwi w poszczególnych jego odcinkach.
Pojemność minutowa (CO) wynosi w spoczynku 5-6L/min. Ponieważ ta sama ilość krwi musi przepływać przez przekrój aorty, jak i przez łączny przekrój wszystkich tętnic, więc zgodnie ze wzrostem tego przekroju wzrostem powierzchni tego przekroju, maleje odpowiednio prędkość przepływu zgodnie ze wzorem:
V=Q/A
Gdzie: V - oznacza prędkość liniową, Q prędkość przepływu (mL/min),
A - całkowitą powierzchnię przekroju.
Ponieważ największa powierzchnia przekroju dotyczy kapilar, więc tu przepływ liniowy w spoczynku jest najniższy i bliski 0, odwrotnie w aorcie, której przekrój wynosi - 4,5 cm2 i gdzie prędkość przepływu, zwłaszcza w okresie wyrzucania krwi z komory lewej, podnosi się do - 120cm/s
Profil ciśnień skurczowego i rozkurczowego w aorcie i tętnicach oraz ciśnień w kapilarach, wenulach i żyłach z oznaczeniem prędkości liniowej i oporów względnych w poszczególnych odcinkach zbiornika tętniczego dużego i zbiornika żylnego dużego przedstawia rycina 98. Warto zaznaczyć, że prędkość przepływu nie jest czymś stałym, ale ulega wahaniom; największe wahania skurczowo- rozkurczowe występują w aorcie i tętnicy płucnej. Mniejsze, aczkolwiek także związane z akcją skurczowo- rozkurczową, są zmiany prędkości przepływu przez żyły płucne i próżne. Ponieważ ilość krwi przepływającej przez naczynie zależy od gradientu ciśnień pomiędzy początkowym i końcowym ich odcinkiem oraz od oporu przepływu, więc przy stałych wartościach ciśnień prędkość przepływu krwi przez różne obszary naczyniowe jest odwrotnie proporcjonalna do przekroju powierzchni danego odcinka układu krążenia. Gradient ciśnień w krążeniu systemowym jest różnicą pomiędzy początkiem tego krążenia, a więc aortą, a jego końcem, czyli prawym przedsionkiem. Średnie ciśnienie w aorcie wynosi - 100 mm Hg, a w prawym przedsionku - 5 mmHg. Gradient ciśnień w dużym krążeniu wynosi, więc 100 - 5 = 95mm Hg i stanowi tzw ciśnienie napędowe perfuzyjne krwi (PP-perfuzion pressure). Gradient ciśnienia w małym krążeniu wynosi tylko 15-6=9mm Hg, gdyż średnie ciśnienie w tętnicy płucnej wynosi 15mmHg, a w lewym przedsionku średnio _ 6 mm Hg. W związku z z tym ciśnienie napędowe przepływu krwi w krążeniu małym jest - 10-krotnie mniejsze niż w systemowym.
Dystrybucję średnich ciśnień i ciśnienia napędowego dużego i małego krążenia przedstawia rycina 99. Dystrybucję objętości krwi w poszczególnych częściach dużego zbiornika naczyniowego przedstawia rycina 94A. Najwięcej krwi, bo - 60% mieści się w naczyniach pojemnościowych, niskościennych, tzn w żyłach małych i dużych. NA tętnice przypada - 16% krwi, a na naczynia włosowate 6% krwi. W sercu i krążeniu płucnym znajduje się odpowiednio 8% i 12% całkowitej objętości krwi. Na uwagę zasługuje tyko nie wielka objętość krwi wypełniająca naczynia włosowate, pomimo, że całkowita powierzchnia ich przekroju jest bardzo duża. Wynika stąd, że naczynia włosowate są krótkie.
Średnie ciśnienia panujące w różnych częściach układu naczyniowego są uwarunkowane z jednej strony tłoczącą krew pracą serca, a z drugiej właściwościami strukturalnymi i oporem, jaki te części stawiają dla prądu krwi. Ponieważ serce pompuje krew do aorty, więc średnie ciśnienie osiąga tu najwyższą wartość wynoszącą - 100 mm Hg, z wahaniami skurczowo rozkurczowymi od 120-80 mm Hg(ryc. 100 A). W miarę przepływu krwi przez poszczególne odcinki krążenia systemowego spada stopniowo ciśnienie średnie, obniżając się do wartości - 5 mm Hg na poziomie dużych żył i prawego przedsionka. Ten spadek ciśnienia tętniczego w poszczególnych częściach częściach krążenia systemowego jest wprost proporcjonalny oporu naczyniowego. Opór przepływowy w dużych i średnich tętnicach jest niewielki i dlatego średnie ciśnienie w tętnicach o średnicy 3mm ciągle jeszcze jest wysokie i wynosi 95-97 mm Hg. Największy opór przypada na małe tętnice i tętniczki(arteriole) i stanowi blisko połowę całkowitego oporu krążenia systemowego. (Rycina 100B). Spadek ciśnienia w tętniczkach wynosi - 55 mmHg i w związku z tym ciśnienie na początku tętniczych naczyń włosowatych wynosi -30-35- nn Hg. Opór naczyń włosowatych stanowi - 24% całkowitego opór krążenia systemowego (ryc. 101) i ciśnienie krwi w końcu żylnym kapilar wynosi 10 mm Hg. Ciśnienie w żyłach drenujących naczynia włosowate również wynosi - 10 mm Hg. Opór małych i dużych żył jest nieznaczny i wynika z ucisku tkanek na te naczynia, a ciśnienie krwi dopływającej do prawego przedsionka spada do - 5 mm Hg. Tak więc, zarówno duże tętnice jak i żyły tyko w nieznacznym stopniu przyczyniają się do powstania obwodowego oporu krążenia systemowego. Największy udział mają tu arteriole, które dzięki skurczom swej błony mięśniowej mogą dowolnie i wybiórczo zmieniać ten opór przepływu w poszczególnych narządach, przystosowując przepływ krwi do aktualnych potrzeb tych narządów.
Przepływ krwi przez poszczególne narządy zależy od całkowitego przekroju naczyń oporowych zaopatrujących te narządy. Główna rola w dystrybucji krwi przypada tu tętniczkom, które działają jak kurki decydujące o wielkości strumienia krwi płynącej a wysokociśnieniowego zbiornika tętniczego do mikrokrążenia poszczególnych narządów. Procentowo najwięcej krwi przepływa przez narządy przewodu pokarmowego i wątroby - 24%, mięśnie szkieletowe - 20%, nerki 20%, i mózg - 15% (ryc. 101). Ten procentowy rozdział krwi wyrzucanej przez lewą komorę do poszczególnych narządów podlega ustawicznym wahaniom, zależnie od ich aktywności metabolicznej. W czasie wysiłku fizycznego, kiedy to pojemność minutowa serca może się podnieść nawet 5-7-krotnie, przepływ przez mięśnie może wzrosnąć nawet do 80-85% tej pojemności, a przepływ przez inne narządy, np. przewód pokarmowy i nerki może zmniejszyć się odpowiednio do 5% i 3% pojemności
Krążenie kapilarne - funkcja.
Zasadnicze funkcje układu krążenia spełniają się na poziomie kapilar, których gęsta sieć wokół komórek zapewnia:
-stałe zaopatrzenie w O2 i środki odżywcze
-usuwanie szkodliwych produktów przemiany materii , zwłaszcza CO2
-regulacje temperatury poszczególnych narządów ciała
Zagęszczenie naczyń włosowatych jest bardzo zróżnicowane i uzależnione od zapotrzebowania tlenowego - w m. Sercowym, mózgu, nerce, wątrobie ilość naczyń włosowatych wynosi ok. 2500-3000 w mm3. W m. Szkieletowym w spoczynku nie przekracza 300-400, a zwiększa się nawet 20-krotnie (otwarcie zwieraczy przedwłośniczkowych) podczas pracy mięśniowej. W warunkach spoczynku 25% naczyń włosowatych jest otwartych. Powierzchnia wymiany jest uzależniona od stanu zwieraczy przedwłośniczkowych. Mięśnie gładkie zwieraczy są skąpo unerwione przez włókna współczulne a wybitnie wrażliwe na czynniki humoralne. Zwieracze posiadaja również anaczny stopień automatyzmu ( rytmiczne ruchy skurczowe i rozkurczowe).
W naczyniach włosowatych zachodzą 2 procesy
Dyfuzja
Filtracja i reabsorpcja
Dyfuzja - mechanizm ten stanowi główny czynnik odnowy środowiska zewnątrznaczyniowego.
Kierunek i szybkość dyfuzji dla danej substancji zależy od gradientu jej stężeń. Niezbędnym warunkiem do utrzymania gradientu pomiędzy środowiskiem zewnętrznym a krwią jest ruch krwi. Wielkość procesu dyfuzji zależy od przepuszczalności bariery (wielkości porów w błonie). Przepuszczalność ściany naczyń ulega zwiększeniu przez działanie kinin osocza, histaminy, serotoniny a także poprzez obniżenie poziomu glikokortykoidów. Zmniejszenie przepuszczalności następuje poprzez jony Ca++ a także odkładanie się w błonie podstawnej nitek włóknika (nawet w warunkach prawidłowych), co z wiekiem prowadzi do starzenia się organizmu (utrudnienie procesów dyfuzji).
Dyfuzja substancji rozpuszczalnych w lipidach, (CO2 i O2) zachodzi całą powierzchnia naczyń śródbłonka naczyń włosowatych (szybka dyfuzja). Dyfuzja substancji rozpuszczalnych tylko w wodzie (Na+, Cl-, glukoza) odbywa się przez pory (wolna dyfuzja). W ciągu 1 min w spoczynku przez ściany naczyń włosowatych przepływa ok. 60l wody. Wynika z tego że przy przepływie 5l/min (objetość minutowa serca) dochodzi do 12-krotnej wymiany dyfuzyjnej. Sprzyja temu wolny przepływ w naczyniach włosowatych (o.o3cm/sek).
Proces dyfuzji jest szybki i posiada duży margines bezpieczeństwa, co w sytuacji wielokrotnego wzrostu prędkości przepływu z jakim mamy do czynienia podczas wysiłku fizycznego nie powoduje ograniczenia procesu dyfuzji.
Czynnikiem ograniczającym prędkość dyfuzji jest zmniejszenie ilości krwi krążącej. Szybkość dyfuzji jest tym większa im gęściejsza jest sieć naczyń włosowatych i mniejsza odległość między naczyniami a komórkami narządu. Współczynnik dyfuzji dla różnych substancji maleje ze wzrostem ich cząsteczki.
Filtracja i reabsorpcja uzależnione są od:
ciśnienia hydrostatycznego w naczyniach tętniczych (30-35 mmHg)
ciśnienia hydrostatycznego w naczyniu żylnym (15-20 mmHg)
ciśnienia hydrostatycznego na zewnątrz naczynia (1-4 mmHg)
ciśnienia onkotycznego białek w naczyniu (25 mmHg)
ciśnienia onkotycznego w przestrzeni zewnątrz naczyniowej
Ciśnienie filtracyjne - jest to ciśnienie transmuralne - różnica między ciśnieniem hydrostatycznym w naczyniu, a ciśnieniem zewnętrznym panującym panującym w przestrzeni wewnątrznaczyniowej
Efektywne ciśnienie onkotyczne - różnica między ciśnieniem onkotycznym w naczyniu a ciśnieniem onkotycznym w przestrzeni zewnątrz naczyniowej
Hipoteza Starlinga - stwierdza ona, że wielkość i kierunek przesunięć wody z rozpuszczalnymi w niej substancjami (z wyjątkiem białek) zależy od różnicy między dwoma ciśnieniami działającymi w przeciwnych kierunkach (ciśnienie filtracyjne i efektywne ciśnienie onkotyczne)
Różnicę pomiędzy tymi wyżej wyszczególnionymi ciśnieniami nazywamy efektywnym ciśnieniem filtracyjnym
Z filtracją związane jest pojęcie współczynnika filtracji włośniczkowej (cfc). Oznacza on objętość płynu przechodzącą w ciągu 1 min. Przez ścianę naczyń włosowatych na każdy 1 mmHg różnicy ciśnień w przeliczeniu na 100g tkanki. Współczynnik ten zależy od liczby otwartych naczyń oraz ich przepuszczalności. Przykładowo CFC w mięśniach w spoczynku wynosi od 0,005-0,007 mll/min/1mmHg100g, a podczas wysiłku obserwuje się jego 4-5 krotny wzrost.
Analizując proces filtracji i reabsorbcji daje się zauważyć nieznaczną przewagę procesów filtracji. W procesie reabsorbcji około 80%-90% zostaje zwrotnie wchłonięte w układzie mikrokrążęnia żylnego. Pozostałe 10%-20% wraca do krwioobiegu przez krążenie limfatyczne. W przeliczeniu na dobę około 20l płynu zostaje przefiltrowane z krwi do tkanek, z tego 16-18l ulega reabsorbcji, a pozostała część wraca jako chłonka (2-4l)
Ilość płynu przemieszczająca się na drodze filtracji i reabsorpcji jest mała w porównaniu z objęto ściami wymienianymi na drodze dyfuzji, dlatego nie mają one dla wymiany odżywczej, pełnia natomiast dużą rolę w regulacji obiętości krwi krążącej
Naczynia włosowate mają pewne zdolności do tworzenia gęstych sieci np. w stanach niedotlenienia może dochodzić do zagęszczenia sieci naczyń włosowatych. Wyróżniamy 5 czynników peptydowych pobudzających proliferację naczyń włosowatych: czynnik wzrostu śródbłonka (_EGF), czynnik wzrostu fibroblastów (FGF), angionina, czynnik wzrostu transformujący beta.
Czynniki kształtujące ciśnienie tętnicze
Prawidłowa wartość ciśnienia skurczowo-rozkurczowego w aorcie lub tętnicy ramieniowej w młodego dorosłego człowieka w pozycji leżącej wynosi ~120/80 mmHg, a średnie 100 mmHg . Wielkość ciśnienia pozostaje w pewnej zależności od wieku. U noworodka ciśnienie skurczowe wynosi 40 mmHg, następnie szybko wzrasta i pod koniec drugiego tygodnia życia ma już wartość ~70 mmHg. W 12 r.ż. wzrasta do 105, w 15 r.ż. do 110 mmHg, osiągając w 18 r.ż. 120 mmHg. Ciśnienie rozkurczowe w 18. r.ż wynosi 80 mmHg. Od okresu dojrzałości następuje stały, powolny wzrost ciśnienia i u osobnika 65 letniego ciśnienie skurczowe wynosi 150-160 mmHg, co oznacza przeciętnie wzrost o 1 mm Hg w ciągu jednego roku życia. Wzrost ten jest prawdopodobnie związany ze stopniową redukcją rozciągliwości tętnic, które z wiekiem stają się coraz mniej rozciągliwe i bardziej sztywne na skutek zmian miażdżycowych. Ciśnienie rozkurczowe u osobnika 15-letniego wynosi 70 mmHg, a u 65-letniego 90 mmHg, co oznacza roczny przyrost o 0,4 mmHg spowodowany prawdopodobnie powolnym wzrostem obwodowego oporu naczyniowego.
Zarówno ciśnienie skurczowe jak i rozkurczowe jest nieco niższe u kobiet niż u mężczyzn poniżej 40-50 r.ż., a wyższe u kobiet niż u mężczyzn po 50 r.ż., co wiąże się prawdopodobnie z większą aktywnością u kobiet syntazy tlenku azotu (NOS) pobudzanej przez estrogeny. Po ustaniu wydzielania tych hormonów (menopauza), produkcja NO maleje, a wraz z nią podatność tętnic na rozciąganie, a więc może rozwinąć się nadciśnienie.
Wielkość ciśnienia zależy od masy ciała osobnika, jego sposobu odżywiania i czynników środowiskowych, przede wszystkim zaś narażenia na działanie różnych czynników stresowych.
Ciśnienie tętnicze krwi podlega działaniu siły ciężkości i zależy od położenia tętnicy, w której dokonuje się pomiaru, w stosunku do serca. Przeciętna odległość od poziomu prawego przedsionka do stóp wynosi u człowieka przeciętnego wzrostu 130 cm , zatem ciśnienie hydrostatyczne związane z działaniem siły ciężkości na poziomie stóp wynosi ~125 cm H2O (90 mmHg). Jeżeli w pozycji leżącej ciśnienie w tętnicy grzbietowej stopy wynosi 105 mmHg, to w pozycji leżącej jest ono wyższe o 95 mmHg i wynosi 200 mmHg. Odwrotnie ciśnienie w naczyniach znajdujących się powyżej poziomu serca jest ujemne względem zerowego punktu odniesienia (poziom obojętności ciśnieniowej(hydrostatycznej) przechodzi przez klatkę piersiowa tuż poniżej poziomu serca) i dlatego w tętnicach mózgowych znajdujących się 40 cm powyżej poziomu serca, ciśnienie wynosi ~60 mmHg (100-40). Przy zmianie pozycji z leżącej na stojącą siła grawitacji powoduje zmniejszenie powrotu żylnego a także redukcję wyrzutu sercowego i ciśnienia tętniczego . Kompensacyjny wzrost częstotliwości skurczów serca i obwodowego oporu naczyniowego prowadzi zarówno do wzrostu zarówno ciśnienia skurczowego jak i rozkurczowego, ponieważ jednak to ostatnie bardziej się zwiększa, więc ciśnienie pulsowe ulega zmniejszeniu.
Wzrost ciśnienia skurczowego i średniego występuje typowo w czasie wysiłku fizycznego. Ciśnienie skurczowe wzrasta wskutek zwiększenia kurczliwości mięśnia sercowego. Ciśnienie rozkurczowe może początkowo się obniżyć, ponieważ następuje rozszerzenie naczyń w pracujących mięśniach, a potem w miarę trwania wzrostu wysiłku, to ciśnienie utrzymuje się prawie na jednakowym poziomie.
(tako rzecze Konturek)
Ciśnienie w zbiorniku tętniczym dużym stanowi wypadkową
- dopływu do zbiornika krwi tłoczonej przez serce )pojemność minutowa serca)
- odpływu krwi, który w znacznym stopniu zależy od błony mięśniowej małych tętniczek. Odpływ zależy od całkowitego oporu obwodowego (TPR)
Wszystkie czynniki, które wpływają bądź na pojemność minutową serca (objętość krążącej krwi, powrót żylny, rytm serca, pobudzenie układu współczulnego) bądź na opór obwodowy (zwężenie lub rozszerzenie naczyń obwodowych, lepkość krwi i wskaźnik hematokrytu czy stan funkcjonalny krwinek) będą stwarzały tendencje do odpowiedniego zmienienia średniego ciśnienia tętniczego krwi. W zdrowym organizmie funkcjonują układy regulacyjne, które takim tendencjom przeciwdziałają i utrzymują homeostatyczne ciśnienie tętnicze na poziomie odpowiednim dla danej sytuacji czynnościowej organizmu.
Amplitudę skurczowo-rozkurczową nazywamy ciśnieniem tętna, ponieważ wyczuwa się ją jako rozciągnięcie ściany tętniczej (pulsacja objętościowa) tzn. jako tętno. Im szybszy wyrzut komorowy i im on sam jest większy tym większe będzie ciśnienie skurczowe. Wzrost ciśnienia tętniczego jest wywołany nie bezpośrednio zwiększoną objętością krwi w tętnicach, lecz rozciągnięciem ich ściany i napięciem sprężystym. Jeżeli objętościowy współczynnik sprężystości aorty zwiększy się (aorta zesztywnieje), to ta sama objętość krwi wyrzuconej do aorty wywoła wyższe napięcie sprężyste ścian aorty i w konsekwencji wywoła większe ciśnienie skurczowe niż w przypadku aorty o bardziej rozciągliwych ścianach. Aorta w swym początkowym przebiegu jest bardziej rozciągliwa niż tętnice obwodowe, dlatego aorta piersiowa magazynuje znaczną część objętości wyrzutowej, przekrój aorty wzrasta na szczycie wyrzutu lewokomorowego o ok.10%, podczas gdy aorty brzusznej o 5%, a dużych tętnic kończyn o 3%.
Wysokość ciśnienia skurczowego jest tym większa im większa jest objętość wyrzutowa serca i szybkość wyrzutu oraz im wyższy współczynnik sprężystości objętościowej aorty. Ciśnienie rozkurczowe jest tym mniejsze im wolniejszy jest rytm serca, im wyższy współczynnik sprężystości aorty i im mniejszy opór obwodowy przepływu.
Amplituda skurczowo-rozkurczowa wzrasta w stanach zesztywnienia aorty (miażdżyca, zmiany kiłowe, zmiany starcze), przy czym ani objętość wyrzutowa, ani ciśnienie średnie nie ulega zwiększeniu. Innym stanem, w którym wzrasta wybitnie ciśnienie skurczowe a maleje rozkurczowe jest niedomykalność zastawek półksiężycowatych aorty. Zwiększa się wtedy odpływ krwi w czasie rozkurczu, ponieważ krew cofa się z powrotem do lewej komory. Z kolei w czasie skurczu lewej komory wzrasta wyrzut do aorty, ponieważ objętość późnoskurczowa przepełnionej lewej komory jest znacznie większa i zgodnie z prawem serca Starlinga, skurcz komory jest silniejszy.
Na ogół podwyższenie ciśnienia rozkurczowego przemawia za wzrostem a obniżenie za redukcją obwodowego oporu naczyniowego. Wzrost ciśnienia skurczowego sugeruje natomiast zwiększenie objętości wyrzutowe serca lub zesztywnienie aorty.
(Traczyk, t.II)
(W malym traczyku jest o regulacji cisnienia tetniczego krw na str. 383, ale Konturek nie zalicza odruchow do czynników kształtujących cisnienie tetnicze,
Rozkład ciśnień w układzie krążenia.
Opór krążenia jest zmienny w kolejnych odcinkach układu krwionośnego. Szeregowo ułożonym oporom przepływu odpowiada liniowy spadek ciśnienia od lewej komory do prawego przedsionka w dużym krążeniu i od prawej komory do lewego przedsionka w krążeniu płucnym (małym). Tam, gdzie opór naczyniowy jest największy, w drobnych tętniczkach (arteriole), ciśnienie napędowe zużywa się najbardziej i spadek ciśnienia jest ostry. Średnie ciśnienie w tętnicach przekroju 3-5 mm jest niewiele niższe niż w aorcie i wynosi około 90 mm Hg. Ciśnienie w małych tętnicach utrzymuje się jeszcze na poziomie 70-80 mm Hg. Dopiero po pokonaniu wysokiego oporu najmniejszych tętniczek (arterioli) o małym przekroju, ciśnienie spada do około 35 mm Hg. Takie samo jest ciśnienie w części tętniczej naczyń włosowatych. W ich części żylnej ciśnienie obniża się do 15-20 mm Hg.
Podobną wartość ma ciśnienie w małych żyłkach. Obniża się ono stopniowo w miarę przesuwania się krwi do prawego przedsionka do średnio 5 mm Hg w prawym przedsionku i około 7-8 mm Hg w przedsionku lewym.
Zmiana pozycji ciała z poziomej na pionową nie zmienia jedynie ciśnienia w płaszczyźnie przebiegającej około 5 cm poniżej przepony. Jest to tzw. płaszczyzna hydrostatycznie obojętna. Poniżej tej płaszczyzny ciśnienie krwi w pozycji stojącej jest wyższe, powyżej zaś niższe od ciśnienia od ciśnienia w pozycji poziomej. Na położenie płaszczyzny hydrostatycznie obojętnej wpływa rozciągliwość (podatność) naczyń krwionośnych. Płaszczyzna hydrostatycznie obojętna przesuwa się zawsze w kierunku obszaru o naczyniach najbardziej rozciągliwych, na który działa słup hydrostatyczny krwi. W dolnej połowie ciała poniżej serca znajduje się wiele dużych rozciągliwych żył o dużej podatności i dlatego tam przesuwa się płaszczyzna ciała hydrostatycznie obojętna. Ciężar słupa krwi, poczynając od płaszczyzny hydrostatycznie obojętnej do naczyń stóp (odległość około 122 cm u osobnika średniego wzrostu), wywiera ciśnienie hydrostatyczne równe 122 cm H2O, czyli około 90 mm Hg. Ciśnienie to dodaje się do średniego ciśnienia tętniczego w aorcie na poziomie płaszczyzny hydrostatycznie obojętnej, w przybliżeniu 95-100 mm Hg, i do ciśnienia żylnego, i rzeczywiste średnie ciśnienie w tętnicach na poziomie stóp wynosi około 100+90= 190 mm Hg, a ciśnienie w żyłach stóp przekracza 90 mm Hg. W tętnicach głowy, położonej około 40-50 cm powyżej płaszczyzny hydrostatycznej obojętnej, ciśnienie słupa krwi o tej wysokości, czyli około 25-35 mm Hg, odejmuje się od średniego ciśnienia tętniczego i jego wartość spada tam do około 65 mm Hg. W rozgałęzieniu tętnicy szyjnej wspólnej ciśnienie jest mniejsze o 25 mm Hg od ciśnienia w aorcie w płaszczyźnie hydrostatycznie obojętnej i wynosi 75 mm Hg, zależnie od budowy ciała i długości szyi.
Czynnik hydrostatyczny nie wpływa na gradient ciśnień (ciśnienie napędowe), ponieważ -zgodnie z prawem naczyń połączonych - ciśnienie zwiększa się lub zmniejsza dokładnie o tę sama wartość zarówno w tętnicach jak i w żyłach. W rezultacie różnica ciśnień i ciśnienie napędowe pozostaje niezmienione bez względu na pozycję ciała. Błędny jest pospolity pogląd, sprzeczny z prawem naczyń połączonych, ż powrót żylny do serca jest, dlatego mniejszy w pozycji stojącej, że krew „płynie pod górę”. Przyczyna tego utrudnienia jest inna. Znacznie zwiękza się ciśnienie w naczyniach dolnej połowy ciała. Zwiększenie ciśnienia transmularnego rozciąga przede wszystkim naczynia żylne, ponieważ ich podatność jest znacznie wieklsza niż tętnic. Po przejściu do pozycji stojącej około 400 ml krwi zostaje nagle zatrzymane w rozciągniętych żyłach dolnej połowy ciała. Ta krew zostaje wyłączona z krążenia, zmniejsza się objętość krwi centralnej w naczyniach klatki piersiowe i powrót żylny. Skutki hemodynamiczne są takie same jak przy utracie krwi. U zdrowego człowieka uruchomione zostaja natychmiast odruchowe mechanizmy regulacyjne obarczenia baroreceptorów tętniczych i mechanoreceptorow sercowo-płucnych (reakcja ortostatyczna układu krążenia). w żyłach położonych poniżej serca ciśnienie w pozycji stojącej spada poniżej ciśnienia atmosferycznego i dochodzi do zapadania żył. Żyły klatki piersiowej nie zapadają się w pozycji stojacej dzięki otaczającemu ujemnemu ciśnieniu w klatce piersiowej, które sprawia, ze ciśnienie transmularne nie zmienia się mimo zmniejszenia ciśnienia wewnątrz naczyń krwionośnych. W prawym przedsionku średnie ciśnienie obniża się w pozycji stojącej do poziomu ciśnienia atmosferycznego, tzn. do 0, ale ciśnienie transmuralne nadal rozciąga ściany przedsionka, ponieważ otaczające ciśnienie zewnętrzne w klatce piersiowej jest niższe od atmosferycznego. Czynnik hydrostatyczny obniża także ciśnienie wewnątrzczaszkowe. Dlatego ciśnienie transmuralne w żyłach mózgu i opon mózgowych nie zmienia się, mimo położenia ich powyżej płaszczyzny hydrostatycznie obojętnej i obniżenia ciśnienia w tętnicach zaopatrujących mózg. Dzięki temu żyły mózgu i opon nie zapadają się w pozycji pionowej ciała. zapadanie następuje dopiero po otwarciu czaszki. Może wtedy dojść nawet do wciągania do żył powietrza atmosferycznego i do zatorów powietrznych. Podobne niebezpieczeństwo zagraża przy otwarciu dużych żyl na szyi, w których - zwłaszcza podczas wdechu - ciśnienie zmniejsza się poniżej wartości ciśnienia atmosferycznego.
Wysokie ciśnienie hydrostatyczne w naczyniach włoskowatych stóp zwiększa filtracje i przechodzenie wody do tkanek,. Dlatego przy dłuższym przebywaniu nieruchomo pozycji stojącej, a nawet siedzącej, występuje lekkie obrzmienie stóp. Obrzękowi przeciwdziała obarczenie baroreceptorów tętniczych i odruchowy skurcz naczyń oporowych przedwłośniczkowych, uniemożliwiający nadmierne zwiększenie ciśnienia filtracyjnego w naczyniach włoskowatych.
Czynnik grawitacyjny może ulec znacznemu wzmocnieniu pod wpływem dodatkowych przyśpieszeń działających na organizm, np. u pilotów samolotów nurkowych, a zwłaszcza przy startach rakiet kosmicznych.
Składowe oporu obwodowego.
Naczyniami oporowymi są małe tętniczki, w których następuje największy spadek ciśnienia krwi. Krew dopływająca do nich na poziomie serca ma średnie ciśnienie 12 kPa, czyli średnie ciśnienie w zbiorniku tętniczym, zaś po przepłynięciu przez nie spada do 4,6 kPa. Ich błona mięśniowa jest pod stałą kontrolą ośrodków naczyniozweżających. Gdy pojawia się zapotrzebowanie na tlen w danym obszarze naczyniowym, wówczas małe tętniczki tam występujące rozszerzają się, a w innych rejonach zwężają, tak, aby krew odpływająca ze zbiornika tętniczego nie zmniejszała się. Jeśli jednak zostanie otwarta większa liczba naczyń oporowych, wówczas odpływ krwi zwiększa się i obniża ciśnienie w zbiorniku tętniczym. W następstwie tego, mechanizmy kontrolujące układ sercowo-naczyniowy przyśpieszają pracę serca i jego pojemność minutowa wzrasta, tak, aby odpływ krwi został zrównoważony przez dopływ. Czynność naczyń oporowych można przyrównać do czynności kurków, które są w większości zakręcone, przepuszczając niewielką ilość krwi. Pojawiające się zapotrzebowanie danego narządu na krew powoduje otwarcie w nim naczyń oporowych, zaś w innym miejscu ich zakręcenie.
Opór naczyniowy jest pokonywany prze różnice ciśnień w zbiorniku tętniczym, a zbiornikiem żylnym.
Całkowity opór naczyniowy - TPR obejmuje wszystkie naczynia krążenia dużego: tętnice, tętniczki, naczynia przedwłosowate tętnicze, naczynia włosowate i żyły. Największe jednak znaczenie dla oporu naczyniowego maja jednak naczynia oporowe, czyli małe tętniczki i naczynia przedwłosowate tętnicze. To właśnie ich mała średnica jest przyczyna największego spadku ciśnienia spośród wymienionych naczyń. Opór naczyniowy - R jest wprost proporcjonalny do różnicy ciśnień pomiędzy zbiornikami tętniczymi i żylnymi - P i wrotnie proporcjonalny do pojemności minutowej serca Q.
R = P/ Q
Opór naczyniowy wyrażony jest w jednostkach obwodowego oporu naczyniowego - PRU.
Jednostkę oporu naczyniowego stanowi stosunek różnicy ciśnień krwi w kPa (mm Hg) - P do ilości przepływającej krwi w ml/s - F:
PRU = P/F
Po dokonaniu zaokrągleń liczbowych można przyjąć, ze różnica średnich ciśnień (P) pomiędzy zbiornikami tętniczym i żylnym krążenia dużego wynosi u człowieka 13,3 kPa. W czasie 1 sek przepływa ze zbiornika tętniczego dużego do zbiornika żylnego dużego 100 ml krwi. Te wartości wyznaczają jedną jednostkę obwodowego oporu naczyniowego.
1 PRU = różnica ciśnień 13,3 kPa (100 mm Hg) / przepływ krwi 100ml/s
Całkowity obwodowy opór naczyniowy w warunkach przeciętnych życia człowieka wynosi jedną jednostkę oporu naczyniowego, TPR = 1 PRU. W czasie skurczu naczyń oporowych całkowity obwodowy opór naczyniowy Mozę wzrosnąć do 4 jednostek: TPR = 4 PRU, w czasie ich rozkurczu zaś może się obniżyć do ¼ jednostki: TPR = 0,25 PRU.
Całkowity płucny opór naczyniowy jest około 10 razy niższy od całkowitego obwodowego oporu naczyniowego (TPR). Wynika stąd, że różnica pomiędzy średnimi ciśnieniami w zbiorniku tętniczym płucnym i zbiorniku żylnym płucnym jest niewielka, wynosi bwiem około 1 kPa. Całkowity płucny opór naczyniowy w stanach chorobowych Mozę wzrosnąć nawet do 1,0 PRU lub obniżyć się do 0,03 PRU.
Ośrodek krążenia - lokalizacja i funkcja.
Krążenie krwi jest kontrolowane przez dwa ośrodki sercowy i naczynioruchowy.
Ośrodki sercowe, odpowiedzialne za przyspieszenie (ośrodek przyspieszający) i zwolnienie (ośrodek zwalniający) rytmu serca, znajdują się w tworze siatkowatym i podwzgórzu, regulują aktywność włókien dosercowych współczulnych i n. błędnego.
Ośrodek sercowy przyspieszający pracę serca znajduje się w rogach bocznych rdzenia kręgowego w części piersiowej w segmentach Th1-Th5. Neurony tego ośrodka wysyłają impulsy do serca we włóknach przedzwojowych do zwojów pnia współczulnego i zwojów współczulnych szyjnych (górnego, środkowego i dolnego).
Serce jest unerwione przez pozazwojowe włókna układu współczulnego pochodzące głównie ze zwojów gwiaździstych oraz szyjnych, włókna te wydzielają noradrenalinę.
Ośrodek zwalniający pracę serca znajduje się w rdzeniu przedłużonym, stanowią go neurony należące do jądra grzbietowego nerwu błędnego. Neurony tego jądra za pośrednictwem włókien eferentnych biegnących do serca w nerwach błędnych, czyli włókien typu B i przywspółczulnych komórek zazwojowych znajdujących się w samym sercu zwalniają jego pracę. Unerwienie przywspółczulne pochodzi z obu pni nerwu błędnego, włókna te wydzielają acetylocholinę.
U człowieka ośrodek zwalniający pracę serca wykazuje stałą przewagę nad ośrodkiem przyspieszającym pracę serca. Wyłączenie wpływu obu ośrodków na serce powoduje w spoczynku wzrost częstotliwości skurczów z 72 do 100 na minutę.
Obydwa ośrodki stanowią końcowa wspólną drogę dla impulsacji biegnącej z kory, podwzgórza oraz receptorów w układzie sercowo naczyniowym.
Z kory mózgowej i podwzgórza impulsy biegną za pośrednictwem neuronów tworu siatkowatego. Pobudzenie pól ruchowych w korze mózgowej oraz ośrodków motywacyjnych w podwzgórzu powoduje hamowanie czynności neuronów jądra grzbietowego nerwu błędnego. Ośrodek w części piersiowej rdzenia kręgowego, przyśpieszający pracę serca, uzyskuje przewagę i częstość skurczów się zwiększa.
Impulsacja z receptorów w układzie sercowo- naczyniowym na drodze odruchowej zwalnia lub przyspiesza częstość skurczów serca. Rozciągnięcie ścian tętnic przez podwyższone ciśnienie krwi drażni baroreceptory w ścianie łuku aorty i zatokach tętnic szyjnych wewnętrznych. Pod wpływem impulsacji biegnącej od baroreceptorów przez włókna aferentne nerwów IX i X ośrodek zwalniający pracę serca zostaje pobudzony i częstość skurczów serca maleje. Spadek ciśnienia tętniczego powoduje przyśpieszenie pracy serca na drodze odruchowej dzięki temu, że ośrodek zwalniający pracę serca zostaje zahamowany.
Ośrodek naczynioruchowy jest zlokalizowany w tworze siatkowatym rdzenia przedłużonego. Wyróżniamy tam dwie części tego ośrodka:
Część presyjną (zwężającą)
Część depresyjną (rozszerzającą)
Część presyjna- jej neurony poprzez neurony w rogach bocznych rdzenia kręgowego w części piersiowej i lędźwiowej przekazują pobudzenie do zwoi współczulnych utrzymujących naczynia krwionośne w stałym napięciu. Biorą w tym udział włókna naczyniozwężające typu Cs, a wielkość impulsacji jest wypadkową:
Impulsacji eferentnej z wyższych ośrodków OUN (kory mózgowej, układu limbicznego, tworu siatkowatego śródmózgowia, ośrodka oddechowego w rdzeniu przedłużonym)
Impulsacji aferentnej (chemoreceptory- kłębuszki szyjne i aortalne)
Strefa presyjna jest również wrażliwa na zmiany prężności O2 oraz C O2 w krwi tętniczej.
Część depresyjna- wpływa hamująco na strefę presyjną poprzez zmniejszenie impulsacji we włóknach naczyniozwężajacych, co w konsekwencji prowadzi do rozszerzenia naczyń krwionośnych i spadku oporu naczyniowego. Konkretnie to wpływa hamująco na rogi boczne.
Pobudzenie części depresyjnej odbywa się poprzez wzrost impulsacji z baroreceptorów zlokalizowanych w zatoce szyjnej, łuku aorty oraz w innych miejscach, a także obniżenie prężności C O2 we krwi tętniczej. Strefa depresyjna oddziałuje na układ krwionośny pośrednio, poprzez strefę presyjną.
Skurcz błony mięśniowej małych tętniczek zwiększa opór naczyniowy, a tym samym zmniejsza przepływ krwi ze zbiornika tętniczego do żylnego i podwyższa ciśnienie w zbiorniku tętniczym, rozkurcz mięśniówki powoduje przeciwny efekt.
Światło tętniczek jest kontrolowane ogólnie:
Na drodze nerwowej (patrz wyżej)
Na drodze humoralnej, przez ośrodki nerwowe kontrolujące wydzielanie hormonów
Oraz kontrolowane miejscowo przez odruchy i działające miejscowo czynniki naczyniorozszerzające i zwężające. W pewnej niezależności od ośrodka naczynioruchowego w rdzeniu przedłużonym pozostaje współczulny układ rozszerzający naczynia krwionośne w mięśniach szkieletowych. Zaczyna się on w korze mózgowej, skąd impulsy biegną za pośrednictwem neuronów podwzgórza i tworu siatkowatego śródmózgowia do neuronów rogów bocznych rdzenia kręgowego. Impulsy biegnące od tych neuronów powodują rozszerzenie naczyń krwionośnych w mięśniach szkieletowych i zwiększają przepływ krwi przez nie.
Mechanizmy regulacyjne układu krążenia: lokalne (przekrwienie czynnościowe i reaktywne) i układowe (odruchy z baroreceptorów- odruch Herringa, Cyona- Ludwiga, Bainbridge'a, Bezolda- Jarischa i z chemoreceptorów oraz wyższych struktur OUN).
Lokalne mechanizmy regulacji- mięśnie gładkie naczyń krwionośnych wykazują stałe napięcie toniczne i zależy ono od dwóch czynników:
Miogenny automatyzm mięśni gładkich
Stała impulsacji włókien współczulnych
Miogenny automatyzm utrzymujący napięcie naczyń krwionośnych tworzy napięcie podstawowe, które zawsze pozostaje w naczyniu, nawet po całkowitym jego odnerwieniu.
Drugi czynnik tworzy napięcie neurogenne ściśle związane z włóknami współczulnymi. Wzajemne zależności między przewagą napięcia podstawowego nad neurogennym układają się w zależności od funkcji zaopatrywanych narządów. W naczyniach krwionośnych zaopatrujących narządy gdzie ma miejsce duża przemiana materii i duże użyci tlenu obserwujemy przewagę napięcia podstawowego nad neurogennym. W innych naczyniach, które regulują przepływ w zakresie regulacji całego organizmu przeważa składowa neurogenna.
W czasie maksymalnej aktywności narządów dochodzi do maksymalnego rozszerzenia naczyń i wtedy mamy do czynienia z przekrwieniem czynnościowym (np. mięśnie podczas dużego wysiłku fizycznego).
Przekrwienie reaktywne natomiast, to zjawisko związane ze wzrostem przepływu krwi w obszarze wcześniej niedokrwionym.
Dużą rolę w miejscowej regulacji, poza lokalnymi metabolitami wydzielanymi zarówno podczas pracy narządu jak i jego niedotlenienia, odgrywają komórki śródbłonka naczyniowego. Komórki te uwalniają szereg czynników, które rozszerzają lub zwężają naczynia krwionośne. Do czynników naczyniozwężających zaliczamy prostacykliny (zmniejszają także agregację płytek) oraz prostaglandyny PGE.
Zwężająco na naczynia wpływają prostaglandyny PGF oraz tromboksan.
Wykazano także, że komórki śródbłonka produkują czynnik rozluźniający mięśniówkę naczyń (EDRF), czynnik ten to tlenek azotu wytwarzany również przez leukocyty i podczas orgazmu. Do jego wytwarzania i wydzielania niezbędne są jony wapnia. Wydzielanie EDRF odbywa się w sposób ciągły, co powoduje zmniejszenie tonicznego napięcia naczyń tętniczych. Uważa się że większość transmiterów układu autonomicznego, które rozszerzają naczynia, jak i niektórych czynników humoralnych, nie działa bezpośrednio na mięśniówkę naczyń tylko za pośrednictwem EDRF. W błonie komórkowej śródbłonka naczyń znajdują się receptory, poprzez które działają substancje uwalniające EDRF rozszerzając naczynia.
Śródbłonek wydziela również śródbłonkowy czynnik kurczący EDCF. Są nim trzy polipeptydy endotelina pierwsza, druga i trzecia.
Uwalnianie NO w większych ilościach następuje pod wpływem acetylocholiny, bradykininy oraz vasoaktywnego peptydu jelitowego (VIP)- prowadzi do rozszerzania tętniczek.
Uwalnianie endoteliny pierwszej prowadzącej do skurczu tętniczek powoduja: adrenalina, wazopresyna, angiotensyna II oraz interleukina 1.
Przepływ krwi jak również ciśnienie tętnicze podlega również regulacji przez ośrodek krążenia na drodze odruchowej. Wyróżniamy następujące odruchy:
Odruchy z mechanoreceptorów:
odruch zatokowy Heringa
odruch aortalny Cyona- Ludwiga
odruch Bezolda- Jarischa
odruch z mechanoreceptorów obszaru sercowo- płucnego
odruch Bainbridge'a
odruch Aschnera
odruch Goltza
Odruchy z mechanoreceptorów. Ich receptory zlokalizowane są w obrębie zatok szyjnych (odruch zatokowy Heringa) oraz łuku aorty (odruch aortalny Cyona- Ludwiga). Bodźcem dla ich pobudzenia jest wzrost ciśnienia tętniczego, co powoduje odkształcenie mechaniczne naczyń. Droga środkowa to nerw zatokowy (gałązki nerwu IX) w odruchu Heringa oraz nerw aortalny (dośrodkowe gałązki n. X) w odruchu Cyona- Ludwiga. W odruchach tych wyróżniamy składową sercową i naczyniową.
Składowa sercowa jest realizowana poprzez pobudzenie jąder nerwu błędnego, co prowadzi do wzrostu impulsacji i w efekcie do ujemnych tropizmów spowalniających serce, obserwuje się również odruchowe zahamowanie tonicznej aktywności współczulnych nerwów sercowych.
Składowa naczyniowa zachodzi poprzez pobudzenie strefy depresyjnej, która wpływa hamująco na strefę presyjną. Wyhamowanie strefy presyjnej prowadzi do zmniejszenia jej tonicznej aktywności co powoduje rozszerzenie naczyń krwionośnych, spadek oporu naczyniowego i wzrost przepływu krwi.
Podobne efekty można otrzymać w wyniku pobudzenia mechanoreceptorów zlokalizowanych w lewej komorze oraz w naczyniach wieńcowych poprzez mechaniczne rozciągnięcie ścian komór.
Odruchy z lewej komory można także wywołać na drodze farmakologicznej poprzez podanie weratryny, weratydyny (alkaloid), nikotyny oraz serotoniny. Związki te prowadzą do zwiększenia pobudliwości mechanoreceptorów, Pobudzenie realizowane jest poprzez mechanoreceptory mimo chemicznego działania tych związków. Efekt końcowy (działanie na ukł. krążenia) jest taki sam jak w odruchu zatokowym (składowa sercowa oraz naczyniowa). Odruch ten nazywamy odruchem Bezolda- Jarischa.
Bodźcem pobudzającym receptory obszaru sercowo płucnego, należącego do niskociśnieniowej części ukł. krążenia, jest rozciągnięcie ścian naczyń poprzez zwiększoną objętość krwi zawartej w sercu i naczyniach klatki piersiowej. Odpowiedź krążeniowa na te odruchy to składowa sercowa i naczyniowa taka jak w przypadku innych mechanoreceptorów.
Odruch Bainbridgea powstaje poprzez pobudzenie receptorów (typ B) zlokalizowanych w prawym przedsionku. Pobudzenie następuje w wyniku nagłego zwiększenia powrotu żylnego (szybkie dożylne wprowadzenie dużej ilości płynów). Efektem końcowym wystąpienia tego odruchu jest wzrost aktywności impulsacji w dosercowych włóknach współczulnych i przyśpieszenie akcji serca (składowa sercowa), jak również obserwuje się zwężenie naczyń krwionośnych (składowa naczyniowa).
Odruch Aschnera oraz odruch Goltza to odruchy krążeniowe, które wpływają na akcje serca (wpływ na naczynia nie jest dokładnie poznany). W odruchu Aschnera poprzez ucisk na gałki oczne dochodzi do zwolnienia akcji serca. Podobna reakcję otrzymuje się w odruchu Goltza gdy uciskamy splot słoneczny. W obu odruchach dochodzi do pobudzenia jąder nerwu błędnego.
Tętno - cechy tętna.
Tętnem nazywamy falisty ruch tętnic, który powstaje w wyniku czynności serca i elastyczności tętnic. Objętość wyrzutowa lewej komory wtłaczana do aorty powoduje jej rozciągnięcie, wzrost ciśnienia i powstanie fali ciśnieniowej. Towarzyszące jej odkształcenie ścian naczyń tętniczych określa się jako falę tętna. Prędkość rozchodzenia się fali tętna zależy od rodzaju naczyń (elastyczności i przebiegu) i wynosi ona w aorcie od 5 do 9 m/sek. Zapis fali tętna rejestrowany jest w postaci ramienia wstępującego i zstępującego. Na ramieniu zstępującym występuje załomek zwany falą dykrotyczną. Spowodowana jest ona poprzez odbicie krwi od zamkniętych zastawek aorty. Prędkość rozchodzenia się fali tętna zależy od średnicy naczynia oraz grubości jego ściany.
Własności tętna: częstotliwość, wypełnienie, napięcie, chybkość oraz miarowość.
Częstotliwość tętna - jest to liczba uderzeń na minutę - 60 ÷ 80. U dzieci 90 ÷140. Wyróżniamy tętno:
tętno wolne - pulsus rarus,
tętno szybkie - pulsus frequens
Wypełnienie tętna - zależy ono od amplitudy ciśnienia tętniczego ( różnica skurczowo - rozkurczowa.
Zależnie od wypełnienia wyróżniamy:
tętno duże - pulsus magnus . Dobrze wypełnione, o wysokiej fali.
tętno małe - pulsus parvus. Posiada małą falę.
tętno dziwacze - pulsus paradoxus. Zmniejszenie wypełnienia tętna, aż do zupełnego jego zaniku w czasie głębokiego wdechu oraz zwiększenie fali w czasie wydechu,
tętno naprzemienne - pulsus alterans. Występuje tutaj na przemian fala tętna słabiej lub silniej wypełniona.
Napięcie tętna - oceniamy siłę oporu, jaki przeciwstawia tętnica przy badaniu palpacyjnym.
Wyróżniamy:
tętno twarde - pulsus durus. Tętno stałe zarówno w okresie ciśnienia skurczowego jak i rozkurczowego
tętno miękkie - pulsus mollis.
Chybkość tętna - jest to szybkość wypełniania i opróżniania się tętnicy.
tętno szybkie - pulsus celer. Fala tętna szybko się podnosi oraz szybko opada, Posiada ostry wierzchołek.
tętno leniwe - pulsus tardus. Fala tętna płaska a różnica skurczowo - rozkurczowa rozciągnięta.
Miarowość tętna - polega ona na tym, że poszczególne fale tętna występują w takich samych odstępach czasujak również wysokości fali tętna są jednakowe. Tętno nie spełniające w/w warunków określane jest tętnem niemiarowym.
Wyróżniamy:
Niemiarowość oddechowa.
Niemiarowość ekstrasystoliczną.
Niemiarowość zupełną.
Krążenie żylne - mechanizmy powrotu żylnego
Krążenie żylne stanowi zbiornik niskooporowy i niskociśnieniowy. Gromadzi się tam około 2,5l krwi, co stanowi 50% objętości krwi. Powierzchnia przekroju żył jest wielokrotnie większa w porównaniu a tętnicami, co prowadzi do mniejszego przepływu jak również oporu naczyniowego. Ściany żył posiadają niewielką ilość włókien sprężystych oraz mięśni gładkich, co powoduje ich większą rozciągliwość.
W żyłach są zastawki, które wymuszają jednokierunkowy przepływ i zapobiegają cofaniu się krwi. Przy niewydolności zastawek dochodzi do powstawania obrzęków (wzrost ciśnienia filtracyjnego).
Krew przepływa od drobnych żyłek w kierunku prawego przedsionka. Ten kierunek przepływu jest możliwy dzięki:
Ssącemu działaniu ruchów oddechowych oraz pracy serca. Wczasie oddychania zmienia się ciśnienie w klatce piersiowej, co powoduje zasysanie krwi. W czasie wdechu ciśnienie w klatce piersiowej obniża się od -2,5 do -6,0 mmHg. Siły ssące działające w ten sposób nazywamy vis a fronte,
Istniejącemu gradiętowi ciśnienia - vis a tergo. Ciśnienie w początku układu żylnego wynosi 15 ÷ 20 mmHg., a średnie ciśnienie w prawym przedsionku waha się w zakresie 0 ÷ 3 mmHg. Przepływ w układzie żylnym zachodzi przy ciśnieniu 17mmHg. Gradient ten jest 5-krotnie mniejszy niż w układzie tętniczym(układ żylny jest układem niskooporowym).
Pompie mięśniowej - vis a laterale. Odbywa się on dzięki skurczom mięśni szkieletowych. Odgrywa to dużą rolę przy pionizacji. W tych warunkach ciśnienie w kończynach dolnych wzrasta nawet do około 80mmHg. Powoduje to zmniejszenie powrotu żylnego. Właśnie skurcze mięśniowe obniżają wysokie ciśnienie w kończynach dolnych do 30mmHg.
Zwężeniu naczyń żylnych. Proces ten zachodzi dzięki odpowiedzi mięśni gładkich układu żylnego na pobudzenie współczulne (krążenie żylne posiada niewielkie unerwienie współczulne: głównie nerw trzewny) co prowadzi do wzrostu powrotu żylnego.
Od objętości krwi krążącej (TBV) - wzrost TBV powoduje zwiększenie dopływu krwi do prawego przedsionka
Krążenie mózgowe - funkcja, regulacja
Krążenie mózgowe jest jednym z podstawowych obszarów krążeniowych w organizmie człowieka w związku z zapewnieniem ukrwienia centralnego układu nerwowego (OUN). Brak ukrwienia trwającego dłużej niż 4min. prowadzi do nieodwracalnych zmian w tkance nerwowej.
ANATOMIA KRĄŻENIA MÓZGOWEGO
Krążenie mózgowe posiada dopływy z dwóch źródeł:
tętnice kręgowe (dwie) łączące się w tętnicę podstawną mózgu,
tętnice szyjne wewnętrzne.
Naczynia krwionośne łączą się poprzez rozgałęzienia naczyń tworząc koło tętnicze Wilisa. Krew z krążenia mózgowego odpływa żyłą wielką mózgu do zatok opony twardej, które również zbierają krew z opon mózgu. Krew powraca w kierunku serca poprzez żyły szyjne wewnętrzne.
Przepływ przez mózg wynosi od 750 do 1000ml, co stanowi około 15% objętości minutowej serca. W związku z dużą aktywnością metaboliczną tkanki mózgowej przepływ krwi utrzymuje się na dużym poziomie i wynosi 50ml/min./100g tkanki. Zużycie tlenu wynosi 3,5ml/min./100g tkanki.
CZYNNIKI REGULUJĄCE PRZEPŁYW MÓZGOWY
W krążeniu mózgowym, podobnie jak w krążeniu nerkowym czy krążeniu wieńcowym, występuje proces autoregulacji przepływu. Mechanizm ten polega na utrzymaniu przepływu na względnie stałym poziomie w zakresie 50÷140mmHg. W autoregulacji odgrywają rolę mechanizmy:
Miogenny - polega on na tym, że komórki mięśni gładkich o typie komórek rozrusznikowych ( pozbawionych unerwienia) odpowiadają skurczom na rozciągnięcie ściany naczynia (wzrost ciśnienia tętniczego).
Metaboliczny - w tym mechanizmie główną rolę odgrywają zmiany prężności CO i jonów H. Wzrost prężności obu czynników powoduje silne rozszerzenie naczyń mózgowych i wzrost przepływu krwi. W regulacji metabolicznej ważną rolę odgrywa również adenozyna (produkt miejscowego niedotlenienia), będąca czynnikiem naczyniorozszerzającym.
Regulacja nerwowa przepływu mózgowego głównie dotyczy dużych naczyń oraz naczyń opony miękkiej. Naczynia mózgowe posiadają podwójne unerwienie:
Przywspółczulne - pobudzanie włókien tego układu powoduje rozszerzenie naczyń mózgowych.
Współczulne - włókna tego układu mogą zarówno rozszerzać jak i zwężać naczynia w zależności od pobudzenia receptorów. Zwężanie naczyń następuje w wyniku pobudzenia receptora α, natomiast rozszerzenie jest realizowane poprzez receptor β2.
W regulacji krążenia mózgowego ma również swój udział poziom ciśnienia płynu mózgowo-rdzeniowego (SCF). Z jednej strony wzrost SCF powoduje zmniejszenie przepływu mózgowego, jednakże z drugiej strony powoduje wzrost ogólnego ciśnienia tętniczego( odruch Cuschinga). Następuje to na drodze odruchowej, zapoczątkowanej pobudzeniem ośrodków rdzenia przedłużonego, który zostaje uaktywniony poprzez hipoksję spowodowaną zmniejszonym przepływem krwi. Podwyższone ciśnienie prowadzi do utrzymania względnie stałego przepływu krwi, w krązeniu mózgowym. Efekt końcowy będzie zależał od wypadkowej między lokalnym zmniejszeniem przepływu a wzrostem ciśnienia tętniczego. W przypadku znacznego wzrostu SCF będzie dochodziło do spadku przepływu mózgowego.
Przepływ krwi przez mózg, w przeciwieństwie do przepływu krwi przez inne narządy, nie zmienia się istotnie w czasie pracy fizycznej i umysłowej, jak również w okresie czuwania i snu.
Krążenie wieńcowe - funkcja, regulacja
Jest jednym z najważniejszym obszarów krążenia w organizmie. Zaopatruje mięsień sercowy, który pełni główną rolę w utrzymaniu prawidłowej funkcji krążenia. Nie ma możliwości wytwarzania krążenia obocznego. Zaczopowanie naczyń wieńcowych prowadzi do zapalenia mięśnia sercowego.
ANATOMIA KRĄŻENIA WIEŃCOWEGO
1. Układ tętniczy
Krew dopływa do serca dwoma tętnicami wieńcowymi prawą i lewą, odchodzącymi od aorty tuż nad zastawkami półksiężycowymi.
Tętnica wieńcowa prawa przebiega w bruździe wieńcowej, następnie w bruździe międzkomorowej tylnej i dochodzi do koniuszka. Zaopatruje ona: prawy przedsionek, prawą komorę, część tylną przegrody międzkomorowej, część tylnej ściany lewej komory oraz mięsień przewodnictwa ( szczególnie węzła zatokowo - przedsionkowego).
Tętnica wieńcowa lewa dzieli się na gałęzie: okalającą i międzykomorową przednią. Zaopatrują one: lewy przedsionek, lewą komorę, przednią część przegrody (mięsień przewodnictwa) oraz część przedniej komory prawej.
2. Układ żylny serca.
Większość żył wpada do prawego przedsionka za pośrednictwem zatoki wieńcowej będącej przedłużeniem żyły wielkiej serca. Około 60% krwi z układu żylnego wraca do zatoki wieńcowej a pozostała część uchodzi do serca żyłami przednimi serca oraz żyłami najmniejszymi.
Przepływ wieńcowy wynosi 5% spoczynkowej objętości minutowej - 250ml/min, co stanowi 60 ÷ 80ml/100g/min. Zużycie tlenu przez mięsień sercowy wynosi około 6 ÷ 8ml tlenu/100g/min.
CZYNNIKI KSZTAŁTUJĄCE PRZEPŁYW WIEŃCOWY:
Fazy cyklu serca. Przepływ wieńcowy jest w znacznym stopniu modyfikowany przez fazy cyklu serca. W fazie skurczu izowolumetrycznego dochodzi do maksymalnego skurczu mięśnia sercowego i ucisku z zewnątrz na naczynia. Jednocześnie ciśnienie w aorcie jest ciśnieniem rozkurczowym, co również zmniejsza perfuzję naczyń. W skurczu izotonicznym (w fazie maksymalnego wyrzutu) dochodzi do wzrostu ciśnienia w aorcie, co powoduje, że mimo ucisku na naczynia, wzrasta perfuzja naczyń wieńcowych. Przepływ w tętnicach wieńcowych nieznacznie wzrasta. Największy przepływ wieńcowy występuje w czasie trwania fazy rozkurczu ( rozkurcz izowolumetryczny). Mięsień znajduje się w fazie relaksacji a ciśnienie w aorcie utrzymuje się na stosunkowo względnie wysokim poziomie.
Część akcji serca. Wpływ częstości akcji serca realizowany jest poprzez fazy cyklu serca. Przyspieszenie akcji serca powoduje skrócenie fazy rozkurczu komór i może prowadzić do zmniejszenia przepływu.
Napięcie mięśnia sercowego. Wzrost napięcia powoduje spadek przepływu wieńcowego.
Adenozyna. Występuje w mięśniu sercowym. Jej stężenie wzrasta w czasie hipoksji, niedotlenienia, reaktywnego przekrwienia, wzrostu ciśnienia oraz podczas wysiłku fizycznego. Adenozyna jest głównym czynnikiem rozszerzającym naczynia wieńcowe. Powoduje rozszerzenie małych tętnic (średnica mniejsza niż 1,0mm) proporcjonalnie bardziej niż dużych (większych niż 1,0mm).
Autoregulacja. Proces autoregulacji można zdefiniować jako wewnętrzną tendencję naczyń do utrzymania stałego przepływu mimo zmiany perfuzyjnego ciśnienia tętniczego. Stałość przepływu wieńcowego obserwuje się gdy ciśnienie perfuzyjne mieści się w granicach od 60mmHg do 140mmHg.
O i CO. Niedotlenienie tętnicze jest czynnikiem powodującym vasodilatację (efekt naczyniorozszerzający) niezależnie od zmian metabolizmu w mięśniu sercowym. Jest ona bardziej widoczna, kiedy ciśnienie parcjalne tlenu we krwi spada poniżej 40mmHg. Mechanizm tego zjawiska jest nieznany, może zależeć od bezpośredniego wpływu na mięśnie gładki naczyń lub może działać poprzez wyzwolenie adenozyny. Wzrost ciśnienia parcjalnego CO wykazuje również działanie vasodilatacyjne. Z samego niedotlenienia mięśnia sercowego uwalniane są takie związki, jak adenozyna czy histamina, które działają silnie rozkurczająco na mięśniówkę tętnic wieńcowych.
Jony potasu i wapnia. Jony potasu są głównym kationem wewnątrzkomórkowym i uważa się, że podczas wysiłku mogą powodować lokalne rozszerzenie arterioli. Jony wapnia powodują vasokonstrykcję (efekt obkurczania naczyń), co znalazło potwierdzenie po zastosowaniu leków blokujących kanały wapniowe w celu zwiększenia przepływu wieńcowego. Niemniej jednak podanie wapnia z zewnątrz nie odgrywa istotnej roli w lokalnej kontroli krążenia wieńcowego.
Neuronalna regulacja krążenia. Na przepływ wieńcowy ma wpływ układ współczulny. Naczynia wieńcowe posiadają receptory α oraz β. Głównie manifestuje się działanie receptorów β, które wykazują działanie naczyniorozszerzające. Ich działanie można zaobserwować po zablokowaniu α receptora z pomocą regityny.
Działanie naczyniozwężające α receptorów jest raczej niewielkie. Wyjątkowe działanie adrenaliny, która w innych narządach zmniejsza światło naczyń. Wazopresyna zmniejsza przepływ wieńcowy. Zwiększenie przepływu wieńcowego występuje pod wpływem impulsacji przywspółczulnej biegnącej do serca przez nerwy błędne - n. X. Występuje tu także hamujące działanie nerwu błędnego na czynność serca.
Krążenie płucne - funkcja, regulacja
ANATOMIA
W obrębie krążenia płucnego wyróżniamy: krążenie czynnościowe i krążenie odżywcze. Krążenie czynnościowe - zapewnia prawidłową wymianę gazową w obrębie płuc. Rozpoczyna się pniem płucnym wychodząc z prawej komory (transport krwi odtlenowanej) a kończy się żyłami płucnymi, które wpadają do lewego przedsionka (krew utlenowana).
Krążenie odżywcze - rozpoczyna się naczyniami oskrzelowymi odchodzącymi od aorty, które rozgałęziają się z drzewem oskrzelowym. P odżywieniu tkanki tkanki płucnej przechodzą w żył oskrzelowe, których niewielka część wpada do żył plucnych (domieszka krwi odtlenowanej do utlenionej - przeciek anatomiczny), a pozostałe wracają przez żyły nieparzyste i wpadają do żyły głównej górnej.
Przez krążenie płucne przepływa 5 litrów krwi na minutę, taka sama ilość jak w krążeniu dużym. Wynika to z jednakowej pojemności minutowej komory prawej i lewej.
Tkanka płucna zużywa 10% tlenu pobranego przez organizm.
Krążenie płucne charakteryzuje się niskim oporem naczyniowym. Stanowi on 1/6 do 1/8 całkowitego oporu krążenia dużego. Fakt, że krążenie płucne jest zbiornikiem niskociśnieniowym wynika z tego, że:
końcowe odcinki naczyń płucnych nie posiadają arterioli, posiadających silną mięśniówkę
płucne naczynia włosowate cechują się bardzo dużą pojemnością (mają dużą średnicę)
naczynia płucne ulegają dużemu biernemu rozciągnięciu w następstwie wzrostu płucnego przepływu krwi
Ciśnienie tętnicze w tętnicy płucnej wynosi około 32 mmHg (skurczowe) i 8 mmHg (rozkurczowe), a średnie ciśnienie tętnicze koło 13 mmHg. Średnie ciśnienie tętnicze obliczamy ze wzoru:
Cśr=Cr + 1/3 (Cs - Cr)
Cr - ciśnienie rozkurczowe
Cs - ciśnienie skurczowe
Krew tętnicza wpada do lewego przedsionka, gdy panuje ciśnienie 7 mmHg. Wyliczony gradient wynosi 6 mmHg jest on w zupełności wystarczający dla utrzymania przepływu tej samej ilości krwi jak w dużym krążeniu, przy średnim ciśnieniu 90 mmHg.
Funkcje krążenia płucnego
Zapewnienie prawidłowej wymiany gazów pomiędzy krwią a powietrzem w pęcherzykach płucnych
Zbiornik krwi. Funkcję tą pełnią zarówno tętnice płucne jak i żyły, a wynika to z dużej podatności naczyń układu płucnego. W pozycji leżącej w rozciągniętych naczyniach płucnych mieści się około 600 ml krwi, przy nasilonym wydechu około 200 ml
Filtr krążeniowy. Zatrzymuje w krążeniu płucnym drobne skrzepy, pęcherzyki powietrza oraz cząstki tłuszczów i nie dopuszcza do ich przejścia do lewej komory i tętnic krążenia dużego.
Funkcja metaboliczna. Dużą aktywność metaboliczną wykazuje Śródbłonek naczyń płucnych. W śródbłonka produkowane są prostacykliny, angjotensyna I za pomocą obecnej konwertyny przechodzi w angiotensynę II. Substancje hormonalne takie jak: noradrenalina, histamina, prostaglandyny (E,F) oraz serotonina są wychwytywane i rozkładane w komórkach śródbłonka.
Funkcja krążenia płucnego
Regulacja humoralna - czynnikami naczeniorozszerzającymi są: histaminina (receptor H1), bradykinina, prostaglandyny, adrenalina, serotonina. Zwężająco na naczynia działa zmniejszenie zawartości tlenu jak i również wzrost CO w pęchcerzykach płucnych.
Regulacja nerwowa - układ współczulny działa naczyniozwężająco. Odruch baroceptorów tętniczych hamuje aktywność współczulną (składowa naczyniowa) i rozszerza się naczynia płucne. Układ współczulny ma niewielki wpływ, niemniej jednak acctylocholina dział naczyniorozszerająco, podobnie jak reuro modulator VIP uwalniany na zakończeniach przywspółczólnych, jak i nielicznych współczólnych. Acctylocholina rozszerza naczynia, zmniejsza opór i ciśnienie tętnicze. Noradrenalina zwęża naczynia, pobudza receptory α, zwiększają opór i ciśnienie. Adrenalina pobudza receptory β.
Krążenie nerkowe - funkcja, regulacja
Nerka unaczyniona jest przez tętnicę nerkową odchodzącą od aorty. Tętnica nerkowa dzieli się na tętnice międzypłatowe, które przechodzą na granicy międzyrdzeniem a korą nerki w tętnicę łukowate. Od tętnic tych odchodzą tętnice międzypłacikowe do kory nerki, zaś do rdzenia tętnice proste. Od tętnic międzypłacikowych odchodzą tętniczki doprowadzające, które rozgałęziają się w kłębuszek nerkowy, na poziomie którego zachodzi filtracja. Z kłębuszka krew odprowadzana jest przez tętniczkę odprowadzającą (sieć - tętnicza) , która dopiero teraz rozgałęzia się w naczynia włosowate odżywiające miąższ nerki. Krew żylna wraca żyłami nerkowymi do żyły głównej dolnej.
Przepływ nerkowy wynosi 1250 mm/min, co stanowi 25% pojemności minutowej serca (przepływ przez korę nerki jest większy niż przez rdzeń). Zużycie tlenu przez nerkę wynosi 18 ml/min. Zużycie tlenu przez korę wynosi 9 ml/100 g/min a przez rdzeń 0,4 ml/100g/min.
Czynniki kształtujące przepływ krwi w nerce:
Autoregulacja przepływu - przepływ krwi przez nerki pozostaje względnie stały w zakresie ciśnień od 90 mmHg do 180 mmHg. Odbywa się to dzięki zmieniającemu się naczyń nerkowych, co wynika ze skurczu tętniczki doprowadzającej w odpowiedzi na rozciągnięcie jej mięśni gładkich
Aminy katecholowe należą do substancji wykazujących działanie naczyniozwęzające, noradrenalina najsilniej działa na tętniczki międzyzrazikowe i tętniczki doprowadzające
Angiotensyna II. Wykazuje ona działanie silnie kurczące naczynia tętnicze, również tętniczki odprowadzające. W powstaniu angiotensyny II podstawową rolę odgrywa renina wydzialana w aparacie przyklębuszkowym nerki. Bodźcem do wydzielania reniny jest niedotlenienie nerki lub spadek ciśnienia tętniczego. Powoduje ona przejście angiotensynogenu w angiotensynę I, a ta w obrzarze krążenia płucnego przechodzi w angiotensynę II.
Układ wegetatywny. Brak jest danych o wpływie układu cholinergicznego na krążenie krwi w nerce. Pobudzenie układu współczulnego (drażnienie nerwów nerkowych) wywołuje widoczny spadek przepływu nerkowego. Efekt ten głównie następuje poprzez receptory /alfa/ 1 adrenergiczne, w mniejszym stopniu przez receptory /alfa/ 2 adrenergiczne.
Prostaglandyny (PGE 2) - zwiększają przepływ w korze nerki i powodują jego zmniejszenie w rdzeniu.
Aminy katecholowe - podanie noradrenaliny powoduje najsilniejszą reakcję vasokonstrykcyjną. Następuje silny skurcz tętnic międzyzrazikowych oraz doprowadzających
Zapewnienie odpowiedniego ukrwienia nerki i ciśnienia w tętnicy doprowadzającej jest niezbędne do prwidłowego procesu filtracji, który jest główną i podstawową funkcją nerki. Proces filtracji odbywa się w kłębuszku nerkowym dzięki istnieniu efektywnego ciśnienia filtracyjnego (EFP ).
EFP = Pc - (pc + P tor)
Pc- ciśnienie hydrostatyczne w naczyniach włosowatych kłębuszka = 55 mmHg
pc- ciśnienie onkotyczne w naczyniach włosowatych = średnio około 25 mmHg
Ptor- ciśnienie hydrostatyczne przesączu w torebce kłębuszka = 15 mmHg
Efektywne ciśnienie filtracyjne wynosi 15 mmHg. Pc w naczyniach włosowatych kłębuszkach (55 mmHg) jest wyższe niż ciśnienie hydrostatyczne w krążeniu kapilarnym innych obszarów naczyniowych. Związane jest to ze specyficzną budową naczynia doprowadzającego i odprowadzającego. Naczynie doprowadzające jest krótkie i szerokie a naczynie odprowadzające długie i wąskie. W utrzymaniu ciśnienia na odpowiednim poziomie zaangażowany jest także proces autoregulacji. Układ renina-ngiotensyna II oraz ukłąd współczulny. Spadek ciśnienia w kapilarach kłębuszkach do 40 mmHg powoduje ustanie procesu filtracji ( EFP = 0 ).
Krążenie mięśniowe - funkcja, regulacja
Mięśnie stanowią około 40% masy ciała. Główną rolę w regulacji ciśnienia tętniczego odgrywa opór naczyniowy w mięśniach szkieletowych. Przepływ krwi w spoczynku wynosi 1,4 - 4,5 ml krwi /100g/min. Stanowi to 20% objętości minutowej serca. Przepływ krwi w czasie spoczynku jest większy w mięśniach czerwonych. Zależy od ilości otwartych zwieraczy. Przy maksymalnym wysiłku występuje 20krotny wzrost przepływu mięśniowego (od 85 - 90% objętności minutowej serca).
Nerwowa regulacja krążenia mięśniowego:
regulacja napięcia neurogennego naczyń zależy najbardziej od pobudzenia maechanoreceptorów sercowopłucnych (bardziej niż baroreceptorów tętniczych). Zmniejszenie powrotu żylnego powoduje skurcz naczyń i wzrost oporu, pobudzenie baroreceptorów i rozkurcz. Pobudzenie włukien współczulnych histaminoergicznych (receptory H1 i H2) powoduje rozszerzenie naczyń. Współczulne włókna holinergiczne nie uczestniczą w odruchu z baroreceptorów tętniczych, biorą udział w emocjonalnej reakcji krążeniowej. Pracujące mięśnie podlegają neurogennemu czynnościowemu rozszerzaniu naczyń. Występują tutaj receptory pobudzane przez produkty metaboliczne (np. K) i napięcie mięśni (od nich wychodzą odruchy krążeniowe). Wzrost ciśnienia tętniczego (poprzez zwężenie naczyń w obszarze trzewnym i w mięśniu niepracującym) i zwiększenie wętylacji pluc powoduje zwiększony przepływ naczynia na drodze metabolicznej i zwiększenie dostawy tlenu i krwi.
Odruchowe przyspieszenie rytmu serca zależy od bodźca mechanicznego (wzrost napięcia mięśni). Jednak w większym stopniu od regulacji ośrodkowej uruchamiane jeszcze przed rozpoczęciem wysiłku fizycznego.
Pompa mięśniowa podtrzymuje zwiększony powrót żylny i zwiększoną pojemność minutową serca
Przekrwienie czynnościowe i regulacja przepływu mieśniowego:
Przepływ krwi w pracującym mięśniu wzrasta w wyniku rozszerzenia naczyń oporowych, gł. przedwłośniczkowych. Powoduje to wzrost ciśnienia w naczyniach włosowatych i wzrost współczynnika filtracji włośniczkowej. Wzrasta dyfuzja i filtracja. Rozszerzenie zwieraczy przedwłośniczkowych powoduje włączenie dodatkowych naczyń włosowatych.
Fazy przekrwiania czynnościowego:
I faza - zależna od pobudzenia współczólnych włókien naczyniorozszerzających. Zahamowanie włókien przywspółczólnych. Jony potasu powodują rozluźnienie mięśni gładkich.
II faza - spadek prężności tlenu ( rozluźnienie naczyń ), adrenalina i histamiana powodują rozszerzenie naczyń, PGE i NO - rozszerzenie.
Efekt adrenolityczny pracy mięśniowej - osłabienie reaktywności receptora /alfa/ 1 i /alfa/ 2.
III faza - wypłukiwanie metabolitów, wyrównanie długu tlenowego, wzmożona reaktywność receptora M1 (ACH) co powoduje rozszerzenie naczyń do kilkunastu minut po pracy mięśniowej.
UKŁAD NERWOWY
Receptory czuciowe - podział, właściwości fizjologiczne
Receptory czuciowe - wyspecjalizowane struktury nerwowe, których funkcją jest odbieranie i kodowanie informacji w postaci impulsów nerwowych i przekazywanie tych impulsów do CUN w nerwach dośrodkowych (aferentnych).Czynność receptorów polega, więc na dostarczaniu do C|UN informacji o środowisku zewnętrznym i wewnętrznym organizmu.
Receptorami są albo wyspecjalizowane komórki receptorowe, albo wolne zakończenia nerwowe. Receptory są pobudzane przez różne rodzaje energii, ale najsilniej reagują tylko na jeden jej rodzaj, są więc adekwatne na określone bodźce.
Bodźce te mogą mieć postać energii:
- mechanicznej
- elektrycznej
- cieplnej
- chemicznej
Zasadniczym zadaniem receptorów jest zamiana energii bodźców na energię elektryczną w samym receptorze oraz impulsów w nerwach dośrodkowych.
Receptory są więc przetwornikami (transmiterami), przetwarzającymi jeden rodzaj energii w inny.
PODZIAŁ RECEPTORÓW:
1. Ze względu na energię bodźców
2. Ze względu na lokalizację i pochodzenie bodźców
3. Inne
1. Podział receptorów ze względu na energię bodźców :
mechanoreceptory - wykrywają odkształcenia tkanek,ucisk, wibracje i dotyk
termoreceptory - wykrywają zmiany temperatury otoczenia
receptory bólowe (nocyreceptory) - pobudzane bodźcami uszkadzającymi tkanki
fotoreceptory - wykrywające działanie energii świetlnej na siatkówkę
chemoreceptory - reagują na zmiany składu chemicznego płynów usrojowych (zmiany pH)
2. Podział receptorów ze względu na lokalizację i pochodzenie bodźców (wg. Sherringtona)
eksteroreceptory - reagują na bodźce środowiska zewnętrznego (np. zmiany temp, ucisk, uszkodzenia)
teloreceptory - obejmują narząd wzroku, słuchu i węchu, które informują o zmianach zachodzących w bardziej odległym otoczeniu
interoreceptory - zlokalizowane w narządach wewnętrzynch, wrażliwe na zmiany w środowisku wewnątrzustrojowym, np. układzie trawiennym, oddchowym
proprioreceptory - występują w mięśniach, ścięgnach, torebkach stawowych i błędniku, służą do odbierania informacji o zmianach w napięciu i długości mięśni, położeniu kończyn względem siebie i tułowia oraz ruchu ciała w przestrzeni
3. Inny podział wyróżnia receptory:
specjalne (wzrok, słuch, smak, węch, równowaga)
powierzchowne ( dotyk, ucisk, ciepło i zimno)
głębokie ( położenia, wibracja głęboki ucisk, głęboki ból)
trzewne (głód, pragnienie, nudności,ból trzewny)
Zmysł wzroku: droga wzrokowa, jej etapy i zachodzące na nich procesy fizjologiczne,odruchy źreniczne, akomodacja oka, widzenie barwne
Zmysł słuchu: droga słuchowa, jej etapy i zachodzące na nich procesy fizjologiczne, metody badania analizatora słuchowego.
Zmysł słuchu człowieka jest wrażliwy na drgania o częstotliwości 16-20000 Hz. Częstotliwości obejmujące mowę człowieka zawarte są między 300 a 3000 Hz. Najlepiej słyszalne są tony od 500 do 4000 Hz.
Próg słyszenia- najmniejsze natężenie danego tonu, przy którym jest on słyszalny przez badanego. Te najmniejsze natężenia dla kolejnych częstotliwości określają tzw. dolną granicę słyszenia. Górną granicę słyszenia stanowią natężenia, przy których występuje uczucie bólu (ok. 120 dB).
Pole słyszenia- obszar zawarty między górną, a dolną granicą słyszenia (obejmujący częstotliwości i natężenie).
Narząd słuchu- anatomicznie dzieli się na:
Ucho zewnętrzne
Ucho środkowe
Ucho wewnętrzne
Do zmysłu słuchu zalicza się również:
Neurony drogi słuchowej
Słuchowe struktury ośrodkowego układu nerwowego
W narządzie słuch wyróżniamy część:
Przewodzącą
Odbiorczą
Część przewodząca:
Ucho zewnętrzne
Ucho środkowe
Płyny ucha środkowego
Część odbiorcza:
Receptory słuchowe w narządzie spiralnym ślimaka
Część słuchowa n. VIII
Neurony drogi słuchowej
Korowe ośrodki słuchu w płatach skroniowych
Droga słuchowa
Receptor odbierający fale akustyczne znajduje się w uchu wewnętrznym i stanowi część narządu spiralnego. Właściwym receptorem słuchu są komórki zmysłowe rzęsate:
Wewnętrzne
Zewnętrzne
Komórki rzęsate znajdują się na błonie podstawnej. Każdą komórkę rzęsatą oplata sieć włókien nerwowych będących wypustkami neuronów dwubiegunowych zwoju spiralnego ślimaka.
I neuron czuciowy- kom. dwubiegunowe zwoju spiralnego ślimaka
II neuron czuciowy- jądra ślimakowe brzuszne i grzbietowe (most)
III neuron czuciowy- jądro brzuszne i grzbietowe ciała czworobocznego (most)
III neuron czuciowy- wzgórek dolny blaszki pokrywy
IV neuron czuciowy- wzgórek dolny blaszki pokrywy
V neuron czuciowy- ciało kolankowate przyśrodkowe
Pobudzenie kom. Rzęsatych jest odbierane przez neurony dwubiegunowe w zwoju spiralnym ślimaka. Neurony tego zwoju wysyłają wypustki biegnące w części ślimakowej n. VIII do jąder ślimakowych brzusznych brzusznych grzbietowych. Neurony jądra grzbietowego ślimaka wysyłają wypustki przechodzące na drugą stronę mostu w obrębie ciała czworobocznego. Wypustki tych neuronów kończą się synapsami na neuronach wzgórka dolnego pokrywy po drugiej stronie pnia mózgu. Natomiast jądro brzuszne ślimaka wysyła włókna do jąder ciała czworobocznego, jednocześnie po tej samej i przeciwnej stronie. Od ciała czworobocznego do wzgórków dolnych impulsy są przekazywane za pośrednictwem wstęgi bocznej. Ze wzgórka dolnego blaszki pokrywy impulsy słuchowe kierują się do ciała kolankowatego przyśrodkowego. Neurony ciała kolankowatego przyśrodkowego wysyłają wypustki przez torebkę wewnętrzną i promienistość słuchową do pola słuchowego w korze mózgu w zakręcie skroniowym górnym w płacie skroniowym, w polu 41 wg Brodmanna.
Poza tymi swoistymi drogami przewodzenia impulsów słuchowych część włókien w rdzeniu przedłużonym przełącza się na drogi nieswoiste w układzie siatkowatym, skąd docierają do całej kory mózgu.
Przetwarzanie dźwięków na impulsy nerwowe:
Teoria fal biegnących Bekesy'ego- pod wpływem drgań dochodzi do powstawania fal biegnących biegnących ślimaku, które powodują wychylenia błony podstawnej. Fale biegnące „przesuwają się” na różne odległości wzdłuż błony podstawnej ślimaka osiągając największą amplitudę w miejscach odpowiadających częstotliwości drgań. Najprawdopodobniej pod wpływem odkształcenia błony podstawnej, w miejscu największej amplitudy fali biegnącej, górne części komórek rzęsatych ulegają chwilowemu przemieszczeniu. Występuje wówczas ruch ugięcia rzęsek prowadzący do powstania potencjałów mikrofonicznych i sumacyjnych ślimaka.
Potencjały mikrofoniczne ślimaka (CM) powstają w komórkach rzęsatych zewnętrznych, wyzwolone bodźcem akustycznym, zależne od częstotliwości dźwięku.
Potencjały sumacyjne ślimaka (SP) również wywołane przez bodźce akustyczne, występują przy dużych natężeniach dźwięku, generowane przez komórki rzęsate wewnętrzne.
W błonie komórek rzęsatych znajdują się kanały potasowe i wapniowe. Pod wpływem mechanicznego odchylania komórek rzęsatych zachodzi depolaryzacja i otwarcie kanałów jonowych. Jony te po wniknięciu do komórki powodują łączenie się z błoną komórkową pęcherzyków synaptycznych zawierających transmitery. Zawartość pęcherzyków uwalnia się następnie do przestrzeni synaptycznej (między komórkami rzęsatymi a dendrytami komórek zwoju spiralnego). Po ich przeniknięciu przez błonę dendrytów zachodzą zmiany przepuszczalności tej błony dla jonów, co wyzwala powstanie potencjału postsynaptycznego i potencjału czynnościowego nerwu.
W komórce rzęsatej natomiast, jeżeli pobudzenie mechaniczne ustało, pojawia się hiperpolaryzacja. Kanały jonowe zamykają się, a tym samym zmniejsza się wypływanie transmitera do przestrzeni synaptycznej, co prowadzi do zmniejszenia częstotliwości impulsów nerwowych.
W tych procesach odrębna jest rola komórek rzęsatych wewnętrznych i zewnętrznych.
Komórki wewnętrzne - generują potencjały czynnościowe części ślimakowej n. VIII (przepływ jonów K+ w czasie depolaryzacji, szybki skurcz, wyostrzenie i wzmocnienie przemieszczania małych części błony podstawnej, selektywne pobudzenie komórek wewnętrznych i włókien aferentnych).
Komórki wewnętrzne - pełnią rolę modelującą odpowiedzi z komórek wewnętrznych (przepływ jonów Ca2+ przy dużych natężeniach dźwięku, aktywacja włókien eferentnych, wolny skurcz komórek zewnętrznych, usztywnienie błony podstawnej ślimaka). Ma to znaczenie ochronne.
Uzupełnieniem teorii Bekesy'ego jest teoria miejsca, które tłumaczy zdolność rozróżniania zmian częstotliwości (wysokości) słyszanych dźwięków. Według tej teorii grupy komórek rzęsatych zostają pobudzane właściwymi dla nich częstotliwościami zgodnie z tzw. mapą lokalizacji dźwięków w ślimaku.
Metody badania słuchu
Ocena sprawności narządu słuchu dokonywana jest na podstawie badań mających na celu określenie zdolności słyszenia tonów lub mowy. Upośledzenie słuchu może być wynikiem zaburzeń w przewodzeniu dźwięku, lub w jego odbieraniu. Uszkodzenia przewodzeniowe dotyczą przewodu słuchowego, błony bębenkowej, kosteczek słuchowych lub błony śluzowej w uchu środkowym. Upośledzenie typu odbiorczego może dotyczyć uszkodzenia receptorów i nerwu słuchowego, lub wyższych pięter słuchowych OUN.
Badanie akumetryczne - najprostsze badanie szeptem, polega na określeniu odległości prawidłowego rozróżniania słów zawierających przewagę tonów niskich (mur, chór, wór) i słów o przewadze tonów wysokich (Sas, czas, sieć). Człowiek z prawidłowym słuchem słyszy szept z odległości 5-10 metrów.
Badanie stroikami - bardzo precyzyjny sposób badania, za pomocą którego można ocenić próg słyszenia przewodnictwa powietrznego i kostnego, ich stosunek oraz określić umiejscowienie i rodzaj niedosłuchu.
Próba Webera - drgający stroik postawiony jest na szczycie czaszki, lub na czole. W warunkach prawidłowych badany podaje, że słyszy „w głowie” lub jednakowo w obu uszach. W uszkodzeniach przewodzenia stoik jest lepiej słyszalny w uchu chorym. W uszkodzeniach odbiorczych stroik jest lepiej słyszalny w uchu zdrowym.
Próba Rinnego - próba ta polega na określeniu stosunku czasu trwania przewodnictwa powietrznego do kostnego. Drgający stroik należy zbliżyć do małżowiny i określić czas słyszenia w sekundach, następnie należy wzbudzić stroik i określić czas słyszenia po przystawieniu do wyrostka sutkowatego. Próbę Rinnego oznacza się ułamkiem: przewodnictwo powietrzne/przewodnictwo kostne. Rinne dodatni prawidłowy, np. 60/30, Rinne ujemny - patologiczny. W niedosłuchach przewodzeniowych słyszeie stroika drogą kostną jest dłuższe niż powietrzną (Rinne ujemny). W niedosłuchach odbiorczych przewodnictwo powietrzne jest dłuższe, ale obydwa czasy są skrócone ( mały Rinne ujemny).
Próba Schwabacha - próba ta polega na określeniu czasu słyszenia drgającego stroika przystawionego do wyrostka sutkowatego i porównania z prawidłowym czasem wybrzmiewania użytego stroika. U osób zdrowych wynosi 20-30 sekund, skrócenie czasu - uszkodzenie odbiorcze, wydłużenie - przewodzeniowe.
Badanie audiometryczne - wykonywane za pomocą audiometru wyposażonego w generator dźwięków, potencjometr, słuchawki i wibrator kostny. Dane oznacza się na audiogramie, audiogramie z którego można określić umiejscowienie i rodzaj niedosłuchu dokładniej niż w badaniach stroikowych.
biektywne metody badania słuchu - polegają na obserwowaniu odruchów występujących po zadziałaniu silnego bodźca akustycznego
Odruch bębenkowy - skurcz mięśni kosteczek słuchowych i wciągnięcie błony bębenkowej
Odruch ślimakowo-oczny Froeschelsa - zwrot gałek ocznych i głowy w kierunku źródła dźwięku.
Zjawiska naczynioruchowe - oznaczane metodą pletyzmografii.
Zmysł równowagi: fizjologiczna odpowiedź na pobudzenie komórek rzęsatych.
Orientacja ciała w przestrzeni oraz zachowanie prawidłowej postawy, równowagi statycznej i kinetycznej jest zależna od ośrodkowej integracji informacji płynących z receptorów narządu przedsionkowego, narządu wzroku, czucia głębokiego w obrębie mięśni, ścięgien i stawów oraz ze skórnych eksteroreceptorów (głównie dotyku i uścisku). Jednak dominujące znaczenie ma narząd przedsionkowy.
Pod wpływem przyspieszeń kątowych lub liniowych rzęski komórek zmysłowych w bańkach przewodów półkolistych oraz plamkach łagiewki i woreczka ulegają chwilowemu uginaniu, czego następstwem jest depolaryzacja lub hiperpolaryzacja komórek rzęsatych. Receptory te reagują również na siłę grawitacji. Aferentne włókna nerwowe otaczające komórki zmysłowe baniek, woreczka i łagiewki przewodzą wówczas impulsy do zwoju przedsionkowego i dalej do jąder przedsionkowych. Unerwienie eferentne zapewnia receptorom hamującą i kontrolującą czynność ze strony OUN.
Narząd przedsionkowy ma liczne połączenia:
Droga przedsionkowo- móżdżkowa- ma istotne znaczenie w zachowaniu równowagi statycznej i kinetycznej
Droga przedsionkowo- rdzeniowa- oddziałuje na regulację postawy ciała
Droga przedsionkowo podłużna- warunkuje wzrokową kontrolę położenia ciała w przestrzeni oraz występowanie oczopląsu
Droga przedsionkowo- siatkowa
Droga wstępująca do wzgórza i kory mózgowej
Narząd przedsionkowy ma określoną aktywność bioelektryczną. Najmniejsze odchylenie osklepka prowadzi natychmiast do pojawienia się potencjałów czynnościowych typu pobudzenia po jednej, a hamowania po drugiej stronie, zależnie od tego czy ruch odbył się w kierunku przedsionka czy w kierunku kanału. Jeżeli ruch rzęsek odbywa się w kierunku kinetocylium (najgrubsza i najdłuższa rzęska) pojawia się hiperpolaryzacja i zmniejszenie częstotliwości potencjałów.
W warunkach fizjologicznych impulsy nerwowe z prawego i lewego błędnika równoważą się wzajemnie na poziomie jąder przedsionkowych w pniu mózgu. Całkowite uszkodzenie jednego błędnika powoduje zakłócenia wynikające z braku dopływu impulsów pobudzających, ale także wyzwala pobudzenia płynące z przeciwnego, zdrowego błędnika. Występują wtedy zawroty głowy, zaburzenia postawy i równowagi, które z czasem zmniejszają się i ustępują całkowicie po 2-3 miesiącach w wyniku kompensacji przedsionkowej.
Istotą pobudzenia komórek zmysłowych rzęsatych jest w warunkach fizjologicznych ruch śródchłonki wyzwolony bodźcami cieplnymi lub kinetycznymi. W czasie stosowania bodźców cieplnych woda o temp. różnej od temp. ciała oziębia lub ogrzewa okolicę przewodów półkolistych poziomych. Prowadzi to do ruchu śródchłonki, który powoduje odchylenie osklepka, a tym samym ugięcie rzęsek rzęsek wystąpienie zjawisk depolaryzacji lub hiperpolaryzacji. Ten sam mechanizm występuje podczas zastosowania jako bodźca przyspieszenia kątowego. Każdemu odchyleniu osklepka towarzyszy subiektywne odczucie zawrotu głowy oraz zjawiska obiektywne taki jak oczopląs, chwianie się, zbaczanie kończyn lub reakcje wegetatywne (nudności, wymioty).
Oczopląs- mimowolne rytmiczne drgające ruchy gałek ocznych w płaszczyźnie poziomej, lub elipsoidalnej. Występuje podczas fizjologicznego lub patologicznego pobudzenia komórek receptorowych narządu przedsionkowego. Pobudzenia te przewodzą impulsy drogą przedsionkowo-podłużną do jąder ruchowych nerwu III, IV i VI. Jest to wieloneuronowy odruch przedsionkowo-oczny. Wyróżnia się oczopląs samoistny i wywołany. Oczopląs samoistny może być pochodzenia błędnikowego, ośrodkowego i ocznego, natomiast oczopląs wywołany może być fizjologiczny lub patologiczny. Oczopląs błędnikowy można wywołać za pomocą pobudzeń cieplnych, lub obrotowych - wykorzystuje się to podczas badań układu równowagi.
Metody badania układu równowagi
Ocena narządu przedsionkowego powinna być poprzedzona badaniem neurologicznym obejmującym m.in. sprawnościowe próby móżdżkowe, odruchy przedsionkowo-rdzeniowe, oraz testy oceny postawy i chodu. W przypadkach obwodowego uszkodzenia zmysłu równowagi, mijanie, zbaczanie i padanie występuje w kierunku błędnikowej fazy oczopląsu. Właściwe badanie narządu przedsionkowego oparte jest na wywołaniu odruchu przedsionkowo-ocznego. Badanie to przeprowadza się stosując stymulacje kinetyczne i cieplne powodujące powstanie oczopląsu wywołanego. Jego rejestracja może być przeprowadzona elektronystagmograficznie lub za pomocą wideokamery.
Próba Hallpike'a - wykonuje się ją w pozycji leżącej z głową pochyloną ku przodowi i podpartą w tej pozycji. Do przewodów słuchowych badanego wprowadza się wodę o temp. 30o C (tzw. próba zimna), a następnie o temp. 44o C (tzw. próba cieplna). Czas trwania oczopląsu wynosi od 90 do 130 s. W przypadku wody zimnej wystąpi oczopląs skierowany w stronę przeciwną do oziębionego ucha, a w przypadku wody ciepłej oczopląs skierowany będzie w stronę ucha badanego.
Próba obrotowa - badany siada na krześle obrotowym Barany'ego z głową pochyloną o 30o ku przodowi, poleca się badanemu, aby zamknął oczy i wykonuje się 10 obrotów fotela w ciągu 20 s. Po tym czasie zatrzymuje się nagle fotel i poleca badanemu, aby patrzył na palec badającego ustawiony po tronie przeciwnej do kierunku obrotów. Występujący oczopląs poobrotowy trwa około 25-35 s. Obowiązuje tu zasada: obrót w lewo i zatrzymanie wywołują większą reakcję ze strony prawego błędnika, a obrót w prawo i zatrzymanie powodują pobudzenie po stronie lewej. Urządzenia sprzężone z elektronystagmografem umożliwiają rejestrację również oczopląsu podczasobrotowego (skierowanego w stronę działającego przyspieszenia).
Odmianą próby obrotowej jest tzw. pobudzenie wahadłowe. Podczas badania specjalny fotel odchyla się cyklicznie raz w prawo, raz w lewo ruchem wygasającym, wywołując pobudzenie raz prawego, a raz lewego narządu przedsionkowego.
Czucie bólu: receptory bólowe, drogi, ośrodki, rodzaje bólu, modyfikacja czucia bólu
Zmysł węchu - czynność analizatora węchowego.
W górnej części jamy nosowej występuje nabłonek węchowy, który zbudowany jest z komórek nerwowo-zmysłowych węchowych, komórek podstawnych i komórek podporowych. Komórka nerwowo-zmysłowa węchowa to komórka o dwóch wypustkach. Jedna wypustka zakończona jest włoskami węchowymi wystającymi nad powierzchnię nabłonka. Druga wypustka przewodzi impulsy do ciała komórki. Komórki węchowe są więc jednocześnie chemoreceptorami i komórkami przewodzącymi impulsy. Komórki węchowe w nabłonku węchowym stykają się bezpośrednio ze światem zewnętrznym organizmu. Jedyną przegrodą dzielącą komórki nerwowe od świata zewnętrznego jest warstwa śluzu, która stale pokrywa nabłonek węchowy. Powodu takiego położenia komórki węchowe są wystawione na działanie różnych czynników, np. wirusów, które przez te komórki mogą docierać do OUN.
Droga węchowa
Aksony komórek węchowych tworzą nić węchową, która przez otwory w blaszce sitowej wnika do jamy czaszki. Aksony kończą się synapsami synapsami opuszce węchowej na dendrytach komórek mitralnych (tworzących kłębuszek nerwowy). Komórki mitralne są drugim neuronem czuciowym i wysyłają aksony biegnące przez pasmo węchowe do trójkąta węchowego i istoty dziurkowanej przedniej. Trzecie neurony czuciowe występują w węchomózgowiu, neurony te znajdują się w korze mózgu w zakręcie hipokampa, guzku węchowym, jądrze węchowym przednim i ciele migdałowatym. Od guzka węchowego przedniego biegną aksony eferentne do kłębuszków węchowych. Dzięki temu sprzężeniu zwrotnemu impulsacja węchowa z nabłonka węchowego jest hamowana również w opuszce węchowej.
Zmysł smaku - czynność analizatora smakowego.
Receptory odbierające czucie smaku występują w obrębie jamy ustnej. Komórki receptorowe skupione są w kubkach smakowych. Komórki te odbierają czucie czterech podstawowych smaków :
1. słodkiego
2. kwaśngo
3. słonego
4. gorzkiego
Komórki smakowe nie odbierają poszczególnych smaków oddzielnie, ale wysyłają impulsację specyficzną dla każdego rodzaju smaku. Komórki smakowe są to chemoreceptory reagujące tylko wtedy, kiedy substancja wywołująca czucie smaku rozpuszczona jest w śluzie pokrywającym ich powierzchnię. Włókna nerwowe przewodzące impulsy z komórek smakowych przebiegają w nwrwach czaszkowych :
w strunie bębenkowej (n. VII)
językowo - gardłowym (n. IX)
błędnym (n. X)
Pierwszy neuron czuciowy odbierający czucie smaku znajduje się w zwojach nerwów czaszkowych: VII, IX i X. Neuron drugi mieści się w jądrze pasma samotnego ( nucleus tractus solotarii ); stąd włókna biegną we wstędze przyśrodkowej( lemniscus medialis) i kończą się na trzecim neuronie czuciowym w jądrze brzusznym wzgórza tylno-przyśrodkowym (nucleus ventralis posteromedialis thalami :). Czwarty neuron czuciowy znajduje się w korze mózgu w zakręcie zaśrodkowym.
Próg pobudliwości komórek smakowych w stosunku do odmiennych związków może się znacznie różnić. Smak słodki występuje pod wpływem wodnego roztworu glukozy o stężeniu 80 mmol/L, sacharyny zaś 23 μmoli /L. Próg pobudliwości komórek smakowych może znacznie wzrosnąć, jeśli uprzednio przez pewien czas pozostawały one w kontakcie z tym samym związkiem.
Fizjologiczna rola rdzenia kręgowego. Odruchy rdzeniowe.
1.BUDOWA RDZENIA KRĘGOWEGO
Rdzeń kręgowy zachowuje cechy budowy odcinkowej - segmentalnej. Składa się z 31 odcinków: 8 szyjnych, 12 piersiowych, 5 lędźwiowych, 5 krzyżowych i 1 guzicznego. Na powierzchni zewnętrznej rdzenia widnieją w linii pośrodkowej dwie bruzdy: przednia, głębsza zwana szczeliną pośrodkową przednią oraz tylna, płytsza - bruzda pośrodkowa tylna. Bruzdy te dzielą rdzeń na dwie symetryczne połowy: prawą i lewą. Na powierzchni każdej połowy rdzenia zaznacza się od przodu podłużna linia zwana bruzdą boczną przednią, z której wychodzą korzenie przednie nerwów rdzeniowych oraz od tyłu bruzda boczna tylna, wzdłuż której wchodzą do rdzenia korzenie tylne nerwów rdzeniowych. Zgodnie z prawem Bella-Magandiego włókna czuciowe, aferentne, zdążają do rdzenia tylnymi korzeniami, a włókna ruchowe, eferentne, opuszczają rdzeń korzeniami przednimi. Wymienione wcześniej bruzdy dzielą każdą połowę rdzenia na sznury: przedni, tylny i boczny. Budowa wewnętrzna rdzenia nie jest jednorodna - występuje istota szara i istota biała. W istocie szarej rozróżniamy słupy przednie i tylne, które na przekroju mają kształt rogów przednich i tylnych, oraz istotę szara środkową skupioną wokół ciągnącego się wzdłuż całego rdzenia kanału środkowego. W odcinku piersiowym pomiędzy słupem przednim i tylnym występuje jeszcze słup boczny. Istota biała utworzona jest z włókien nerwowych, skupionych w rdzeniu w tzw. sznury: przednie, boczne i tylne.
DROGI RDZENIA KRĘGOWEGO
Włókna substancji białej tworzące sznury przednie, boczne i tylne, zawierają szlaki lub drogi łączące rdzeń kręgowy z mózgowiem. Wśród nich wyróżnia się krótkie szlaki własne rdzenia oraz długie szlaki wstępujące i zstępujące. Szlaki własne służą do połączeń pomiędzy różnymi. Szlaki własne służą do połączeń pomiędzy różnymi poziomami rdzenia kręgowego. Szlaki długie zstępujące łącza mózgowie z rdzeniem kręgowym A szlaki wstępujące łączą rdzeń z wyższymi piętrami centralnego układu nerwowego.
Drogi wstępujące:
pęczek smukły i pęczek klinowaty - występują w obrębie sznurów tylnych, zawierają długie szlaki wstępujące, przewodzące sygnały czucia głębokiego i precyzyjnego dotyku z receptorów skóry i mięśni oraz nieliczne krótkie drogi własne rdzenia;
droga rdzeniowo-móżdżkowa przednia i tylna - znajdują się w sznurach bocznych, przekazują do móżdżku dane o rozciągnięciu mięśni i położeniu kończyn konieczne do koordynowania ruchów;
droga rdzeniowo-wzgórzowa boczna - w sznurze bocznym, przenosi czucie bólu i temperatury;
droga rdzeniowo-wzgórzowa przednia - w sznurze przednim, przenosi czucie ucisku i dotyku; pęczek własny;
Drogi zstępujące:
droga piramidowa boczna;
droga piramidowa przednia (korowo-rdzeniowa) - przenosi impulsy świadome do komórek ruchowych;
pęczek własny boczny i przedni;
drogi pozapiramidowe: czerwienno-rdzeniowa, siateczkowo-rdzeniowa, przedsionkowo-rdzeniowa (informacje z błędników i móżdżku), czworaczo-rdzeniowa (koordynacja ruchów pod wpływem bodźców wzrokowych i akustycznych);
Drogi piramidowa tworzą układ dowolnoruchowy, a pozapiramidowe układ mimowolnoruchowy.
SKŁADOWE ODRUCHU RDZENIOWEGO
Z rdzeniem kręgowym bezpośrednio związane jest pojęcie łuku odruchowego.
Komponenty łuku odruchowego to:
receptor
aferentne włókno nerwowe (dośrodkowe)
ośrodek nerwowy
Czucie powierzchowne i głębokie, drogi przewodzenia, ośrodki.
W zależności od pochodzenia i miejsca działania bodźca Sherrington podzielił czucie na: eksteroceptywne, proprioceptywne, interoceptywne i teleceptywne. Zajmiemy się dwoma pierwszymi rodzajami czucia.
Czucie eksteroceptywne, czyli powierzchowne jest odbierane przez receptory znajdujące się w skórze - eksteroreceptory. Bodźcami dla eksteroreceptorów są zmiany zachodzące w najbliższym otoczeniu organizmu, działające na skórę.
Czucie proprioceptywne, czyli głębokie, dostarcza informacji o pozycji kończyn w stosunku do tułowia i głowy oraz o ruchu całego ciała w przestrzeni. Proprioreceptory znajdują się w całym układzie ruchu: w mięśniach, ścięgnach, powierzchniach stawowych oraz w przedsionku i w przewodach półkolistych w błędniku.
A) CZUCIE EKSTEROCEPTYWNE DOTYKU I UCISKU
Informacje ogólne - Czucie dotyku wywoływane jest wyłącznie przez odkształcenie skóry. Nie wywołuje go równomierny ucisk, nie powodujący odkształcenia powierzchni skóry. Informacja aferentna z receptorów czucia dotyku przewodzona jest do rdzenia kręgowego przez włókna zaliczane do grupy A, z osłonka mielinową, o średnicy od 6 do 12 mikrom. Prędkość przewodzenia w tych włóknach jest rzędu kilkudziesięciu metrów na sekundę. Przykłady receptorów dotyku: wolne zakończenia nerwowe, ciałka dotykowe, tarczki Merkla czyli łąkotki dotykowe i receptory koszyczkowe mieszków włosowych. Przykłady receptorów ucisku to: ciałka zmysłowe Ruffiniego i ciałka Pacciniego. Gęstość z jaką występują receptory w skórze, jest różna dla poszczególnych okolic. Największe zagęszczenie występuje w skórze końca nosa, w opuszkach palców i w wargach. Najmniej receptorów jest w skórze grzbietu, ud, ramion. Okolice o dużej gęstości receptorów wykazują jednocześnie dużą wrażliwość na dotyk i maja dużą reprezentację korową. Przeciwnie, okolice mało wrażliwe na dotyk są reprezentowane przez małe pola w korze mózgu.
Droga impulsów z receptorów dotyku i ucisku - Są dwie drogi przewodzenia impulsów z eksteroreceptorów dotyku i ucisku. Impulsy od receptora do I neuronu w zwojach nerwowych czaszkowych lub w zwojach rdzeniowych są przewodzone za pośrednictwem włókna aferentnego, będącego wypustka tego neuronu. Dalej biegną przez korzenie grzbietowe i wstępują do mózgowia w sznurze tylnym, w pęczku smukłym i w pęczku klinowatym do II neuronu czuciowego w jądrze smukłym i jądrze klinowatym rdzenia przedłużonego. Część impulsów przewodzona jest inną drogą, impulsy przewodzone są do II neuronu, który znajduje się w rogach tylnych rdzenia kręgowego. Aksony II neuronów czuciowych przechodzą w spoidle białym i w spoidle szarym przednim na drugą stronę rdzenia i wstępują ku górze w sznurze bocznym w drodze rdzeniowo-wzgórzowej bocznej i w sznurze przednim w drodze rdzeniowo-wzgórzowej przedniej do jądra brzusznego tylno-bocznego wzgórza, gdzie znajdują się III neurony czuciowe. Jednak III neuron czuciowy dla receptorów twarzy, jamy ustnej i głowy, unerwianych przez nerw trójdzielny, znajduje się w jądrze brzusznym tylno-przyśrodkowym wzgórza. W dalszej części obie drogi się pokrywają. Wypustki III neuronu biegną przez torebkę wewnętrzną i istotę białą półkul mózgowych do pola czuciowego w zakręcie zaśrodkowym kory mózgu, kończąc się na IV neuronie w polu 1-3 wg Brodmanna. Czuciowe komórki nerwowe i ich wypustki nie są bezładnie przemieszane, ale są rozmieszczone zgodnie z somatotopową organizacja neuronalną. Od receptorów określonej powierzchni skóry są przewodzone impulsy w tych samych pęczkach włókien, a neurony czuciowe sąsiadują ze sobą. Rozmieszczenie III i IV neuronów czuciowych we wzgórzu i w korze mózgu jest zniekształconym odbiciem powłok całego ciała. We wzgórzu II neurony w jądrach brzusznych tylno-bocznym i tylno-przyśrodkowym są skupione w przestrzeni trójwymiarowej. W korze mózgu zaś IV neurony są rozmieszczone równolegle do powierzchni zakrętu zaśrodkowego. Korowa reprezentacja głowy znajduje się najbardziej bocznie w zakręcie zaśrodkowym, reprezentacja dla kończyn dolnych jest zaś umiejscowiona przyśrodkowo.
Badanie czucia dotyku - Są trzy metody badania dotyku: metoda von Freya, metoda topognozji i metoda cyrklowa.
B)CZUCIE EKSTEROCEPTYWNE TEMPERATURY
Informacje ogólne - Spadek temperatury skóry jest odbierany przez kolbę końcową (Krausego), wzrost temperatury zaś przez położone głębiej w skórze ciałka zmysłowe (Ruffiniego), wrażliwe na temperaturę są także receptory bólowe. Bodźcem progowym dla receptorów zimna jest spadek temperatury skóry o 0,004C na sekundę w przedziale od 10 do 41C, dla receptorów ciepła zaś wzrost temperatury skóry o 0,001C na sekundę w przedziale od 20 do 45C. Receptory zimna i ciepła odbierają wzrost lub spadek temperatury tylko wtedy, kiedy temperatura otoczenia różni się od temperatury powierzchni skóry. Przy jednakowej temperaturze powierzchni skóry i otoczenia receptory nie są pobudzane. Stan taki nosi nazwę zera fizjologicznego. Włókna nerwowe przewodzące impulsację od receptorów wrażliwych na spadek lub wzrost temperatury nalezą do włókien grupy A o średnicy od 2 do 55 mikrom.
Drogi impulsów z receptorów czucia temperatury - I neuron czuciowy przekazujący pobudzenie z receptorów ciepła i zimna, tułowia i kończyn, znajduje się w zwojach rdzeniowych, II neuron w rogach tylnych rdzenia kręgowego. Ich aksony przechodzą na drugą stronę rdzenia i wstępują ku górze w drodze rdzeniowo-wzgórzowej bocznej. III neuron znajduje się w jądrze brzusznym tylno-bocznym wzgórza Od receptorów ciepła i zimna, występujących w obrębie głowy impulsacja jest przewodzona za pośrednictwem neuronów zwoju trójdzielnego i wstęgi trójdzielnej do jądra brzusznego tylno -przyśrodkowego wzgórza. IV neuron czuciowy znajduje się w zakręcie zaśrodkowym kory mózgu.
Badanie czucia temperatury - przeprowadza się za pomocą termod i probówek wypełnionych ciepłą lub zimną wodą o temperaturze wyższej lub niższej, od kilku do kilkunastu stopni, od aktualnej temperatury powierzchni skóry
C) CZUCIE EKSTEROCEPTYWNE BÓLU - OMÓWIONE W OSOBNYM PYTANIU
CZUCIE PROPRIOCEPTYWNE Z UKŁADU RUCHU
Iformacje ogólne - W układzie szkieletowym i mięśniowym znajdują się receptory pobudzane pracą statyczną i dynamiczną mięśni szkieletowych. Znajdujące się tam receptory odbierają napięcie oraz rozciągnięcie mięśni i ścięgien, a także ucisk wywierany na powierzchnie stawowe. Receptory te występują we wrzecionkach nerwowo mięśniowych w postaci zakończeń pierścieniowo spiralnych, ciałek zmysłowych Ruffiniego, w ścięgnach jako ciałka buławkowate Golgiego, w okostnej jako ciałka blaszkowate Paciniego oraz wolne zakończenia nerwowe. Ruch ciała zarówno po prostej jak i obrotowy jest odbierany przez receptory znajdujące się w błędniku stanowiącym narząd równowagi.
Droga impulsów z układu ruchu - Informacja z proprioreceptorów układu ruchu jest odbierana przez I neuron czuciowy znajdujący się w zwojach rdzeniowych, a następnie jest przekazywana przez dwie różne drogi do kory mózgu i do kory móżdżku. Impulsacja przewodzona przez pierwszy neuron biegnie bezpośrednio do mózgowia w pęczku smukłym i pęczku klinowatym do II neuronu w jądrze smukłym i w jądrze klinowatym, a następnie przechodzi na druga stronę rdzenia przedłużonego i podąża we wstędze przyśrodkowej do III neuronu w jądrze brzusznym tylno-bocznym wzgórza. IV neuron czuciowy znajduje się w zakręcie zaśrodkowym kory mózgu. Część wypustek neuronów ze zwojów rdzeniowych (I neuron) kończy się synapsami już w obrębie rogów tylnych rdzenia kręgowego na II neuronie czuciowym. Aksony tych neuronów przechodzą na druga stronę rdzenia kręgowego, wstępując ku górze:
-w drodze rdzeniowo-wzgórzowej przedniej i bocznej do III euronu w jądrze brzusznym tylno-bocznym wzgórza, który z kolei wysyła wypustki do IV neuronu w zakręcie zaśrodkowym kory mózgu;
-w drodze rdzeniowo-móżdżkowej przedniej i tylnej do kory móżdżku;
W tych samych polach zakrętu zaśrodkowego kory mózgu znajdują się neurony odbierające impulsację z proprioreceptorów układu ruchu oraz eksteroreceptorów skóry.
Badanie czucia z proprioreceptorów - W warunkach fizjologicznych nie jest odczuwana impulsacja z proprioreceptorów, która pozostaje poniżej progu świadomości. Jej występowanie można wykazać jedynie pośrednio. Mając zamknięte oczy, człowiek bezbłędnie określa położenie kończyny, która nie dotyka niczego, co mogłoby stanowić dodatkowe źródło informacji.
CZUCIE PROPRIORECEPTOROWE RÓWNOWAGI
Informacje ogólne - W przewodach półkolistych i w przedsionku znajdują się receptory narządu równowagi. Komórki receptorów w bańkach błoniastych przewodów półkolistych reagują na obrót głowy, czyli na przyspieszenie kątowe, a komórki występujące w łagiewce i woreczku są wrażliwe na przyspieszenie liniowe.
droga impulsów z błędnika - Włókna nerwowe oplatające komórki nabłonka zmysłowego przekazują pobudzenie do I neuronu czuciowego w zwoju przedsionkowym. II neuron znajduje się w moście w jednym z czterech jąder przedsionkowych: górnym, dolnym, bocznym lub przyśrodkowym Z tych jąder impulsacja jest wysyłana do:
-kory móżdżku przez konar dolny móżdżku
-jąder ruchowych dla mięśni gałek ocznych - jąder nerwów
czaszkowych III, IV i VI za pośrednictwem pęczków
podłużnych przyśrodkowych
-rdzenia kręgowego przez drogę przedsionkowo-rdzeniową
Dzięki tym połączeniom zmiana położenia głowy w stosunku do tułowia odebrana przez receptory błędnika wywołuje natychmiastową odruchową korekcję napięcia mięśni kończyn i tułowia oraz odpowiednie ustawienie gałek ocznych.
Percepcja dotycząca ustawienia głowy w stosunku do tułowia jest uzależniona od impulsacji nerwowej biegnącej od jąder przedsionkowych poprzez jądra przekaźnikowe wzgórza do zakrętu zaśrodkowego w korze mózgu.
Rdzeń przedłużony. Funkcje fizjologiczne rdzenia przedłużonego.
Przez rdzeń przedłużony biegną drogi wstępujące (przewodzące informacje z eksteroreceptorów, proprioreceptorów oraz droga rdzeniowo-móżdżkowa) i zstępujące (piramidowe i pozapiramidowe). Ponadto zlokalizowane są tu ośrodki nerwowe (ośrodek - zbiorowisko neuronów koniecznych do wykonywania określonej czynności):
Oddychania
Częstości skurczów serca
Ciśnienia krwi
Połykania
Kaszlu
Kichania
Nudności
Wymioty
Ssania
Żucia
Wydzielania potu
Naczyniowo-ruchowy
Regulujący tempo podstawowej przemiany materii
Ośrodek dla mięśni ucha (napięcie błony bębenkowej, kosteczek słuchowych)
Jądra nerwów czaszkowych od VI do XII
1, 2, 3 - kontrola oddychania, częstości skurczów serca i ciśnienia krwi
Autonomiczne ośrodki w rdzeniu przedłużonym kontrolujące na drodze odruchowej czynność krążenia, serca, płuc nazywane są ośrodkami życiowymi, gdyż ich uszkodzenia prowadzi zwykle do śmierci. Włókna dośrodkowe biegnące do tych ośrodków rozpoczynają się w wielu przypadkach w wysoko wyspecjalizowanych receptorach trzewnych. Wyspecjalizowane receptory obejmują nie tylko receptory kłębków i zatok tętnic szyjnych oraz kłębków aorty, lecz również komórki receptorowe zlokalizowane w samym rdzeniu przedłużonym. Reakcje ruchowe są stopniowane i precyzyjnie dostosowywane, zawierają składowe zarówno somatyczne, jak i trzewne. Odruchy kontrolujące czynność płuc i układu krążenia szczegółowo przedstawiono w odpowiednich rozdziałach dotyczących krążenia i oddychania.
4, 5, 6, 7,8 - inne autonomiczne odruchy opuszkowe
Połykanie, kaszel, kichanie, nudności i wymioty są również reakcjami odruchowymi integrowanymi w rdzeniu przedłużonym. Odruch połykania spowodowany jest dowolnym aktem przemieszczania zawartości jamy ustnej do gardła. Kaszel inicjowany jest przez podrażnienie górnych dróg oddechowych. Głośnia zamyka się, a silny skurcz mięśni oddechowych wzmaga ciśnienie wewnątrzpłucne, na szczycie którego głośnia nagle otwiera się, co powoduje gwałtowne wypchnięcie powietrza. Kichanie jest podobną reakcją na podrażnienie nabłonka jamy nosowej. Kichanie wyzwalane jest przez podrażnienie włókien bólowych w nerwie trójdzielnym.
Wymioty są innym przykładem odruchu trzewnego, zintegrowanego w rdzeniu przedłużonym. Składowe somatyczne, jak i trzewne tego odruchu występują po sobie, odpowiednio skoordynowane w czasie. Wymioty rozpoczynają się ślinieniem i nudnościami. Fale antyperystaltyczne wywołują opróżnienie do żołądka zawartości górnej części jelita cienkiego. Głośnia się zamyka, co zapobiega wciągnięciu wymiocin do tchawicy. Oddech zatrzymuje się w środkowej fazie wdechu. Mięśnie tłoczni brzusznej kurczą się, a ponieważ klatka piersiowa jest utrzymywana w ustalonej pozycji, skurcz ten zwiększa ciśnienie w jamie brzusznej. Zwieracz odźwiernika żołądka i przełyk rozluźniają się i zawartość żołądka zostaje usunięta na zewnątrz. Czynności te kontroluje "ośrodek wymiotny", znajdujący się w układzie siatkowatym rdzenia przedłużonego na wysokości jąder oliwki.
Wymioty wywoływane są przez podrażnienie błony śluzowej górnej części przewodu pokarmowego. Impulsy z błony śluzowej przenoszone są do ośrodka wymiotnego przez trzewne drogi aferentne, biegnące w nerwach współczulnych i nerwach błędnych. Inne włókna aferentne dochodzą przypuszczalnie do ośrodka wymiotnego z miedzymózgowia i układu limbicznego, gdyż odruch wymiotny występuje również w odpowiedzi na reakcje zabarwione emocjonalnie: 'wywołujący nudności" zapach lub "odrażający" widok. W rdzeniu przedłużonym występują komórki chemoreceptywne, które inicjują wymioty, po pobudzeniu ich przez krążące we krwi związki chemiczne. Chemoreceptorowa strefa wyzwalająca odruch wymiotny znajduje się w pólku najdalszym lub w jego okolicy, jest to pasmo tkanki w kształcie litery V, ułożone na bocznych ścianach komory czwartej w pobliżu zasuwki. Struktura ta należy do struktur układu okołokomorowego i łatwiej do niej przenika z krwi krążącej wiele substancji w porównaniu z sąsiednimi okolicami rdzenia przedłużonego.
Uszkodzenie pólka najdalszego maja niewielki wpływ na odruch wymiotny wywołany podrażnieniem przewodu pokarmowego, lecz znoszą wymioty będące następstwem wstrzyknięcia apomorfiny i wielu innych leków wymiotnych. Lezje pólka najdalszego zmniejszają również wymioty występujące w mocznicy i chorobie popromiennej, w których to stanach dochodzi do wytwarzania i uwalniania do krwi krążącej endogennych substancji wymiotnych. Występowanie wymiotów w licznych stanach patologicznych może być wytłumaczone chemoreceptorowym mechanizmem wywoływania wymiotów pod wpływem krążących we krwi toksyn.
9 - odruch ssania
Następuje na przykład przy pobudzeniu zakończeń nerwu trójdzielnego w okolicy ust noworodka. W rdzeniu przedłużonym pobudzenie zostaje przełączone na nerwy ruchowe - twarzowy i podjęzykowy, które wywołują ruch ssania.
- odruch żucia
Żucie jest odruchem złożonym, w którym bodźce idące z jamy ustnej zostają przełączone na część nerwu trójdzielnego, wprawiającą w ruch mięśnie żwacze i nerw podjęzykowy, unerwiający ruchowo język.
- ośrodek naczynioruchowy
Pobudzenie jest odruchowe i rozszerza naczynia krwionośne.
Podwzgórze. Funkcje fizjologiczne podwzgórza.
Układ piramidowy.
Czynności ruchowe człowieka są wynikiem aktywności skurczowej mięśni szkieletowych. Najbardziej charakterystyczne ruchy o dużej precyzji, złożoności i zróżnicowaniu. Wyzwalanie, kontrola i koordynacja tych ruchów wymagają współpracy ośrodków nerwowych znajdujących się na trzech różnych poziomach integracji centralnego układu nerwowego:
Najniższym- rdzeniowym
Wyższym- mózgowym (pień mózgu, jądra kresomózgowia)
Najwyższym- mózgowym
W miarę rozwoju wyższe piętra integracji ruchowej przejmują na siebie kontrolę prostszych czynności ruchowych niższych pięter i spełniają funkcję nadrzędną w stosunku do tych niższych pięter centralnego układu nerwowego.
Poza tym rozwijają zdolność regulacji coraz to bardziej precyzyjnych i skomplikowanych ruchów.
Szczególne znaczenie w integracji ruchowej maja nadrzędne ośrodki ruchowe znajdujące się w:
Korze mózgowej
Jądrach podkorowych
Móżdżku
Najniższy rdzeniowy poziom uczestniczy w kontroli podstawowych odruchów związanych z regulacją długości i napięcia mięśni szkieletowych (odruch zgięcia, odruch rozciągania, odwrócony odruch rozciągania).
Wyższy- mózgowy poziom kontroluje bardziej złożone czynności ruchowe sterowane automatycznie- ruchy związane z lokomocją i utrzymaniem odpowiedniej postawy ciała.
Poziom ten, przy udziale móżdżku, wpływa także na układ piramidowy w zakresie kontroli ruchów dowolnych i napięcia mięśniowego.
Najwyższy mózgowy poziom integracyjny, obejmujący głównie układ piramidowy, steruje ruchami dowolnymi bardziej precyzyjnymi, uruchamia aparat ruchowy mowy i współdziała z układem pozapiramidowym.
Obszary kory bezpośrednio związane z kontrolą wykonywania ruchów dowolnych to:
Kora somatoruchowa (pole 4)- pierwotne pole ruchowe
Okolica przedruchowa (pole 6)
Dodatkowe pole ruchowe
W obrębie pierwotnego pola ruchowego znajdują się liczne komórki piramidowe olbrzymie (Betza). Otrzymują one impulsację z innych obszarów pierwszorzędowej kory ruchowej (kory somatomotorycznej) i z pierwszorzędowej kory czuciowej (kory somatosensorycznej) po tej samej lub przeciwległej półkuli, oraz z jąder podkorowych i wzgórza. Impulsacje przekazywane na komórki Betza wpływają na przekazywanie lub hamowanie impulsów z obszarów ruchowych do innych ośrodków korowych i niższych podkorowych, pnia mózgu i rdzenia oraz dalej do mięśni szkieletowych. Impulsy te są także częściowo przekazywane do komórek pośredniczących oraz do jąder podkorowych i stąd z powrotem przez wzgórze do kory ruchowej. Takie krążenie impulsacji po zamkniętych sieciach neuronalnych między korą a ośrodkami podkorowymi modyfikuje pobudliwość ośrodków ruchowych.
Pierwotne pole ruchowe, które jest pierwszorzędową korą ruchową, obejmuje tylną część zakrętu przedśrodkowego (pole 4). Obszar ten cechuje się większą liczbą neuronów piramidowych (szczególnie neuronów piramidowych olbrzymich). W zakręcie przedśrodkowym znajdują się ośrodki dla ruchów:
|
|
Ośrodki te stanowią razem obraz homunkulusa ruchowego, tj. zniekształconego człowieka
Ku przodowi od okolicy ruchowej znajduje się okolica przedruchowa, zwana nadrzędnym polem ruchowym. Ciągnie się ona wzdłuż przedniej części zakrętu przedśrodkowego i przechodzi na tylne części zakrętów czołowych. W okolicy tej wyróżniamy ośrodek dla ruchów:
Obrotowych głowy
Gałek ocznych (po przeciwnej stronie)
W kierunku szczytu mózgu okolica przedruchowa przechodzi w pole dodatkowe. Pobudzenie tego pola wyzwala ruchy po tej samej i przeciwnej stronie ciała. Są to mało precyzyjne ruchy:
Rąk
Tułowia
Pole to współdziała z pierwotnym polem ruchowym, zapewniając utrzymanie pozycji głowy, tułowia i rąk. Współdziała też w zakresie regulacji napięcia mięśniowego i kierowaniu ruchami dowolnymi.
Pierwszorzędowa kora ruchowa i okolica przedruchowa dają razem początek ok. 40% włókien, które wchodzą w skład drogi:
Korowo- mostowej
Korowo- opuszkowej
Korowo- rdzeniowej
Pozostałe włókna biorą początek z kory somatosensorycznej oraz z obszarów przedruchowych i płatów ciemieniowo- potyliczno- skroniowych.
Przyjmuje się, że droga piramidowa rozpoczyna się w komórkach piramidowych olbrzymich (Betza), ale w pierwszorzędowej okolicy ruchowej znajduje się tylko ok. 3% komórek (34 tys.) Betza, więc droga piramidowa jest utworzona z aksonów komórek piramidowych nie tylko kory ruchowej, ale także kory czuciowej i innych okolic korowych.
Komórki Betza stanowią neurony nadrzędne kory i wysyłają włókna eferentne (odśrodkowe) do neuronów podrzędnych jąder podkorowych i ośrodków pnia mózgu i rdzenia kręgowego (motoneuronów). Odbierają one także impulsację z innych obszarów kory ruchowej po tej samej i przeciwległej stronie mózgu, z:
Nieswoistych jąder przekaźnikowych wzgórza
Ekstero- proprioreceptorów obwodowych
Te impulsacje aferentne (dośrodkowe) docierają do komórek Betza albo bezpośrednio, albo za pośrednictwem innych neuronów.
Impulsacje eferentne z tych komórek wędrują do motoneuronów nerwów czaszkowych w pniu mózgu i rogów przednich rdzenia kręgowego jako impulsacje swoiste.
W pierwotnym polu ruchowym kory mózgowej istnieją ośrodki dla poszczególnych mięśni i grup mięśniowych. Ta korowa reprezentacja ruchowa w korze posiada cechy organizacji somatotropowej (topograficznej).
Ponieważ droga piramidowa jest w głównej swojej masie (90%) skrzyżowana, to lewa kora ruchowa kontroluje ruchy dowolne prawej połowy ciała, a prawa kora ruchowa lewej połowy ciała. Wyjątkiem są mięśnie twarzy i języka.
Poszczególne ośrodki wyzwalające ruchy mięśniowe są reprezentowane na zewnętrznej powierzchni półkuli, w zakręcie przedśrodkowym, natomiast reprezentacja kończyny dolnej i narządów płciowych znajduje się już na przyśrodkowej powierzchni półkuli, w obrębie płacika przyśrodkowego. Najrozleglejszą reprezentację posiadają ośrodki dla:
Mięśni artykulacyjnych
Mięśni mimicznych twarzy
Mięśni kciuka
Mięśni palców
Mięśni dłoni
Wielkość korowej reprezentacji (projekcji) dla poszczególnych mięśni może zmieniać się w zależności od używania tych mięśni oraz ich roli i znaczenia dla całości zachowania organizmu.
Kora ruchowa jest tylko rodzajem „przejściowej stacji”, przez którą przepływają impulsacje z innych, głównie kojarzeniowych, okolic kory.
Aktywność ruchowa zachodzi wówczas, gdy ośrodki kory pierwszorzędowej są odpowiednio pobudzane przez impulsy płynące z okolic kory kojarzeniowej. Stąd impulsy są dalej przesyłane do pierwszorzędowego pola ruchowego. To ostatnie jest odpowiedzialne za prostsze czynności ruchowe obejmujące już poszczególne mięśnie.
PLANOWANIE DZIAŁANIE
JĄDRA PODSTAWY
MÓZGU
ZAMIAR KOROWE POLA KORA PRZEDRUCHOWA RUCH
KOJARZENIOWE I RUCHOWA DOWOLNY
PÓŁKULE MÓŻDŻKU ROBAK MÓŻDŻKU
Bardziej złożone wzorce aktywności ruchowej dotyczące ruchów manipulacyjnych i mówienia są reprezentowane w korze przedruchowej
DROGA KOROWO- RDZENIOWA.
Aksony komórek piramidowych kory ruchowej biegną jako włókna projekcyjne początkowo przez istotę białą półkul mózgowych (wieniec promienisty), potem wnikają do torebki wewnętrznej. W obrębie kolana znajdują się włókna przewodzące pobudzenie dla mięśni mimicznych twarzy, języka, krtani i gardła. Ku tyłowi od kolana znajdują się zgrupowania włókien zaopatrujących motoneurony dla mięśni kończyn górnych, tułowia i kończyn dolnych. Ta tylna odnoga torebki jest zaopatrywana w krew przez odgałęzienia tętnicy środkowej mózgu. Uszkodzenie tych naczyń (zakrzep, zmiany miażdżycowe) może spowodować zniszczenie jąder podkorowych i torebki wewnętrznej z następowym niedowładem połowicznym po przeciwległej stronie ciała.
Po opuszczeniu torebki wewnętrznej włókna korowo- rdzeniowe biegną dalej przez konary mózgu, nadal zachowując organizację topograficzną.
Następnie przechodzą one przez most, gdzie ulegają rozproszeniu, tworząc tu wiele pęczków i częściowo zatracając organizację topograficzną.
Przy dolnym końcu mostu włókna korowo- rdzeniowe z powrotem ulegają konsolidacji, tworząc pojedyncze zgrupowania zwane piramidą.
Na granicy opuszki i rdzenia kręgowego około 85-90% włókien każdej z piramid krzyżuje się, przechodząc na drugą stronę rdzenia, gdzie tworzy drogę korowo- rdzeniową boczną biegnącą w sznurach bocznych. Droga ta biegnie w pobliżu drogi czerwienno- rdzeniowej skrzyżowanej w pniu mózgu. Obie te drogi noszą nazwę szlaku zstępującego bocznego. Komponenta czerwienno- rdzeniowa ma charakter pobudzający i wpływa na ruchy niezależne mięśni zginaczy palców. Jest ona drogą ściśle współdziałającą ze szlakiem piramidowym.
Część (ok. 10- 15%) włókien drogi piramidowej pozostaje nieskrzyżowanych i biegnie dalej w sznurach przednich rdzenia jako droga korowo- rdzeniowa przednia. Włókna tej drogi krzyżują się częściowo dopiero przed swoim zakończeniem, głównie w segmentach szyjnych i piersiowych rdzenia. Tam znajdują się α-motoneurony zaopatrujące mięśnie przykręgosłupowe i mięśnie proksymalnych odcinków kończyn górnych i dolnych.
Większość (60- 65%) włókien drogi korowo- rdzeniowej bocznej (skrzyżowanej) kończy się na wysokości rdzenia szyjnego (zgrubienie szyjne), niewielka ich liczba (10%) w segmentach piersiowych, a pozostałe w segmentach lędźwiowych (zgrubienie lędźwiowe).
Impulsację przewodzoną droga piramidową do motoneuronów pnia mózgu i rdzenia kręgowego można podzielić na:
Swoistą
Nieswoistą
Impulsacja swoista obejmuje włókna drogi piramidowej, pochodzące z komórek piramidowych olbrzymich (Betza), z których każda zaopatruje kilka motoneuronów podrzędnych jąder ruchowych mięśni czaszkowych pnia mózgu lub nerwów rdzeniowych.
Impulsacja nieswoista dotyczy włókien ruchowych pochodzących z wielu różnych obszarów korowych i zaopatrujących nieswoiście liczne neurony układu siatkowatego pnia mózgu. Impulsacje w tym układzie mają charakter bardziej „rozlany” i warunkują pobudzenie ośrodków znajdujących się w obrębie tego układu (np. ośrodka oddechowego) oraz wywołują pobudzenie kory mózgowej poprzez aktywujący układ siatkowaty.
Włókna drogi korowo- rdzeniowej bocznej kontrolują czynności motoryczne kończyn po tej samej stronie ciała i to głównie w obrębie ich dystalnych części.
W związku ze skrzyżowaniem tej drogi kora ruchowa po stronie lewej kontroluje czynności motoryczne kończyn prawej ręki i prawej nogi, posiadając nieznaczny tylko wpływ na czynności ruchowe kończyn po stronie lewej.
Droga zaś korowo- rdzeniowa przednia kończy się w odcinkach rdzenia poza obrębem jego zgrubień, krzyżując się dopiero przed swoim zakończeniem w rogach przednich. Droga ta zaopatruje głównie motoneurony mięśni tułowia, szyi i proksymalnych mięśni kończyn.
Niewielka liczba włókien (ok.1%) drogi korowo- rdzeniowej biegnie w sznurach bocznych i nie krzyżuje się przed utworzeniem synapsy z motoneuronami mięśni przykręgosłupowych i proksymalnych części kończyn.
Należy pamiętać, że ok. 20-30% włókien korowo- rdzeniowych rozpoczyna się w korze położonej ku tyłowi od bruzdy środkowej. Większość tych włókien biegnie do rdzenia w drodze korowo rdzeniowej bocznej i kończy się synapsami na neuronach głównie rogów tylnych rdzenia.
Ta „sensoryczna” komponenta drogi piramidowej służy do kontroli impulsacji czuciowych napływających do rogów tylnych z receptorów mięśniowych. W ten sposób kora mózgowa kontroluje impulsację z proprioreceptorów mięśniowych wpływając pośrednio na odruchy własne mięśni.
Z punktu widzenia klinicznego drogę dla ruchów dowolnych można podzielić na dwie główne składowe:
Górny neuron motoryczny
Dolny neuron motoryczny
Uszkodzenia górnego neuronu motorycznego objawiają się w obwodowych odcinkach kończyny górnej (ręka i palce) i maja charakter niedowładu spastycznego. Przy uszkodzeniach górnego neuronu motorycznego zaniki mięśniowe są słabo zaznaczone lub występują później.
Objawy uszkodzenia dolnego neuronu motorycznego zależą od miejsca uszkodzenia, a więc czy dotyczy ono rogów przednich, korzeni przednich, czy też określonego nerwu ruchowego. Typowym objawem uszkodzenia jest niedowład wiotki (spadek napięcia mięśniowego) i szybko postępujący zanik mięśni.
Układ pozapiramidowy.
Impulsacja układu ruchowego podkorowego bezpośrednio wysyłana jest przez jądra kresomózgowia, ale bezpośrednio pochodzi z kory mózgu (neurony korowe wysyłają wypustki do jąder kresomózgowia).
Do układu ruchowego podkorowego należą:
jądro ogoniaste
jądro soczewkowate (skorupa i gałka blada)
jądro brzuszno-boczne wzgórza
jądro niskowzgórzowe
istota czarna i jądro czerwienne.
Funkcją układu ruchowego podkorowego jest współdziałanie w wyzwalaniu ruchów dowolnych i regulowanie napięcia mięśni poprzecznie prążkowanych. Funkcje te układ ruchowy podkorowy spełnia dzięki występowaniu sprzężeń zwrotnych między korą mózgu, a jądrami kresomózgowia, oraz dzięki połączeniom o typie sprzężeń zwrotnych między strukturami podkorowymi. Tak więc impulsacja biegnąca z kory mózgu powraca do niej z powrotem przez szereg neuronów tworzących łańcuchy neuronów.
Choroby związane z układem pozapiramidowym.
Objawy pląsawicy - nadmierna ruchliwość połączona z ruchami mimowolnymi
Objawy choroby Parkinsona - zmniejszona ruchliwość, sztywność, drżenie mięśniowe. W chorobie tej występuje zaburzenie przewodnictwa dopaminergicznego (hipodopaminergia).
Drżenie mięśniowe
W obrębie śródmózgowia znajdują się dwa ośrodki: jeden wyzwalający drżenie mięśniowe i drugi, hamujący je. W warunkach fizjologicznych ośrodek hamujący stale odbiera impulsację z podwzgórza i w ten sposób utrzymuje się jego stała przewaga nad ośrodkiem wyzwalającym drżenie. Obniżenie temp. krwi lub drażnienie podwzgórza przez toksyny bakteryjne, powoduje zablokowanie czynności ośrodka hamującego. Ośrodek pobudzający uzyskuje przewagę i wyzwala drżenie mięśiowe.
Móżdżek. Funkcje fizjologiczne móżdżku.
Twór siatkowaty. Funkcje fizjologiczne tworu siatkowatego
Układ siatkowaty pnia mózgu stanowi najważniejszy układ kontrolujący i integrujący centralnego układu nerwowego.
W jego obrębie mieszczą się życiowo ważne ośrodki:
Ośrodek oddechowy
Ośrodek sercowy
Ośrodek naczynioruchowy
Ponadto spełnia on szereg innych ważnych funkcji:
Reguluje temperaturę ciała
Wpływa na neuroendokrynne czynności podwzgórza
Ma znaczenie w procesie czuwania i snu
Wpływa na funkcje motoryczne i aktywność ruchową mięśni
Jako układ nieswoisty uczestniczy w przewodzeniu części impulsów czuciowych do kory. Zapewnia jej więc stan wzbudzenia i możliwość odbioru wrażeń pod wpływem impulsacji czuciowych przekazywanych swoistymi drogami czuciowymi
Oddziałuje na impulsacje motoryczne w czasie ich przewodzenia drogami piramidowymi i pozapiramidowymi z kory i jąder podkorowych do rdzenia
Wpływa na podwzgórze i układ limbiczny, oddziałując na zachowanie emocjonalne i układ immunologiczny organizmu.
Podłożem anatomicznym układu siatkowatego jest twór siatkowaty, ciągnący się przez cały pień mózgu - od rdzenia kręgowego aż do przedniej części śródmózgowia.
W pniu mózgu twór siatkowaty wypełnia przestrzeń między jądrami nerwów czaszkowych, drogami wstępującymi i zstępującymi .
Neurony układu siatkowego nie wykazują jakiegoś charakterystycznego układu morfologicznego, ale tworzą rodzaj rozległej sieci neuronalnej. W sieci tej poszczególne elementy (neurony) mogą być uczynniane przez wiele neuronów sąsiednich.
Maja też one zdolność wytwarzania i uwalniania na swoich zakończeniach różnych mediatorów, tj. acetylocholina, NA, serotonina, dopamina, GABA.
Układ siatkowaty jest układem nieswoistym - pobudzenia jednego neutronu mogą przenieść się na wiele neuronów układu i odwrotnie - pobudzenia z wielu różnych strukturCON mogą aktywować ściśle określone obszary US.
Wypustki neutronów US krzyżują się i biegną w różnych kierunkach, tworząc gęstą sieć połączeń.
Niektóre neurony tego tworu posiadają długi akson, rozdzielający się na dwie wypustki:
- wstępującą
- zstępującą
Wypustki te tworzą podłużne pęczki, które łączą różne poziomy układu siatkowatego z wyższymi (kora mózgowa, uklad limbiczny, wzgórze) lub niższymi (rdzeń kręgowy) piętrami CUN.
W obrębie US można wyróżnić skupiska neutronów (jądra) o odrębnych właściwościach fizjologicznych:
- jądro siatkowate mostu zawierają neurony serotoninorgiczne,
- jądro szwu odgrywają ważną rolę w powstawaniu snu NREM,
- jadro wielkokomórkowe - neurony uwalniające acetylocholinę,
- jądro środkowe opuszki.
Do US zalicza się także struktury o podobnych właściwościach funkcjonalnych:
Istota szara okołowodociągowa
jadro miejsca sinawego mostu
okolice pokrywy.
Twór siatkowaty otrzymuje liczne połączenia z obydwóch półkul mózgowych i różnych okolic CUN. Odbiera z nich część impulsacji czuciowej i ruchowej i przekazuje je na wieloneuronalną drogę nieswoistą.
Na podstawie badań morfologicznych i neurofizjologicznych wyróżnia się w CUN dwie oddzielne części:
wstępujący układ siadkowaty
zstępujący układ siatkowaty
WSTĘPUJACY UKŁAD SIATKOWATY
W obrębie wstępującego układu siatkowatego wyróżnia się
rozlany hamujący układ wzgórzowy
aktywujący układ śródmózgowia
ad a) rozlany hamujący układ wzgórzowy - najwyższe piętro układu siatkowatego.
Obejmuje jądra nieswoiste wzgórza:
jądra śródblaszkowe
jądra przyśrodkowe
jądra brzuszne:
przednio - boczne
przednio - przyśrodkowe
jądra siatkowate
Te nieswoiste jądra wzgórza utrzymują dwustronne połączenia z całą korą mózgową. Włókna pochodzące z tych jąder liczą się w warstwach powierzchniowych kory i dlatego maja wpływ na czynności bioelektryczne kory mózgowej. Włóknami wstępującymi napływają impulsacje z układu siatkowatego do całej kory, niezależnie od impulsacji przekazywanych za pośrednictwem wzgórzowych stacji przełącznikowych i układów swoistych, które odbierane są tylko w określonych polach kory czuciowej.
Drażniąc bodźcami elektrycznymi o niskiej częstotliwości jądra nieswoiste wzgórza, można wywołać tzw. odpowiedź rekrutacyjną kory czyli:
zmniejszenie częstotliwości
zwiększenie amplitudy potencjałów korowych
Te zmiany aktywności bioelektrycznej obejmują całą korę mózgową. Neurony układu siatkowatego skupione we wzgórzu synchronizują, więc czynność bioelektryczną kory i wykazują aktywność antagonistyczną w stosunku do neuronów układu siatkowatego pnia mózgu (zwłaszcza układu aktywującego śródmózgowia).
Szczególną rolę przypisuje się jądrom siatkowatym wzgórza w procesie percepcji. Tworzą one tzw. wzgórzowy układ bramkujący - wybiórczo przepuszczają impulsację biegnącą do kory, przewodzoną przez jądra swoiste wzgórza. W ten sposób jądra te eliminują nadmiar informacji wysyłanej przez receptory obwodowe i niższe ośrodki czuciowe.
ad b) aktywujący układ siatkowaty śródmózgowia (RAS)
Układ ten odbiera impulsacje ze wszystkich receptorów całego organizmu w czasie, gdy są one przekazywane szybkimi drogami swoistymi do kory czuciowej mózgu. Pobudzenia te z układu siatkowatego są dalej przewodzone powoli do rozległych obszarów kory i ośrodków podkorowych. Tam wytwarzają stan gotowości czynnościowej, czyli wzbudzenia. Wzbudzenie to jest niezbędne do prawidłowego funkcjonowania okolic czuciowych, ruchowych i kojarzeniowych kory, a także ośrodków podkorowych kierujących zachowaniem popędowo - emocjonalnym. Wzbudzeniu kory towarzyszy zmiana aktywności bioelektrycznej kory:
- spadek amplitudy
- wzrost częstotliwości potencjałów korowych, czyli desynchronizacja.
Tak, więc w czasie, gdy impulsacje z receptorów napływają do swoistych ośrodków czuciowych kory, wywołując w niej wrażenia zmysłowe, część tych impulsacji jest przekazywana na wolno przewodzące wieloneuronalne drogi nieswoiste wstępujące (układ pozawstęgowy).
Stan wzbudzenia kory wywołany pobudzeniem układu siatkowatego warunkuje przytomność i świadomość, bez których nie jest możliwe odbieranie i percepcja wrażeń zmysłowych.
Przewodzenie impulsów w drogach nieswoistych można zablokować środkami narkotycznymi lub przez zniszczenie aktywizującego układu siatkowatego. To samo zjawisko występuje podczas snu, kiedy to zachowane jest przewodzenie impulsów w drogach swoistych, a zahamowane w drogach nieswoistych. Zanika wtedy świadomość i jednocześnie ustaje odbieranie wrażeń zmysłowych. Trwałe uszkodzenie RAS prowadzi do nieodwracalnej utraty przytomności i śpiączki.
Tak, więc RAS odgrywa istotną rolę w utrzymaniu stanu czuwania i wzbudzenia kory.
Układ ten dysponuje dwustronnymi połączeniami z korą mózgową, z których jedne są bezpośrednie - z pominięciem wzgórza, a drugie biegną przez układ siatkowaty wzgórza.
W sumie czynności układu siatkowatego wstępującego związane są głównie z procesami:
- Czucia
- Percepcji
- Czuwania
- Zachowania świadomości
ZSTĘPUJĄCY UKŁAD SIATKOWATY
Zstępujący układ siatkowaty:
Koordynuje ruchy
Kontroluje czynności odruchowe rdzenia kręgowego
Modyfikuje efekty notoryczne kory mózgowej
Reguluje czynności życiowo ważnych ośrodków autonomicznych pnia mózgu zwł. Ośrodków:
Oddechowego
Regulujących krążenie)
Działanie układu zstępującego może mieć wpływ hamujący lub torujący (ułatwiający)
Na motoneurony rdzeniowe:
Zstępujący układ hamujący
Zstępujący układ pobudzający
Jedna i druga komponenta ma połączenia z:
Korą mózgową (drogi korowo-siatkowe)
Jądrami podkorowymi
Móżdżkiem
Rdzeniem kręgowym (drogi siatkowato-rdzeniowe;
Nakrywkowo-rdzeniowe)
zstępujący układ hamujący:
Bierze początek w neuronach skupionych w brzuszno-przyśrodkowej części tworu siatkowatego rdzenia przedłużonego
Hamuje ośrodki ruchowe rdzenia dla mięśni prostowników, a pobudza ośrodki ruchowe dla mięśni zginaczy
Podrażnienie zstępującej drogi hamującej:
Obniża lub znosi odruchy rdzeniowe
Obniża napięcie mięśniowe
b)Zstępujący układ pobudzający
Rozpoczyna się w grzbietowo-bocznej części tworu siatkowatego mostu
Pobudza ośrodki ruchowe rdzenie dla mięśni prostowników, a hamuje ośrodki ruchowe dla mięśni zginaczy
Drażnienie zstępującej drogi pobudzającej powoduje:
Pojawienie się odruchów rdzeniowych
Wzrost napięcia mięśniowego
Układ limbiczny. Funkcje fizjologiczne układu limbicznego.
Sen: teorie snu, elektrofizjologia snu, fizjologiczne znaczenie snu.
Odruchy warunkowe.
Fizjologiczna czynność kory mózgowej: kontrola ruchu, lateralizacja, fizjologia mowy,
korowe pola czuciowe, korowe pola asocjacyjne.
UKŁAD POKARMOWY
Funkcje żołądka.
Funkcje:
gromadzi i przechowuje spożywane pokarmy
trawi pokarmy
wyjaławia pokarmy
Gromadzenie pokarmów w żołądku
pokarmy płynne wzdłuż krzywizny mniejszej do części odźwiernikowej
pokarmy stałe początkowo są w trzonie żołądka, a następnie (gdy jest ich coraz więcej) wypełniają dno, kolejne porcje zajmują część środkową rozpychając na boki pokarm, który już był w żołądku (pokarm, który był pierwszy w żołądku styka się z błoną, ten który przyszedł później znajduje się w części środkowej żołądka).
Trawienie pokarmów w żołądku
na początku pokarmy z cz. Środkowej są trawione alfa-amylazą ślinową - zmieszanie treści pokarmowej - właściwe trawienie
sok żołądkowy (patrz pytanie SKŁAD I ROLA SOKÓW)
skurcze błony mięśniowej żołądka (patrz pytanie MOTORYKA PRZEWODU POKARMOWEGO)
Budowa żołądka:
W obrazie radiologicznym żołądek ma kształt: hipertoniczny, ortotoniczny, hipotoniczny i atoniczny
Zwieracz odźwiernika jest oddzielony od warstwy okrężnej błony mięśniowej dwunastnicy przegrodą łączntkankową
Unerwienie:
PS+ z nn. X; włókna pozazwojowe mają charakter cholinergiczny, peptydergiczny (VI, SP, GRP, somatostatyna) lub nitroergiczny; działają pobudzająco na dalsze części żołądka i hamująco (włókna peptydergiczne, puryergiczne, nitroergiczne) na cz. początkową
S+ z nn. Rdzeniowych piersiowych Th6-Th10; włókna pozazwojowe mają charakter adrenergiczny; hamują motorykę żołądka
Bariera śluzowa żołądka:
Bariera śluzówkowa żołądka oznacza zdolność żołądka do zapobiegania szybkiemu przenikaniu jonów H+ z jego światła do krwi, a Na+ w kierunku przeciwnym
Uszkadzana przez: HCl o wysokim stężeniu, naturalne detergenty, alkohol powyżej 10% i aspirynę
Gdy nie ma bariery śluzówkowej HCl:
Pobudza motorykę żołądka przez zadrażnienie splotów śródściennych
Pobudza wydzielanie pepsynogenu i jego aktywację w samej błonie śluzowej
Pobudza komórki tuczne do wydzielania histaminy, która pobudza uwalnianie HCl, zwiększa przepuszczalność naczyń włosowatych i przesączanie składników osocza, a to powoduje obrzęk błony śluzowej żołądka
Przenikanie białek osocza do światła żołądka
Powstanie powierzchownych wybroczynów śluzówkowych
błona śluzowa ulega adaptacji na działanie czynników uszkadzających
uszkodzeniom zapobiegają PGE2 i PGI2, małe stężenie kwasów żółciowych lub alkoholu- wywołują „cytoprotekcję adaptacyjną”
Motoryka przewodu pokarmowego.
przewód pokarmowy jest zbudowany z mm. poprzecznie prążkowanych (gardło, 1/3 górna przełyku, zwieracz zewnętrzny odbytu) i z mm. gładkich (pozostałe odcinki)
podstawowym mechanizmem kontrolującym skurcze są wahania potencjału błonowego zwane falami wolnymi = podstawowy rytm elektryczny BER
źródło BER: komórki mięśniowe o niestałym potencjale błonowym (komórki rozrusznikowe)
częstość BER: 3 cykle/min w żołądku, 12/min w dwunastnicy, 8/min w jelicie cienkim
prędkość rozprzestrzeniania: w żołądku 1cm/s, w jelicie ok. 20 cm/s
BER nie wywołuje skurczów lecz wyznacza częstość potencjałów czynnościowych
Siła skurczu zależy od amplitudy i liczby potencjałów
Czynniki wywołujące potencjał czynnościowy:
mechaniczne rozciąganie
transmitery z autonomicznych nn. zewnętrznych i z układu nerwowego jelitowego
hormony żołądkowo-jelitowe: gastryna, CCK, motylina
lokalne czynniki humoralne: serotonina, histamina
Mm. gładkie wykazują dwa rodzaje skurczów:
toniczne np. zwieracze, długotrwały wzrost napięcia, trwały przykurcz
rytmiczne (fazowe) w obwodowej części przełyku, żołądku, jelicie cienkim; szybkie skurcze i rozkurcze
Skurcze komórek mięśniowych gładkich są inicjowane przez potencjały czynnościowe i nagłe zwiększenie jonów Ca2+ w cytoplazmie:
Ca2+ + kalmodulina powodują rozkład ATP - fosforylacja meromiozyny ciężkiej - połączenie z aktyną - skurcz
DAG pobudza fosfolipazę C - fosforylacja miozyny ciężkiej
Żucie
Cykl żucia składa się z następujących faz:
faza przygotowawcza
faza zetknięcia szczęk z kęsem pokarmowym
faza miażdżenia pokarmu
faza zetknięcia zębów obu szczęk
faza rozcierania pokarmu między zębami
końcowego centralnego zamknięcia szczęk
Żucie jest kontrolowane odruchowo, ośrodek żucia znajduje się w tworze siatkowatym
Receptory odruchu żucia znajdują się w błonie śluzowej jamy ustnej i w mięśniach:
droga dośrodkowa n. V, IX, X
droga odśrodkowa: nn. V, VII, IX, XII
W jamie ustnej i żołądku (przed wydzieleniem HCl) ulega strawieniu 40 - 60% skrobi z pokarmu
Połykanie
Fazy:
ustna - charakter dowolny
gardłowa - charakter odruchowy
przełykowa - charakter odruchowy
Faza ustna
przesunięcie kęsa z jamy ustnej do gardła, zamknięcie wszystkich trzech dróg odchodzących od gardła
trwa 0,3 sekundy
pod kontrolą okolic ruchowych kory mózgowej
Faza gardłowa:
pokarm przesuwa się przez gardło dzięki skurczom okrężnych mm. gardła (zwieraczy górnych, środkowych, dolnych) i równoczesnemu rozluźnieniu zwieracza gardłowo-przełykowego
trwa ok. 1,5 s
krtań przesuwa się ku dołowi - drogi oddechowe są udrożnione
Faza przełykowa:
impulsy aferentne biegną w nn. V, IX, X do ośrodka połykania
impulsy eferentne przez nn. V, VII, IX, X i XII
Funkcjonalny podział przełyku:
cz. górna = UES (poniżej górnego zwieracza przełyku), unerwiona przez gałązki somatyczne n. X
cz. środkowa - trzon przełyku; unerwiona przez gałązki autonomiczne n. X
cz. dolna = LES (zwieracz przełyku); unerwiona przez gałązki autonomiczne n. X
Ciśnienie:
w stanie spoczynku trzon: 0,5 - 1,0 kPa poniżej ciśnienia atmosferycznego; dolny zwieracz przełyku: 1-2 kPa powyżej ciśnienia atmosferycznego
połykanie: chwilowy spadek ciśnienia w górnym zwieraczu przełyku -- przejście pokarmu - chwilowy wzrost i zmniejszenie do wartości spoczynkowej
rozpoczyna się fala perystaltyczna wywołująca charakterystyczne zmiany w ciśnieniu trzonu przełyku, zwane zespołem połykania; fala perystaltyczna przesuwa się z prędkością 2-4 cm/s
spadek ciśnienia w dolnym zwieraczu utrzymuje się przez 5-10 s po przejściu fali perystaltycznej wzrasta do 2-3 kPa, po kolejnych 5-10 s wraca do wartości spoczynkowej - zapobiega to refluksowi treści pokarmowej do przełyku
Perystaltyka przełyku:
pierwotna - kontynuacja fali perystaltycznej gardła, rozpoczyna się poniżej górnego zwieracza przełyku
wtórna - rozpoczyna się na dowolnej wysokości przełyku i nie jest poprzedzana skurczami w gardle, jest następstwem zatrzymania się resztek pokarmowych w przełyku po przejściu perystaltyki pierwotnej
Płyn do żołądka dociera po ok. 1 s, natomiast kęs po 5 s
Refluks występuje gdy jest zwiększone ciśnienie śródbrzuszne, po spożyciu zbyt obfitych posiłków, u ludzi otyłych, w czasie ciąży, w zaburzeniach motorycznych przełyku
Motoryka żołądka
aktywność skurczowa żołądka:
cz. początkowa to rezerwuar dla spożywanych płynów i pokarmów (1,5 - 6 l)
cz. dalsza - mieszanie pokarmów z sokiem żołądkowym i przesuwanie do dwunastnicy
stopniowe rozluźnienie części początkowej jest wywołane odruchem wago-wagalnym (z gałązkami hamującymi n.X), neurotransmitery: VIP i NO
wyraźne skurcze rozpoczynają się w ½ długości trzonu od strefy „rozrusznikowej” żołądka i przesuwają się w postaci fali z szybkością 1 cm/s
fale skurczu żołądka:
fala I i II - rytmiczne okrężne skurcze 2-4/min; czas trwania 2-20 s
fala III - skurcze toniczne, obejmują szerszy segment żołądka; czas trwania ok. 1 min
pokarm jest wielokrotnie przesuwany tam (propulsja) i z powrotem (retropulsja), ulega dokładnemu rozdrobnieniu i wymieszaniu z sokiem żołądkowym
aktywność elektryczna żołądka:
typy aktywności elektrycznej żołądka: BER i potencjały czynnościowe
BER zaczyna się w okolicy krzywizny większej (okolica „rozrusznikowa” żołądka)
Potencjały czynnościowe powstają pod wpływem rozciągania żołądka, pobudzenia ukł. PS+, działania neuromediatorów np. ACh lub hormonów żołądkowo-jeltowych np. gastryny, motyliny
Opróżnianie żołądka
najszybciej płyny izotoniczne > hipo- i hipertoniczne
tłuszcze i węglowodany zwalniają opróżnianie
z pokarmów stałych najszybciej opróżnia się żołądek z białek
„jednostka motoryczna”= żołądek, zwieracz odźwiernika, dwunastnica
w dwunastnicy znajdują się receptory wrażliwe na działanie: H+, tłuszczu, roztworów hiperosmolarnych
mechanizmy odpowiedzialne za zwolnienie opróżniania żołądka pod wpływem H+, tłuszczu, roztworów hiperosmolarnych obejmują:
odruchy nerwowe (nn. Autonomiczne - X)
odruchy śródścienne (ośrodki w splotach śródściennych)
hormony żołądkowo-jelitowe:
CCK - hamuje opróżnianie; jest uwalniana przez produkty hydrolizy tłuszczów, białek; receptory CCKA są blokowane przez loksiglumid
Gastryna, glukagon i GIP hamują opróżnianie, ale tylko w dawkach farmakologicznych
Motoryka jelita cienkiego
unerwienie:
zewnętrzne - nn. autonomiczne - przedzwojowe gałązki n. X i nn. S+, pozazwojowe - włókna PS+ i S+ ze splotu trzewnego i krezkowego górnego
wewnętrzne - sploty śródścienne (ich neurony tworzą układ nerwowy jelitowy = ENS, zwany „mózgiem jelitowym”)
włókna cholinergiczne, adrenergiczne, peptydergiczne, purynergiczne i nitroergiczne uwalniają: VIP, somatostatynę, opioidy, substancję P, ATP, NO
Aktywność skurczowa jelita cienkiego
rodzaje skurczów:
odcinkowe = segmentowe = niepropulsywne; mieszają dokładnie miazgę pokarmową z sokami trawiennymi ułatwiając proces trawienia i wchłaniania
perystaltyczne = robaczkowe = propulsywne; powstają na zasadzie miejscowego odruchu obejmującego śródścienne sploty jelitowe
prawo jelit Bayliss'a i Starlinga: „pobudzenie jelita w jakimś punkcie wywołuje skurcz powyżej i rozkurcz poniżej”
prędkość fali perystaltycznej: 2 cm/s niekiedy do 10-20 cm/s
w czasie fali p ciśnienie podnosi się do 0,5 - 1,5 kPa przez 10 s - 8 min. (fale typu III) [patrz żołądek]
ruchy błony śluzowej mogą być skojarzone ze skurczami kosmków jelitowych zachodzących pod wpływem gastryny, CCK i wilikininy
Aktywność elektryczna jelita cienkiego
opuszka dwunastnicy wykazuje najwyższą częstość fal BER i stanowi strefę „rozrusznikową” dla pozostałej części dwunastnicy i jelita cienkiego
błona mięśniowa jelita wytwarza także potencjały czynnościowe, pojawiające się w fazie depolaryzacji cyklu BER i nakładające się na nie jako nagle zmiany potencjału błonowego
MMC - wędrujący kompleks mioelektryczny występujący w okresie międzytrawiennym, faza III odpowiada fali perystaltycznej
Występuje aktywność pokarmowa - po jedzeniu zanikają MMC i pojawiają się nieregularne potencjały i skurcze jelitowe wywołane gastryną i CCK
Zwieracz krętniczo-kątniczy
Podczas skurczu panuje ciśnienie 2 kPa
Zapobiega zarzucania zawartości jelita grubego do krętego
Odruch żołądkowo - krętniczy powoduje rozkurcz tego zwieracza
Rozciąganie jelita grubego (kątnicy) powoduje skurcz zwieracza krętniczo - kątniczego
Gastryna rozluźnia zwieracz
Motoryka jelita grubego
Unerwienie:
zewnętrzne - nn. autonomiczne, przewodzą odruchy żołądkowo-okrężniczy i jelitowo-jelitowy
sploty śródścienne - neurony ruchowe (mm. gładkie) i czuciowe
nn. X. - okrężnica wstępująca + prawa ½ okrężnicy poprzecznej, resztę nn. miedniczne
nn. S+ początkowego odcinka jelita grubego ze zwoju krezkowego górnego, a końcowego odcinka ze splotu podbrzusznego dolnego
aktywność skurczowa i elektryczna jelita grubego
rodzaje skurczów:
odcinkowe - jednocześnie w wielu różnych odcinkach okrężnicy, trwają 2 min., nie przesuwają się wzdłuż jelita
propulsywne - obejmują krótkie segmenty jelita (jelito ślepe i okrężnica wstępująca)
perystaltyczne - brak „rozluźnienia przyjęcia”, prędkość fali 20 cm/min
masowe - kilka razy dziennie, występuje nagły zanik wypukleń okrężnicy poprzecznej i zstępującej, obejmują cały segment o długości 20 - 30 cm, przesuwanie zwartości jelita w ciągu 30 s nasilają się po spożyciu pokarmu i w godzinach rannych (odruch żołądkowo-okrężniczy)
po jedzeniu w wyniku odruchów żołądkowo-kątniczego, żołądkowo-okrężniczego lub dwunastniczo-okrężniczego oraz pod wpływem homonów gastryny, CCK i motyliny wzrasta motoryka, występują skurcze wielosegmentowe perystaltyczne, a na koniec masowe
błona mięśniowa okrężnicy wykazuje BER i potencjały czynnościowe
BER na początku okrężnicy: 2-3 cykle/min; w końcowej części jelita grubego: 6-9 cykli/min
Potencjały czynnościowe występują na skutek rozciągania jelita, pobudzenia układ PS+ oraz hormonów: gastryny, CCK, motyliny
Gastryna, CCK, motylina i ACh pobudzają skurcze, natomiast sekretyna i NA hamują
Motoryczne mechanizmy odbytniczo - okrężnicze
Uczucie „parcia na stolec” pod wpływem podrażnienia mechanoreceptorów ściany
Podczas aktu defekacji hamowany jest ośrodek oddawania kału w rdzeniu krzyżowym, prowadzi to do skurczu zwieraczy odbytu i rozkurczu odbytnicy
Odruch defekacyjny składa się z:
odruchu śródściennego - wzrost skurczów perystaltycznych okrężnicy zstępującej, esowatej i odbytnicy
odruchu rdzeniowego - droga dośrodkowa to nn. miedniczne; zwiększenie perystaltyki i ruchów masowych
podczas defekacji występuje dodatkowo odruchowy skurcz mm. tłoczni brzusznej, przepony i przepony miednicy
Trawienie i wchłanianie w przewodzie pokarmowym węglowodanów, tłuszczy i białek.
Podstawy strukturalne wchłaniania:
Fałdy okrężne powodują 3-krotny wzrost powierzchni błony śluzowej, kosmki - 10-krotny, mikrokosmki - 20-krotny; całkowita powierzchnia jelita wynosi 300 m2
Brzeżek szczoteczkowy odgrywa ważną rolę w procesach trawienia przyściennego (kontaktowego)
Procesy transportu jelitowego:
Wyróżniamy transport bierny i czynny:
bierna dyfuzja odbywająca się zgodnie z gradientem chemicznym i elektrycznym -przechodzą substancje drobnocząsteczkowe wraz z wodą i wielkocząsteczkowe rozpuszczalne w lipidach (kwasy tłuszczowe, monoacyloglicerole, cholesteroli, wit. A,D,E,K)
w jelicie czczym jony Na+ przechodzą na drodze transportu czynnego i biernego, natomiast w jelicie krętym tylko na drodze transportu czynnego
dyfuzja ułatwiona
wtórny transport aktywny
pinocytoza - u noworodków immunoglobuliny i przeciwciała z mleka matki
Trawienie i wchłanianie węglowodanów
W diecie przeciętnie znajduje się ok. 300-500 g czyli ok. 6000 kJ co stanowi 60-70 % pokrycia kalorycznego
Głównym węglowodanem jest skrobia (20%-amyloza i 80% - amylopektyna) zbudowana z reszt glukozy; inne to sacharoza, laktoza, fruktoza, pentozy
Trawienie następuje pod wpływem ptialiny (pH=7) w jamie ustnej aż do pH=4, jej brak nie zakłóca trawienia skrobi
W jamie ustnej i żołądku ulega strawieniu 30-40% skrobi
W jelitach trawienie następuje pod wpływem α-amylazy trzustkowej i na powierzchni brzeżka szczoteczkowego
Trawienie oligosacharydów pod wpływem maltazy, izomaltazy, sacharazy i laktazy (w warstwie glikokaliksu)
W przeciętnej diecie 60% to skrobia, 30% sacharoza i 10% to laktoza; po strawieniu powstają: 80% to glukoza, 1% to fruktoza i 5% to galaktoza
Na wiązanie 1,4β działają tylko bakterie jelitowe
Niestrawione węglowodany zwiększają osmolarność powodując biegunki
Niestrawność lakozy - nietolerancja mleka i jego przetworów; badanie: doustne podanie laktozy i gdy nie ma wzrostu stężenia glukozy świadczy to o braku laktazy
Wchłanianie glukozy, galaktozy i fruktozy następuje w dwunastnicy i górnym odcinku jelita czczego pod wpływem transporterów i na drodze dyfuzji ułatwionej
glukoza i galaktoza na drodze transportu czynnego, dzięki transporterom SGLT1 i SGLT2 (przenoszą one cukry o 6 atomach węgla, z pierścieniem piranozowym, grupą aldehydową przy pierwszym węglu i grupą hydroksylową przy węglu drugim, potrzebne jony Na+)
z enterocytów glukoza jest przenoszona przez transporter GLUT2 do płynu zewnątrzkomórkowego i krwi (zgodnie z gradientem),a sód przez pompę Na-K
wchłanianie glukozy następuje nawet przeciwko gradientowi stężeń (transport aktywny wspomagany)
fruktoza - przez transporter GLUT5 (transport ułatwiony)
Regulacja wchłaniania:
ukł. PS+ wzmaga wchłanianie przez zwiększenie perystaltyki jelit, wchłanianie pobudza także insulina(ale nie w jelitach) i glikokortykosteroidy
ukł. S+ hamuje wchłanianie przez zmniejszenie perystaltyki jelit i zmniejszenie przepływu trzewnego krwi, wchłanianie hamuje także gastryna, sekretyna i prostaglandyny
Pobudzajaco na wchłanianie |
Hamujaco na wchłanianie |
PS+ Insulina (nie w jelitach) Glikokortykosteroidy |
S+ Gastryna Sekretyna Prostaglanyny |
Trawienie i wchłanianie białek
dzienne zapotrzebowanie na białko wynosi 0,5-0,75 g/kg masy ciała
w okresie wzrostu, ciąży i rekonwalescencji 4g/kg mc
Trawienie: proteazy żołądkowe, trzustkowe, jelitowe; proces kończy się na początku jelita czczego
trawieniu żołądkowemu nie ulegają protaminy i keratyna
kwaśny sok żołądkowy powoduje denaturację i pęcznienie białek ciężkostrawnych jak skleroproteina, kolagen, elastyna, keratyna
proteazy trzustkowe są białkami i trawi się nawzajem
produkty hydrolizy białka są wchłaniane w jelicie jako wolne aminokwasy oraz składowe małych peptydów (di- i tripeptydów)
transportery dla wolnych aminokwasów i oligopeptydów są różne
Wchłanianie aminokwasów i oligopeptydów do enterocytów zachodzi na drodze transportu czynnego przeciwko gradientowi chemicznemu, ulegają nagromadzeniu w enterocytach, następnie na drodze dyfuzji ułatwionej przechodzą do płynu zewnątrzkomórkowego i do krwi
AA muszą być L-izomerami
Transportery w enterocytach:
Dla AA obojętnych (Met, Ile, Val, Phe, Trp, Tre) wymagana obecnośc Na+
Dla AA zasadowych (Lys, Arg, ornityna, cystyna) częściowo hamowane przez AA obojętne
Dla Pro, hydroksyproliny, pochodnych metylowych glicyny, wymagana obecność Na+
Dla AA kwaśnych (Glu, Asp), niezależny od Na+
Dla di- i tripeptydów
Trawienie i wchłanianie białka rzadko ulega zaburzeniu
10 % białka jest wydalane z kałem, a w przypadku braku enzymów trzustkowych 85%
zapalenie trzustki lub zwłóknienie torbielowate trzustki powoduje zmniejszenie ilości enzymów
przy braku trypsyny inne proenzymy nie ulegają aktywacji
cystynutria - zaburzenie wchłaniania jelitowego lub zwrotnej resorpcji z kanalików nerkowych cystyny, Lys, Arg i ornityny
Trawienie i wchłanianie tłuszczów
w przeciętnej diecie występuje 15-150 g/dzień czyli 10-50% dziennego zapotrzebowania energetycznego (ale prawidłowo nie powinien przekraczać 25-30%)
główna postać to tłuszcze obojętne, fosfolipidy, cholesterol i jego estry
w pokarmie najczęściej występują:
C-18 stearynowy (nasycony)
C-16 palmitynowy (nasycony)
C-18 oleinowy (nienasycony)
C-18 linolenowy (nienasycony)
Kwasy tłuszczowe krótkołańcuchowe w mleku i maśle
Średniołańcuchowych (C10-C14) prawie nie ma
Proces trawienia i wchłaniania odbywa się głównie w dwunastnicy i początkowym odcinku jelita czczego
W kale wydalane do 6g/dzień (głównie złuszczone komórki nabłonka jelitowego i bakterii jelitowych)
Przed strawieniem występuje emulsyfikacja (w żołądku i jelicie - sole żółciowe, lecytyny, kwasy tłuszczowe, monoacyloglicerole) i rozdrobnienie
Pod wpływem lipazy trzustkowej i enzymówlipolitycznych następuje zamiana tłuszczów nierozpuszczalnych w wodzie na rozpuszczalne w micelach żółciowych i łatwo przyswajalne w jelitach
TAG mleka ulegają hydrolizie w żołądku pod wpływem lipazy językowej (ze ślinianek) i żołądkowej
Lipaza trzustkowa działa w pH=8 w pozycji 1 i 3 glicerolu
Sole żółciowe zmniejszają aktywność lipazy, natomiast kolipaza (ztrzustki) zwiększa aktywność lipazy
Kompleks lipaza-kolipaa działa w pH=6 i nie podlega strawieniu przez proteazy trzustkowe
W procesie trawienia niezbędne są tez HCO3- (wpływ na pH) i sole żółciowe (micele)
Wchłanianie
wnikanie produktów trawienia do enteocytów na drodze dyfuzji
w enterocytach następuje resynteza TAG i tworzenie chylomikronów, następnie chylomikrony sa uwalniane do naczyń limfatycznych i dochodza do krwi
chylomikrony sa największymi lipiproteinami przenoszącymi tłuszcze; skład: 90% TAG, 5-9% fosfolipidy, 0,5-1% białka, 0,7-1,5% cholesterol i jego estry, 1-7% wolne kwasy tłuszczowe
na czczo w jelicie powstają VLDLi HDL, a wątroba produkuje LDL (z rozpadu VLDL)
po pokarmie wysokotłuszczowym tworzą się chylomikony nadające chłonce mleczne zabarwienie
zaburzenia - upośledzone trawienie i/lub wchłanianie:
trawienie - brak lipazy trzustkowej lub soli żółciowych
biegunka tłuszczowa - niewydolność zewnątrzwydzielnicza trzustki
brak soli żółciowych - zaburzenia krążenia jelitowo-wątrobowego (np.: przetoka żółciowa) lub zmiana ich właściwości fizyko-chemicznych (dekoniugacja bakteryjna)
Wchłanianie cholesterolu i witamin rozpuszczalnych w tłuszczach
zwykła dieta zawiera 0,5-1,0 g/dzień
źródło: żółtka jaj
wchłanianie zachodzi w górnym odcinku jelita cienkiego
cholesterol jest nierozpuszczalny w wodzie, znajduje się w micelach mieszanych
z jelit wchłania się jako wolny cholesterol do enterocytów, łączy się z kwasami tłuszczowymi i tworzy cholesterol endogenny
ok. 70% przechodzi do limfy i dalej do krwi, a 30% dochodzi do wątroby przez krążenie wrotne
do wchłaniania i utrzymania cholesterolu w roztworze żółci niezbędne są sole żółciowe
witaminy A,D,E,K transportowane są w micelach.
Skład i rola soków ( śliny, soku żołądkowego, trzustkowego i jelitowego).
Ślina
Jest wytwarzana przez ślinianki i gruczoły rozsiane w błonie śluzowej jamy ustnej
Działanie:
ochronne - rozpuszczanie i wypłukiwanie z jamy ustnej resztek pokarmowych, buforowanie drażniących substancji pokarmowych, działa bakteriobójczo, nawilża jamę ustną i narząd żucia i mowy, protekcja i regeneracja błony śluzowej
trawienne - zlepianie cząstek pokarmowych w kęs, wypłukiwanie cząstek pokarmowych z powierzchni języka, trawienie skrobi pod wpływem ptialiny
Objętość i skład śliny:
0,33-0,5 ml/min - 1,5-2,3 ml/min - 5,0 ml/min
dobowo 1-2 l
w spoczynku 60% śliny pochodzi ze ślinianki podżuchwowej, 26% z przyusznej, 5% z podjęzykowej
podczas jedzenia: 50% z podżuchwowej, 35% z przyusznic
skład:
99% to woda
1% to składniki nieorganiczne: Na+, K+, Ca++, Cl-, HCO3- i składniki organiczne: białko, mucyny
objętość śliny i zawartość składników nieorganicznych (Na+, Cl-, HCO3- ) rośnie w miarę zwiększania siły bodźca wydzielniczego
pH=5-6, przy wydzielaniu max. pH=7-8
gruczoły ślinowe wychwytują, magazynują i wydzielają jodki
w skład wchodzą również związki wielkocząsteczkowe jak enzymy, białka osocza, mucyny, substancje grupowe krwi, lizozym, kalikreina, EGF
amylaza ślinowa = ptialina ma optimum przy pH=6,9, działa na wiązania α-1,4-glikozydowe skrobi
mucyny: mukopolisacharydy i mukoproteiny
wydzielanie substancji grup A, B, H jest uwarunkowane genetycznie, nie zależy od grupy krwi
mechanizmy wydzielania śliny
wydzielanie zależy od aktywności receptorów błon komórkowych i nagromadzenia cyklicznych nukleotydów w komórkach wydzielniczych
PS+ : ACh - receptory M—pobudza cyklazę guanylową i powoduje wzrost stężenia cGMP; powoduje wydzielanie śliny wodnistej, wzmożony metabolizm ślinianek, rozszerzenie naczyń ślinianek, zwiększenie przepływu krwi, skurcz komórek mioepitelialnych; długotrwałe pobudzenie układ PS+ powoduje przerost gruczołu
S+: A, NA, dopamina - receptory β - pobudzają cyklazę adenylanową i powodują wzrost stężenia cAMP; powoduje zmiany w układzie elektrolitowym śliny, zwiększa metabolizm ślinianek, skurcz komórek mioepitelialnych, zmiany w przepływie krwi
Koncepcja Ludwiga - ślina nie jest zwykłym przesączem lecz jest czynnie wydzielana
Prawo Heidenheina: ze wzrostem siły pobudzenia zwiększa się objętość wydzielanej śliny i zawartych w niej soli nieorganicznych
Thaysen - dwustopniowe wydzielanie śliny: najpierw komórki pęcherzykowe wydzielają ślinie pierwotną o stężeniu Na+ = Na+ w osoczu, a stężenie K+ jest przybliżone do takiego stężenia, jakie występuje w ślinie ostatecznej, następnie ślina pierwotna przechodzi przez układ kanalików ślinowych, następuje zmiana składu elektrolitowego (słabe wydzielanie: Na+ ulega resorpcji, silne wydzielania: zwiększone wydalanie Na+)
Wydzielanie żołądkowe
Komórki okładzinowe wydzielają HCl, wodę i czynnik wiążący wit. B12 (wydzielina okładzinowa)
Komórki główne wydzielają pepsynogen, płyn o składzie zbliżonym do płynu pozakomórkowego (wydzielina nieokładzinowa)
Komórki śluzowe wydzielają śluz o charakterze żelu
Błonie śluzowej żołądka znajdują się komórki wewnątrzwydzielnicze należące do serii APUD:
EC1, EC2 wydzielają serotoninę i motylinę
Komórki D wydzielają somatostatynę
Inne komórki wydzielają substancję P, VIP, GRP, enkefalinę
Komórki tuczne (ECL), spichrzające i uwalniające histaminę pod wpływem gastryny
Komórki G wytwarzają, spichrzają i uwalniają gastrynę
Skład i wydzielanie soku żołądkowego:
sok żołądkowy to mieszanina kwaśnej wydzieliny okładzinowej i alkalicznej nieokładzinowej (ich wzajemne proporcje są różne)
hipoteza dwóch komponent:
komórki okładzinowe wydzielają H+ w stałym stężeniu 170 mmol, ale o zmiennej objętości zależnej od stopnia pobudzenia wydzielniczego
wydzielina nieokładzinowa ma stałą objętość i względnie stały skład, jej wydzielanie nie zależy od pobudzenia
cechą charakterystyczną soku żołądkowego jest bardzo wysokie stężenie H+
proces wydzielania:
wytwarzanie H+
aktywny transport H+ przez błonę pokrywającą kanaliki wewnątrzkomórkowe, ATP-aza zależna jest od H+ i K, występuje tylko w komórkach okładzinowych (na zasadzie antyportu lub pompy protonowej), jest blokowana przez omeprazol powodujący bezkwas (achlorhydria)
przemiana kwasów tłuszczowych i glukozy dostarcza H+, ATP, CO2 i OH-, które są ważne w okresie wydzielania
w mechanizmach śródkomórkowych wydzielania HCl przez komórki okładzinowe biorą udział receptory:
histaminowy H2, który pobudza przez białko Gs cyklazę adenylanową, powoduje to wzrost stężenia cAMP; blokowany przez cimetydynę i ranitydynę
acetylocholinowy M i gastrynowy, powodują wzrost stężenia Ca+ w komórkach okładzinowych ; receptor M jest blokowany przez atropinę, zaś receptor gastrynowy przez proglumid
jony Cl- (170 mmol/l) są wydzielane przez pompę chlorkową sprzężoną z pompą protonową; w spoczynku Cl- > H+, jest to zależne od różnicy potencjałów transśluzówkowego zwanej PD (różnica potencjału)
PD ulega spadkowi po aspirynie lub etanolu
Wydzielanie pepsyny:
wydzielana jest pod postacią nieczynnych ziarnistości (zymogenów) zwanych pepsynogenami (z komórek głównych i śluzowych gruczołów właściwych - pepsynogeny gr. I oraz z komórek śluzowych nabłonka pokrywającego antrum i dwunastnicę- pepsynogeny gr. II; różnią się optimum pH, aktywnością i siłą trawienną)
cykl odnowy ziarnistości trwa ok. 6 h
w obecności kwasu (pH<5) pepsynogeny przechodzą w pepsynę
bodźce pobudzające wydzielanie pepsynogenów:
faza głodowa (rzekome karmienie i hipoglikemia insulinowa)
obecność pokarmu w żołądku
pobudzenie cholinergiczne (rozciąganie żołądka)
zakwaszenie błony śluzowej
sekretyna w dwunastnicy
uszkodzenie bariery śluzówkowej pobudza wydzielanie pepsyn
błona śluzowa pokryta jest śluzem, który jest wydzielany pod wpływem drażnienia błony śluzowej, ma działanie ochronne i składa się ze związków wielkocząsteczkowych (glikoproteiny, białka, mukopolisacharydy), mukoproteiny, ma właściwości zlepne i poślizgowe
78% ludzi wydziela w soku żołądkowym substancje grupowe A, B, H
wydzielany jest także czynnik wewnętrzny IF, który wiąże wit. B12, jest on wydzielany pod wpływem gastryny, histaminy, insuliny; kompleks IF-B12 nie podlega trawieniu peptycznemu, natomiast spadek stężenia IF prowadzi do niedokrwistości złośliwej
gastryna, Ach, histamina, Ca2+ (patrz pytanie HORMONY PRZEWODU POKARMOWEGO)
pobudzenie wydzielania żołądkowego HCl:
piwo, czerwone wino, kawa pobudzają wydzielanie HCl (przez pobudzenie wydzielania gastryny)
wydzielanie HCl jest proporcjonalne do liczby komórek okładzinowych
podstawowe wydzielanie trawienne jest to wydzielanie żołądkowe okresu międzytrawiennego i jest wynikiem uwalniania Ach z nerwów i histaminy z komórek tucznych
fazy:
głowowa (20% wydzielania) - pobudzenie żołądka przez bodźce pokarmowe działające na receptory w pobliżu głowy; odruchy pokarmowe warunkowe i bezwarunkowe mogą być wywołane rzekomym karmieniem, pobudzeniem wagalnym (hipoglikemia insulinowa, cytoglikopenia); występuje po 5-7 minutach i trwa 2-3 h, cechuje ja wysokie stężenie HCl i pepsyny
pobudzenie ośrodków korowych i podkorowych (podwzgórze, układ limbiczny), które pobudzają nn. X, te uwalniają ACh i następuje pobudzenie żołądkowych gruczołów właściwych (HCl, pepsyna) i komórek G
W tej fazie uwalnianie gastryny ma charakter niecholinergiczny (atropina i przecięcie nn. X nie hamuje, ale samo wydzielanie H+ działa hamująco); następuje rozkurcz żołądka i jelit oraz wzrost sekrecji trzustkowej
żołądkowa: występuje gdy pokarm dochodzi do żołądka, trwa przez 3-5 h, cechuje ją obfite wydzielanie soku żołądkowego i H+ oraz gastryny, najsilniejszym bodźcem jest pokarm białkowy 9pobudza uwalnianie gastryny), rozciąganie części odźwiernikowej i trzonu żołądka, co prowadzi do stymulacji komórek G, tak samo działa neutralizacja błony śluzowej części odźwiernikowej, działanie chemiczne swoistych substancji pokarmowych oraz wydzielanie GRP
jelitowa: gdy pokarm dostaje się do dwunastnicy i jelita cienkiego, odruchy krótkie (śródścienne) i długie (wago-wagalne), pobudza wydzielanie żołądkowe i komórki G w jelicie, GRP i enterooksyntyna pobudzają gruczoły właściwe, histamina jest „końcowym chemostymulatorem”
Wydzielanie trzustkowe
skład soku trzustkowego:
wodny roztwór elektrolitów o dużym stężeniu HCO3- (wydzielina wodno-alkaliczna) z komórek śródpęcherzykowych i enzymów trawiących podstawowe składniki pokarmowe (białka tłuszcze, cukry) z komóek pęcherzykowych
aniony: HCO3- (o stężeniu 25-170 mmol/l, ich stężenie rośnie proporcjonalnie do wzrostu objętości soku), Cl- 9stężenie zależy odwrotnie proporcjonalnie do stężenia HCO3- ), suma stężeń Cl- i HCO3- wynosi w przybliżeniu 170 mmol/l i jest stała
kationy: Na+ i K+ na stałym poziomie, są podobne do stężeń występujących w osoczu
wysokie stężenie białka (0,1 - 10 %) głównie enzymy (proenzymy lub czynne) aktywowane przez enterokinazy z błony śluzowej dwunastnicy lub pod działaniem trypsyny
podział enzymów:
proteolityczne: trypsyna, chymotrypsyna A i B, elastaza (endopeptydazy), karbodsypeptydaza A i B (egzopeptydazy)
lipolityczne:
lipaza w formie czynnej hydrolizuje wiązania estrowe TAG (powstają kwasy tłuszczowe, monoacyloglicerole, glicerol), wymaga współdziałania soli żółciowych
fosfolipaza - występuje w formie czynnej i nieaktywnej, fosfolipaza A = lecytynaza odszczepia resztę kwasu tłuszczowego w pozycji 2 (powstaje lizolecytyna, ma właściwości detergencyjne, uczestniczy w tworzeniu miceli rozpuszczających produkty lipolityczne); fosfolipaza B odszczepia drugą resztę kwasu tluszczowego i z lizolecytyny powstaje glicerofosforan choliny
esterazy - rozszczepiają estry karboksylowe (cholesterolu, wit. A, D, E, K, monoacyloglicerole), wymagają soli żółciowych; esterazy glikolityczne to np. α-amylaza 9czynna), hydrolizuje wewnętrzne wiązania α-1,4-glikozydowe skrobi, powstaje maltoza, maltotrioza, α-dekstryny
nukleaza hydrolizuje wiązania estrowe kwasów nukleinowych, powstają oligo- i mononukleotydy
wydzielany w ilości 1-4 l/dobę, pH=8,0 - 8,3
Mechanizm wydzielania elektrolitów:
model „anhydrazy węglanowej)
model „wymiany dyfuzyjnej” - czynny transport Na+ i K+
cechą wydzielania trzustkowego pobudzanego sekretyną jest zwiększenie objętości soku trzustkowego i stężenia HCO3- z jednoczesnym obniżeniem stężenia Cl-
koncepcja dwuskładnikowa Hollandera:
komponenta o dużej objętości i wysokim stężeniu HCO3- produkowanych przez komórki śródpęcherzykowe i pęcherzykowe
komponenta o małej objętości, zawierająca Na+, Cl- i enzymy wytwarzane przez komórki pęcherzykowe
Mechanizmy wydzielania enzymów:
procesy wytwarzania, gromadzenia i wydzielania prekursorów enzymów trawiennych przez komórki pęcherzykowe są pobudzane przez hormony (CCK, gastryna), neuromediatory (ACh, GRP); procesy te tworzą cykl wydzielniczy
produkcja enzymów:
synteza enzymów w polisomach ER
przejście ich do cystern siateczki
przejście do aparatu Golgiego
zagęszczenie do ziarnistości wydzielniczych i wydalanie ich do światła pęcherzyków wydzielniczych (musi zaistnieć bodziec wydzielniczy)
pęcherzyki zbliżają się do powierzchni błony, następuje egzocytoza (musi zaistnieć bodziec wydzielniczy)
drugie przekaźniki: cAMP, IP3 (mobilizuje Ca2+ i kinazy białkowe)
wg. Pawłowa trzustka adaptuje się do rodzaju przyjmowanych pokarmów
Wydzielanie jelitowe
Sok jelitowy składem przypomina płyn zewnątrzkomórkowy
Komórki:
kubkowe - wytwarzają śluz
chłonne (enterocyty) z mikrokosmkami (brzeżek szczoteczkowy), mają na swojej powierzchni enzymy trawiące (trawienie kontaktowe) oraz mają zdolność do wchłaniania składników pokarmowych
komórki należące do serii APUD(dokrewne), są to komórki otwarte kontaktujące się ze światłem jelita
komórki G - wydzielają gastrynę
komórki S - wydzielają sekretynę
komórki I - wydzielają CCK
komórki EC1 - wydzielają serotonię
komórki EC2 - wydzielają motylinę
komórki EGL - wydzielają glukagon, glicentynę, enteroglukagon
komórki D - wydzielają somatostatynę
komórki H1 - wydzielają VIP
komórki K wydzielają GIP
komórki N - wydzielają neurotensynę
komórki G, S, I, K, EC - są w dwunastnicy i na początku jelita czczego
komórki D, H, EGL - występują w całym jelicie cienkim
komórki n występują w jelicie czczym i krętym
Przepływ jelitowy wzrasta (o 100-200%) podczas trawienia i wchłaniania, uczestniczą w tym sekretyna, CCK i śródścienne odruchy(ACh, VIP, GRP)
Unerwienie:
zewnętrzne nn. autonomiczne (synapsy z neuronami splotów śródściennych)
wydzielanie gruczołów dwunastniczych:
gruczoły dwunastnicze = Brunnera, skąpa wydzielina, śluzowata (mukoproteidy) o pH=8,2 - 9,1, zawiera enzymy trawienne czynnie wydzielane: pepsynogen II, mucyna, enterokinaza
najsilniejszym bodźcem wydzielniczym jest pokarm - zwiększa ilość wydzieliny, ale nie skład; hormony: gastryna, sekretyna, CCK i nn. X
rola ochronna
Wydzielanie jelita cienkiego
enterokinaza, fosfataza alkaliczna i sacharaza są czynnie wydzielane, sekretyna i CCK wzmagają wydzielanie tych enzymów
bodziec pokarmowy przez odruchy trzewne i enterokryninę
inne bodźce: VIP, GIP, glukagon >> CCK, gastryna, PGE, zwiększają ilość soku, nie wpływają na skład
PGI2 hamuje wydzielanie jelita cienkiego
Dzienne wydzielanie: 1500 ml
Wydzielanie jelita grubego:
nie ma kosmków, niewiele wydzieliny śluzowej
K+ [150-200mmol] > HCO3- [80-15 mmol] > Cl- [60-70mmol] > Na+ [3-10mmol]
bodziec: ucisk i rozciąganie jelita, drażnienie nn. X, hormony jelitowe (VIP, GIP, neurotensyna)
mineralokortykosteroidy wzmagają resorpcję Na+ i wydzielanie K+
Regulacja czynności przewodu pokarmowego.
Neurohormonalna regulacja przyjmowania pokarmu i czynności motorniczo-wydzielniczych układu trawiennego
Przyjmowanie pokarmu i zasoby energetyczne są pod kontrolą autonomicznego układu nerwowego, ośrodki znajdujące się w podwzgórzu:
sytości: jądro brzuszno-przyśrodkowe
głodu = łaknienia: boczne części podwzgórza, znajduje się w stanie stałego pobudzenia, ego aktywność zależy od glukozy: zwiększone zużycie glukozy przez jego neurony powoduje spadek aktywności
Czynniki humoralne i nerwowe związane są z sygnałami z układu nerwowego jelit - ze splotu podśluzówkowego (Meissnera) i splotu warstwy mięśniowej (Auerbacha):
CCK dział na receptory obwodowe CCKA w zakończeniach aferentnych nn. X i na receptory ośrodkowe znajdujące się w podwzgórzu (CCKB)
GRP (peptyd uwalniający gastrynę) i kalcytonina zmniejsza łaknienie
Insulina zwiększa łaknienie
Neuromediatory w podwzgórzu: serotonina, katecholaminy, neuropeptyd Y, substancje opiatowe, GABA
Sygnały metaboliczne: leptyna (uwalniana przez adipocyty tkanki tłuszczowej, hormon peptydowy)
Hormony jelitowe są uwalniane przez aktywację chemo- i mechanoreceptorów oraz produkty trawienia i zmiany ich pH, stymulację komórek dokrewnych serii APUD
Regulacja wydzielania śliny:
Układ autonomiczny, szczególnie PS+; ślinianki unerwione przez włókna cholinergiczne i peptydergiczne (ACh, VIP i substancja P) działają pobudzająco i rozszerzają naczynia krwionośne; hydrolizę ACh blokuje fizostygmina zaś atropina blokuje receptor M
Włókna S+ za pośrednictwem splotów okołonaczyniowych uwalniają NA i dopaminę (receptory α i β) oraz neuropeptyd Y - zmniejsza się ilość wydzielanej śliny, obfituje w niej białko, K+ i HCO3-
Pod wpływem pokarmu wydzielanie śliny jest odruchem bezwarunkowym, natomiast widok, zapach lub samo wyobrażenie smacznego pokarmu jest odruchem warunkowym
Hormony przysadki, tarczycy i nadnerczy modyfikują wydzielanie śliny:
hormon wzrostu, tyroksyna i kortyzol pobudzają wydzielanie śliny
aldosteron hamuje wydzielanie Na+, wzmaga sekrecję K+
Regulacja perystaltyki przełyku:
Transmitery neuronów śródściennych wywołujące skurcz okrężny to Ach i substancja P
Transmitery neuronów śródściennych wywołujące rozkurcz to NO i VIP
Mechanizmy zamykające zwieracz wpustu:
Toniczny skurcz dolnego zwieracza przełyku
Mechanizm zastawkowy pomiędzy przełykiem a żołądkiem (kąt Hissa)
Ucisk przełyku przez odnogi przepony
Bierny ucisk ciśnienia śródbrzusznego na dolny, przeponowy odcinek przełyku
Spoczynkowe napięcie zwieracza pochodzenia miogennego nie zależy od hormonów i nerwów
napięcie to modyfikują: nn. autonomiczne, transmitery i enterohormony
nn. X poprzez włókna pozazwojowe NANC uwalniające VIP, substancję P, NO, ATP warunkują rozkurcz, przez Ach (receptory M) warunkują skurcz
nn. S+ wzmagają skurcze przez NA i receptory α
Hormony żołądkowo-jelitowe:
skurcze wzmagają: gastryna, motylina, PP (polipeptyd trzustkowy)
skurcze hamują: sekretyna, CCK, glukagon, progesteron
Zaburzenia motoryczne: rozlany skurcz przełyku, nadmierny skurcz dolnego zwieracza (achlazja), przepuklina rozworu przełykowego przepony
Regulacja motoryki żołądkowej:
Autonomiczne nn. zewnętrzne i neurony splotu warstwy mięśniowej żołądka
Wewnątrzpochodna aktywność skurczowa mm. żołądka
Czynniki humoralne i hormonalne
gastryna i motylina - wzmagają częstość i siłę skurczów żołądka
CCK hamuje opróżnianie żołądka
Sekretyna, glukagon, VIP hamują potencjały czynnościowe oraz skurcze trzonu i antrum żołądka
nn. X. odruch wagalno-wagalny: rozkurcz części proksymalnej żołądka przy połykaniu kolejnych porcji pokarmu jest wynikiem odruchu hamującego z VIP i NO, gdy ubywa pokarmu - odruch pobudzający z Ach (receptory M) - skurcz części proksymalnej żołądka
Czynniki neurohormonalne pobudzające wydzielanie żołądka:
Podwójna kontrola:nn. X i gastryna - warunkują optymalne pobudzenie
Wydzielanie żołądkowe jest hamowane przez: histaminę, gastrynę, ACh i Ca2+
Wydzielanie żołądkowe jest pobudzane przez alkohol, piwo, kawę i produkty trawienia białek
Regulacja aktywności motorycznej jelit:
Na regulację wpływ mają zewnętrzne nn. autonomiczne, śródścienne sploty autonomiczne i hormony żołądkowo-jelitowe
Bodźcem dla perystaltyki odruchowej jest zadrażnienie mechanoreceptorów w błonie śluzowej (przez rozciągnięcie)
z receptorów neurony dwubiegunowe splotu Meissnera do neuronów splotu Auerbacha - skurcz
blokada: środki znieczulające receptory (kokaina), porażające zwoje (heksametonium) oraz zakończenia cholinergiczne (atropina) oraz duże dawki nikotyny
substancja P i motylina pobudzają aktywność motoryczną jelita
serotonina pobudza neurony uwalniające transmitery hamujące: VIP, NO, somatostatynę (hamują aktywność motoryczną jelit)
Nerwy zewnętrzne:
nn. X pobudzają aktywność motoryczną, z wyjątkiem zwieraczy - rozkurcz
nn. S+ hamują aktywność motoryczną, z wyjątkiem zwieraczy - powodują skurcz
pośredniczą w długich odruchach trzewnych, np. odruchu żołądkowo-krętniczym (pobudza perystaltykę jelita krętego przy rozciąganiu żołądka), odruchu krętniczo-żołądkowym (zahamowanie motoryki żołądka w wyniku rozciągania jelita krętego), odruchu jelitowo-jelitowym (przy rozciąganiu, ucisku lub uszkodzeniu jelita wpływa hamująco przez nn. S+)
Hormony żołądkowo-jelitowe:
gastryna i CCK wzmagają częstość potencjałów czynnościowych i skurcze jelita, nie wpływają na BER
sekretyna, glukagon, VIP, GIP zmniejszają częstość potencjałów czynnościowych i aktywność skurczową, nie wpływają na BER
motylina zwiększa aktywność elektryczną i skurcze jelit, okresowo zwiększa aktywność MMC
ACh pobudza skurcze (przez receptory M)
NA hamuje motorykę przez receptory α
PGF pobudzają skurcze
PGE i PGI hamują skurcze; PGE2 i PGI2 są uwalniane podczas skurczów perystaltycznych i je wyhamowują
W splocie podśluzówkowym jelita i w splocie warstwy mięśniowej jelita występują neurony:
przewodzące pobudzenie od receptorów w błonie śluzowej jelita
pośredniczące
unerwiające komórki gruczołowe błony śluzowej
unerwiające błonę mięśniową jelita
unerwiające naczynia krwionośne
Hamowanie wydzielania żołądkowego:
Hamowanie ośrodkowe - zanik łaknienia (ośrodek w podwzgórzu), osłabia fazę głowową, zmniejsza wydzielanie żołądkowe
Hamowanie odźwiernikowe - gdy w błonie śluzowej antrum pH<3 zwiększa wydzielanie somatostatyny (hamowanie komórek G i komórek okładzinowych)
Hamowanie dwunastnicze - zakwaszenie błony śluzowej dwunastnicy, zadziałanie na błonę produktów lipolitycznych i roztworów hipertonicznych; odruch dwunastniczo-żołądkowy, uwalnianie z błony somatostatyny, sekretyny, CCK
Regulacja wydzielania trzustkowego:
Wydzielanie podstawowe jest warunkowane toniczną aktywnością nn. X i samoistnym uwalnianiem hormonów jelitowych; jest cykliczne, a szczyt przypada na fazę III MMC
Wydzielanie jest pobudzane:
faza głowowa - widok, zapach, żucie, połykanie prowadzi do pobudzenia odruchów wagalnych i w konsekwencji wydzielania enzymów, stanowi 20% odpowiedzi wydzielniczej trzustki, uczestniczą w tej odpowiedzi:
pobudzenie cholinergicznych i peptydergicznych komórek pęcherzykowych
uwalnianie cholinergiczne gastryny i stymulacja wydzielania żołądkowego HCl do dwunastnicy, a tam uwalnianie sekretyny i CCK co prowadzi do pobudzenia wydzielania trzustkowgo
faza żołądkowa stanowi 5-10% wydzielania trzustkowego, uczestniczą odruchy wago-wagalne; sok trzustkowy uwalniany w fazie głowowej i żołądkowej jest bogaty w enzymy zaś ubogi w HCO3-
faza jelitowa stanowi 70-80% wydzielania trzustkowego, sekretyna i CCK są uwalniane pod wpływem HCl i produktow trawienia białek i tłuszczów - odruchy wago-wagalne
Głównymi bodźcami fazy jelitowej są CCK i GRP
L-Phe, L-Trp, polipeptydy, kwasy tłuszczowe, H+, sole żółciowe pobudzają uwalnianie CCK, ona działa pobudzająco na zakończenia nn. czuciowych w żołądku i jelitach z następową aktywacją aferwntnych włókien nerwów: wagalnych, jądra grzbietowego i eferentnych włókien nn. X co prowadzi do hamowania opróżniania żołądka oraz skurczów pęcherzyka żółciowego a pobudza sekrecję trzustkową
GRP działa bezpośrednio lub przez gastrynę lub przez CCK
Uwalnianie CCK z komórek dokrewnych (komórek I) jelita cienkiego jest warunkowane przez tzw. peptyd monitorujący (uwalniany z komórek pęcherzykowych do soku trzustkowego) i peptyd uwalniający CCK (wytwarzany przez błonę śluzową jelita = CCK-RP)
uwalnianie tych peptydów jest regulowane przez AUN:
nn. X pobudzają uwalnianie peptydu monitorującego
somatostatyna hamuje to uwalnianie
Interakcja sekretyny, CCK i GRP powoduje utrzymanie wysokiego i stałego pH w dwunastnicy
Czynniki hamujące uwalnianie soku trzustkowego:
polipeptyd trzustkowy (PP) działa na ośrodki nn. X i komórki pęcherzykowe trzustki
somatostatyna
Interakcja wewnątrz- i zewnątrzwydzielnicza trzustki:
Insulina pobudza syntezę enzymów trzustkowych, działa troficznie na część zewnątrzwydzielniczą trzustki
Glukagon hamuje syntezę i wydzielanie enzymów trzustkowych co prowadzi do degranulacji i zaniku komórek zewnątrzwydzielniczych
Działanie insulinotropowe wykazują: GIP, VIP, CCK, enteroglukagon - wpływ „inkretynowy”
wyspy uwalniają PP i somatostatynę
CZYNNOŚCI WĄTROBY
Czynności:
tworzenie i wydzielanie żółci
udział w podstawowych przemianach metabolicznych ustroju
degradacja i sprzęganie hormonów steroidowych i inaktywacja hormonów polipeptydowych
funkcje krążeniowe - gromadzenie i filtracja krwi odpływającej z układu trawiennego
wydzielanie żółci:
Składnik |
Żółć wątrobowa |
Żółć pęcherzykowa |
Woda Cholesterol Kwasy żółciowe Bilirubina Białka Na+ Cl- HCO3- PH |
97 % o,2 % 1, 0 % 0,1 % 0,2 % 230 mmol/l 80-120 mmol/l 27-65 mmol/l 7,0-7,5 |
89 % do 5 % do 10 % do 15% do 3 % 330 mmol/l 1-5 mmol/l 1-2 mmol/l 6-7
|
żółć jest izotoniczna z osoczem krwi
pomiędzy stężeniem wszystkich kationów i soli żółciowych istnieje współzależność:
stężenie soli żółciowych = 2,03 [Na+ + K+] - 302
po stymulacji sekretyną lub pokarmem wzrasta stężenie HCO3-, zaś maleje Cl-
kwasy żółciowe są wytwarzane lub sprzęgane z glicyną lub tauryną w hepatocytach i aktywnie wydzielane do żółci, w pęcherzyku ulegają zagęszczeniu i są uwalniane do dwunastnicy, czynne wchłanianie następuje w jelicie krętym (95%) wtedy dostają się do krążenia wrotnego i 90% z krwi przepływającej przez zraziki ulega przejściu do żółci; 6-12 cykli/dobę, wydalanie: 0,2 g/dobę = 0,8 mmol/dobę
w żółci znajdują się 4 rodzaje kwasów żółciowych
cholowy
chenodeoksycholowy = chenowy
deoksycholowy
litocholowy
ich stosunek wynosi odpowiednio 4:2:1:0
kwas cholowy i chenowy są kwasami pierwotnymi, powstają tylko w hepatocytach, w jelicie grubym następuje ich dehydroksylacja i powstają wtórne kwasy żółciowe
kwas litocholowy w większości jest wydalany z kałem, a ten, który został wchłonięty w wątrobie łączy się a glicyną i powstaje sulfolitocholan
część wtórnych kwasów żółciowych przechodzi w trzeciorzędowe kwasy żółciowe (przedstawiciel: kwas ursodeoksycholowy z kwasu chenodeoksycholowego)
sprzężone kwasy żółciowe (z glicyną lub tauryną) są rozpuszczalne w wodzie, w jelicie krętym znajduje się receptorowy mechanizm ich aktywnego wychwytu i transportu
niesprzężone kwasy żółciowe są wchłaniane w jelicie cienkim i grubym na drodze dyfuzji niejonowej, reszta jest wydalana z kałem
w stężeniach powyżej krytycznego stężenia micelarnego (2 mmol/l) sprzężone kwasy żółciowe tworzą micele
stosunek cholesterolu do kwasów żółciowych wynosi 1:20 - 1:30, gdy poniżej 1:13 cholesterol wytrąca się w postaci mikrokryształków i powstają kamienie cholesterolowe
w żółci powstają też kamienie Ca2+-bilirubinowe
wytrącanie kamieni żółciowych sprzyja obecności zarodków krystalizacji - glikoprotein pochodzących ze śluzu pokrywającego błonę śluzową pęcherzyka i złuszczonego nabłonka tej błony
barwniki żółciowe: bilirubina jest nierozpuszczalna w wodzie, przechodzi do krwi gdzie łączy się z albuminami i jest transportowana do wątroby i hepatocytów (pośredniczą zasadowe białka cytoplazmatyczne = białka XY), w mikrokosmkach ulega sprzężeniu z kwasem glukuronowym i powstaje diglukuronid bilirubiny, który jest dobrze rozpuszczalny w wodzie i który aktywnie przechodzi do żółci
diglukuronid bilirubiny jest wydalany z kałem, a część ulega redukcji do urobilinogenu i sterkobilinogenu:
urobilinogen z jelit dostaje się do wątroby i powtórnie do żółc, lub z jelit do krążenia ogólnego i do moczu gdzie przechodzi w urobilinę
sterkobilinogen przekształaca się w sterkobilinę
żółtaczki:
miąższowa - uszkodzenie hepatocytów i upośledzenie pobierania przez nie bilirubiny
mechaniczna - zaczopowanie dróg żółciowych
hemolityczna - nadmierny rozpad krwinek czerwonych i tworzenie bilirubiny
przy żółtaczce miąższowej lub hemolitycznej obserwuje się wzrost stężenia wolnej bilirubiny we krwi, zaś przy mechanicznej wzrost stężenia bilirubiny sprzężonej we krwi
Mechanizmy wydzielania żółci:
składniki żółci:
substancje aktywnie wydzielane do żółci których stężenie jest większe niż w osoczu (sole i barwniki żółciowe)
substancje o stężeniu podobnym do stężenia w osoczu (Na+, K+, Ca2+, Cl-)
substancje o stężeniu mniejszym niż w osoczu (cholesteroli, fosfolipidy, glukoza, białka)
mechanizmy transportu:
anionowy - dla soli i barwników żółciowych
kationowy - dla IV-rzędowych amin
obojętny dla glikozydów nasercowych
działają niezależnie od siebie
dla każdej aktywnie wydzielanej substancji można określić maksymalną pojemność wydzielniczą (Tm - transport maksymalny)
etapy transportu :
pobieranie substancji z krwi przez hepatocyty
gromadzenie w hepatocytach
metabolizm wewnątrzkomórkowy poprzedzający ich wydzielanie
wydzielanie do żółci
siłą napędową transportu soli żółciowych i jonów Na+ jest aktywny transport jonów Na+ w błonie bocznopodstawnej hepatocytów, znaczenie ma pompa Na-K
kwasy żółciowe są transportowane do żółci przy udziale nośników (transport ułatwiony)
woda i elektrolity Na+, K+, Ca2+, Cl-, HCO3- przechodzą do kanalików żółciowych na drodze filtracji osmotycznej
nabłonek pokrywający drogi żółciowe wydziela frakcję żółci bogatą w HCO3- po stymulacji przez sekretynę, VIP i glukagon
NO i VIP powodują rozluźnienie ściany pęcherzyka i równoczesny skurcz zwieracza bańki wątrobowo - trzustkowej
Regulacja wydzielania żółci:
wydzielanie żółci wynosi 250 - 1100 ml/dobę
regulowane przez sole żółciowe, krążenie wątrobowe, unerwienie autonomiczne i czynniki hormonalne
wydzielanie żółci przez hepatocyty zależy od kwasów żółciowych aktywnie wydzielanych przez te komórki do kanalików żółciowych i wytwarzających tam wysoki gradient osmotyczny
źródłem żółci jest też komponenta alkaliczna wydzielana przez komórki nabłonka pokrywającego przewody żółciowe, jest ona niezależna od kwasów żółciowych, stymulowana przez hormony
czynniki choleretyczne = choleretyki - pobudzają wydzielanie żółci w zakresie frakcji zależnej od kwasów żółciowych i frakcji alkalicznej
znaczne obniżenie przepływu wątrobowego krwi powoduje znaczną hipoksję wątroby i zmniejszenie wydzielania żółci
układ PS+ pobudza wydzielanie, zwiększa objętość żółci i zawartości składników stałych
czynniki hormonalne:
sekretyna, glukagon, VIP, gastryna, CCK, histamina zwiększają objętość żółci i stężenie HCO3-, Cl- i zmniejszają stężenie kwasów żółciowych (działanie sekretynopodobne)
w okresie międzytrawiennym żółć jest wydzielana do pęcherzyka i co 90-110 minut w fazie II i III MMC do dwunastnicy (niewielkie ilości)
opróżnienie pęcherzyka w 50-80 % zachodzi w 30 min po posiłku
główne bodźce opróżniania pęcherzyka: nn. X i CCK - wtedy rozkurcz zwieracza Oddiego (bańki wątrobowo - trzuskowej)
Czynności wątrobowego układu krążenia
żyła wrotna dostarcza 70% krwi dochodzącej do wątroby, pokrywa 60 % zapotrzebowania na tlen
t. wątrobowa dostarcza 30 % krwi dochodzącej do wątroby, pokrywa 40% zapotrzebowania na tlen
w spoczynku całkowita objętość krwi wynosi 35% (1800 ml/min) pojemności minutowej
krążenie wrotne - niskociśnieniowy rezerwuar, może stanowić 20 % masy wątroby i może pomieścić 200-400 ml krwi
utrudniony przepływ krwi przez wątrobę powoduje zwiększenie ciśnienia w krążeniu wrotnym, a to prowadzi do powiększenia śledziony, żylaków przełyku, żż. przypępkowych, żylaków odbytnicy
wewnętrzne rozgałęzienia ż. wrotnej mają błonę mięśniową gładką podlegającą noradrenergicznym (S+) nerwom naczynioskurczowym, brak nn. PS+, ale są obecne nn. NANC działające naczyniorozkurczowo, uwalniają VIP, GRP, CGRP, NO i in.
Adrenalina w małych dawkach rozszerza naczynia wątrobowe, natomiast w dużych dawkach zwęża naczynia wątrobowe
NA zwęża naczynia, zmniejsza ciśnienie, zwiększa przepływ krwi przez wątrobę
Insulina wzmaga przepływ krwi przez wątrobę
Gastryna, CCK, VIP, glukagon, sekretyna powodują rozszerzenie naczyń krążenia trzewnego i wątrobowego, zwiększają zużycie tlenu przez narządy trzewne
Autoregulacja krążenia wątrobowego
Czynności metaboliczne wątroby:
Uczestniczy w przemianie węglowodanów:
glikogeneza lub glikogenoliza
galaktoza i fruktoza zostają przemienione w glukozę
glukoneogeneza
tworzenie ważnych związków z pośrednich produktów metabolizmu cukrów
„buforowanie: stężenia glikozy we krwi
wątrobowy wychwyt glukozy jest niezależny od bodźców nerwowych i hormonalnych
Uczestniczy w przemianie tłuszczów:
β-oksydacja kwasów tłuszczowych i tworzenie ciał ketonowych
synteza lipoprotein (LDL, HDL)
synteza cholesterolu i fosfolipidów
przemiana cukrów i białek na tłuszcze
Uczestniczy w przemianach białek:
deaminacja oksydatywna aminokwasów, powstają ketokwasy i amoniak
transaminacja - produkty do cyklu Krebsa
tworzenie mocznika z NH3 wychwytywanego przez hepatocyty w płynach ustrojowych
synteza ok. 85% białek osocza (wyjątek: immunoglobuliny)
wzajemne zamiany aminokwasów
synteza niektórych aminokwasów i substancji z nich pochodzących (glutamina, tauryna)
jedyny narząd syntezy mocznika i wydalania bilirubiny z osocza
Inne czynności wątroby:
magazynuje witaminy A, D, B12:
wit. A na 1-2 lat
wit. D na 3-12 miesięcy
wit. B12 na 3-6 lat
wytwarza czynniki krzepnięcia krwi: fibrynogen, protrombina, VII, IX, X
spichrza żelazo w postaci ferrytyny
główny narząd detoksykacji
inaktywuje wiele hormonów: steroidowe i niektóre peptydowe (insulina, glukagon)
uczestniczy w termoregulacji, ma najwyższą temperaturę
Pęcherzyk żółciowy i drogi żółciowe:
zagęszcza żółć 5-20 razy, zwiększa jej lepkość
bodźce: pokarm, CCK, nn. X, okresowe skurcze perystaltyczne (MMC) dwunastnicy
Hormony przewodu pokarmowego.
Są wydzielane przez komórki rozsianego układu wydzielania wewnętrznego
Mają budowę peptydową, krążą we krwi lub działają miejscowo
Podział:
gr. I: gastryna, cholecystokinina (CCK)
gr. I: sekretyna, glukagon, glicentyna (GLI), wazoaktywny peptyd jelitowy (VIP), peptyd hamujący czynność żołądka (GIP)
GASTRYNA:
wydzielana przez komórki G błony śluzowej:
G34 - gastryna „duża” z 34 aminokwasów; T1/2=15 minut,
G17 - gastryna „mała”; T1/2=2-3 minut, jest główną komponentą uwalnianą przez błonę śluzową części odźwiernikowej
G14 - gastryna „mini”; T1/2=2-3 minut
G-4, T1/2=1,75 minut
Mają identyczną sekwencje łańcucha końca karboksylowego
na czczo przeważa G-34, po pobudzeniu G-17 (najsilniej pobudza wydzielanie żołądkowe)
brak HCl powoduje pobudzenie komórek G i wzrost gastryny we krwi
natomiast HCl powoduje uwalnianie somatostatynę z komórek G, która hamuje uwalnianie gastryny, przy pH=1 calkowita zahamowanie uwalniania gastryny (autoregulacja antralna)
zespół Zollingera - Ellisona = gastrinoma - przerost komórek G powodujące znaczne zwiększenie gastryny we krwi oraz wrzody dwunastnicy, hiperchlorhydria, biegunka tłuszczowa
w uwalnianiu gastryny w fazie głowowej pośredniczy GRP (nie podlega wpływom atropiny)
faza żołądkowa: duże uwalnianie gastryny, pośredniczą GRP, produkty rozpadu białek, odruchy cholinergiczne
faza jelitowa - niewielkie uwalnianie gastryny pod wpływem produktów trawienia białek, GRP
działanie gastryny:
pobudza wydzielanie kwasu solnego i pepsyny
wywiera wpływ troficzny na proliferacje komórek błony śluzowej żołądka i dwunastnicy oraz jelita grubego
wzmaga aktywność motoryczną przewodu pokarmowego
zwiększa skurcz dolnego m. zwieracza przełyku i odźwiernika
hamuje skurcz m. zwieracza krętniczo-kątniczego i m. zwieracza bańki wątrobowo-trzustkowej
w mniejszym stopniu pobudza wydzielanie soku jelitowego, trzustkowego i zółci
inaktywacja gastryny zachodzi w nerkach i jelicie cienkim
CHOLECYSTOKININA
Wytwarzana przez komórki I wewnątrzwydzielnicze błony śluzowej dwunastnicy i początku jelita cienkiego pod wpływem produktów trawienia białek i tłuszczy oraz H+ i soli żółciowych
Postacie o identycznym łańcuchu polipeptydowym C-końca, różna ilość aminokwasów: 8,12,33,39 i 54
Ostatnie 5 aminokwasów C-końca gastryny są takie same jak CCK
Miejsce katabolizmu: nerki
Pobudza wydzielanie soku trzustkowego i w mniejszym stopniu: żołądkowego, jelitowego i żółci
Silnie kurczy ścianę pęcherzyka żółciowego i rozkurcza m. zwieracz bańki wątrobowo-trzustkowej
Zwiększa przepływ krwi i metabolizm w trzustce
Wzmaga perystaltykę jelit i hamuje żołądka
Kurczy m. zwieracz przełyku i m. odźwiernika
Potęguje wydzielanie HCO3 trzustki pobudzonej przez sekretynę
Pobudza uwalnianie glukagonu
SEKRETYNA
Wydzielana przez komórki S wewnątrzwydzielnicze błony śluzowej dwunastnicy i jelita cienkiego pod wpływem bardzo kwaśnej zawartości żołądka a także długołańcuchowych kwasów tłuszczowych
Z 27 aminokwasów, nie ma centrum aktywnego zasadowa; T1/2=2-3 minuta
Miejsce katabolizmu: nerki
Silnie pobudza wydzielanie trzustkowe oraz żółci (potęguje wydzielanie przez CCK)
Zwiększa przepływ krwi i metabolizm w trzustce
Hamuje perystaltykę żołądka i jelit
Hamuje wydzielanie HCl i gastryny ale pobudza wydzielanie pepsyny
Pobudza wydzielanie HCO3- przez trzustkę, wątrobę i gruczoły dwunastnicze
Pobudza uwalnianie innych hormonów zwłaszcza insuliny
VIP
W błonie śluzowej jelita cienkiego i grubego
rozszerza naczynia krwionośne w przewodzie pokarmowym, działa inotropowo +
pobudza ruchy oddechowe
hamuje motorykę żołądka i wydzielanie soku żołądkowego, trzustkowego i żółci
słabe pobudzenie wydzielania jelitowego
pobudzenie procesów lipolizy i glikogenolizy wątrobowej
GIP
uwalniany z błony śluzowej dwunastnicy i jelita czczego pod wpływem tłuszczów, glukozy i AA stosowanych doustnie
hamuje perystaltykę i wydzielanie soku żołądkowego
pobudza wydzielanie jelitowe
wzmaga uwalnianie insuliny przy podwyższony stężeniu glukozy we krwi
MOTYLINA
wydzielana z komórek EC2 błony śluzowej dwunastnicy pod wpływem alkalizacji
wzmaga motorykę żołądka i jelit
hamuje opróżnianie żołądka (kurczy m. zwieracz odźwiernika)
wyzwala w żołądku i jelitach MMC (co 90 - 110 minut)
SOMATOSTATYNA (SOM)
wytwarzana w błonie śluzowej żołądka i jelit oraz w trzustce
hamuje motorykę i wydzielanie soków trawiennych
hamuje działanie gastryny, CCK i insuliny na gruczoły trawienne
TRANSMITERY
PS+ : Ach
S+ : NA
Neurony splotów jelita: Ach, serotonina (5HT), GABA
Modulatory: substancja P (SP), CCK, dynorfina (DYN), enkefaliny (ENK), peptyd uwalniający gastrynę (GRP), VIP, peptyd pochodny genu kalcytocynowego (CGRP), neuropeptyd Y (NPY)
Acetylocholina
przez receptor M1 pobudza komórki okładzinowe
pobudza uwalnianie histaminy z komórek tucznych (ECL) (też przez receptor M1)
hamuje komórki D
pobudza neurony peptydergiczne uwalniajace GRP
Histamina:
pobudza wydzielanie HCl
błona śluzowa w obrębie komórek tucznych zawiera dekarboksylazę histydynową
pochodne metylowe histaminy są silniejszym bodźcem niż sama histamina
działanie sokopędne
blokery receptorów H2 : cymeydyna, ranitydyna
Ca2+
pobudzają wydzielanie żołądkowe
ułatwiają uwalnianie gastryny
PLIPEPTYD TRZUSTKOWY
wydzielany prze komórki dokrewne trzustki
z 36 aminokwasów
hamuje wydzielanie enzymów i HCO3 przez trzustkę
ENKEFALINY
Działają przez receptory opiatowe - skurcz zwieraczy przewodu pokarmowego
Hamuje motorykę i wydzielanie jelitowe
NEUROTENSYNSA
Wydzielina z komórek jelita czczego i krętego pod wpływem produktów trawienia tłuszczy i białek
Pobudza wydzielanie soku trzustkowego i jelitowego
Hamuje wydzielanie żołądkowe
Pobudza motorykę jelitową
Zwiększa przepływ krwi przez krążenie trzewiowe
PEPTYD UWALNIAJACY GASTRYNĘ (GRP)
Uwalniany z neuronów peptydergicznych żołądka, jelit i trzustki pod wpływem pobudzenia nn. Błędnych
Pobudza wydzielanie gastryny, CCK
PEPTYD Y (PYY)
Z błony śluzowej jelita krętego
Hamuje opróżnianie żołądka i motorykę jelitową
Hamuje wydzielanie żołądkowe i trzustkowe
Zwalnia procesy przyswajania tłuszczów
WYCIĄGI JELITOWE:
Duokrynina, enterokrynina, enterogastron, bulbogastron, enteroglukagon
Czynność jelita grubego.
Procesy zachodzące w jelicie grubym:
Zwrotne wchłanianie wody
Wchłanianie elektrolitów, witamin i aminokwasów
Formowanie kału i czasowe magazynowanie niestrawionych produktów
Mnożenie się drobnoustrojów, które wytwarzają związki zarówno niezbędne jak i toksyczne dla organizmu człowieka
Wchłanianie w jelicie grubym
wchłanianie wody i elektrolitów
PD - transepitelialna różnica potencjału elektrycznego = 30-40 mV
Dobowo dochodzi 1,5 l treści:
Na+ = 200 mmol, Cl- = 100 mmol, K+ = 10 mmol
90 % ulega wchłonięciu
najsilniej wchłaniany Na+ (w kale tylko 40 mmol), w początkowym odcinku okrężnicy transport aktywny, odpowiedzialny za PD
K+ jest biernie wydzielany, w kale 100 mmol, wchłanianie w końcowym odcinku okrężnicy na drodze transportu aktywnego
Woda jest wchłaniana biernie, głównie na początku jelita grubego
Rezerwa pojemności chłonnej 2-3 l/dobę, po przekroczeniu - biegunki
W jelicie grubym następuje także wchłanianie amoniaku, AA i kwasów tłuszczowych oraz niektórych witamin
Czynniki wpływające na wchłanianie:
perystaltyka jelitowa
przepływ krwi
hormony:
aldosteron zwiększa wchłanianie Na+ i wydzielanie K+
wazopresyna zmniejsza wchłanianie Na+, Cl- i wody
Ilość bakterii wydalonych z kałem może stanowić 30 % masy jego stałych składników
Procesy gnilne i fermentacyjne:
gnicie dzięki Streptococcus faecalis i Clostridium welchii
węglowodany przechodzą w kwasy organiczne (masłowy, propionowy, bursztynowy, mlekowy)
metan, H2, CO2 są wydalane w ilości 150 ml/dobę
enzymy bakteryjne rozkładają niestrawione białko - dekarboksylacja, dezaminacja:
Trp - indol, skatol, tryptamina -nadają kałowi woń
Histydyna - histamina
Lys - kadaweryna
Ornityna - putrescyna
Arg - agmatyna
Phe - kw. Benzoesowy
Tyr - tyramina, parakrezol
Cys - siarkowodór
niektóre drobnoustroje tworzą: witaminy (biotyna, kwas pantotenowy, inozytol, kwas foliowy, kwas nikotynowy, B12, K)
podanie antybiotyków hamuje rozwój flory bakteryjnej co powoduje pobudzenie organizmu do wzrostu
pod wpływem bakterii powstaje amoniak
Formowanie kału:
skład:
75% to woda (200 ml/dzień)
25% składniki stałe, z czego:
30 % to bakterie
15 % substancje nieorganiczne ( Ca2+, fosforany)
5 % ciała tłuszczowe
40 % niestrawione cząsteczki pokarmów (celuloza)
10 % białko roślinne i złuszczonego nabłonka jelitowego
Odczyn kału jest od zewnątrz alkaliczny zaś od wewnątrz kwaśny
Wydzielanie jelita grubego (patrz pytanie SKŁAD I ROLA SOKÓW )
Motoryka jelita grubego i oddawanie kału (patrz pytanie MOTORYKA PRZEWODU POKARMOWEGO)
TERMOREGULACJA I PRZEMIANA MATERII
Regulacja temperatury w organizmie człowieka (ośrodek termoregulacji).
Termoregulacja polega na ustaleniu się równowagi między wytwarzaniem i utratą ciepła w zależności od zewnętrznych warunków termicznych. Tymi dwoma funkcjami steruje ośrodek termoregulacji zlokalizowany w podwzgórzu. Składa się on z dwóch części- przednia to ośrodek eliminacji ciepła, tylna- ośrodek zachowania ciepła, odpowiedzialny za zatrzymywanie i wytwarzanie ciepła. Czynność tego ośrodka jest regulowana na zasadzie sprzężenia zwrotnego przez impulsy docierające z położonych obwodowo termoreceptorów i ośrodkowo termodetektorów (też w mięśniach, górnych drogach oddechowych, ścianach naczyń).
Termoreceptory są zlokalizowane w skórze- dzielą się na receptory zimna (liczniejsze) i ciepła. Przy stałej temperaturze częstotliwość pobudzania dośrodkowych włókien nerwowych wynosi maksymalnie 10Hz. Wzrost lub spadek temperatury powoduje gwałtowny wzrost częstotliwości wyładowań w odpowiednich włóknach. Termodetektory znajdują się głównie w przedniej części ośrodka termoregulacji oraz w szyjnym odcinku rdzenia kręgowego.
Termoliza
Termoliza to zwiększenie utraty ciepła przy zmniejszonym wytwarzaniu. Dla układu krążenia oznacza to rozszerzenie naczyń skóry i zwiększenie skórnego przepływu krwi. Towarzyszy temu kompensacyjne zmniejszenie przepływu przez trzewny obszar naczyniowy i nerki. Może się zwiększyć też pojemność minutowa serca.
Aby naczynia rozkurczyły się musi ustać pobudzenie z układu współczulnego (zwężające je). Dodatkową rolę odgrywa miejscowe podwyższenie temperatury i uwalnianie bradykininy przez gruczoły potowe.
Gruczoły potowe umożliwiają obniżenie temperatury cała poprzez odparowywanie potu z powierzchni ciała. Jest to utrudnione przy dużej wilgotności powietrza. Aktywacja gruczołów potowych następuje pod wpływem stymulacji ośrodków termodetekcji(?) wrażliwych na wzrost temperatury (cholinergiczne włókna współczulne). Istnieje prosta zależność między ilością wydzielanego potu a temperatura krwi docięrającej do podwzgórza w zakresie od 20 do 40*C.
Termogeneza
Termogeneza zachodzi na drodze drżenia mięśniowego, przyśpieszonego metabolizmu wątroby i tkanki tłuszczowej (zwłaszcza brunatnej). Praca mięśni ma małą użyteczność, w związku, z czym wytwarza dużo ciepła. Pobudzenie motoneuronów α rdzenia kręgowego powoduje wzrost napięcia mięśniowego i drżenie. Występuje ono we wszystkich mięśniach szkieletowych z wyjątkiem kilku pozbawionych receptorów na rozciąganie. W skrajnych warunkach tempo podstawowej przemiany materii może wzrosnąć 4- 5,5 krotnie. Głównym substratem energetycznym są węglowodany, (ale lipidy również).
Niska temperatura otoczenia lub wnętrza organizmu stymuluje układ adrenergiczny do uwalniania hormonów ciepło-twórczych (aminy katecholowe, glukagon, T3-->mięśnie szkieletowe, wątroba, brunatna tkanka tłuszczowa-->ciepło).
Brunatna tkanka tłuszczowa występuje głównie u niemowląt, ale może przetrwać do dorosłości u ludzi narażonych na niskie temperatury. Jest bogato unerwiona współczulnie, zawiera dużo mitochondriów, a te ostatnie białko transbłonowe- termogeninę.
NORADRENALINA ---> receptor β adrenergiczny ---> termogeniena -kanał protonowy w wewnętrznej błonie mitochondrialnej ---> zwarci gradientu protonowego ---> CIEPŁO
Podstawowa i całkowita przemiana materii, czynnościowy przyrost przemian
Przyrost czynnościowy to nadwyżka w obrotach energią ponad przemianę podstawową. Przyjęcie pożywienia na 6-8 godzin zwiększa PM(?) w zależności od przyjętego pokarmu. Jest to specyficzno dynamiczne działanie pożywienia. Białka podnoszą PPM o 20- 30%, cukry 7%, tłuszcze 3%. Jest to związane głównie z asymilacją produktów trawienia, a nie z czynnością układu pokarmowego. Blisko połowa aminokwasów ulega dezaminacji, przebudowie i utlenieniu, co wiąże się z uwalnianiem znacznych ilości energii (głównie w wątrobie).
Spadek temperatury otoczenia powoduje zwiększenie tempa przemiany materii w celu utrzymania stałej temperatury organizmu. Podwyższenie się lub zrównoważenie temperatury otoczenia i temperatury ciała człowieka nie powoduje efektu odwrotnego.
Praca mięśni to główny czynnik podnoszący temperaturę, gdyż ich metabolizm wiąże się z rozpadem cukrów, zużyciem tlenu, produkcja ciepła, wzmaga to działanie czynność układu krążenia i oddechowego.
Bezczynne leżenie +10% PPM Stanie +50% PPM Praca biurowa +100% PPM Spacer +180% PPM Marsz +300% PPM |
Pływanie +600% PPM Bieg +700% PPM Sen -10% PPM Praca umysłowa bardzo mało Stany emocjonalne czasami znaczny wzrost |
ZASADY REGULACJI FUNKCJI W ORGANIŹMIE ŻYWYM
Sprzężenia zwrotne.
Homeostat.
Homeostaza-dynamiczna równowaga czynnościowa ustroju zachowana mimo zmieniających się wartości otoczenia, zabezpiecza stałość podstawowych parametrów fiz-chem środowiska wew. Odpowiedzialna za adaptację do zmiennych warunków środowiska.
Kontrola:
Sprzężenie proste-jednokierunkowy przepływ informacji
Sprzężenie zwrotne-wielkość wyjściowa z narządu regulowanego staje się wielkością wejściową dla narządu regulującego. W sprzężeniu dodatnim układ taki prowadzi do przyśpieszenia i zwiększenia produkcji, np. enzymu (krzepnięcie). W sprzężeniu ujemnym, które stabilizuje układ, wielkość wyjściowa z narządu regulowanego zmienia w kierunku przeciwnym wielkość wyjściową z narządu regulującego (reakcje przeciwdziałające).
Bardziej skomplikowany mechanizm kontroli: homeostat i serwomechanizm.
Działanie homeostatu można wyjaśnić na przykładzie reg. temp. ciała.
Układ nastawczy-ośrodek w tylnej części podwzgórza; komparator-termodetektory w przedniej cz. podwzgórza z wielkością prawidłową na którą nastawiony jest układ nastawczy; ukł.regulujący-ukł.współczulny; ukł. regulowany-nacz. krw. mięśnie, hormony tarczycy;
W zależności od impulsów wysyłanych z komparatora(porównującego inf. napływające z termoreceptorów z ukł. nastawczym) na zasadzie ujemnego sprzężenia zwr. mechanizmy termoregulacyjne powodują produkcję ciepła lub jego utratę.(piękny rysunek w skrypcie)
Proces w którym sygnał nastawczy zmienia się dynamicznie i nie ma charakteru stałego nazywamy serwomechanizmem. Zmiany te przebiegają odpowiednio do celów realizowanych przez organizm.(np. rytm i siła skurczów serca-dostosowanie do aktualnej sytuacji org. w celu zachowania składu chemicznego tkanek)
Serwomechanizm.
strona 1
fizjologia - ver.1.1 - opracowanie zagadnien 2003 / 2004
Podwzgórze
Przysadka mózgowa
Gruczoł docelowy
Wyszukiwarka
Podobne podstrony:
kolo fizjo opracowane zagadnienia
Opracowanie Zagadnień na egzamin Mikroprocki
opracowane zagadnienia 2011
monopolizacja gospodarki, Opracowane zagadnienia
Opracowanie zagadnień NIK, Bezpieczenstwo Narodowe rok I
temp krytyczna, TRANSPORT PWR, STUDIA, SEMESTR II, FIZYKA, fizyka-wyklad, zagadnienia opracowane, za
socjologia - opracowane zagadnienia(2), Uniwerek
Opracowane zagadnienia na koło z podstaw turystyki, Notatki na koła
opracowane zagadnienia ściąga nowa
chemia fizyczna wykłady, sprawozdania, opracowane zagadnienia do egzaminu Sprawozdanie ćw 7 zależ
Drobnoustroje chorobotwórcze opracowane zagadnienia
Egzamin opracowane zagadnienia 2
Opracowanie zagadnień na prawo handlowe
Podstawy biologicznego rozwoju człowieka opracowane zagadnienia z roku 14 2015
opracowane zagadnienia na egazamin
Opracowane Zagadnienia
Socjologia organizacji socjologia organizacji opracowanie zagadnien
ChMB kolokwium I opracowane zagadnienia by Owca
więcej podobnych podstron