Otrzymywanie ołowiu
Własności i zastosowanie ołowiu
Ołów (Pb) - jest pierwiastkiem chemicznym o liczbie atomowej 82, z grupy węglowców; szary, ciężki, miękki, łatwo topliwy metal odporny chemicznie; używany do wyrobów płyt akumulatorowych, aparatury chemicznej; związki ołowiu są trujące. Wartościowość + 2 i + 4 Temperatura topnienia ołowiu wynosi 327°C, a temperatura wrzenia wynosi 1740°C- Na powietrzu powierzchnia ołowiu pokrywa się ochronną warstewką tlenku. W obecności tlenu nie jest odporny na działanie kwasów.
Siarczek ołowiu, który uważany jest za podstawowy surowiec w produkcji, w stanie czystym zawiera około 86% Pb. Zawartość ołowiu w rudach siarczkowych jest znacznie mniejsza i wynosi w granicach od 2 do 4%. Rudy ołowiu są zanieczyszczone głównie skałą płonną, składającą się z krzemionki oraz węglanów wapnia i magnezu
Ze względu na matą zawartość ołowiu w rudzie poddaje się ją procesowi wzbogacania, najczęściej melodą flotacji. Otrzymane w ten sposób produkty wzbogacenia nazywa się koncentratami. Zawierają one około 35-75% ołowiu.
Ołów jest metalem miękkim i bardzo plastycznym przez co można go walcować na cienką folię. Wytrzymałość na rozciąganie jest mała i dla tego z ołowiu nie można ciągnąć drutu. Domieszki w postaci arsenu, antymonu, cynku, zwiększają jego wytrzymałość i twardość. Ołów jest metalem, który daje się łatwo obrabiać w temperaturze otoczenia Ulega on umocnieniu w czasie przeróbki ale zjawisko to zanika po kilku minutach. Praktycznie obróbka plastyczna ołowiu w temperaturze pokojowej jest obróbką na gorąco. Daje się łatwo spawać i lutować. Metaliczny ołów ma zastosowanie w przemyśle chemicznym przy produkcji kwasu siarkowego (do wykładania komór i panwi), celulozy, wapnia bielącego. Ma zastosowanie do wyrobu rur kanalizacyjnych, gazowych, przewodów do kwasu siarkowego, siarkawego i fosforowego, do przewodów elektrycznych i kabli podwodnych, ekranów ochronnych w laboratoriach radiologicznych i radiacyjnych, płyt akumulatorowych,
Ołów utwardzony antymonem (10-30%) ma zastosowanie jako meta! czcionkowy, ołów z arsenem (0,3% As) jest łatwo płynny i służy do wyrobu śrutu myśliwskiego. Znalazł on również zastosowanie do wyrobu stopów łożyskowych. Związki ołowiu są szeroko stosowane jako pigmenty o dobrze kryjących własnościach np, zasadowy węglan olowiawy Pb(OH)2*2PbCO, chromian ołowiawy PbCr04, minia ołowiana PbsOs.
3.2. Własności fizyczne, chemiczne i mechaniczne ołowiu:
1. fizyczne:
gęstość p = 11,34 [g / cm3 ]
masa atomowa MPb= 207,19
temperatura topnienia Ttop = 327,4 [°C ]
temperatura wrzenia Twrze= 17501 °C ]
ciepło właściwe 0,0309 [ kcal / gK ]
ciepło topnienia 5,51 [ kcal / kg ]
ciepło parowania 206 [ kcal / kg ]
przewodnictwo cieplne 0.084 [cal/cm -s -K ]
ciepło topnienia 6,3 [cal / g ]
ciepło parowania 222,6 [ cal / g ]
zabarwienie metaliczno-szare
miękki
opór
właściwy 0.2065 [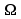 mm2/m
]
mm2/m
]
przewodność elektryczna 4, 842 [ m / Q • mm2 ]
2. chemiczne:
-ołów reaguje z wodą tworząc trudno rozpuszczalne węglany i siarczany ołowiu, które po pewnym czasie tworzą silnie przylegającą warstwę chroniącą przed dalszym atakiem wody
-odporny na działanie rozcieńczonego kwasu siarkowego, kwasu solnego i kwasu fluorowodorowego
-w powietrzu wilgotnym zawierającym dwutlenek węgla powierzchnia ołowiu staje się
matowa pokrywając warstewką tlenku Pb2O, który ulegnie przemianie w węglan
zasadowy 3PbCOs * Pb(OH)2
-ołów po stopnieniu ulega utlenieniu na Pb2O, a następnie przy podwyższeniu temperatury na PbO
-ołów rozpuszcza się w kwasie azotowym
-w temperaturze 600 [°C] ołów paruje co jest przyczyną strat w procesach metalurgicznych
-ołów jest odporny na działanie takich czynników jak woda morska, kwasu fosforowego, stężonego kwasu octowego, kwasu chromowego, amoniaku, utleniaczy i związków organicznych
3- mechaniczne-
•& wytrzymałość na rozciąganie Rm = 11.2-22,2 I Mpa ]
•> wydłużenie A,o = 21-73%
•& twardość HB = 2,5-3
•& przewężenie Z = 100%
<• udarność U = 2,3 EkG ' m / cm2!
3.3. Technologia otrzymywania ołowiu:
Otrzymywanie ołowiu z koncentratów
Koncentraty ołowiowe przerabia się na otów metodą prażenia i redukcji. Prażenie siarczkowych koncentratów ołowiowych ma na celu przemianę siarczków w tlenki i uzyskanie spieku w postaci porowatych kawałków. Prażenie przeprowadza się na urządzeniach taśmowych, Podstawową reakcją dostarczającą znacznych ilości ciepła podczas prażenia siarczków jest utlenianie według równania:
2PbS+3O2=2PbO +2SO2
Siarczek ołowiu ma budowę zwartą i z tego powodu utlenia się tylko na powierzchni ziarna. Aby uzyskać lepsze wyniki prażenia należy stosować siarczki o znacznym stopniu rozdrobnienia i zapewnić podczas procesu dobry dopływ tlenu.
Wytapianie ołowiu surowego z prażonki jest procesem redukcyjnym prowadzącym w piecach szybowych,
Do pieca szybowego wsypuje się od góry spieczoną prażonkę i koks, natomiast od dołu przez dysze wprowadza się powietrze. Tlen zawarty w powietrzu powoduje niecałkowite spalenie się koksu, a powstały tlenek węgla redukuje do czystego ołowiu. Równocześnie ulegają redukcji niektóre tlenki metali, które rozpuszczają się w ołowiu. W ten sposób surowy ołów zbiera się w garze pieca. Zawarte we wsadzie pewne ilości siarczków różnych metali nie ulegają redukcji lecz topnieją tworząc płynny kamień o temperaturze topnienia 1000°C. Składniki skały płonnej tworzą żużel o temperaturze topnienia 12000C. Produkty w garze pieca rozdzielają się według ich gęstości. Warstwę dolną stanowi ołów surowy, natomiast warstwę górną kamień i żużel. Ołów spływa po rynnie do kotła rafinacyjnego lub do specjalnych form. Żużel l kamień odprowadza się okresowo z pieca do odstojników. Po pewnym czasie w odstojniku następuje pod wpływem różnicy gęstości oddzielenie kamienia od żużla. Kamień zawierający cenne składniki podlega dalszej przeróbce, natomiast żużel przerabia się w celu odzyskania pozostałego w nim ołowiu i wydzielenia cynku- Ołów surowy zawiera mniejsze lub większe ilości miedzi, antymonu, cynku, arsenu, bizmutu, a także srebra i złota. Domieszki te w ilości 1-6% pogarszają własności plastyczne oraz jego odporność na korozję,
3.4. Rafinacja ołowiu:
Rafinację ołowiu można podzielić na trzy zabiegi:
•:• rafinację wstępną
•& usuwanie srebra i złota
•!• rafinację końcową.
Podczas rafinacji wstępnej wydziela się najpierw miedz, a następnie inne domieszki oprócz metali szlachetnych Usuwanie miedzi odbywa się w kotłach rafinacyjnych, w których podczas ochładzania do temperatury nieco wyższej od temperatury topnienia ołowiu wydziela się miedz w postaci kryształów. Wydzielona miedz z ołowiu jest lżejsza i wypływa na powierzchnie. Odmiedziowany ołów
świeży się w piecu płomieniowym. Podczas świeżenia usuwa się cynę, arsen i antymon, które tworzą
tlenki trwalsze od tlenków ołowiu,
Usuwanie srebra i złota odbywa się za pomocą cynku, który wprowadzony do roztopionego ołowiu
tworzy ze srebrem i złotem nierozpuszczalne związki. Związki cynku ze srebrem i złotem wypływają
na powierzchnię ołowiu w postaci piany. Zebrana piana poddawana jest dalszym zabiegom w celu
wydzielenia z niej szlachetnych metali. Pozbawiony ołów srebra i złota zawiera nadal bizmut, arsen,
antymon oraz inne zanieczyszczenia,
Rafinację końcową przeprowadza się trzema sposobami poprzez:
•i* utlenianie
•> chlorowanie
<• fugowanie.
Utlenianie przeprowadza się w piecu płomieniowym lub w kotle rafinacyjnym. Czynnikiem utleniającym jest powietrze zasysane do pieca naturalnym ciągiem spalin. Część tworzącego się tlenku cynku uchodzi z powietrzem, natomiast pozostała część tworzy na powierzchni ołowiu żużel-Proces chlorowania polega na przepuszczeniu gazowego chloru przez ciekły ołów. Tworzące się chlorki cynku są usuwane mechanicznie z powierzchni roztopionego metalu, Ługowanie polega na działaniu roztopionym wodorotlenkiem sodu na zanieczyszczony cynkiem ołów. Tworzy się wówczas nierozpuszczalny w ołowiu cynkan sodu Na20*ZnO, który usuwa się mechanicznie. Pozbawiony cynku ołów oczyszcza się Jeszcze z bizmutu za pomocą wapnia, który z bizmutem tworzy nierozpuszczalne związki. Związki te usuwa się z powierzchni ołowiu mechanicznie. Ołów można oczyszczać metodą elektrolizy.
3.5. Elektrolityczna rafinacja ołowiu:
W charakterze elektrolitów do rafinacji ołowiu znalazł zastosowanie elektrolit o nazwie heksafluorokrzemianowy. Elektrolit Jest otrzymywany przez neutralizację kwasu heksafluorokrzemianowego tlenkiem ołowiu:
H2SiF6 + PbO = PbSiF6 + H2O
Przez zmieszanie heksaftuorokrzemianu, ołowiu (II) z kwasem heksafluorokrzernianowym otrzymuje
się elektrolit zawierający od 40 do 80 [g / dm3] Pb2* oraz 70 do 100 [g / dm3] H2SiF6.
Anody odlewane są z ołowiu zanieczyszczonego, przeznaczonego do rafinowania o zawartości
97-99% Pb. Katody przygotowane są z ołowiu rafinowanego o zawartości Pb = 99,99% w postaci płyt
o grubości 1-2[mm]-
W procesie elektrorafinacji ołowiu zachodzą następujące reakcje:
<• na anodzie Pb = Pb2* + 2e
•:• na katodzie Pb21 + 2e = Pb
Na anodzie przebiega roztwarzanie natomiast na katodzie osadzanie się ołowiu Charakterystyczne dla procesu rafinacji ołowiu jest stosowanie małych gęstości prądu 150-250 [A / m2] Wydajność prądu w procesie elektrorafinacji jest wysoka i wynosi do 97% co wynika z nad napięcia wodoru na ołowiu. Wysoka wydajność prądu, małe napięcie między elektrodami 0,4-r0,6 [V] umożliwia rafinowanie ołowiu przy małym jednostkowym zużyciu energii elektrycznej,
Przy elektrycznym roztwarzaniu anod wraz z ołowiem do roztworu przechodzą zanieczyszczenia w postaci Zn, Co, Fe, Ni, Sn. natomiast As, Sb, Bi, Cu, Ag, Au pozostają w szlamie anodowym. Potencjał normalny ołowiu wynosi 0,12 [V]. Potencjał takich zanieczyszczeń jak Cu, As, Sb, Bi są większe i pozostają nierozpuszczalne w anodzie. Zanieczyszczenia w postaci Fe, Co, NI, Zn i Sn ulegają anodowemu roztworzeniu. Obecność kobaltu i niklu w ołowiu anodowym jest niepożądana ze względu na wydzielanie się tych zanieczyszczeń na katodzie. Najbardziej kłopotliwym zanieczyszczeniem jest cyna, która ze względu na swój potencjał równy 0,14 (V] jest zbliżona do ołowiu. Cyna z ołowiem ulega anodowemu roztwarzaniu i katodowemu wydzielaniu. Dlatego cynę usuwa się z ołowiu przez odlewanie anod lub też przy przetapianiu rafinowanego ołowiu katodowego w obecności NaOH. W wyniku elektrolitycznego rafinowania otrzymuje się ołów o zawartości 99,97-99,998% Pb i szlam anodowy, w którym koncentrują się takie cenne metale jak: srebro, złoto, bizmut oraz Inne.
ćwiczenie nr 5
Redukcja tlenku ołowiu za pomocą węgla •
Cal ćwiczenia:
Celem ćwiczenia jest zapoznanie się z procesem redukcji PbO przy użyciu reduktorów w fazie stałej, Aparaturą do wykonania ćwiczenia jest:
<• tygiel ceramiczny z określoną zawartością tlenku ołowiu i reduktora
<• piec elektryczny w którym umieszczony zostanie tygiel z PbO + C Odczynnikiem jest tlenek ołowiu.
Wykonanie ćwiczenia:
-odważenie na wadze technicznej próbki PbO -15 g
-umieszczenie próbki w przygotowanym tyglu
-obliczenie stechiometryczne ilości C:
PbO + C == 2 Pb + CO2
-odważenie obliczonej ilości C na wadze technicznej <• do tygla, w którym umieszczono uprzednio próbkę PbO wprowadziliśmy odważoną ilość C ^ zawartość tygla starannie wymieszaliśmy bagietką
•& tygiel umieściliśmy w piecu nagrzanym do temperatury 700°C na okres 75 min
^ po upływie 75 min tygiel wyjęliśmy z pieca i odlaliśmy wytopiony meta!
<* po ochłodzeniu zważyliśmy na wadze technicznej otów wytopiony z badanej próbki.
Z reakcji obliczamy ile należy wsypać węgla do tygla. Redukcja węglem:
2PbO + C = 2Pb + CO2
MPb = 207,2
MPbO= 223,2 z Mc = 12
MCO2= 44
446,4 gPbO - 12 g C 15gPbO - X g C
X=0.4gC+10%=0,44gC
Obliczamy masę teoretyczną otrzymanego ołowiu
446,4 g PbO - 414,4 g Pb 15gPbO - XgPb
X=13,92gPb
Następnie ważymy otrzymany ołów
mP - masa praktyczna
mP = 9 gPb
%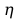 -
sprawność procesu
-
sprawność procesu
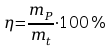
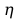 r\
=
64,65%
r\
=
64,65%
Wnioski:
Celem ćwiczenia było otrzymanie ołowiu przez redukcję tlenku ołowiu węglem Część ołowiu została w tyglu, więc nie wszystko zostało zważone.
Wyszukiwarka
Podobne podstrony:
176+ 282 29
wypociny+ 282 29
212+ 282 29
Jakie+wydarzenia+historyczne+staly+sie+tlem+Potopu+H Sienkiewicza+ 282 29
Procesy podstawowe+ 282 29
zawieszenie+ayudi80+ 282 29
cz B3owiek+jako+przedmiot+bada F1+psychologicznych+ 2811+str 29+ 282 29
users+ 282 29
209+ 282 29
nadmiar+ 282 29
198+ 282 29
miksi+tietokoneen+pit E4 E4+olla+nainen+ 282 29
zas+ 282 29
dyskografia+ 282 29
232+ 282 29
Dynamika+procesowa+i+sterowanie+ 282 29
150+ 282 29