ZESTAW 2
faza ciemna fotosyntezy typu C3 (cykl Calvina) znaczenie jego produktów Cykl Calvina - - Faza niezależna od światła zachodzi w stromie chloroplastów i polega na przyswajaniu CO2 do związku organicznego przy udziale ATP i NADPH w procesie cyklicznym bez bezpośredniego udziału światła. Cykl nazywany jest od nazwiska odkrywcy cyklem Calvina, dzieli się na trzy fazy: karboksylację, redukcję i regenerację.
W całym cyklu Calvina powstaje sześć cząsteczek aldehydu, z czego pięć zużywane jest do odtworzenia rybulozodwufosforanu, a jedna stanowi produkt końcowy fotosyntezy, służący do powstania glukozy.
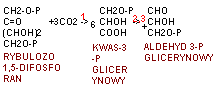
1-karboksyloza rybulozodifosforanowa
2 - kinaza fosfoglicerynianowa
3 - dehydrogenaza triozofosforanowa
Karboksylacja polega na enzymatycznym przyłączeniu CO2 do pięciowęglowego związku rybulozo-1,5-bisfosforanu; pierwotnie tworzy się przejściowy związek 6-węglowy, który rozpada się na 2 cząsteczki 3-węglowego kwasu 3-fosfoglicerynowego. Reakcję karboksylacji przeprowadza jeden z najbardziej rozpowszechnionych w świecie roślin enzymów karboksylaza/oksygenaza rybulozo-1,5-bisfosforanowa (rubisco). Rośliny, u których produktem karboksylacji jest trioza - kwas 3-fosfoglicerynowy, noszą nazwę roślin - C3.
Redukcja - podczas tej reakcji wykorzystywane są: ATP i NADPH do wytworzenia dwóch cząsteczek aldehydu 3-fosfoglicerynowego.
Regeneracja - cząsteczki 3-węglowego aldehydu 3-fosfoglicerynowego są wykorzystane do tworzenia bardziej złożonych cukrów (przede wszystkim glukozy) oraz innych związków organicznych; część trioz jest przekształcana z wykorzystaniem ATP do odtworzenia pierwotnego akceptora CO2, czyli rybulozo-1,5-bisfosforanu. Regeneracja zachodzi wieloetapowo z udziałem szeregu enzymów.
Znaczenie glukozy jest podstawowym związkiem energetycznym dla większości organizmów, Jest ona również wykorzystywana jako substrat wielu procesów zachodzących w komórce - m.in. do produkcji celulozy
cykl glioksylanowy - przebieg i rola CYKL GLIOKSYLANOWY - modyfikacja cyklu Krebsa; cykl jest rozpowszechniony u bakterii aerobowych, grzybów. Początkowe metabolity są takie same jak w cyklu Krebsa, dopiero izocytrynian pod wpływem liazy ulega rozkładowi na bursztynian i glioksylan. Glikosylan jest przekształcony w jabłczan (po reakcji acetylo-CoA) a ten w szczawiooctan. Słuzy do regeneracji szczawiooctanu. Natomiast bursztynian również jest przekształcony w jabłczan poprzez fumaran, jabłczan w cytozolu utleniony jest do szzczawioctanu, który jest przekształcony w fosfoendopirogronian. W tym cyklu kways tłuszczowe ulegają przekształceniu w cukry. Enzymy cyklu glikosylanowego są skupione w gliksysomach.
znaczenie w procesach metabolicznych
acetylo-CoA, CH3-C(O)-S-CoA, tioester kwasu octowego i koenzymu A, ważny związek metaboliczny. Acetylokoenzym A powstaje podczas β-oksydacji kwasów tłuszczowych lub dekarboksylacji oksydacyjnej kwasu pirogronowego. Jest przenośnikiem aktywowanej grupy acetylowej. Bierze udział w cyklu Krebsa. Ponadto jest wykorzystywany w organizmach żywych do syntezy acetylocholiny, cholesterolu, hormonów steroidowych.
translacji bialek to w biologii proces syntezy łańcucha polipeptydowego białek na matrycy mRNA. Proces ten katalizowany jest przez rybosomy. Translacja polega na interpretacji informacji zawartej w kolejności ułożenia nukleotydów mRNA, zgodnie z zasadami kodu genetycznego, na kolejność ułożenia reszt aminokwasowych w białku. Translacja odbywa się w kierunku od 5' do 3' mRNA, a syntetyzowane białko powstaje od końca aminowego do karboksylowego. Proces składa się z trzech etapów: inicjacji, elongacji i terminacji. Zakończenie odbywa się gdy w mRNA zostanie napotkany nonsensowny (stop) kodon nie odpowiadający żadnemu tRNA.
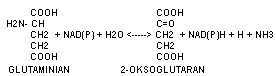
Etap translacji (odczytania, przetłumaczenia)
- zachodzi w rybosomach.
- biorą w nim udział cząsteczki tRNA.
- aminokwas łącząc się z cząsteczką tRNA ulega uaktywnieniu:
tRNA + aminokwas - aminoacylo tRNA
- cząsteczki mRNA umiejscawiają się między dwiema podjednostkami rybosomu.
- cząsteczki tRNA dostają się do rybosomu i jeśli maja antykodon komplementarny do kodonu w mRNA to zostawiają tam transportowany aminokwas.
- między aminokwasami powstają wiązania peptydowi, rybosom przesuwa się wzdłuż nici mRNA, a łańcuch peptydowy wydłuża się.
- translacja zaczyna się kodonem startowym- metionina (AUG), a kończy kodonem nonsensownym (UAA, UAG, ULG).
- translacja wymaga: udziału rybosomów, mRNA, dostatecznej ilości aminokwasów, energii, tRNA. translacja jest zatem kluczowym procesem warunkujacym zycie organizmow
znaczenie mRNA w biosyntezie mRNA powstaje w jądrze komórkowym w procesie transkrypcji z DNA. Jest syntetyzowany z trifosforanów nukleozydów. Trójki nukleotydów, czyli kodony, rozmieszczone w jego łańcuchu wyznaczają kolejność aminokwasów syntetyzowanego białka. mRNA - przenosi informację z DNA z jądra do cytoplazmy. Powstaje w wyniku transkrypcji.
Do transkrypcji niezbędna jest polimeraza RNA, która powoduje rozbicie DNA zna 2 pojedyncze łańcuchy. Jeden łańcuch DNA jest matrycą dla tworzącego się mRNA, czyli kolejność nukleotydów w DNA determinuje sekwencję nukleotydów w mRNA (w mRNA nie ma tyminy tylko jest uracyl). Drugim łańcuch helisy dobudowuje nukleotydy lub rozpada się na wolne nukleotydy niezbędne w replikacji. Pozostałe trójki nukleotydów w mRNA komplementarne do trójek w DNA (do kodu) i stanowią kodony.
W procesie transkrypcji u eukariontów powstaje najpierw pre--mRNA, jako składnik frakcji heterogennego jądrowego hnRNA. Dalszym etapem jest proces modyfikacji, w którym następuje dobieranie i łączenie z sobą fragmentów łańcucha RNA, aby powstał ostatecznie łańcuch zawierający informację o ściśle określonym białku.
Modyfikacji ulegają końce łańcucha mRNA. Modyfikacja końców mRNA, jak również obecność białek informomero-wych mają na celu ochronę informacji o cząsteczce białka zarówno podczas przebywania matrycowego RNA w jądrze komórkowym, jak i podczas jego transportu do cytosolu
B-oksydacja kw. Tłuszczowego dowolny przykład beta-oksydacja kwasów tłuszczowych - rozkład cząsteczek kwasów tłuszczowych na dwuwęglowe fragmenty, które następnie wchodzą do cyklu kwasu cytrynowego. Beta-oksydacja. W komórkach (mitochondria) kwasy tłuszczowe ulegają aktywacji do tioestrów przy udziale ATP. Dzięki temu stają się związkami reaktywnymi i wysokoenergetycznymi.Dehydrogenaza przy udziale FAD (FAD FADH2) powoduje odwodorowanie kwasów tłuszczowych w pozycji alfa, beta. Do nienasyconych kwasów tłuszczowych dołączona zostaje cząsteczka wody dając beta-hydroksykwasy. Te z kolei są utleniane przez odwodorowanie w pozycji beta, przy udziale dehydrogenazy i NAD+. Powstały tioester beta-ketokwasu przy udziale drugiej cząsteczki CoA-SH ulega tiolizie (rozpadowi) do acetylo-koenzymu A i acylo-koenzymu A (zawiera dwa węgle mniej niż poprzedni), który poddany jest ponownej beta-oksydacji. Jeden cykl obejmuje dwukrotne odwodorowanie i przenoszenie wodoru na tlen (łańcuch oddechowy) z wytworzeniem 5 cząsteczek ATP (2 cząsteczki z FADH+H, 3 cząsteczki z NADH+H) z odczepieniem acetyloCoA. Proces jest sprzężony z cyklem Krebsa i łańcuchem oddechowym. Beta oksydacja dostarcza ATP.
czynniki wpływające na aktywność enzymów Szybkość reakcji enzymatycznej uzalezniona jest od: stężenia enzymu, stężenia substratu, temperatury, pH, potencjału oksydacyjno-redukcyjnego oraz obecności substancji hamujących lub aktywujących dzialanie enzymu. Wpływ temp. Enzym jest substancją białkową i wzrost temperatury powyżej optymalnej dla jego działania powoduje stopniową denaturację i zanik właściwości katalitycznych. Optymalna temp. Dla enzymów jest zależna od ich pochodzenia dla enzymów zwierzęcych jest ona zbliżona do temp. ciała dla roślinnych jej zakres wynosi 20-30oC enzymy bakteryjne bardzo zróżnicowane optimum nawet powyżej 100oC
Wpływ pH środowisko silnie kwasne i silne zasadowe dziala denaturująco, niszcząc nieodwracalnie aktywnośc enzymów. Każdy enzym charakteryzuje się optymalnym pH, przy którym wykazuje najwiekszą aktywność. Niewielkie odchylenia od wartości optymalnej nie powodują denaturacji, ale obniżają szybkość katalizowanej reakcji. Małe zmiany pH wpływają na stopien jonizacji enzymu i substratu warunkującego tworzenie się kompleksu ES. Optimum pH dla większości enzymów znajduje się w pobliżu obojętnego lub słabo kwaśnego. Znane są jednak przykłady optymalnego działania niektórych enzymów w odczynie kwaśnym (pepsyna) lub zasadowym (trypsyna).
OD STĘŻENIA ENZYMU I STĘŻENIA SUBSTRATU przy nadmiarze substratu szybkość reakcji enzymatycznej jest wprost proporcjonalna do stężenia enzymu. Przy stałym stężeniu enzymu szybkość reakcji enzymatycznej jst w pewnych granicach zalezna od stężenia substratu. Przy bardzo niskim stężeniu substratu przyrost szybkości reakcji jest wprost proporcjonalny do stężenia substratu, natomiast przy bardzo wysokim stężeniu substratu szybkość reakcji osiąga stała wartość maksymalną, niezależna od dalszego zwiększenia stężenia substratu. WPLYW AKTYWATORÓW I INHIBITOROW większość enzymów wymaga do pełnej aktywacji czynnikow przyspieszajacych lub umożliwiających działanie. Czynniki te nazywane są aktywatorami. Aktywatorami mogą być jony metali lub aniony współdziałające z białkiem enzymu, związki regulujące potencjał redox środowiska, od którego zalezy budowa centrów aktywnych, bądź też związki odszczepiające pewne grupy chemiczne, blokujące centra aktywne. Substancje, które hamują działanie enzymów to inhibitory. Ich działanie polega na ograniczeniu możliwości utworzenia kompleksu enzym-substrat z powodu łaczenia się jednym ze składników biorących udział w reakcji.
NAD - wzór, znaczenie i reakcje z jego udziałem
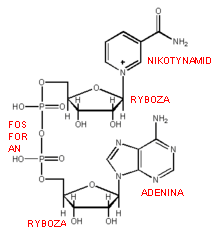
koenzym przenoszący atomy wodoru w procesie oddychania komórkowego. Jest składnikiem dużej ilości enzymów z klasy oksydoreduktaz.
Związek zbudowany z nukleozydu adeninowego oraz z nukleotydu, w skład którego wchodzi prócz reszty kwasu ortofosforowego(V) i rybozy - amid kwasu nikotynowego (witamina PP).
Mechanizm przenoszenia atomów wodoru przez NAD polega na przejściu amidu kwasu nikotynowego z postaci utlenionej w zredukowaną (NADP, reakcja redoks).
Funkcja NAD I NADP jest współdziałanie z dehydrogenazami przy odwodorowaniu substratów, którymi mogą być alkohole pierwszo i drugorzędowe, aldehydy, 2-3 hydroksykwasy, aminokwasy. Gdy uczestniczy NAD+ akceptorem protonu i elektronu jest jeden z nukleotydów flawinowych i wtedy koenzym uczestniczy w procesie pozyskiwania energii.
Przekaz protonów i elektronów z udziałem transhydrogenazy na NAD NADPH+NAD+ > NADP+ +NADH
Przemiana 2+oksoglutaranu do glutaminianu z udzialem NH3 lub odwrotnie przy współdziałaniu NAD lub NADP.
dezaminacje aminokwasów Nadmiar aminokwasów ulega w wątrobie dezaminacji (odłączenie grupy aminowej -NH2 od aminokwasu) i przemianie na glukozę lub ketokwasy. Odłączone od aminokwasów grupy -NH2 zostają przekształcone do amoniaku lub mocznika i są wydalone. Zatem w procesie dezaminacji aminokwasu wydzielony zostaje amoniak i powstaje alfa-ketokwas lub kwas nienasycony. Wyróżniamy dezaminację oksydacyjną i deazminację nieoksydacyjną.
W dezaminacji oksydacyjnej enzymy mogą współdziałać z NAD+ , NADP+ , FAD lub FMN. Do enzymów współdziałających z NAD+ lub NADP+ należy dehydogenaza glutaminianowa, która występuje w komórkach wątroby. W budowie enzym ten zawiera cynk. Katalizuje przemianę kwasu glutaminowego do kwasu alfa-ketoglutarowego i amoniaku:
Kwas glutaminowy + NAD+ + H2O <---> kwas alfa-ketoglutarowy + NH3 + NADH+H+ (NADH2 - dwunukleotyd nikotynamidoadeninowy zredukowany)
Dehydrogenaza ta może również katalizować deaminację oksydacyjną waliny i leucyny. U bakterii występuje również dehydrogenaza L-alaninowa współdziałająca z NAD+, katalizująca deaminację alaniny do pirogronianu i amoniaku.
Enzymy współdziałające z FMN i FAD w deaminacji oksydacyjnej, należą do oksydaz aminokwasowych. Produktem reakcji enzymatycznej jest iminokwas, który ulega nieenzymatycznej przemianie do amoniaku i alfa-ketokwasu. FADH2 (FAD zredukowany) powraca do formy utlenionej FAD+ po oddaniu atomów wodoru na tlen O2:
FADH2 + O2 ---> FAD+ + H2O2
W reakcji powstaje nadtlenek wodoru (H2O2), który podlega rozkładowi przy udziale peroksydazy.
Deaminacja nieoksydacyjna jest katalizowana przez enzymy nazwane deaminazami Należy tutaj amoniakoliaza asparaginianowa, która katalizuje odwracalną reakcje daminacji asparaginianu do furanu. Ta reakcja umożliwia także włączanie azotu amonowego do związków organicznych.
Wyszukiwarka
Podobne podstrony:
zestaw 6 biochemia, OGRODNICTWO UP LUBLIN, BIOCHEMIA, zestawy
Zestawy z biochemie co były na egzamnie, OGRODNICTWO UP LUBLIN, BIOCHEMIA
zestaw 4 biochemia, OGRODNICTWO UP LUBLIN, BIOCHEMIA, zestawy
zestaw 1 biochemia, OGRODNICTWO UP LUBLIN, BIOCHEMIA, zestawy
zestaw 3 biochemia, OGRODNICTWO UP LUBLIN, BIOCHEMIA, zestawy
zestaw 7 biochemia, OGRODNICTWO UP LUBLIN, BIOCHEMIA, zestawy
BIAŁKA, OGRODNICTWO UP LUBLIN, BIOCHEMIA, dodatkowe materiały
BIAŁKA ściąga, OGRODNICTWO UP LUBLIN, BIOCHEMIA
Gerbera nakolosanotatki 13-01-2014, OGRODNICTWO UP LUBLIN, ROŚLINY OZDOBNE, ozdobne II semestr
przech-sciagi, OGRODNICTWO UP LUBLIN, PRZECHOWALNICTWO
eko4, OGRODNICTWO UP LUBLIN, EKOLOGIA
Zielarstwo - wyk-ad 6 - 16.11.2010, OGRODNICTWO UP LUBLIN (buka), Semestr III, ZIELARSTWO
Ekonomia- wszystkie wykłady i ćwiczenia- ściaga, OGRODNICTWO UP LUBLIN, EKONOMIA
Sciagi warzywa, OGRODNICTWO UP LUBLIN (buka), Semestr III, WARZYWNICTWO OGÓLNE
Doniczki test, OGRODNICTWO UP LUBLIN, ROŚLINY OZDOBNE, ozdobne II semestr
botanika pytania, OGRODNICTWO UP LUBLIN, BOTANIKA
GLEBOZNAWSTWO - wykład 7 - 23.11.2009r, OGRODNICTWO UP LUBLIN, GLEBOZNAWSTWO, wykłady
szkółkarstwo 3 kolokwium, OGRODNICTWO UP LUBLIN (buka), Semestr III, SZKÓŁKARSTWO
Palmy, OGRODNICTWO UP LUBLIN, ROŚLINY OZDOBNE, ozdobne II semestr
więcej podobnych podstron