TEST 1
Najmniej trwałe układy nukleonowe występują w jądrach:
o dużym defekcie masy,
o parzystej liczbie protonów i parzystej liczbie neutronów,
o liczbie atomowej 56,
o nieparzystej liczbie protonów i nieparzystej liczbie neutronów i przewadze ilości neutronów nad ilością protonów.
Orbitale p cechuje:
symetryczny rozkład gęstości prawdopodobieństwa względem odpowiednich osi współrzędnych,
brak płaszczyzn węzłowych,
brak zależności rozmiaru orbitalu od wartości głównej liczby kwantowej,
stała wartość funkcji opisującej orbitale atomowe.
Pierwiastki o konfiguracji elektronowej powłoki walencyjnej typu ns2p6 należą do:
pierwiastków przejściowych,
pierwiastków metali ziem alkalicznych,
metali zawierających się w grupach od 3 do 12 układu okresowego,
do pierwiastków 18 grupy układu okresowego tzw. helowców.
Zgodnie z przybliżeniem Borna-Oppenheimera równowagowa długość wiązania równa się:
sumie promieni van der Waalsa atomów biorących udział w wiązaniu,
minimum energii,
sumie promieni jąder atomów biorących udział w wiązaniu,
różnicy elektroujemności atomów biorących udział w wiązaniu podzielonej przez odwrotność ilości elektronów π (więcej energii trzeba dostarczyć aby rozerwać wiązanie w etenie niż etanie).
Które z twierdzeń dotyczących diagramu poziomów energetycznych orbitali molekularny na przykładzie H2 jest fałszywe:
N orbitali atomowych może powstań N orbitali molekularnych,
diagram fazowy jest zgodny z zakazem Pauliego,
diagram fazowy jest zgodny z regułą Hunda,
orbital molekularny wiążący charakteryzuje się najniższą energią.
Promieniotwórczy potas-40 w okresie półrozpadu t1/2 = 1,25 ⋅ 109l ulega w 12% przemianie
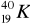
w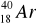
, tzn.:wychwytowi K,
przemianie β,
przemianie α,
przemianie, której towarzyszy emisja promieniowania γ.
Przemianie węgla
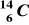
w azot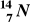
towarzyszy emisja:fali uderzeniowej,
promieniowania β,
promieniowania α,
promieniowania γ.
Zjawisko kapilarne jest efektem istnienia:
potencjału normalnego w układach redox,
napięcia powierzchniowego,
drgań rozciągających w cząsteczkach znajdujących się w roztworze,
pola elektrostatycznego.
Temperatura krytyczna to:
zysk energetyczny reakcji egzotermicznej na 1 mol substancji,
ilość ciepła jaką trzeba dostarczyć do układu, aby zaszła reakcja endotermicza,
temperatura, w której zanika powierzchnia podziału między fazami w warunkach ogrzewania cieczy w naczyniu zamkniętym,
temperatura jaka niezbędna do zainicjowania reakcji w układach homogenicznych.
Punkt potrójny na diagramie fazowym:
odpowiada takim warunkom, w których w układzie istnieją trzy różne fazy jednocześnie,
jest punktem przecięcia rzutu prostopadłego temperatury krytycznej na oś temperatury,
odpowiada warunkom normalnym,
jest punktem przecięcia dwóch linii równowagi faz.
Kwasy wieloprotonowe są:
najsłabiej zdysocjowane na pierwszym stopniu dysocjacji, znacznie mocniej na drugim i na dalszych,
zdysocjowane w równych stopniu bez względu na ilość oddanych protonów na kolejnych etapach dysocjacji,
najsilniej zdysocjowane na pierwszym stopniu dysocjacji,
związkami nie ulegającymi procesom dysocjacji, gdyż potrzebna jest znacznie większa energia do usunięcia protonu z takiej cząsteczki w porównaniu do kwasów jednoprotonowych.
Ochrona katodowa przed korozją polega na:
połączeniu żelaznego obiektu z metalem o bardziej ujemnej wartości potencjału standardowego (np. Mg, -2,36V),
pasywacji warstwą tlenków biernych chemicznie,
natrysk farby metodą elektrostatyczną,
połączeniu żelaznego obiektu z metalem o dodatniej wartości potencjału standardowego (np. Pb, 1,67V).
Izotony to:
nuklidy o tej samej liczbie atomowej i różnej liczbie neutronów w jądrze,
nuklidy o tej samej liczbie neutronów (A-Z), lecz różnych wartościach A i Z,
nuklidy o tej samej liczbie masowej A, lecz różnych liczbach atomowych Z,
nuklidy nie posiadające neutronów w jądrze.
W reakcji NH4+ + H2O → NH3 + H3O+ , kation NH4+ jest:
solą,
zasadą,
kwasem,
utleniaczem.
W reakcji HSO4 - + H2O → SO42- + H3O+ , anion HSO4 - jest:
solą,
zasadą,
utleniaczem,
reduktorem.
Zgodnie z prawem Henry'ego, jeżeli rozpuszczony w cieczy gaz jest w stanie równowagi, to stężenie gazu w roztworze jest proporcjonalne do:
ilości cząsteczek rozpuszczalnika,
prężności pary tego gazu nad powierzchnią roztworu,
objętości roztworu,
masy molowej rozpuszczalnika.
Enzym to substancja, która:
spowalnia reakcję chemiczną, ale nie ulega przy tym zmianie,
jest substratem reakcji,
powstaje jako produkt reakcji heterolitycznego rozpadu wiązania,
powoduje obniżenie energii aktywacji.
Katalizator to substancja, która:
przyspiesza reakcję chemiczną, ale nie ulega przy tym zmianie,
jest substratem reakcji,
powstaje jako produkt reakcji heterolitycznego rozpadu wiązania,
rola polega na obniżeniu energii aktywacji.
13. Każdy z czterech atomów wodoru jest połączony wiązaniem kowalencyjnym z atomem węgla. Zhybrydyzowane orbitale sp3 atomu węgla skierowane są ku wierzchołkom czworościanu foremnego. Jądra atomów wodoru znajdują się w wierzchołkach czworościanu. Powyższy opis dotyczy cząsteczki:
metanu,
etanu,
etenu,
acetylenu.
Reakcja 3KClO → 2KCl + KClO3 jest:
reakcją wymiany jonowej,
reakcją dysproporcjonowania,
rodnikową zachodzącą po etapie inicjacji,
reakcją, która nie zachodzą w warunkach naturalnych.
Reakcje dysproporcjonowanie to reakcje:
wymiany jonowej,
reakcje redoks, w których zachodzi równocześnie samoutlenienie i samoredukcja atomów tego samego pierwiastka w cząsteczce,
rodnikowe zachodzące po etapie inicjacji,
które nie zachodzą w warunkach naturalnych.
W ogniwie galwanicznym:
katoda ma niższy potencjał niż anoda,
na anodzie zachodzi proces redukcji,
w ogniwie galwanicznym, elektroda o bardziej ujemnym potencjale stanowi katodę, względem elektrody o mniej ujemnym lub dodatnim potencjale,
w efekcie zachodzącego na anodzie procesu utleniania elektrony przechodzą do elektrody nadając jej ładunek ujemny.
W odniesieniu do szeregu elektrochemicznego prawdziwe są następujące stwierdzenia:
ze wzrostem wartości ujemnej potencjału, zmniejszają się właściwości redukcyjne pierwiastków,
ze wzrostem wartości dodatnich potencjału, maleje podatność pierwiastków do przyjmowania elektronów,
w ogniwie galwanicznym, elektroda o bardziej ujemnym potencjale stanowi katodę, względem elektrody o mniej ujemnym lub dodatnim potencjale,
w układzie, w którym znajdują się pierwiastki o różnych potencjałach, nie może dojść do przepływu elektronów.
Ług sodowy NaOH jest:
mocnym elektrolitem,
słabym elektrolitem,
substancją nie ulegającą procesom dysocjacji,
substancją ulegającą procesom dysocjacji tylko w niewielkim stopniu.
Reakcje: CH3COO- + H2O ↔ CH3COOH + OH-
NH4+ + H2O ↔ NH3 + H3O+
są przykładem hydrolizy:
soli słabego kwasu i mocnej zasady,
soli mocnego kwasu i mocnej zasady,
soli mocnego kwasu i słabej zasady,
soli słabego kwasów i słabej zasady.
Zjawisko napięcia kątowego Baeyera dotyczy:
szeregu homologicznego cykloalkanów od cyklopropanu do cyklopentanu,
szeregu homologicznego cykloalkanów od cyklopropanu do cykloheksanu,
węglowodorów aromatycznych,
alkinów.
Wartość zdolności jonowymiennej:
zwiększa się wraz ze wzrostem liczby grup funkcyjnych, a zmniejsza się wraz ze stopniem usieciowania jonitu,
zmniejsza się wraz ze wzrostem liczby grup funkcyjnych, a zwiększa się wraz ze stopniem usieciowania jonitu,,
zmniejsza się wraz ze wzrostem liczby grup funkcyjnych oraz zmniejsza się wraz ze stopniem usieciowania jonitu,,
nie zależy od budowy jonitu.
Występowanie zdelokalizowanych elektronów π w cząsteczce benzenu oraz ich udział w tworzeniu wielu wiązań:
powoduje zwiększenie trwałości cząsteczki,
powoduje zmniejszenie trwałości cząsteczki,
nie ma wpływu na trwałość cząsteczki,
jest twierdzeniem nieprawdziwym, gdyż cząsteczka benzenu nie spełnia warunku Hückla.
W którym z punktów uszeregowano alkohole zgodnie ze wzrastającą ich temperaturą wrzenia:
2-metylo-1-propanol,1-propanol, 1-butanol, 1-pentanol,
1-pentanol, 1-butanol, 1-propanol, 2-metylo-1-propanol,
1-propanol, 2-metylo-1-propanol, 1-butanol, 1-pentanol,
1-propanol, 1-butanol, 2-metylo-1-propanol, 1-pentanol.
Jeżeli w rozpatrywanej cząsteczce jedyną grupą funkcyjną jest grupa hydroksylowa, połączona z grupą arylową, to dany związek jest:
alkoholem pierwszorzędowym,
alkoholem każdego rzędu,
fenolem,
taki związek nie istniej w warunkach środowiska naturalnego, gdyż nie jest możliwe utworzenie wiązania między atomem tlenu grupy hydroksylowej i atomem węgla grupy arylowej, bogatej w elektrony zdelokalizowane.
Atom węgla jest połączony z trzema innymi atomami tj.: atomem węgla, wodoru i tlenu trzema wiązaniami δ. Do utworzenia wiązań zostały wykorzystane zhybrydyzowane orbitale sp2. Wiązania te znajdują się w jednej płaszczyźnie, a kąty między nimi wynoszą 120°. Pozostały orbital p atomu węgla nakłada się z orbitalem p, tworząc wiązanie podwójne. Wiązanie podwójne występuje między atomami o różnej elektroujemności i dlatego chmura elektronowa nie jest centralnie rozmieszczona, lecz przesunięta w kierunku bardziej elektroujemnego atomu tlenu. Powyższy opis dotyczących budowy grupy funkcyjnej:
alkoholu,
aldehydu,
ketonu,
kwasu karboksylowego.
N-etylo-N-metyloanilina jest aminą:
czwartorzędową,
pierwszorzędową,
drugorzędową,
trzeciorzędową.
Zadania
Ile gramów Fe(OH)3 rozpuści się 1 dm3 wody destylowanej. Iloczyn rozpuszczalności Fe(OH)3 wynosi 6,0 ⋅ 10-38. Masy molowe: Fe - 56, O - 16, H - 1 (4 pkt).
Uzgodnij współczynniki stechiometryczne następującej reakcji chemicznej:
H2S + HNO3 ↔ H2SO4 +NO + H2O
Napisz reakcje połówkowe wskaż utleniacz i reduktor (2 pkt).
TEST 2
Najmniej trwałe układy nukleonowe występują w jądrach:
o dużym defekcie masy,
o parzystej liczbie protonów i parzystej liczbie neutronów,
o liczbie atomowej 56,
o nieparzystej liczbie protonów i nieparzystej liczbie neutronów i przewadze ilości neutronów nad ilością protonów.
Orbitale p cechuje:
symetryczny rozkład gęstości prawdopodobieństwa względem odpowiednich osi współrzędnych,
brak płaszczyzn węzłowych,
brak zależności rozmiaru orbitalu od wartości głównej liczby kwantowej,
stała wartość funkcji opisującej orbitale atomowe.
Pierwiastki o konfiguracji elektronowej powłoki walencyjnej typu ns2p6 należą do:
pierwiastków przejściowych,
pierwiastków metali ziem alkalicznych,
metali zawierających się w grupach od 3 do 12 układu okresowego,
do pierwiastków 18 grupy układu okresowego tzw. helowców.
Zgodnie z przybliżeniem Borna-Oppenheimera równowagowa długość wiązania równa się:
sumie promieni van der Waalsa atomów biorących udział w wiązaniu,
minimum energii,
sumie promieni jąder atomów biorących udział w wiązaniu,
różnicy elektroujemności atomów biorących udział w wiązaniu podzielonej przez odwrotność ilości elektronów π (więcej energii trzeba dostarczyć aby rozerwać wiązanie w etenie niż etanie).
Które z twierdzeń dotyczących diagramu poziomów energetycznych orbitali molekularny na przykładzie H2 jest fałszywe:
a N orbitali atomowych może powstań N orbitali molekularnych,
diagram fazowy jest zgodny z zakazem Pauliego,
diagram fazowy jest zgodny z regułą Hunda,
orbital molekularny wiążący charakteryzuje się najniższą energią.
Promieniotwórczy potas-40 w okresie półrozpadu t1/2 = 1,25 ⋅ 109l ulega w 12% przemianie
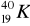
w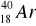
, tzn.:wychwytowi K,
przemianie β,
przemianie α,
przemianie, której towarzyszy emisja promieniowania γ.
Temperatura krytyczna to:
zysk energetyczny reakcji egzotermicznej na 1 mol substancji,
ilość ciepła jaką trzeba dostarczyć do układu, aby zaszła reakcja endotermicza,
temperatura, w której zanika powierzchnia podziału między fazami w warunkach ogrzewania cieczy w naczyniu zamkniętym,
temperatura jaka niezbędna do zainicjowania reakcji w układach homogenicznych.
Ochrona katodowa przed korozją polega na:
połączeniu żelaznego obiektu z metalem o bardziej ujemnej wartości potencjału standardowego (np. Mg, -2,36V),
pasywacji warstwą tlenków biernych chemicznie,
natrysk farby metodą elektrostatyczną,
połączeniu żelaznego obiektu z metalem o dodatniej wartości potencjału standardowego (np. Pb, 1,67V).
Izotony to:
nuklidy o tej samej liczbie atomowej i różnej liczbie neutronów w jądrze,
nuklidy o tej samej liczbie neutronów (A-Z), lecz różnych wartościach A i Z,
nuklidy o tej samej liczbie masowej A, lecz różnych liczbach atomowych Z,
nuklidy nie posiadające neutronów w jądrze.
W reakcji NH4+ + H2O → NH3 + H3O+ , kation NH4+ jest:
solą,
zasadą,
kwasem,
utleniaczem.
Zgodnie z prawem Henry'ego, jeżeli rozpuszczony w cieczy gaz jest w stanie równowagi, to stężenie gazu w roztworze jest proporcjonalne do:
ilości cząsteczek rozpuszczalnika,
prężności pary tego gazu nad powierzchnią roztworu,
objętości roztworu,
masy molowej rozpuszczalnika.
Enzym to substancja, która:
spowalnia reakcję chemiczną, ale nie ulega przy tym zmianie,
jest substratem reakcji,
powstaje jako produkt reakcji heterolitycznego rozpadu wiązania,
powoduje obniżenie energii aktywacji.
13. Każdy z czterech atomów wodoru jest połączony wiązaniem kowalencyjnym z atomem węgla. Zhybrydyzowane orbitale sp3 atomu węgla skierowane są ku wierzchołkom czworościanu foremnego. Jądra atomów wodoru znajdują się w wierzchołkach czworościanu. Powyższy opis dotyczy cząsteczki:
metanu,
etanu,
etenu,
acetylenu.
Reakcja 3KClO → 2KCl + KClO3 jest:
reakcją wymiany jonowej,
reakcją dysproporcjonowania,
rodnikową zachodzącą po etapie inicjacji,
reakcją, która nie zachodzą w warunkach naturalnych.
W ogniwie galwanicznym:
katoda ma niższy potencjał niż anoda,
na anodzie zachodzi proces redukcji,
w ogniwie galwanicznym, elektroda o bardziej ujemnym potencjale stanowi katodę, względem elektrody o mniej ujemnym lub dodatnim potencjale,
w efekcie zachodzącego na anodzie procesu utleniania elektrony przechodzą do elektrody nadając jej ładunek ujemny.
Ług sodowy NaOH jest:
mocnym elektrolitem,
słabym elektrolitem,
substancją nie ulegającą procesom dysocjacji,
substancją ulegającą procesom dysocjacji tylko w niewielkim stopniu.
Reakcje: CH3COO- + H2O ↔ CH3COOH + OH-
NH4+ + H2O ↔ NH3 + H3O+
są przykładem hydrolizy:
soli słabego kwasu i mocnej zasady,
soli mocnego kwasu i mocnej zasady,
soli mocnego kwasu i słabej zasady,
soli słabego kwasów i słabej zasady.
Zjawisko napięcia kątowego Baeyera dotyczy:
szeregu homologicznego cykloalkanów od cyklopropanu do cyklopentanu,
szeregu homologicznego cykloalkanów od cyklopropanu do cykloheksanu,
węglowodorów aromatycznych,
alkinów.
Wartość zdolności jonowymiennej:
zwiększa się wraz ze wzrostem liczby grup funkcyjnych, a zmniejsza się wraz ze stopniem usieciowania jonitu,
zmniejsza się wraz ze wzrostem liczby grup funkcyjnych, a zwiększa się wraz ze stopniem usieciowania jonitu,,
zmniejsza się wraz ze wzrostem liczby grup funkcyjnych oraz zmniejsza się wraz ze stopniem usieciowania jonitu,,
nie zależy od budowy jonitu.
Występowanie zdelokalizowanych elektronów π w cząsteczce benzenu oraz ich udział w tworzeniu wielu wiązań:
powoduje zwiększenie trwałości cząsteczki,
powoduje zmniejszenie trwałości cząsteczki,
nie ma wpływu na trwałość cząsteczki,
jest twierdzeniem nieprawdziwym, gdyż cząsteczka benzenu nie spełnia warunku Hückla.
W którym z punktów uszeregowano alkohole zgodnie ze wzrastającą ich temperaturą wrzenia:
2-metylo-1-propanol,1-propanol, 1-butanol, 1-pentanol,
1-pentanol, 1-butanol, 1-propanol, 2-metylo-1-propanol,
1-propanol, 2-metylo-1-propanol, 1-butanol, 1-pentanol,
1-propanol, 1-butanol, 2-metylo-1-propanol, 1-pentanol.
Jeżeli w rozpatrywanej cząsteczce jedyną grupą funkcyjną jest grupa hydroksylowa, połączona z grupą arylową, to dany związek jest:
alkoholem pierwszorzędowym,
alkoholem każdego rzędu,
fenolem,
taki związek nie istniej w warunkach środowiska naturalnego, gdyż nie jest możliwe utworzenie wiązania między atomem tlenu grupy hydroksylowej i atomem węgla grupy arylowej, bogatej w elektrony zdelokalizowane.
Atom węgla jest połączony z trzema innymi atomami tj.: atomem węgla, wodoru i tlenu trzema wiązaniami δ. Do utworzenia wiązań zostały wykorzystane zhybrydyzowane orbitale sp2. Wiązania te znajdują się w jednej płaszczyźnie, a kąty między nimi wynoszą 120°. Pozostały orbital p atomu węgla nakłada się z orbitalem p, tworząc wiązanie podwójne. Wiązanie podwójne występuje między atomami o różnej elektroujemności i dlatego chmura elektronowa nie jest centralnie rozmieszczona, lecz przesunięta w kierunku bardziej elektroujemnego atomu tlenu. Powyższy opis dotyczących budowy grupy funkcyjnej:
alkoholu,
aldehydu,
ketonu,
kwasu karboksylowego.
N-etylo-N-metyloanilina jest aminą:
czwartorzędową,
pierwszorzędową,
drugorzędową,
trzeciorzędową.
Zadania
Ile gramów Fe(OH)3 rozpuści się 1 dm3 wody destylowanej. Iloczyn rozpuszczalności Fe(OH)3 wynosi 6,0 ⋅ 10-38. Masy molowe: Fe - 56, O - 16, H - 1 (4 pkt).
Uzgodnij współczynniki stechiometryczne następującej reakcji chemicznej:
H2S + HNO3 ↔ H2SO4 +NO + H2O
Napisz reakcje połówkowe wskaż utleniacz i reduktor (2 pkt).
Wyszukiwarka
Podobne podstrony:
testy 1rok egz2, Inżynieria Środowiska PW semestr I, chemia, sesja
11. testy 1rok v4, Inżynieria Środowiska PW semestr I, chemia, sesja
10. testy 1rok egz6, Inżynieria Środowiska PW semestr I, chemia, sesja
testy 1rok egz3, Inżynieria Środowiska PW semestr I, chemia, sesja
8. testy 1rok vegz, Inżynieria Środowiska PW semestr I, chemia, sesja
12. testy 1rok egz4, Inżynieria Środowiska PW semestr I, chemia, sesja
16. egzamin test 1rok, Inżynieria Środowiska PW semestr I, chemia, sesja
13. egzamin 17 09 04, Inżynieria Środowiska PW semestr I, chemia, sesja
SESJA ZIMOWA 2006, Inżynieria Środowiska PW semestr I, chemia, sesja
zestawy 28 pyt Ai B mini, Inżynieria Środowiska PW semestr I, chemia, sesja
wszystkie pytania - ciąg - sciąga - długopisy, Inżynieria Środowiska PW semestr I, chemia, sesja
egzamin test v3, Inżynieria Środowiska PW semestr I, chemia, sesja
sciaga chemia, Inżynieria Środowiska PW semestr I, chemia, sesja
egzamin 2004sciaga, Inżynieria Środowiska PW semestr I, chemia, sesja
więcej podobnych podstron