SPRAWOZDANIE Z ĆWICZENIA NR 2- OGNIWA GALWANICZNE
Grupa II:
Michał Październik
Adam Pośpiech
Paweł Pietrzykowski
Grzegorz Wiszowaty
Ćw.1. Pomiar siły elektromotorycznej ogniwa stężeniowego |
||
Data |
Ocena |
Podpis asystenta |
Tabela 1. Wynik pomiarów
Stężenie roztworów CuSO4 [mol/l] |
Siła elektromotoryczna [V] |
||||
C1 |
C2 |
E1 |
E2 |
E3 |
Eśr |
0,001 0,001 0,001 |
0,05 0,025 0,01 |
0,0254 0,0176 0,0108 |
0,0246 0,0165 0,0100 |
0,0235 0,0156 0,0095 |
0,0245 0,0165 0,0101 |
Wartość siły elektromotorycznej ogniwa stężeniowego dla podanych stężen, obliczona ze wzoru Nernsta wynosi:
dla C1 =0,001mol/l, dla C2 = 0, 05 mol/l SEM = 0,0500V
dla C1 =0,001mol/l, dla C2 = 0,025 mol/l SEM = 0,0410V
dla C1 =0,001mol/l, dla C2 = 0,01 mol/l SEM = 0.0295V
Obliczenia:
SEM = ![]()
dla C1 =0,001mol/l, dla C2 = 0, 05 mol/l
SEM = ![]()
= ![]()
= 0,0500V
dla C1 =0,001mol/l, dla C2 = 0,025 mol/l
SEM = ![]()
= ![]()
= 0,0410V
dla C1 =0,001mol/l, dla C2 = 0,01 mol/l
SEM = ![]()
= ![]()
= 0.0295V
Ćw.2. Pomiar siły elektromotorycznej ogniwa Daniella |
||
Data |
Ocena |
Podpis asystenta
|
Tabela 2. Wyniki pomiarów
Schemat ogniwa |
Siła elektromotoryczna [V] |
|||
|
Pomiar 1 |
Pomiar 2 |
Pomiar 3 |
Wartość średnia |
Zn|ZnSO4||CuSO4|Cu |
1,0857 |
1,0866 |
1,0872 |
1,0865 |
Siła elektromotoryczna badanego ogniwa, obliczona ze wzoru Nernsta, wynosi 1,0996V
Obliczenia:
[ZnSO4] = [CuSO4] = 0,1 mol/l
E0 badanego ogniwa = E0 Cu|Cu2+ - E0 Zn|Zn2+ = 0,337V - (-0,7626V)= 1,0996V
SEM= E0 - ![]()
= 1,0996V- ![]()
= 1,0996V
Ćw.3. Pomiar potencjału elektrody srebrowej |
||
Data |
Ocena |
Podpis asystenta |
Tabela 3. Wyniki pomiarów
Schemat ogniwa |
Siła elektromotoryczna [V] |
|||
|
Pomiar 1 |
Pomiar 2 |
Pomiar 3 |
Wartość średnia |
Hg,Hg2Cl2 | Cl-|| AgNO3 | Ag |
0,4452 |
0,4461 |
0,4457 |
0,4456 |
Potencjał elektrody srebrowej (na podstawie zmierzonej wartości SEM badanego ogniwa):
E0 Ag+|Ag = SEM+ E0 kalomelowej = 0,4456V+ 0,242V= 0,6876V
Potencjał elektrody srebrowej obliczony z równania Nernsta (E0 Ag+|Ag = +0,799V) wynosi 0,723V.
Obliczenia:
E Ag+|Ag = E0 Ag+|Ag + ![]()
= 0,799V - 0,076V = 723V
Ćw.4. Pomiar potencjału oksydacyjno- redukcyjnego |
||
Data |
Ocena |
Podpis asystenta |
Schemat ogniwa:
Hg,Hg2Cl2 | Cl-||Fe2+, Fe3+|Pt
Tabela 4. Wyniki pomiarów.
Siła elektromotoryczna[V] |
|||
Pomiar 1 |
Pomiar 2 |
Pomiar 3 |
Wartość średnia |
0,4503 |
0,4464 |
0,4458 |
0,4475 |
Potencjał elektrody oksydacyjno-redukcyjnej (na podstawie zmierzonej wartości SEM badanego ogniwa)
E Fe2+|Fe3+ = SEM + E0 kalomelowej = 0,4475V+ 0,242V= 0,6895V
Wartość E Fe2+|Fe3+ obliczona teoretycznie wynosi 0,771V
Obliczenia:
[Fe2+] = [Fe3+] = 0,1 mol/l
E Fe2+|Fe3 = E0 Fe2+|Fe3+ +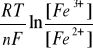
= 0,771V
Ćw.5. Pomiar ΔG, ΔS, ΔH dla reakcji zachodzącej w ogniwie galwanicznym |
||
Data |
Ocena |
Podpis asystenta |
Tabela 5. Wyniki pomiarów
T [K] |
E [V] |
ΔE [V] |
|
293 298 303 308 313 |
0,373 0,396 0,400 0,404 0,488 |
0,023 0,004 0,004 0,084 |
0,0046 0,0008 0,0008 0,0168 |
Obliczyć (metodą najmniejszych kwadratów) współczynniki funkcji E(T):
a = 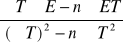
= 0,0047
b = 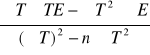
= -1
Równanie funkcji E(T): E = 0,0047xT-1
Znając równanie funkcji możemy wyznaczyć współczynnik temperaturowy SEM:
![]()
= 0,0047
Obliczamy ΔG, ΔS, ΔH dla reakcji przebiegających w ogniwie w warunkach standardowych:
ΔG = -nFE298 = -2x96500x0,4006 = -77,31 KJ/mol
ΔS = nF![]()
= 2x96500x0,0047= 907,1 J/mol x K
ΔH = nF[T![]()
- E298] = 2x96500x(298x0,0047- 0,4006)=193000 KJ/mol
Wyszukiwarka
Podobne podstrony:
Ćwiczenie nr 4, ZiIP, II Rok ZIP, Obróbka skrawaniem, Obrobka skrawaniem, Obróbka skrawaniem
SPRAWOZDZANIE Z ĆWICZENIA NR 6, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdani
sprawko z ćwiczenia 11, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
SPRAWOZDANIE Z ĆWICZENIA 4, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z
Sprawozdanie z cwiczenia 19, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z
sprawko z ćwiczenia 11, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
SPRAWOZDANIE Z farmako, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
Napiecie powierzchniowe, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fiz
janka, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizycznej 1, Sprawozd
Wspolczynnik podzialu, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyc
sprawko z przewodnictwa poprawione, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawoz
Farmakokinetyka, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizycznej 1
Adsorpcja, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizycznej 1, Spra
Sprawozdanie z cw III poprawiona, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozda
inwersja sacharozy, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyczne
sprawko z refraktometrii, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fi
sprawozdanie z ćw.7, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyczn
więcej podobnych podstron