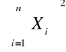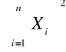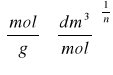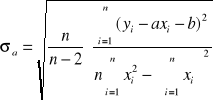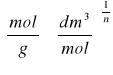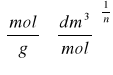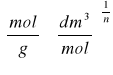Wrocław, 13.12.06r.
Grupa II:
Michał Październik
Paweł Pietrzykowski
Adam Pośpiech
Grzegorz Wiszowaty
Ćwiczenie nr 10
Adsorpcja
Cel ćwiczenia:
Wyznaczenie parametrów izoterm Freundlicha dla adsorpcji kwasu organicznego na węglu aktywnym.
Tabela 1. Przygotowane roztwory kwasu octowego w kolbach miarowych o pojemności 100 ml.
Numer roztworu |
1 |
2 |
3 |
4 |
5 |
Kwas (ml) |
30 |
25 |
20 |
15 |
10 |
Woda (ml) |
70 |
75 |
80 |
85 |
90 |
Wzory:
CH3COOH + NaOH CH3COONa + H2O
![]()
![]()
, gdzie x/m - ilość adsorbatu zaadsorbowana na jednostkę masy adsorbentu
k, n - stałe charakterystyczne dla układu adsorbat-adsorbent,
C2 - stężenie kwasu po adsorpcji.
Badana zależność:
![]()
, gdzie (opis jak wyżej)
Dane:
CmNaOH= |
0,1073 |
[mol/l] |
Masa próbki węgla aktywowanego(mC)= |
2,00 |
[g] |
Objętość CH3COOH wzięta do miareczkowania (V)= |
0,01 |
[dm3] |
VNaOH przed ads.[ml] |
VNaOH po ads.[ml] |
C1[mol/l] |
C2[mol/l] |
C1Vk-C2Vk [mol] |
x/m[mol/g] |
21,9 |
13,6 |
0,2350 |
0,1459 |
0,00445 |
0,00223 |
17,95 |
10,7 |
0,1926 |
0,1148 |
0,00389 |
0,00194 |
14,1 |
7,8 |
0,1513 |
0,0837 |
0,00338 |
0,00169 |
11 |
5,2 |
0,1180 |
0,0558 |
0,00311 |
0,00156 |
7,1 |
2,65 |
0,0762 |
0,0284 |
0,00239 |
0,00119 |
Gdzie Vk = 0,05 l
C1= VNaOH przed ads. x 0,1073M/10ml
C2 = VNaOH po ads x 0,1073M/10 ml
Postać liniowa izotermy Freundlicha:
![]()
Obliczenia współczynnika a (1/n) oraz b (log k) metodą najmniejszych kwadratów:
log C2(X) |
log x/m (Y) |
XY |
X2 |
-0,8359 |
-2,6524 |
2,217024 |
0,6987 |
-0,9400 |
-2,7111 |
2,5485 |
0,8836 |
-1,0773 |
-2,7721 |
2,98642 |
1,1606 |
-1,2534 |
-2,8080 |
3,519579 |
1,5710 |
-1,5462 |
-2,9231 |
4,519564 |
2,3906 |
Σx = -5,6527
Σy = -13,8668
Σxy = 15,791
Σx2 = 6,7045
(Σx)2 = 31,9534
a = 1/n = 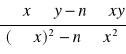
= 0,3635 , stąd n = 1/a = 2,75103
b= log k = 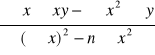
= -2,36239, stąd k = 10-2,36239 = 4,34x10-3 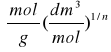
Obliczenia:
Tabela 2. Wyniki miareczkowania mianowanym 0,1093 mol/l NaOH 10 ml objętości poszczególnych roztworów kwasu przed adsorpcją.
Numer roztworu |
Wyniki miareczkowania |
Stężenie kwasu (C1 [mol/l]) |
||
|
Miareczkowanie I 0,1093 mol/l NaOH [ml] |
Miareczkowanie II 0,1093 mol/l NaOH [ml] |
Wartość średnia miareczkowania 0,1093 mol/l NaOH [ml] |
|
1 |
30,25 |
30,30 |
30,275 |
0,3309 |
2 |
24,70 |
24,80 |
24,75 |
0,2705 |
3 |
20,10 |
20,20 |
20,15 |
0,2202 |
4 |
15,10 |
15,10 |
15,10 |
0,1650 |
5 |
10,15 |
10,10 |
10,175 |
0,1109 |
Tabela 3. Wyniki miareczkowania mianowanym 0,1093 mol/l NaOH 10 ml objętości poszczególnych roztworów kwasu po adsorpcji.
Numer roztworu |
Wyniki miareczkowania |
Stężenie kwasu (C2 [mol/l]) |
||||
|
Miareczkowanie I 0,1093 mol/l NaOH [ml] |
Miareczkowanie II 0,1093 mol/l NaOH [ml] |
Wartość średnia miareczkowania 0,1093 mol/l NaOH [ml] |
|
||
1 |
23,65 |
23,70 |
23,675 |
0,2588 |
||
2 |
18,50 |
18,60 |
18,55 |
0,2028 |
||
3 |
14,50 |
14,40 |
14,45 |
0,1579 |
||
4 |
10,50 |
10,50 |
10,50 |
0,1148 |
||
5 |
5,90 |
5,90 |
5,90 |
0,06449 |
||
Tabela 4. Ilość moli kwasu (adsorbatu) zaadsorbowana na jednostke masy węgla aktywnego (adsorbentu).
Numer roztworu |
Ilość moli CH3COOH zaadsorbowanych na węglu aktywowanym (C1V-C2V) |
mC [g] |
x/m [mol/g] |
1 |
0,000721 |
2 |
0,000361 |
2 |
0,000677 |
2 |
0,000339 |
3 |
0,000623 |
2 |
0,000312 |
4 |
0,000502 |
2 |
0,000251 |
5 |
0,000464 |
2 |
0,000232 |
Tabela 5. Parametry równania regresji.
Xi |
Yi |
Xi*Yi |
Xi2 |
|||||
-0,5870 |
-3,4425 |
2,020866 |
0,344611 |
|||||
-0,6929 |
-3,4698 |
2,404336 |
0,480155 |
|||||
-0,8016 |
-3,5058 |
2,810348 |
0,642591 |
|||||
-0,9401 |
-3,6003 |
3,384516 |
0,883709 |
|||||
-1,1905 |
-3,6345 |
4,326914 |
1,417308 |
|||||
|
-4,2122
|
|
17,742219 |
|||||
|
-17,6530
|
|
18,841873 |
|||||
|
74,734903 |
|
|
|||||

|
-4,2122 |
|
-17,6530 |
|
14,946981 |
|
17,742219 |
|
3,768375 |
|
18,841873 |
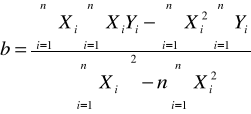
a= |
0,3436 |
b= |
-3,2411 |
r= |
0,9678 |
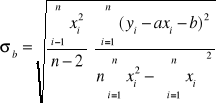
Błędy pomiaru
Błąd a= |
0,1032 |
Błąd b= |
|
Wykres zależności lg(x/m)=f(lgC2)
Podsumowanie (Parametry izotermy Freundlicha):
![]()
, gdzie x/m - ilość adsorbatu zaadsorbowana na
jednostkę masy adsorbentu,
k, n - stałe charakterystyczne dla układu adsorbat-adsorbent,
C2 - stężenie kwasu po adsorpcji.
Z powyższej zależności, przedstawiającej postać liniową izotermy Freundlicha możemy wywnioskować:
![]()
![]()
,
gdzie a,b - współczynniki regresji liniowej
a= |
0,3436 |
|
b= |
-3,241 |
|
Δa= |
0,1032 |
|
Δb= |
0,0896 |
|
![]()
![]()
po uwzględnieniu błędu ![]()
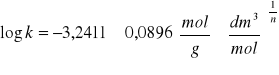
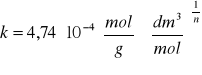
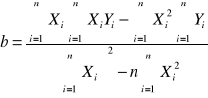
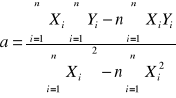
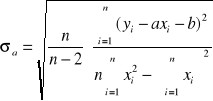
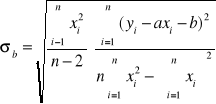
Wyszukiwarka
Podobne podstrony:
SPRAWOZDANIE Z farmako, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
sprawko z ćwiczenia 11, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
Napiecie powierzchniowe, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fiz
janka, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizycznej 1, Sprawozd
Wspolczynnik podzialu, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyc
sprawko z przewodnictwa poprawione, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawoz
79, Farmacja, II rok farmacji, I semstr, fizyczna
SPRAWOZDANIE Z ĆWICZENIA NR 2, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania
Farmakokinetyka, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizycznej 1
Sprawozdanie z cw III poprawiona, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozda
inwersja sacharozy, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyczne
sprawko z refraktometrii, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fi
sprawozdanie z ćw.7, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyczn
SPRAWOZDANIE Z ĆWICZENIA 4, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z
Przewodnictwo elektrolitów, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z
Ogniwa galwaniczne, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyczne
więcej podobnych podstron