Dysocjacja elektrolityczna
Kryształy w strukturze jonowej oraz substancje złożone z cząstek o silnie spolaryzowanym wiązaniu kowalencyjnym ulegają w roztworze wodnym lub innego rozpuszczalnika o dużej wartości stałej dielektrycznej, ułatwiającego odsuwanie się od siebie jonów, procesowi całkowitej lub w dość znacznym stopniu zaawansowanej dysocjacji elektrolitycznej. Elektrolity, które ulegają całkowitej dysocjacji noszą nazwę elektrolitów mocnych. Elektrolity o budowie niejonowej lub słabo spolaryzowanym wiązaniu atomowym ulegają dysocjacji w nieznacznym stopniu. Są to elektrolity słabe. Między tymi grupami krańcowymi istnieje grupa elektrolitów o średniej mocy. Przykładami mocnych elektrolitów w roztworach wodnych są kwasy nieorganiczne: nadchlorowy, siarkowy, solny, wodorotlenki alkaliczne, czwartorzędowe zasady amoniowe oraz ich sole, sole metali alkalicznych i metali ziem alkalicznych, nadchlorany i azotany metali.
Stopień dysocjacji wyraża się stosunkiem liczby cząstek, które uległy dysocjacji elektrolitycznej, do całkowitej liczby cząstek w roztworze.
Należy zaznaczyć, że moc elektrolitu nie stanowi jego cechy gatunkowej. Jest ona w dużym stopniu zależna także od rozpuszczalnika oraz stężenia roztworu.
Równowagi kwasowo - zasadowe
Zgodnie a teorią protonową jonizacja kwasu może nastąpić tylko w rozpuszczalniku mającym właściwości protonowoakceptorowe. Proces ten przebiega zgodnie z ogólnym zapisem reakcji kwasowo - zasadowych , z tym, że rolę zasady odgrywa rozpuszczalnik S:
HA + S = A- + SH+
SH+ jest postacią , w której występuje jon wodorowy w danym środowisku.W przypadku wody nosi on nazwę jonu hydronowego(oksonowego), w przypadku ogólnym jonu lionowego. Stała jonizacji kwasowej jest, więc określona równaniem:
Ka = 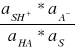
Taka definicja stałej jonizacji kwasu przewiduje wpływ zmian aktywności rozpuszczalnika na równowagę między zjonizowaną i niezjonizowaną postacią kwasu, który może być znaczy w przypadku roztworów stężonych. jeśli rozpatrywane są roztwory rozcieńczone , to można przyjąć, że aS = 1 ,niezależnie od stężeń elektrolitu i wtedy:
Ka = 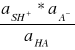
Jonizacja zasady może nastąpić tylko wtedy,kiedy rozpuszczalnik może odszczepiać protony. Proces jonizacji polega wtedy na reakcji
B + SH = BH+ + S-
stała zaś jonizacji zasady określona jest równaniem:
Kb = 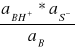
jeśli pominie się aktywność rozpuszczalnika.
Wpływ rozpuszczalnika na jonizację kwasów i zasad. Leżące u podstaw teorii protonowej BrÖnsteda ujęcie jonizacji kwasów i zasad w roztworach jako procesów wymiany protonu rozpuszczalnikiem prowadzi do wniosku ,że moc kwasów i zasad jest funkcją nie tylko ich właściwości, ale również właściwości rozpuszczalnika. Klasyczna teoria Arrheniusa-Ostwalda wiązała wpływ rozpuszczalnika na dysocjację elektrolitów jedynie z wartością jego przenikalności elektrycznej. Przenikalność elektryczna odgrywa decydującą rolę w przypadku dysocjacji i asocjacji elektrolitów,które w stanie stałym tworzą jonowe sieci krystaliczne. W przypadku jonizacji kwasów i zasad istotniejszą rolę odgrywają jednak inne, specyficzne cechy rozpuszczalnika ,decydujące o energii jego wiązania z protonem. Jonizacji kwasów sprzyja duże powinowactwo rozpuszczalnika do protonu, tzn. jego zasadowość. Rozpuszczalniki takie noszą nazwę protonofilowych. Tak np. kwas octowy, który zachowuje się jak słaby kwas w roztworach wodnych, jest prawie całkowicie zjonizowanych w roztworach w ciekłym amoniaku, chociaż względna przenikalność elektryczna amoniaku(22 w -34ႰC) jest znacznie mniejsza od względnej przenikalności elektrycznej wody (78,5 w 25ႰC).Jonizacja kwasu octowego w ciekłym amoniaku przebiega według równania:
CH3COOH + NH3 = CH3COO- + NH![]()
Jon amonowy jest postacią, w której jon wodorowy występuje w środowisku amoniaku. Również inne kwasy zachowujące się jak słabe w roztworach wodnych są w ciekłym amoniaku całkowicie jonizowane. To niwelujące działanie rozpuszczalników zasadowych na jonizację kwasów utrudnia rozróżnianie ich mocy. Woda jest rozpuszczalnikiem słabiej protonofilowanym niż amoniak, ale również w roztworach wodnych szereg mocnych kwasów ulega praktycznie 100% jonizacji. Można się spodziewać, że jonizacja mocnych kwasów będzie znacznie słabsza, jeśli rozpuszczalnikiem będzie substancja mniej profilowana od wody. Warunek ten spełnia np. .bezwodny kwas octowy. Kwasy uznane za mocne na podstawie uch właściwości w roztworach wodnych, w roztworach, w których rolę rozpuszczalnika odgrywa bezwodny kwas octowy, są zjonizowane w nieznacznym stopniu, przy czym jonizacja ta zachodzi według równania:
HA + CH3COOH = CH3COOH![]()
+ A-
Na podstawie pomiarów przewodnictwa roztworów mocnych kwasów w kwasie octowym można pod względem mocy uszeregować je w następującej kolejności:
HClO4>HBr>H2SO4>HCl>HNO3
Odwrotny jest wpływ poszczególnych grup rozpuszczalników na jonizację zasad. Rozpuszczalniki słabej protonogenowe od wody osłabiają jonizację rozpuszczonych w nich zasad, natomiast rozpuszczalniki silniej protonogenowe sprzyjają jej. Tak np. słabe zasady, jakimi są aminy alifatyczne i aromatyczne, ulegają daleko posuniętej jonizacji wtedy, kiedy rozpuszczalnikiem jest kwas octowy, lub jeszcze lepiej, ciekły fluorowodór. Jonizacja np. pirydyny w kwasie octowym zachodzi według równania:
C5H5N + CH3COOH = C5H5NH+ + CH3COO-
Jon octanowy jest tu odpowiednikiem jonu wodorotlenowego w roztworach wodnych, tzn. jest jonem lianowym. Szereg rozpuszczalników, a wśród nich woda, kwas octowy, amoniak, wskazuje zarówno właściwości protonofilowe, jak i protonogenowe. W rozpuszczalnikach takich ,zwanych amfiprotonowymi, może następować zarówno jonizacja kwasów ,jak i zasad. W reakcji z kwasami rozpuszczalnik amfiprotonowy odgrywa rolę zasady (przyłącza proton),w reakcji z zasadami odgrywa rolę kwasu(odszczepia proton).Rozpuszczalniki tego typu również w nieobecności obcej zasady czy kwasu ulegają w nieznacznym stopniu procesowi zwanemu autojonizacją lub autoprotolizą. Oznaczając cząsteczkę rozpuszczalnika amfiprotonowego symbolem SH można proces autojonizacji zapisać w sposób następujący:
2SH = SH![]()
+ S-
S-jest jonem lianowym,SH![]()
- jonem lionowym.
Osobną grupę stanowią rozpuszczalniki, których cząsteczki nie mogą być ani donorami, ani akceptorami protonów. Są to rozpuszczalniki aprotonowe lub obojętne. Kwasy albo zasady rozpuszczone w takich rozpuszczalnikach tworzą roztwory nie przewodzące prądu elektrycznego. Przykładem rozpuszczalników tego typu może być benzen, inne ciekawe węglowodory lub chlorowcowodory. Roztwory kwasu octowego lub pirydyny w benzenie nie zawierają jonów. Mimo to roztwory takie nie są pozbawione cech kwasowych lub zasadowych. Jonizacja kwasów lub zasad nie jest zjawiskiem warunkującym ich kwasowe lub zasadowe działanie .Tak np. w rozpuszczalnikach, o których mowa, kwasy i zasady powodują charakterystyczne zmiany barwy wskaźników kwasowo-zasadowych oraz zobojętniają je wzajemnie.
Zobojętnienie-rekcje zobojętniania między kwasami a zasadami w rozpuszczalnikach obojętnych polegają na bezpośredniej wymianie protonu. W przypadku reakcji zobojętniania przebiegających w rozpuszczalnikach amfiprotonowych w wymianie protonu może pośredniczyć rozpuszczalnik. Na przykład zobojętnienie mocnego kwasu mocną zasadą w roztworze wodnym sprowadza się wistocie do reakcji:
H3O+ + OH- Ⴎ 2H2O
Ponieważ w roztworze takim nośnikami właściwości kwasowych i zasadowych są jony odpowiednio H3O+ i OH-.W związku z tym efekt cieplny takiej reakcji nie zależy od rodzaju kwasu i zasady i wynosi -57,3 kJ*mol-1(-13,7kcal*mol-1).
Hydroliza. W wyniku odszczepienia protonu przez cząsteczkę kwasu octowego
CH3COOH + H2O = CH3COO- + H3O+
Powstaje anion octanowy, który jest zasadą ,ponieważ ma on możliwość przyłączania protonu. Reakcja jonizacji kwasu octowego nie przebiega do końca,lecz prowadzi do stanu równowagi określonego wartością stałej jonizacji, której odpowiada określone stężenie jonów octanowych oraz nie zjonizowanego kwasu octowego. Podobnie, po wprowadzeniu do roztworu wodnego jonów octanowych w postaci soli np. octanu sodowego, reagują one zgodnie ze swoim zasadowym charakterem z wodą, odgrywającą w tym przypadku rolę kwasu:
CH3COO- + H2O = CH3COOH + OH-
Proces ten nazywany jest hydrolizą. Analogiczna reakcja w środowisku bezwodnym nosi nazwę solwolizy. Reakcja hydrolizy w rozpatrywanym przypadku prowadzi również do stanu równowagi między jonami octanowymi i niezjonizowanym kwasem octowym. Stała jonizacji kwasu jest związana prostą zależnością ze stałą równowagi reakcji hydrolizy. Stała jonizacji określona jest równaniem:
Ka = 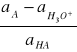
Natomiast stała hydrolizy soli tego kwasu z mocną zasadą równaniem:
Kh = 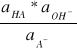
W istocie rzeczy stała hydrolizy jest w tym przypadku stałą zasadowości anionu A-. Zamiast mówić o hydrolizie soli słabego kwasu możemy mówić o zasadowej reakcji anionu tego kwasu. Łącząc równania otrzymujemy:
Ka* Kh = kW
Gdzie kw = a![]()
+ aOH- nosi nazwę iloczynu jonowego wody. Z równania tego wynika, że iloczyn stałej jonizacji kwasu przez stałą zasadowości (czyli stałą hydrolizy) sprzężonej z nim zasady jest równy iloczynowi jonowemu wody. Stałe te są więc względem siebie odwrotnie proporcjonalne .Znajomość stałej jonizacji kwasu pozwala na obliczenia stałej hydrolizy jego soli z mocną zasadą.
Analogiczne zależności są słuszne w przypadku hydrolizy soli słabej zasady z mocnym kwasem. Jako przykład możemy rozpatrzyć reakcję zasadową amoniaku i hydrolizę jego soli z mocnym kwasem. Jonizacja amoniaku w wodzie przebiega według równania:
NH3 + H2O = NH![]()
+ OH-
Natomiast hydroliza soli amonowej polega na reakcji:
NH![]()
+ H2O = NH3 + H3O+
Gdy cząsteczkę amoniaku (ogólnie słabej zasady) oznaczymy przez B, zaś cząsteczkę sprzężonego z nią kwasu przez BH+, wówczas stała jonizacji zasady Kb i stała hydrolizy jego soli Kh będą określone równaniem:
Kb = 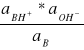
oraz
Kh = 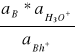
Łącząc otrzymujemy zależność
KbKh = kW
Jeśli sól powstała w wyniku zobojętniania słabego kwasu słabą zasadą, to jej hydroliza prowadzi do odtworzenia zarówno wolnego kwasu, jak i wolnej zasady. Zachodzą wtedy reakcje:
A- + H2O = AH + OH-
BH+ + H2O = B + H3O+
Oraz
H3O+ + OH- = 2H2O
Sumaryczna reakcja jest więc następująca:
A- + BH+ = AH + B
Stała hydrolizy jest w tym przypadku określona przez
Kh = 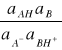
Podstawiając
![]()
= ![]()
i ![]()
= ![]()
Oraz:
aH3O+ aOH- = kW
otrzymujemy zależność:
Kh = ![]()
Elektrolity amfoteryczne. Grupa kwasowa i grupa zasadowa mogą wchodzić w skład tego samego związku, który nosi wtedy nazwę elektrolitu amfoterycznego. Najbardziej znanymi przedstawicielami elektrolitów amfoterycznych są aminokwasy. Ich budowę można przedstawić wzorem NH2RCOOH.W przypadku tej grupy związków obok zwykłych reakcji kwasowo-zasadowych może zachodzić również wewnątrzcząsteczkowa wymiana protonu:
H2N.R.COOH = +H3N.R.COO-
Stężenie powstających jonów dwubiegunowych jest funkcją względnej mocy(kwasowej i zasadowej) obu grup, a ponadto funkcją pH roztworu W roztworach kwaśnych powstają jony +H3N.R.COOH,w roztworach zasadowych zaś jony H2N.R.COO-.Przy pewnej wartości pH roztworu, zwanej punktem izoelektrycznym, steżenia obu tych jonów są jednakowe, stężenia zaś jonów dwubiegunowych osiąga maksimum. Wartość pH punktu izoelektrycznego określona jest równaniem:
pHizoel = ½ logK1 - ½ logK2
przy czym K1 oznacza stałą kwasowości kwasu sprzężonego z obojętną cząsteczką,tzn.+H3N.R.COOH,zaś K2 stałą kwasowości cząsteczki +H3N.R.COO-.
Punkt izoelektryczny elektrolitów amfoterycznych jest ich ważną cechą charakterystyczną. Punktowi temu odpowiada minimum przewodnictwa elektrycznego, ciśnienia osmatycznego oraz lepkości roztworu. Roztwory koloidalne białek, które są amfolitami o wielu grupach funkcyjnych, ulegają najłatwiej koagulacji w punkcie izoelektrycznym.
Barwa substancji
Barwa substancji jest ściśle związana z jej widmem absorpcyjnym. Jeśli maksima przypadają w obszarze światła widzialnego to substancja posiada barwę. Substancje bezbarwne mają minimum w całym obszarze światła widzialnego. Cząsteczki w których występują wiązania ၳ i do zmiany tworzących je elektronów wymagana jest dość znaczna energia posiadają na ogół maksima absorpcyjne leżące w obszarze ultrafioletu, a więc są substancjami bezbarwnymi. Jeśli natomiast do zmiany stanów energetycznych elektronów wymagana jest mniejsza energia, wówczas maksima absorpcyjne przesunięte są w obszar fal dłuższych.
Ugrupowanie atomów, w których występują wiązania wielokrotne zawierające wiązanie ၰ lub też charakterystyczne grupy, w których występujące elektrony ulegają stosunkowo łatwemu wzbudzeniu, noszą nazwę grup chromoforowych lub chromoforów. Przykładowo można wymienić tutaj C=C, N=N, C=O, NO2 .Substancje, których cząsteczki zawierają grupy chromoforowe, mają maksima absorpcyjne w obszarze bliskiego ultrafioletu lub światła widzialnego. Obecność większej liczby grup chromoforowych wzmacnia oczywiście efekt przesówania widma w stronę fal dłuższych. Efekt ten jest szczególnie silny wówczas, gdy występuje układ wiązań podwójnych sprzężonych. Pojawienie się większej liczby tych wiązań powoduje obniżenie różnicy energii między stanem podstawowym i wzbudzonym. Istotną rolę odgrywają tutaj uwspólnione elektrony p tworzące wiązania ၰ.
Oprócz chromoforów istotną rolę, polegającą na wzmocnieniu ich działania, odgrywają gr.auksochromowe. W skład nich wchodzą takie, jak np.-NR2,-OR, gdzie R może być rodnikiem alkilowym lub atomem wodoru, które przesówają maksima absorpcyjne w stronę fal dłuższych. Inne, np. CH3CO-,C6H5CO-,których obecność w cząsteczce powoduje przesunięcie maksimum w stronę fal krótszych , noszą nazwę grup hipsochromowych.
Benzen mający układ trzech uwspólnionych wiązań ၰ posiada maksima absorpcyjne w obszarze bliskiego ultrafioletu. Sprzężenie ich z wiązaniami podwójnymi występującymi w łańcuchu bocznym, jak np. w dwufenylopolienach C6H5-(CH=CH)-C 6H5, przesuwa widmo w kierunku fal dłuższych.Obserwuje się tu stopniowe przejście od związku jeszcze bezbarwnego, jakim jest stilben.C6H5-CH=CH-C6H5,do związków barwnych. W ślad za zwiększeniem się liczby n grup -(CH=CH)- barwa zmienia się od żółtej przez zieloną i pomarańczową do miedziano-czerwonej, którą uzyskuje się dla n=8.
Wprowadzenie do łańcucha bocznego grupy =CH2 izoluje układ wiązań podwójnych sprzężonych i powoduje przesunięcie widma absorpcyjnego na powrót w stronę fal krótszych. Związek C6H5-(CH=CH)4-C6H5 jest np. zielonożółty, a C6H5-(CH=CH)4-CH2-C6H5-bezbarwny.
Grupy chromoforowe znajdujące się w tej samej cząsteczce wzmacniają swoje działanie wówczas, gdy usytuowane są tuż obok siebie lub tworzą układ sprzężony, a gdy są w większym oddaleniu to każda działa niezależnie od siebie.
Wskaźniki (indykatory) substancje, które zmieniają barwę w zależności od stężenia jonów wodorowych (H+) w roztworze. Na ogół są to substancje mające charakter słabego kwasu HA, lub słabej zasady B. W postaci niezdysocjowanej mają inną barwę niż w postaci jonowej. Każdy wskaźnik zmienia swoją barwę po przekroczeniu charakterystycznej dla nieg wartości pH roztworu, przy czym zmiana ta nie następuje skokowo, lecz w pewnym zakresie pH (patrz tabela). Dla wskaźnika, jak dla słabego kwasu (zasady) można zapisać reakcję dysocjacji oraz wzór na stałą równowagi:
, stąd
(ostatnie równanie z właściwości logarytmów). Ze wzorów wynika, że gdy jest duże stężenie jonów wodorowych (niska wartość pH) przeważa stężenie formy niezdysocjowanej - obserwujemy barwę-1 wskaźnika, natomiast przy dużych wartościach pH przeważa forma zdysocjowana i obserwujemy barwę-2 wskaźnika. Przy pH roztworu równym pKa ±1 obserwujemy barwę przejściową (wypadkową barwy-1 i barwy-2.
kg
Wyszukiwarka
Podobne podstrony:
KRTB-odlewn-zagadnienia 2015, Studia Politechnika Poznańska, Semestr VIII (MiBM), Kierunki rozwoju t
Krzysztof Serafin - zagadnienia, Studia, Politechnika Wrocławska, Filozofia Szczęścia
Zagadnienie1, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egza
zagadnienie 3, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egz
zagadnienie 9, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egz
Zagadnienie16, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egz
ZAGADNIENIA NA EGZAMIN Z FIZY, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABO
zagadnienia chemia wody, Politechnika Wrocławska, Inżynieria Środowiska, II rok, Chemia wody
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
CH.F.L9, Studia, Politechnika
zagadnienie 9, ● STUDIA EKONOMICZNO-MENEDŻERSKIE (SGH i UW), prawo handlowe
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
podstawowe informacje o ochronie prawnej wzorów przemysłowych, Studia - Politechnika Śląska, Zarządz
Sprawko spawalnictwo 1, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 semestr, obro
dziadek25, Studia, Politechnika
więcej podobnych podstron