Roztwór - układ wieloskładnikowy jednofazowy, utworzony
przez rozpuszczalnik i ciała rozpuszczane.
• składnik roztworu będący w przewadze ilościowej nosi nazwę rozpuszczalnika,
• pozostałe składniki są rozpatrywane jako substancje rozpuszczone.
Rozróżnia się:
• ze względu na stan skupienia: roztwory gazowe, ciekłe i stałe.
• ze względu na spełnienie warunku o jednakowym współczynniku aktywności wszystkich składników (równym jedności) i zachowaniu (lub odstępstwie) od prawa Raoulta (ciecze) i Daltona (gazy): roztwory doskonałe i rzeczywiste.
Maksymalną liczbę gramów substancji, jaką w danych warunkach ciśnienia i temperatury można rozpuścić w 100 g rozpuszczalnika tworząc roztwór nasycony nazywamy rozpuszczalnością.
W danej temperaturze istnieje stan równowagi dynamicznej pomiędzy roztworem a nadmiarem substancji rozpuszczonej. W jednostce czasu tyle samo molekuł przechodzi z kryształu do roztworu co wbudowuje się w sieć krystaliczną. Roztwór ten nazywamy roztworem nasyconym. Dla każdej temperatury istnieje inny stan równowagi pomiędzy stężeniem substancji w roztworze, a jej nadmiarem.
Stężenie roztworu - zawartość substancji rozpuszczonej odniesiona do ilości
rozpuszczalnika lub całego roztworu.
Istnieje wiele sposobów wyrażania stężenia roztworów. Różnią się one między sobą tylko jednostkami, w których podaje się ilości substancji rozpuszczonej, rozpuszczalnika lub roztworu.
W praktyce chemicznej stężenia roztworów wyraża się najczęściej w:
• procentach - wagowych lub objętościowych (stężenie procentowe, %)
• molach w 1 dm3 roztworu (stężenie molowe, mol/dm3]
• molach w 1 kg rozpuszczalnika (stężenie molarne, mol/kg)
• ułamkach molowych składników tworzących roztwór (x)
• gramorównoważnikach w 1 dm3 roztworu (stężenie normalne gR/dm3)
• Stężenie procentowe roztworu Cp
Cp jest określane:
• liczbą jednostek wagowych (mg, g, kg, Mg) substancji rozpuszczonej zawartych w 100 jednostkach wagowych (mg, g, kg, Mg) roztworu - stężenie procentowe wagowe
• liczbą jednostek objętościowych (cm3, dm3, ml) substancji rozpuszczonej zawartych w 100 jednostkach objętościowych (cm3, dm3, ml) roztworu - stężenie procentowe objętościowe
W a + b jednostek wagowych roztworu znajduje się a jednostek wagowych substancji rozpuszczonej, to w 100 jednostkach wagowych roztworu znajduje się Cp jednostek wagowych substancji rozpuszczonej, czyli;
a + b j. wag. roztworu ── a j. wag. Substancji
100 j. wag. roztworu ── Cp j. wag. substancji
Z powyższego otrzymujemy wzór na stężenie procentowe:
![]()
a - liczba jednostek wagowych substancji rozpuszczonej
b - liczba jednostek rozpuszczalnika
Cp - stężeniem procentowym roztworu
• Stężenie molowe roztworu Cm Cm jest liczbą moli substancji rozpuszczonej w 1 dm3 roztworu
Stężenie molowe możemy wyrazić wzorem
![]()
nj - ilość moli składnika j,
V - objętość roztworu
Ilość moli składnika nj możemy obliczyć z wzoru:
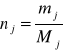
mj - masa substancji j,
Mj - masa molowa substancji j
Wstawiając wyrażenie na nj do wzoru na Cm otrzymamy
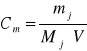
• Stężenie molarne (molarność)
jest wielkością określającą liczbę moli substancji rozpuszczonych w 1 kg rozpuszczalnika (lub liczbę mmoli substancji rozpuszczonych w 1 g rozpuszczalnika). Jednostką stężenia molarnego jest mol/kg.
Roztwór p─molalny sporządza się rozpuszczając p moli substancji w 1 kg rozpuszczalnika. Stężenie molarne jest dość rzadko stosowane, używa się go m.in. w pomiarach ebulioskopowych i krioskopowych.
• Stężenie normalne (normalność)
określa liczbę gramorównoważników substancji zawartej w 1 dm3 roztworu.
Normalność definiuje się jako:
![]()
gdzie: n - masa substancji rozpuszczonej
R - masa 1 gramorównowaznika tejże substancji
V - objętość roztworu w dm3
Stężenia normalne najczęściej stosowane są w alkali- i acydymetrii. Roztwory o jednakowej normalności zobojętniają się w jednakowych objętościach np. 100 cm3 1 n H2SO4 zobojętnia 100 cm3 1 n KOH.
• Ułamek molowy
Ułamek molowy xj składnika nj w roztworze określa udział liczby moli danego składnika w całkowitej liczbie moli fazy mieszanej.
Zależność między, oraz jest następująca:
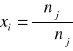
xj - ułamkiem molowym składnika
nj - liczbą moli tego składnika
Σnj - ogólną liczbą moli składników tworzących roztwór
Dla dwuskładnikowego roztworu ułamki molowe obu komponentów są opisane równaniami: ![]()
oraz ![]()
Czyli: x1+x2=1
Wyszukiwarka
Podobne podstrony:
Zagadnienie1, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egza
zagadnienie 3, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egz
Zagadnienie16, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egz
chemia 10, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
pyt. 15, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
6b, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
10.2, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
pyt. 15, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
6a, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
Zagadanienie 7, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, eg
5, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
8, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
14 - chemia, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzam
19, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
17, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
chemia 2, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
11, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
chemia 10, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
więcej podobnych podstron