Topnienie - przemiana fazowa, polegająca na przejściu substancji ze stanu stałego w stan ciekły.
Zjawisko topnienia ściśle wiąże się ze zjawiskiem krzepnięcia. Oznaczana eksperymentalnie temperatura topnienia nie zawsze jednak odpowiada ściśle temperaturze krzepnięcia. Wynika to m.in. z wpływu zanieczyszczeń, szybkości schładzania lub ogrzewania, tworzeniem zarodków krystalizacji oraz ze zjawisk powierzchniowych i międzyfazowych.
Krzepnięcie - proces przechodzenia ciała ze stanu ciekłego w stan stały. Krzepnięcie wielu substancji zachodzi w określonej temperaturze zwanej temperaturą krzepnięcia (dla wody 0 °C). W miejscu styku substancji w stanie stałym i stanie ciekłym w cieczy i w ciele stałym podczas krzepnięcia i topnienia jest taka sama temperatura zwana temperaturą topnienia. Temperatura topnienia jest podawana jako wielkość charakterystyczna dla wielu substancji. Temperatura topnienia (krzepnięcia) zależy nieznacznie od ciśnienia. Krzepnięciu towarzyszy wydzielanie ciepła co jest równoważne temu, że krzepnięcie przy stałym ciśnieniu wymaga odprowadzenia ciepła z krzepnącej substancji. Ilość ciepła wydzielanego podczas krzepnięcia wyraża się wzorem
gdzie
ct - ciepło krzepnięcia (topnienia)
m - masa substancji
Skraplanie lub kondensacja - zjawisko zmiany stanu skupienia, przejścia substancji z fazy gazowej w fazę ciekłą. Przeciwieństwo parowania.
Skraplanie może zachodzić przy odpowiednim ciśnieniu i w temperaturze niższej od temperatury krytycznej. Zestaw parametrów; ciśnienie i temperatura, dla których rozpoczyna się proces skraplania nazywany jest punktem rosy.
Kondensacja wiąże się ze zmniejszeniem odległości między cząsteczkami substancji. Spadek temperatury powoduje, że cząsteczki poruszają się wolniej. Siły oddziaływania między nimi wzrastają, aż do momentu uzyskania nowego stanu równowagi. Przy tym zachodzi wydzielanie energii w postaci ciepła. Cząsteczki tworzą zwartą masę, jednak nie powstają między nimi trwałe wiązania charakterystyczne dla ciał stałych.
Parowanie (ewaporacja) - proces zmiany stanu skupienia, przechodzenia z fazy ciekłej danej substancji w fazę gazową (parę) zachodzący z reguły na powierzchni cieczy. Może odbywać się w całym zakresie ciśnień i temperatur, w których mogą współistnieć z sobą obie fazy.
Szybkość procesu parowania zależy od temperatury oraz ciśnienia parcjalnego pary nad cieczą. Gdy ciśnienie pary jest równe ciśnieniu pary nasyconej w danej temperaturze, to parowanie nie zachodzi. Stan też określa się jako równowagę między parowaniem a skraplaniem. Obniżenie ciśnienia oraz napływ gazu o mniejszym stężeniu pary, zwiększa szybkość parowania. Gdy ciśnienie pary nasyconej zrówna się z ciśnieniem otoczenia, wówczas proces parowania - zwany wówczas wrzeniem - zaczyna zachodzić również w całej objętości cieczy.
Parowanie zachodzi wtedy, gdy cząsteczka ma dostatecznie wysoką energię kinetyczną, by wykonać pracę przeciwko siłom przyciągania między cząsteczkami cieczy.
Sublimacja - przemiana fazowa bezpośredniego przejścia ze stanu stałego w stan gazowy z pominięciem stanu ciekłego. Zjawisko odwrotne do sublimacji to resublimacja.
Po raz pierwszy najdokładniej proces ten opisał nieznany alchemik średniowieczny zwany pseudo-Geberem (XII w.). W następnych wiekach sublimacja stała się procesem powszechnie stosowanym w laboratoriach chemicznych. Sublimację wyzyskuje się w laboratoriach i w przemyśle do oczyszczania względnie wydzielania z mieszanin substancji takich jak jod, kamfora, salmiak, naftalen, antracen i in.
Resublimacja (desublimacja) - przejście fazowe, polegające na bezpośrednim przechodzeniu substancji z fazy gazowej (pary) w fazę stałą z pominięciem stanu ciekłego. Resublimacja jest procesem odwrotnym do sublimacji. W wyniku resublimacji wody (pary wodnej) powstaje szron. Resublimacja, w połączeniu z sublimacją lub parowaniem, jest wykorzystywana do oczyszczania lub rozdzielania substancji i otrzymywania jej w postaci drobnych kryształów (jest to m.in. metoda oczyszczania jodu).
Reguła faz Gibbsa - zależność obowiązująca dla każdego układu będącego w równowadze termodynamicznej, łącząca liczbę faz w układzie, liczbę składników niezależnych oraz liczbę stopni swobody:
gdzie:
s - liczba stopni swobody, czyli liczba zmiennych intensywnych, które można zmieniać bez jakościowej zmiany układu (bez zmiany liczby faz w równowadze)
α - liczba niezależnych składników, a więc takich, które nie dają się określić za pomocą zależności chemicznych poprzez stężenia innych składników (niezależnych).
β - liczba faz, a więc postaci materii jednorodnej chemicznie i fizycznie (np. roztwór, faza gazowa, kryształy o określonym składzie)
Dla układów w których zachodzą reakcje chemiczne często podaje się również inną (w pewnym sensie uproszczoną) wersję reguły faz:
gdzie:
r - liczba reakcji chemicznych zachodzących w układzie
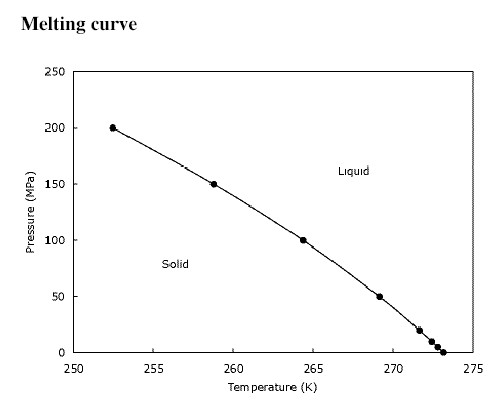
Zmiany temperatury topnienia i wrzenia ze zmianą ciśnienia
Ciśnieniem normalnym nazywamy ciśnienie równe ciśnieniu atmosferycznemu, czyli około 1014 hPa. Przy takim ciśnieniu temperatura wrzenia wody wynosi 100°C, a temperatura topnienia 0°C. Jeżeli ciśnienie jest mniejsze od ciśnienia normalnego, woda wrze w niższej temperaturze. Natomiast im wyższe ciśnienie, tym, wyższa temperatura wrzenia. Temperatura topnienia zmienia się odwrotnie - ze wzrostem ciśnienia maleje temperatura topnienia (woda topi się w coraz niższej temperaturze).
Zależności temperatur wrzenia i topnienia od ciśnienia nie da się wyrazić jakimś prostym wzorem, można je jedynie wyznaczyć doświadczalnie. Na przykład dla wody kilka punktów doświadczalnych zamieszczono poniżej:
Ciśnienie [hPa] |
Temperatura wrzenia [°C] |
23,4 |
20 |
123,5 |
50 |
475,1 |
80 |
702,3 |
90 |
980,1 |
99 |
1430,2 |
110 |
Zwiększanie temperatury wrzenia ze wzrostem ciśnienia jest charakterystyczne dla wszystkich cieczy. Zjawisko to jest bardzo często wykorzystywane do otrzymywania bardzo niskich temperatur, za pomocą skraplania pod wysokim ciśnieniem gazów takich jak hel czy azot.
Inaczej sytuacja ma się w przypadku temperatur topnienia. Zależnie od tego, czy ciecz przy ochładzaniu zwiększa czy zmniejsza swoją objętość, zmiany ciśnienia mają różny wpływ. Jeżeli ciecz, tak jak woda, zwiększa swoją objętość w czasie krzepnięcia, to zwiększenie ciśnienia spowoduje obniżenie temperatury topnienia. Zmniejszenie ciśnienia spowoduje, że ciesz będzie krzepnąć wyższej temperaturze. Na przykład dla wody, temperatura topnienia zmienia się o około 0,007°C na 1 atm.
Jeżeli ciecze zmniejszają swoją objętość podczas krzepnięcia, na przykład parafiny, to wzrost ciśnienia powoduje wzrost temperatury topnienia. In niższe ciśnienie, tym w niższej temperaturze topi się ciało. Dla parafiny zmiana temperatury topnienia z ciśnieniem wynosi około 0,04 stopnia na 1 atm.
Wyszukiwarka
Podobne podstrony:
chemia 10, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
pyt. 15, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
10.2, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
pyt. 15, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
Zagadnienie1, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egza
6a, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
Zagadanienie 7, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, eg
5, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
8, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
14 - chemia, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzam
19, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
zagadnienie 3, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egz
zagadnienie 9, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egz
Zagadnienie16, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egz
17, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
chemia 2, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
11, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
chemia 10, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
więcej podobnych podstron