Nr ćw. 8 |
Data 29.03.07 |
Nagórski Artur |
Semestr II |
Grupa C Nr Lab. 1 |
Wydział Technologii Chemicznej |
Prowadząca: Dr Inż. Monika Jakubowska |
Ocena: |
||
Temat: Reakcje kompleksowania
Wykonanie ćwiczenia
Ocena reakcji kompleksowania na podstawie zmiany barwy.
Do płytki porcelanowej, w której wgłębieniach umieszczono po jednej kropli nasyconego roztworu tiocyjanianu amonowego dodać z pipety kapilarnej po jednej kropli roztworu następujących jonów: Fe3+, Ni2+, Co2+, Cu2+. Obserwować kolory otrzymanych roztworów.
Do płytki porcelanowej, w której wgłębieniach umieszczono po jednej kropli 2M roztworu NH4OH dodać z pipety kapilarnej kolejno kroplę roztworu jonów: Zn2+, Cd2+, Cu2+, Ni2+ oraz Co2+. Obserwować kolory otrzymanych roztworów.
Stopniowe tworzenie kompleksów.
Do czterech probówek zawierających po 2 - 4 cm3 roztworu, Co2+, dodać kolejno: 5, 15, 25 kropli oraz ok. 2 cm3 nasyconego roztworu tiocyjanianu amonowego. Po dokonaniu oceny intensywności barwy, każdy z roztworów rozcieńczyć do równej objętości. Ponownie ocenić intensywność zabarwienia roztworu.
Do probówki zawierającej 1 - 2 kropli roztworu jonów Fe3+ dodać 1 cm3 stężonego HCl oraz 1 - 2 kropli roztworu SCN-. Po zaobserwowaniu barwy kompleksu, dopełnić probówkę wodą i z tak otrzymanego roztworu pobrać do czterech probówek kolejno 1, 2, 3, 15 cm3 i dopełnić probówki wodą do równej objętości. Porównać zabarwienie otrzymanych roztworów.
Roztwór buforowy związku kompleksowego.
Do probówki zawierającej 0,5 - 1 cm3 roztworu EDTA oraz 2 - 3 krople roztworu tiocyjanianu, dodawać ostrożnie po kropli roztwór zawierający jony Fe3+ aż do momentu pojawienia się czerwonego zabarwienia (określenie czułości reakcji kompleksowania).
Do wgłębienia płytki porcelanowej dodać po 2 krople nasyconego roztworu tiocyjanianu amonowego. Następnie przygotować z roztworu 0,1 M Fe3+ pięć kolejnych roztworów przez kolejne dziesięciokrotne rozcieńczenie wodą. Do kolejnych wgłębień płytki dodawać przy pomocy kapilary po jednej kropli roztworu Fe3+ o stężeniu 10-1, 10-2, 10-3, 10-4, 10-5, 10-6. Na podstawie obserwacji zabarwienia ocenić czułość roztworu na jony Fe3+.
Do probówki zawierającej ok. 1 cm3 roztworu Cu2+ dodać ok. 9 cm3 wody. Przez kolejne rozcieńczenie otrzymanego roztworu w proporcji 1: 10 przygotować serię czterech roztworów Cu2+ o malejącym stężeniu. Do każdej z probówek dodać kilka kropli 6 M roztworu NH4OH. Porównać intensywność zabarwienia roztworów.
2. Opracowanie wyników i wnioski.
1.1
Lp. |
Me+n |
Wzór kompleksu |
Barwa |
pK |
1. |
Fe3+ |
Fe(SCN)63- |
Krwistoczerwona |
3,6 |
2. |
Ni2+ |
Ni(SCN)42- |
Seledynowa |
1,9 |
3. |
Co2+ |
Co(SCN)42- |
Jasny róż |
0,8 |
4. |
Cu2+ |
Cu(SCN)42- |
Limonkowa |
6,3 |
1. |
Zn2+ |
Zn(NH3)42+ |
Bezbarwna |
6,71 |
2. |
Cd2+ |
Cd(NH3)42+ |
Bezbarwna |
7,11 |
3. |
Cu2+ |
Cu(NH3)42+ |
Ciemny niebieski |
12,0 |
4. |
Ni2+ |
Ni(NH3)62+ |
Błękitna |
12,6 |
5. |
Co2+ |
Co(NH3)62+ |
Zgniła zieleń |
7,93 |
Reakcje:
Fe3+ + 6SCN- ↔ Fe(SCN)63-
Ni2+ + 4SCN- ↔ Ni(SCN)42-
Co2+ + 4SCN- ↔ Co(SCN)42-
Cu2+ + 4SCN- ↔ Cu(SCN)42-
Zn2+ + 4NH3 ↔ Zn(NH3)42+
Cd2+ + 4NH3 ↔ Cd(NH3)42+
Cu2+ + 4NH3 ↔ Cu(NH3)42+
Ni2+ + 6NH3 ↔ Ni(NH3)62+
Co2+ + 6NH3 ↔ Co(NH3)62+
Jak wynika z przeprowadzonego doświadczenia kompleksy mają różne zabarwienia a intensywność zabarwienia zależy od trwałości kompleksu ( im kompleks jest trwalszy tym zabarwienie jest bardziej intensywne)
1.2
Zaobserwowałem barwę jasno różową w probówkach, w których dodawałem roztwór kroplami, w ostatniej probówce roztwór przyjął barwę różową.
Po rozcieńczeniu roztworów do równej objętości, barwy roztworów uległy rozjaśnieniu. W miarę rozcieńczenia barwa kompleksu zanika co prowadzi do wniosku - im mniej tiocyjanku tym barwa jest jaśniejsza.
Co2+ + SCN- → CoSCN+
CoSCN+ + SCN- → Co(SCN)2
Co(SCN)2+ SCN- → Co(SCN)3-
Co(SCN)3-+ SCN- → Co(SCN)42-
Fe3+ + Cl- ↔ FeCl2+
FeCl2+ + Cl- ↔ FeCl2+
FeCl2+ + Cl- ↔ FeCl3
FeCl3 + Cl- ↔ FeCl4-
FeCl4- + Cl- ↔ FeCl52-
FeCl52-+ Cl- ↔ FeCl63-
Fe3+ + SCN- ↔ FeSCN2+ pK1 = 3,1
FeSCN2+ + SCN- ↔ Fe(SCN)2+ pK2 = 1,6
Fe(SCN)2+ + SCN- ↔ Fe(SCN)3 pK3 = 0,3
Fe(SCN)3 + SCN- ↔ Fe(SCN)4- pK4 = -0,1
Fe(SCN)4- + SCN- ↔ Fe(SCN)52- pK5 = -0,3
Fe(SCN)52- + SCN- ↔ Fe(SCN)63- pK6 = -1
Po dodaniu stężonego HCl roztwór odbarwił się na kolor żółto-zielony. Świadczy to o utworzeniu kompleksu chlorkowego z Fe3+, po dodaniu SCN- barwa zmieniła się na krwistoczerwoną. Świadczy to o utworzeniu kompleksu trwalszego - tiocyjankowego z Fe3+. Po dodaniu wody barwa uległa rozjaśnieniu przechodząc w odcienie pomarańczy.
1.3.1
1 kropla - jasny żółty
2 kropla - słomkowy
3 kropla - jasny pomarańczowy
4 kropla - czerwony intensywny
5 kropla - krwistoczerwony
Y4- + Fe3+ ↔ FeY-
Fe3+ + SCN- ↔ FeSCN2+
1.3.2
Kolor zabarwienia roztworów tiocyjankowych z jonami Fe3+ w miarę rozcieńczania znika.
10-1 M - krwistoczerwony
10-2 M - czerwony
10-3 M - pomarańczowy
10-4 M - jasno pomarańczowy
10-5 M - jasno żółty
10-6 M - prawie bezbarwny
1.3.3
Kolor kompleksu Cu(NH3)2 zmienia się w zakresie barwy od niebieskiego do prawie bezbarwnego. Im mniejsze stężenie tym kolor jest jaśniejszy i mniej intensywny.
10-1 M - niebieski
10-2 M - jasny niebieski
10-3 M - lekko błękitny
10-4 M - prawie bezbarwny
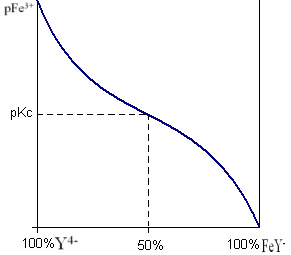
Buforujące działanie ma roztwór Fe3+/Fe EDTA wobec jonów SCN-. W zależności od ilości jonów Fe3+ pojawia się zabarwienie roztworu po dodaniu jonów SCN-. Dopóki w roztworze znajdują się jony EDTA to każda porcja jonów Fe3+ jest wiązana w trwalszy kompleks Fe3+/Fe EDTA. Dopiero po odpowiednim rozcieńczeniu pojawi się krwistoczerwona barwa świadcząca o kompleksie FeSCN-.
Wyszukiwarka
Podobne podstrony:
reakcje w układzie kwas-zasada, Study =], CHEMIA, laborki chemia nieorganiczna
badanie właściwości redoks kompleksów Fe, chemia nieorganiczna, laboratorium, Chemia nieorganiczna
skala pH, laborki chemia nieorganiczna
bufory, Study =], CHEMIA, laborki chemia nieorganiczna
odczyn roztworów wodnych soli, laborki chemia nieorganiczna
ZWIĄZKI KOMPLEKSOWE, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
Cw9 Reakcje kompleksowania II, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
Cw8 Reakcje kompleksowania I, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna
reakcje kompleksowania 111, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna n
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
sprawko z kompleksy I, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie or
Laborki PŁ, bio, Chemia, Biofizyka, Toksykologia, Chemia Nieorganiczna i Ogólna
reakcje w roztworach maturalne, Nauka, CHEMIA, Szkoła, Chemia Nieorganiczna
nieorg reakcje kompleksowania
Mechanizmy reakcji chemicznych, Studia, Chemia organiczna i nieorganiczna
sprawko z kompleksów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie org
Sole podwójne i związki kompleksowe. Preparatyka i właściwości, chemia nieorganiczna
kompleksy, chemia nieorganiczna
dr Wawrzyniak, chemia nieorganiczna, sprawodzanie Szybkość reakcji chemicznych i równowaga chemiczna
więcej podobnych podstron