KORZENIEWICZ ŁUKASZ 1998-04-23
IMAb
Ćwiczenia laboratoryjne z chemii.
Temat: Wykładnik stężenia jonów wodorowych. Hydroliza.
Woda jest bardzo słabym elektrolitem amfoterycznym i ulega autodysocjacji według schematu:
![]()
.
Równowaga między jonami ![]()
i ![]()
, a niezdysocjowaną wodą wyraża się przez stałą równowagi autojonizacji wody:
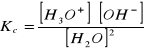
.
Ponieważ stężenie czystej wody jest wielkością stałą, iloczyn ![]()
, oraz ![]()
także jest wielkością stałą i nazywany jest iloczynem jonowym wody:
![]()
.
W czystej wodzie, jak i we wszystkich roztworach obojętnych ![]()
. Posługiwanie się tak małymi stężeniami jest niewygodne i dla tego operuje się ujemnym logarytmem dziesiętnym stężenia jonów wodorowych:
![]()
lub ![]()
.
![]()
.
pH czystej wody wynosi 7, roztwory których pH<7 mają odczyn kwaśny, a roztwory o pH>7 mają odczyn zasadowy. W bardziej stężonych roztworach mocnych kwasów i zasad skala pH może sięgać poza granice 0 i 14.
Hydroliza stałego kwasu i mocnej zasady ![]()
:
![]()
jon octanowy w roztworze wodnym ma zdolność przyłączenia protonu:
![]()
- odczyn zasadowy.
Hydroliza mocnego kwasu i słabej zasady NH4Cl:
![]()
jon amonowy ![]()
jest zdolny w roztworze wodnym oddać proton:
![]()
- odczyn kwaśny.
Doświadczenie 1:
Do pięciu probówek wlaliśmy po 1/5 objętości kwasu octowego ![]()
i następnie do pozostałych pięciu wlaliśmy tę samą ilość roztworu wodorotlenku amonu NH4OH. Potem ustawiliśmy probówki tak aby za probówkami z kwasem były probówki z wodorotlenkiem amonu. Następnie do kolejnych probówek dodaliśmy następujące wskaźniki:
3 krople oranżu metylowego,
2 krople czerwieni metylowej,
3 krople lakmusu,
3 krople fenoloftaleiny,
3 krople wskaźnika uniwersalnego.
1 |
oranż metylowy |
czerwony |
pomarańczowy |
2 |
czerwień metylowa |
różowy |
żółty |
3 |
lakmus |
bezbarwny |
jasno niebieski |
4 |
fenoloftaleina |
bezbarwny |
intensywny różowy |
5 |
wsk. uniwersalny |
jasno czerwony |
fioletowy |
Doświadczenie 2:
Do zlewki wlaliśmy chlorek i wodorotlenek amonowy, a następnie do drugiej wlaliśmy octan sodowy ![]()
i kwas octowy ![]()
. W obu probówkach określiliśmy pH za pomocą papierków wskaźnikowych.
METODA POMIARU |
KWAŚNY |
ZASADOWY |
1. Papierek lakmusowy |
bez zmian |
niebieski |
2. Papierek uniwersalny |
5 |
9 |
3. Papierek o wąskim zakresie pH |
4,8 |
9,6 |
4. Wskaźnik uniwersalny |
5,5 |
8,0 |
Doświadczenie 3:
Do ośmiu probówek wlaliśmy po 1/5 objętości wody destylowanej i pięć kropli wskaźnika uniwersalnego. Jedną probówkę pozostawiliśmy jako wzorzec, do pozostałych dodaliśmy kolejno po łopatce soli chlorku potasowego, siarczku sodowego, chlorku amonowego, octanu sodowego, chlorku cynku(II), siarczanu(VI) sodu, chlorku wapnia. Powtórzyliśmy ćwiczenie dodając inne wskaźniki.
1.![]()
- reakcja nie zachodzi,
2. 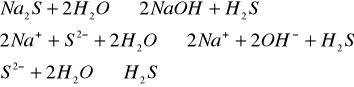
- odczyn zasadowy,
3. 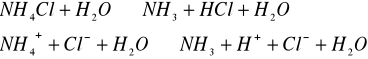
- odczyn kwaśny,
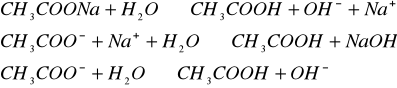
- odczyn zasadowy,

- odczyn kwaśny,
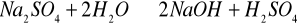
- reakcja nie zachodzi,
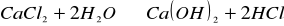
- reakcja nie zachodzi.
Lp. |
WZÓR |
WSKAŻNIK |
KOLOR ROZTWORU |
pH |
1. |
KCl |
uniwersalny |
zielony |
7 |
2. |
Na2S |
uniwersalny |
fioletowy |
10 |
3. |
NH4Cl |
uniwersalny |
żółty |
6 |
4. |
CH3COONa |
uniwersalny |
niebieski |
8 |
5. |
ZnCl2 |
uniwersalny |
pomarańczowy |
5 |
6. |
Na2SO4 |
uniwersalny |
zielony |
7 |
7. |
CaCl2 |
uniwersalny |
żółty |
6 |
Doświadczenie 4:
Do probówki wlaliśmy 1/5 objętości octanu sodowego i dodaliśmy 2-3 krople fenoloftaleiny. Powstały roztwór ogrzaliśmy do wrzenia, a potem ochłodziliśmy.
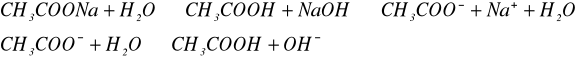
Doświadczenie 5:
Do roztworu chlorku cynku(II) wrzuciliśmy parę kawałków cynku i ogrzaliśmy. Zaobserwowaliśmy wydzielanie się gazu:
![]()
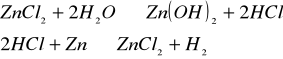
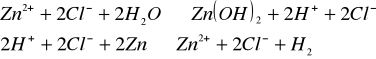
.
Wyszukiwarka
Podobne podstrony:
Ćw.ch.3, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Ćw.ch.5, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Ćw.ch.4(1), Szkoła, penek, Przedmioty, Chemia, Laboratoria
Ćw.ch.3, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Poprawka Cw 3, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Chemia kataliza, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Roztwory, Szkoła, penek, Przedmioty, Chemia, Laboratoria
KOROZJA1, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Hydroliza, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Szybkość reakcji, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Pierwiastki 2, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Redox2, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Elektroliza, Szkoła, penek, Przedmioty, Chemia, Laboratoria
w03 Dysocjacja elektrolity, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Sprawozdanie 5 ćwiczenia 4 i 5, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Reakcje redoks, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Korozja, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Korozja-now, Szkoła, penek, Przedmioty, Chemia, Laboratoria
więcej podobnych podstron