Karol Popis WP-53
Zadanie 1.3
Hel o zasobie masy m=2[kg] traktowany tak jak gaz doskonały pracuje w obiegu prawobieżnym złożonym z następujących odwracalnych przemian termodynamicznych, izobarycznej, izochorycznej i izotermicznej rozgęszczania helu. Ciśnienie Elu po izotermicznym rozgęszczeniu i izobarycznym zgęszczaniu jest odpowiednio równe p1=p2=1.962*105[Pa]. Ciśnienie po izochorycznym sprężaniu p3=5p1=9.81*105 [Pa]. Temperatura końca przemiany izobarycznej równa jest T2=400.16 [K], zaś początku i końca przemiany izotermicznej T3=T1=5T2=2000.8[K]. Objętość początku i końca przemiany izochorycznej V2=V3=8.4805[m3], zaś przemiany izobarycznej V1=5V2=42.025[m3] Indywidualna stała gazowa helu ma wartość R=2079.01 [J/kgK], zaś wykładnik izentropy k=1.66. Prace bezwzględne objętościowe przemian mają następujące: L1-2=-4mRT2=-6.65549*106[J], L2-3=0 oraz L3-1=5mRT2ln5=13.3895*106[J]. Oblicz przyrosty ilości ciepła przemian obiegu.
Dane:
M=2[kg]
P = const
V = const
T = const
P1 = 2 [at]
T1 = 127 [C]
R = 2079.01 [J/kg*K]
K = 1.66
1.Tabela zestawienia danych oraz wyników obliczeń.
Parametr stanu |
Punkt charaktery-styczny |
1 |
2 |
3 |
Pi |
[p1] |
P2=p1 |
P3=5p1 |
|
Ti |
T1=5T2 |
[T2] |
T3=T1=5T2 |
|
Vi |
V1=5V2 |
V2=mRT2/p1 |
V3=V2 |
|
ΔQij |
ΔQ1-2=-4(kR/k-1)mT2 |
ΔQ2-3=4(R/k-1)mT2 |
Q3-1=5mRT2ln5 |
|
2.1.Obliczam przyrost ilości ciepła między punktami 2 i 1
δH = δQ - δLT
δLT = -Vdp p = const dp = 0
dH = CpmdT Cp = const
H = CpmT m = const
Układ substancjalny m = const
δQ = CpmdT
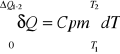
ΔQ1-2 = Cpm ( T2-T1 )
T1 = 5T2 ΔQ1-2 = -4CpmT2
Z równania Mayera
Cp-Cv = R
K = Cp/Cv to Cp = kR/k-1
ΔQ1-2 = -k ( 4R/k-1 ) mT2
ΔQ1-2 = - 1.66*(4*2079.01/1.66-1)*2*400.16
ΔQ1-2 = -1,67396*107 [J]
2.2.Obl. przyrost ilości ciepła przemiany izochorycznej między punktami 2 i 3
Postać pierwszej zasady termodynamiki:
dEI = δQ - δL δL = pdV
V = const Dv = 0 δL = 0
dEI = δQ
EI = CvmT
Gaz doskonały Cv = const
Układ substancjalny m=const to dEI = CvmdT
δQ = CvmdT
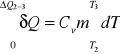
ΔQ2-3 = Cvm ( T3-T2 )
T3 = T1 T1 = 5T2
T3 = 5T2
Cv=
Q2-3 = 4CvmT2
Równanie Mayera
Cp-Cv = R
K = Cp/Cv to Cp = R/k-1
ΔQ2-3 = 4( R/k-1 )mT2
ΔQ2-3 = 4 ( 2079.01/1.66-1 )*2*400.16
ΔQ2-3 = 1,00841*107 [J]
2.3.Obliczam przyrost ilości ciepła przemiany izotermicznej między punktami 1 i 3
dEI = δQ - δL
dEI = δQ
EI = CvmT
Cv = const
M = const → dEI=0
T = const
Z równania izotermy mamy:
pV = p1V1 → p=p1V11/V
δQ=p2V1dV/V
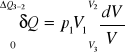
ΔQ3-1 = p1V2lnV = p1V1lnV1/V3
V1 = 5V3
ΔQ3-1 = p1V2ln5
P2V1 = mRT1
ΔQ3-1 = MRT2ln5
T1 = 5T2
ΔQ3-1 = 5mRT2ln²
ΔQ3-1 = 5*2*2079.01*400.16*1.609
ΔQ3-1 = 1,33855*107 [J]
3.Obliczam pracę obiegu.
Lob = |Lex| - |Lk| = |Qd| - |Qw|
|Lk| = |-4/5mRT1|
|Lex| = |mRT1ln5|
|Lex| = 2*2079.01*²*400.16*1.609
|Lex| = 1,33855*107
4.Obliczam przyrost ilości ciepła obiegu.
Qob = |Qd - Qw|
ds = dQ/T dQ = Tds
Qd = |Q2-3 + Q3-1|
Qw = |Q1-2|
Wyszukiwarka
Podobne podstrony:
II 6.2, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 7, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 4.2, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 8.1, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 3.3, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 1.2, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 10, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 11, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 27.4.b, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 12, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 27.4.a, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 20, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 27, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 27.2.b, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 15, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 13, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 4.5a, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 23, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 5.1b, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
więcej podobnych podstron