I. Charakterystyka chemiczna pierwiastków
Przedstawione informacje i zagadnienia z zakresu chemii nieorganicznej nie mają na celu zastąpienia podręczników. Naiwnością byłoby bowiem założyć, że to co opisuje się na wielu stronach podręcznika można nagle skrócić do przysłowiowej ściągi. Zamysł jest inny. Podając podstawowe informacje o pierwiastkach w oparciu o ich położenie w układzie okresowym może, w zamyśle autora, ułatwić czytanie podręczników. Wiele konkretnych informacji podają również same zadania testowe. Dlatego w załączeniu proponuje się właśnie rozwiązania konkretnych zadań maturalnych z tego zakresu. Właściwości chemiczne pierwiastków wchodzą w zakres tzw. chemii nieorganicznej i dla ucznia wydają się bardzo trudne do opanowania ze względu na różnorodność informacji. Istotnie wiele faktów wymaga po prostu wyuczenia pamięciowego (symbole, wzory podstawowych kwasów) wiele informacji można jednak uzyskać korzystają w sposób świadomy z podstawowej i dozwolonej, a wręcz zalecanej, ściągawki jaką jest układ okresowy pierwiastków.
Proponuję zacząć od przypomnienia sobie istoty genezy układu okresowego za pomocą animacji pokazanej na płycie I w części: Atom i cząsteczka. W części poświęconej budowie atomu szczegółowiej będzie potraktowana część układu związana ze strukturą atomu. Obecnie skoncentrujemy się na wykazaniu pewnych ogólnych prawidłowości dotyczących właściwości chemicznych pierwiastków. Zmienność cech chemicznych jest rozpatrywana w zależności od położenia pierwiastka w grupie (linie pionowe) oraz w okresie linie poziome. Numer grupy w której znajduje się pierwiastek pozwala przewidzieć ilość elektronów walencyjnych oraz ich mobilność, czyli łatwość oddawania lub też skłonność do przyjmowania. Proste reguły w tym zakresie dotyczą wyłącznie pierwiastków grup tzw. głównych, tworzących bloki energetyczne s oraz p, czyli tych, które są zapełniane jako zewnętrzne. Pierwiastki tych grup posiadając różną ilość elektronów zewnętrznych są więc najbardziej zróżnicowane chemicznie. W tym miejscu należy sobie przypomnieć ogólną zasadę zwaną regułą oktetu i dubletu. Rozważając zachowanie pierwiastków staramy się przewidzieć w jaki sposób mogą osiągnąć taką optymalną ilość elektronów. Tu dochodzimy do sedna sprawy. Pierwiastki bloku energetycznego s posiadając jeden lub dwa elektrony walencyjne oktet mogą osiągnąć tylko w jeden sposób - oddając elektrony walencyjne. Przyjmują więc, w zależności od grupy, wartościowość 1 lub 2. Pierwiastki te najłatwiej z wszystkich oddają elektrony są więc najaktywniejszymi metalami i tym samym również najaktywniejszymi reduktorami. Tak więc aby je otrzymać z połączeń trzeba się uciec do specjalnego sposobu ich redukcji z połączeń - jest to elektroliza w środowisku stopionych soli (patrz część dotycząca elektrolizy). Metale pierwszej grupy są więc najaktywniejszymi pierwiastkami lecz ich aktywność ulega zmianie w obrębie grupy. Skoro ich aktywność polega na oddawaniu elektronów to im większy promień atomowy (czyli im wyższy okres) tym łatwiej jest oddawany elektron przyciągany normalnie przez jądro atomowe i tym aktywniejszy jest metal. Metale tych grup są więc najaktywniejszymi metalami i wykazują najbardziej zasadowy charakter. Podobnie zachowuję się pierwiastki grupy 13 (trzeciej). Mając trzy elektrony walencyjne wykazują tylko jedną wartościowość +3. Jako, że pierwiastki tej grupy mogą wyłącznie oddawać elektrony są również metalami. Ich cechy metaliczne są nieco słabsze i dlatego wykazują pośrednie właściwości chemiczne -są typowymi amfoterami.
Amfotery to pierwiastki, których tlenki i wodorotlenki wykazują, w zależności od środowiska, charakter kwasowy lub zasadowy. Oznacza to, że reagują zarówno z mocnymi kwasami jak i zasadami. Właściwości amfoteryczne, w większym lub mniejszym stopniu, wykazują wszystkie pierwiastki bloku energetycznego d.
Większe zróżnicowanie chemiczne zaczyna się od grupy czwartej (14). Pierwiastki tej grupy posiadając cztery elektrony mogą osiągnąć oktet w zależności od pierwiastka z którym reagują a konkretnie od jego elektroujemności. Reagując z pierwiastkiem bardziej elektroujemnym oddają cztery lub dwa elektrony (elektrowartościowość +II; +IV). W reakcji z pierwiastkami mniej elektroujemnymi (bardziej metalicznymi) przyjmują cztery elektrony wykazując elektrowartościowość +IV. W obrębie grup, w miarę wzrostu liczby atomowe, obserwuje się również pewną zmienność, która posiada jednak pewną prawidłowość. Im większa wartość liczby atomowej, a tym samym większy promień atomowy, przeważa tendencja do oddawania elektronów czyli uwydatniają się właściwości metaliczne i dlatego w grupie czwartej od typowego niemetalu jakim jest węgiel przechodzi się do pierwiastków które będą chętniej elektrony oddawały czyli będą miały dominujące cechy metaliczne, w tej grupie są to cyna i ołów. Pośrednie pierwiastki będą więc wykazywały właściwości amfoteryczne. Pierwiastki grupy piątej czyli 15 będą łatwiej osiągały oktet przyjmując trzy elektrony dlatego wykazują elektrowartościowość -III. Oddając elektrony pierwiastkom bardziej elektroujemnym np. tlenowi wykazują typowe elektrowartościowości +III oraz +V. Pewną odmienność wykazuje azot, jego elektroujemność jest na tyle znacząca, że w reakcji z tlenem może oddawać po jednym elektronie i dlatego wykazuje wszystkie elektrowartościowości od +I do +V. Taka specyfika dotyczy wszystkich pierwiastków okresu drugiego, czyli rozpoczynających grupy główne. Ich elektrony walencyjne znajdując się w drugiej powłoce są tak blisko jądra atomowego, że ich przyciąganie jest nietypowo duże i objawia się trudnością w oddawaniu elektronów. Z tego również względu np. beryl tak znacznie (co podkreślają wszystkie podręczniki) różni się od pozostałych berylowców. Znacznie silniejsze przyciąganie elektronów z drugiej powłoki powoduje również, że w drugim okresie w miarę wzrostu liczby atomowej maleje promień atomowy pierwiastków. (W dalszych okresach taka prawidłowość już nie występuje i obserwuje się co prawda nieznaczny ale jednak wzrost promienia atomowego). Omówiona przed chwilą prawidłowość w sposób szczególny objawia się w grupie 16 (szóstej głównej). Typowa elektrowartościowość pierwiastków tej grupy to zgodnie z przewidywaniami -II (dopełnieni do oktetu) w przypadku znajdującego się w drugim okresie tlenu to jedyna elektrowartościowość(!). Pozostałe pierwiastki wykazują tą elektrowartościowość w połączeniach z metalami (powstają sole kwasów beztlenowych) oraz wodorem, wykazujące cechy słabych kwasów. Oddzielnego potraktowania wymaga połączenie wodorowe tlenu, czyli woda. Ten związek będzie oddzielnie omówiony przy okazji roztworów. Pierwiastki tej grupy reagując z pierwiastkami bardziej elektroujemnymi np. z tlenem przyjmują typowe elektrowartościowości +IV i +VI. Tlenki te wykazują właściwości bezwodników kwasowych, szczególnie ważne są tlenki siarki(IV) oraz siarki(VI). W kolejnej grupie 17 czyli głównej siódmej, zgodnie z przewidywaniami rośnie zdolność do przyjęcia jednego elektronu dopełniającego elektrony walencyjne do oktetu. Tak więc zasadniczą elektrowartościowość tych pierwiastków (fluorowców) to -I. Wykazują ją w połączeniach z metalami (sole kwasów beztlenowych) oraz wodorem tworząc szereg kwasów beztlenowych. Ciekawostką jest fakt, że moc tych kwasów wzrasta z liczbą atomową fluorowca. Jest to o tyle ciekawe, że aktywność samych fluorowców zmienia się w odwrotnej kolejności (maleje od fluoru do jodu). Dzieje się tak dlatego, że rosnący promień fluorowca powoduje, że atom wodoru jest coraz słabiej przyciągany przez jego jądro, a co za tym idzie w środowisku wodnym ulega łatwiej odszczepieniu jako jon wodorowy. Zgodnie z teorią Arheniusa jest więc mocniejszym kwasem. Są to kwasy mocne, jednak jako że nie wykazujące właściwości utleniających, nie reagują z metalami o dodatnich potencjałach elektrochemicznych. W połączeniach z tlenem fluorowce wykazują kilka elektrowartościowości preferujących parzystą ilość elektronów pozostałych na ostatniej powłoce. Tak więc z siedmiu elektronów oddaje kolejno 1, 3. 5 oraz 7. Przyjmując odpowiednie elektrowartościowości dodatnie. Tlenki fluorowców, a w szczególności chloru, na tych stopniach utlenienia mają charakter bezwodników kwasowych tworząc kwas chlorowy(I), chlorowy(III), chlorowy(V) i wreszcie chlorowy(VII). Wzory tych kwasów łatwo utworzyć pamiętając o zasadzie zerowania elektrowartościowości pierwiastków wchodzących w skład cząsteczki (Szczegóły w programie nauki uzgadniania reakcji redoks). Moc tych kwasów jest zróżnicowana i określana jest na podstawie ogólnych prawidłowości zmian mocy kwasów tlenowych. W szeregu kwasów tlenowych danego pierwiastka moc kwasów rośnie wraz i ilością atomów tlenu w reszcie kwasowej. Większa ilość atomów tlenu w reszcie oznacza bowiem jej większą elektroujemność a co za tym idzie wzrost polarności wiązania wodór - tlen reszty kwasowej. Tak więc najmocniejszym z kwasów tlenowych chloru jest kwas chlorowy(VII), który ponadto wykazuje jeszcze silne właściwości utleniające. Moc tego kwasu jest porównywalna z kwasem siarkowym(VI). W praktyce szkolnej ten kwas jest jednak znacznie rzadziej przytaczany od siarkowego. Kolejną według numeracji jest grupa 18 czyli ósma główna. Osiem elektronów walencyjnych pierwiastków tej grupy powoduje, że są one bierne chemicznie dlatego nazywa się je najczęściej gazami szlachetnymi. Jedyną istotną informacją o nich jest to, że w odróżnieniu od większości pierwiastków gazowych nie występują w postaci cząsteczek dwuatomowych.
Program nauczania chemii przewiduje również informacje o pierwiastkach znajdujących się w bloku energetycznym d. Mówi się zasadniczo o trzech pierwiastkach - chromie, manganie i żelazie. Elektrony walencyjne pierwiastków tej grupy są rozłożone na dwóch podpowłokach - s oraz zapełnianej sukcesywnie podpowłoki d. Ze względu na ostatnią powłokę dwuelektronową (s) wszystkie pierwiastki tego bloku są typowymi metalami, zapełniana podpowłoka d nadaje im szczególne właściwości - najczęściej wiele elektrowartościowości (których wartości są na ogół trudniejsze do przewidzenia).
Odnośnie tych pierwiastków należy zapamiętać szczególnie poniższe informacje:
Tlenki tych pierwiastków w miarę wzrostu ich stopnia utlenienia zmieniają charakter chemiczny od zasadowego, przez amfoteryczny do kwasowego, np. tlenki manganu(II), żelaza(II) i chromu(II) mają charakter zasadowy - reagują więc wyłącznie z kwasami tworząc jony proste: Mn2+; Fe2+czy Cr2+. W połączeniach w których wykazują najwyższy stopień utlenienia mają charakter kwasowy, tak jest przykładowo w manganianach(VII), manganianach(VI), chromianach(VI), dichromianach(VI) - są to jony złożone.
W miarę wzrostu stopnia utlenienia pierwiastków rośnie ich charakter utleniający, który najczęściej zależy od wartości pH roztworu.
Pierwiastki tego bloku tworzą również połączenia barwne (połączenia pierwiastków bloku energetycznego s oraz p były bezbarwne !) wizja zapamiętania „kolorków” wydaje się bardzo trudna a tymczasem jest ich niewiele. Oto one:
Miedź - sole jonów miedzi(II) niebieskie. Połączenia te tworzą sole uwodnione, które również wykazują barwę niebieską przykładem może być pięciowodny siarczan(VI) miedzi(II) : CuSO4ּ5H2O. Barwy tlenków: miedzi(II) - czarny; miedzi(I) - ceglasty
Żelazo - sole żelaza(III)- brunatne; żelaza(II) - zielonkawe
Chrom - sole i tlenek chromu(III) barwa zielona; chromiany(VI) - żółty; dichromiany(VI) - oranżowy
Właściwości chemiczne pierwiastków -
Zadania z testów maturalnych z rozwiązaniami
Zad. 1 Napisz konfigurację elektronową atomu żelaza i jonów żelaza
Zad.2 Napisz równania reakcji za pomocą których można dokonać następujących przemian chemicznych: żelazo → chlorek żelaza(III) → wodorotlenek żelaza(III) → tlenek żelaza(III) → żelazo
Zad. 3 Zaproponuj reakcję w wyniku której nastąpi utlenienie jonów żelaza(II) do jonów żelaza(III). Napisz równanie reakcji w formie jonowej
Zad. 4 Przeprowadzono cykl reakcji według poniższego schematu:
Mg → MgO →MgCl2 Napisz równania tych reakcji. Oblicz ile gramów MgCl2 można otrzymać z 48 g magnezu, zakładając 75% wydajność obu procesów.
Zad. 5 Rozwiąż chemograf. Zapisz równania reakcji i podaj nazwy związków A - E. Reakcje 3 i 4 zapisz również w postaci jonowej
Glin + Cl2 → A
A + NaOH → B
B + H2SO4 → C
B + NaOH → D
Al + O2 → E
E + ? → C
Zad. 6 Cynk tzw. metodą mokrą otrzymuje się z blendy cynkowej (siarczku cynku). Najpierw ruda cynku prażona jest w obecności tlenu (a). Stały produkt prażenia poddawany jest reakcji z kwasem siarkowym(VI) (b). Otrzymaną sól poddaje się elektrolizie w wodnym roztworze. Napisz równania reakcji (a) i (b) oraz wyjaśnij proces elektrolizy soli cynku.
Zad.7 Wodorowęglan amonu (NH4)HCO3 zwany potocznie „amoniakiem do pieczenia ciasta” rozkłada się już w temperaturze 333 K, tworząc dwa gazowe produkty i wodę.
A/ Napisz równanie rozkładu tego związku i oblicz objętość obu gazów w warunkach normalnych, gdy rozkładowi ulega 31,6 g wodorowęglanu amonu
B/ Jeden z gazowych produktów rozkładu ma charakter kwasowy. Podaj jego nazwę i wykaż charakter kwasowy, zapisując równanie odpowiedniej reakcji chemicznej w formie jonowej.
Zad. 8 Wody lecznicze tzw. siarczane zawierają między innymi wodorowęglan wapnia i siarkowodór. Powstanie wód siarczanowych tłumaczy się procesami zachodzącymi według schematu: siarczan(VI) wapnia → siarczek wapnia → (reakcja hydrolizy) → wodorotlenek wapnia + CO2 → wodorowęglan wapnia. Napisz w formie cząsteczkowej równania reakcji przebiegających w poszczególnych etapach procesu oraz równanie sumaryczne dwóch ostatnich etapów
Zad.9 Napisz równania reakcji przemian z poniższego schematu oraz zaznacz, które z nich są reakcjami redoks: NH4Cl →(1) → NH3→(5) → NO →(6) → N02→(7)→HNO3
N2 →(3) → Mg3N2 ; N2 →2 → NH3 →4→ (NH4)2SO4
Zad. 10
Napisz poniższe równania reakcji i zaznacz, które z nich są reakcjami redoks
Cr →CrSO4
CrSO4 → Cr2(SO4)3
Cr2(SO4)3 →Cr(OH)3
Cr(OH)3 → Cr2(SO4)3
Cr(OH)3 → Cr2O3
Cr(OH)3 → Na[Cr(OH)4]
Na[Cr(OH)4] → Na2CrO4
Cr2O3 → K2CrO4
K2Cr2O7 → Cr2(SO4)3
Cr2O3 → Cr
Zad. 11 Przeprowadzono reakcję zgodnie ze schematem [tu rysunek probówki z roztworem wodnym siarczanu(VI) chromu(III)] do której wprowadzono papierek) Jaka będzie barwa papierka uniwersalnego w tym roztworze ? Wyjaśnij przyczynę i napisz równanie jonowe odpowiedniej reakcji chemicznej.
Zad. 12 Chrom tworzy tlenki między innymi na II, III, VI stopniu utlenienia. Napisz wzory tych tlenków. Określ ich charakter chemiczny i potwierdź go odpowiednimi równaniami reakcji. Sformułuj wniosek dotyczący zmiany charakteru chemicznego chromu w zależności od stopnia utlenienia.
zad. 13 Schemat przedstawia reakcje jakim poddano azotan(V) ołowiu(II) w roztworach wodnych:
Pb(NO3)2 + H2CO3 →
Pb(NO3)2+ → PbS
Pb(NO3)2 + NaOH →
Pb(NO3)2 + → PbSO4
Napisz równania powyższych reakcji chemicznych w formie cząsteczkowej i jonowej skróconej
Zad. 14 W przyrodzie żelazo występuje w formie rudy zwanej magnetyt (Fe3O4) Napisz równanie reakcji magnetytu z tlenkiem węgla(II) oraz nazwij typ tej reakcji
Zad. 15 Dany jest schemat pięciu przemian związków żelaza.
FeCl2 → Fe(OH)2
Fe(OH)2 → Fe(OH)3
Fe(OH)3 → Fe2O3
Fe(OH)3 → Fe2(SO4)3
Fe2O3 → Fe2(SO4)3
Napisz równania powyższych reakcji w formie cząsteczkowej, zaś reakcji 1 i 4 w formie jonowej i jonowej skróconej
Zad. 16 Zaprojektuj doświadczenie potwierdzające amfoteryczny charakter wodorotlenku chromu(III). Przedstaw:
Doświadczenie za pomocą schematycznego rysunku
Obserwowane objawy reakcji
Równania zachodzących reakcji w formie cząsteczkowej i skróconej jonowej (z uwzględnieniem hydroksokompleksów)
Napisz w formie cząsteczkowej i skróconej jonowej równania reakcji otrzymywania wodorotlenku chromu(III). Za pomocą cząsteczkowych równań reakcji przedstaw następujące przemiany: K2Cr2O7 → Cr2(SO4)3 → K2CrO4. Współczynniki w równaniach dobierz metodą bilansu elektronowego. Jaką rolę w tych reakcjach pełnią związki chromu ( wskaż reduktor i utleniacz)
Zad.17 Jedną z metod otrzymywania ołowiu jest prażenie galeny [siarczku ołowiu(II)] przy dużym dostępie tlenu. Jako produkty powstają tlenek siarki(IV) i tlenek ołowiu(II). W kolejnej reakcji tlenek ołowiu(II) poddaje się reakcji z tlenkiem węgla(II), otrzymując metaliczny ołów. Napisz równania reakcji oraz oblicz ile kg ołowiu można otrzymać ze 100 kg galeny, zakładając, że obie reakcje biegną z wydajnością 90%.
Zad. 18 Ułóż równania reakcji chemicznych dla podanych substratów, a jeśli reakcja nie zachodzi, uzasadnij, dlaczego:
Bar + woda →
Wodorotlenek żelaza(II) + nadtlenek wodoru →
Anion bromkowy + anion siarczanowy(VI) + kation wodorowy →
Piryt + tlen (ogrzewanie) →
Gips krystaliczny + prażenie →
Miedź + kwas ortofosforowy →
Dokończ równania następujących reakcji, dla równań 1,3,5 zastosuj bilans elektronowy
Zn + HNO3 stęż. →
Cr(OH)3 + NaOH →
Fe + H+ →
MnO4- + SO32-+ OH- →
Zad. 19 Poniższy schemat przedstawia ciąg reakcji jakim ulegają związki cynku:
Zn + HCl → A
Zn + H2SO4 → B
B + NaOH → D
D + NaOH → Na2[Zn(OH)4]
Zn + AgNO3 →
Podaj nazwy związków: A, B, D, E oraz związku powstającego w reakcji nr 4. Przedstaw konfigurację elektronową atomu cynku i na tej podstawie zalicz ten pierwiastek do odpowiedniego bloku energetycznego w układzie okresowym.
Zad. 20 Całość dotyczy krzemu
Przedstaw konfigurację elektronową atomu krzemu i na tej podstawie określ typowe stopnie utlenienia tego pierwiastka w związkach chemicznych. Podaj treść reguł, które zastosowałeś przy zapisie konfiguracji elektronowej.
Biorąc pod uwagę typowe stopnie utlenienia atomu krzemu, napisz wzory tlenków tego pierwiastka, podaj ich nazwy. Porównaj właściwości tlenków węgla i krzemu, w których pierwiastki te występują na maksymalnych stopniach utlenienia
Tlenek krzemu(IV) stapiany z wodorotlenkiem sodu tworzy ortokrzemian sodu. Sól ta pod wpływem wody ulega powolnej hydrolizie, tworząc kwas ortokrzemowy o wzorze H4SiO4 Powstający kwas wykazuje tendencje do kondensacji. W wyniku tej reakcji powstaje kwas ortodikrzemowy o wzorze H6Si2O7 Napisz równania tych reakcji.
Zad 21
W oparciu o położenie baru w układzie okresowym podaj cechy charakterystyczne związków baru (tlenku, wodorotlenku i jednej soli) i porównaj je z odpowiednimi związkami wapnia.
Zad. 22
Jednym z pierwiastków bloku d jest chrom.
Podaj konfigurację elektronową chromu w notacji 1s 2s 2p ....... i z uwzględnieniem wzorów klatkowych. Podaj liczbę jego elektronów niesparowanych
Chrom tworzy tlenki na II, III i VI stopniu utlenienia. Podaj wzory i nazwy tlenków chromu oraz określ ich charakter chemiczny. Napisz równania reakcji tych tlenków z wodorotlenkiem sodu i kwasem solnym
Omów właściwości chemiczne związków chromu(VI):
Trwałość chromianów(VI) i dichromianów(VI) w różnych środowiskach - wypowiedź poprzyj odpowiednimi równaniami reakcji
Właściwości dichromianów(VI) w reakcjach redoks - podaj w formie jonowej i cząsteczkowej zbilansowane równania reakcji dichromianu(VI) potasu z siarczanem(IV) sodu w środowisku kwaśnym.
Dichromiany(VI) utleniają alkohole II - rzędowe do ketonów. Napisz równanie reakcji utlenienia propan - 2 - olu
Zad. 23 W oparciu o budowę atomu podaj podobieństwo i różnice występujące pomiędzy pierwiastkami grupy berylowców. Przy pomocy równań reakcji przedstaw cykl przemian: Ca → Ca(OH)2 → CaCO3 → Ca(HCO3)2 → CaCO3 → CaO → CaCl2. Omów zjawisko twardości wody.
Zad. 24
Na przykładzie fluorowców i litowców przedstaw podobieństwa pomiędzy pierwiastkami tej samej grupy oraz różnice pomiędzy pierwiastkami grupy 1 i 17. Określ typ i dokonaj charakterystyki wiązań w RbCl i HBr
Zad. 25
W jaki sposób doświadczalnie można wykazać różnice w aktywności fluorowców. Napisz równania reakcji ilustrujące to doświadczenie.
Zad. 26
Napisz równania poniższych reakcji:
Na + O2 → A
A + Na → B
B + H2O → NaOH
NaOH + SO2→ D
Cl2 + H2 → Eaq
Eaq + NaOH → F podaj nazwy związków A, B, D, E i F
Zad. 27
Opisz właściwości chromu i jego najważniejsze związki na III i VI stopniu utlenienia
Zad. 28
Na skalę techniczna chrom otrzymuje się z chromitu FeCr2O4 przez prażenie z węglanem sodu w obecności tlenu. W tych warunkach tworzy się chromian(VI) sodu, tlenek żelaza(III) i tlenek węgla(IV). Z takiej mieszaniny wymywa się rozpuszczalny chromian sodu. Następnie roztwór zakwasza się przez dodanie kwasu siarkowego(VI) i wykrystalizowuje dichromian (VI) sodu. Otrzymany dichromian poddaje się redukcji węglem. Powstaje wówczas tlenek chromu(III), tlenek węgla(II) i węglan sodu. Czysty chrom otrzymuje się w ostatnim etapie, poddając redukcji tlenek chromu(III) pyłem glinowym. Napisz równania kolejnych czterech równań reakcji.
Zad. 29
Przedstaw konfigurację elektronową atomów manganu oraz jego dwudodatniego jonu. Ile niesparowanych elektronów posiada atom manganu? Przy pomocy równań reakcji przedstaw poniższe przemiany:
Mn → MnSO4
MnSO4 → Mn(OH)2
Mn(OH)2 → MnO2
MnSO4 → MnS
MnO2 → MnCl2
Mn → MnS
MnS → MnCl2
MnCl2 → Mn3(PO4)2
Zad.30
Odszukaj w układzie pierwiastek, którego atomy mają następującą konfigurację elektronową: 1s22s22p63s23p64s23d5 podaj nazwę i symbol tego pierwiastka. Podaj ogólne wzory elektronowe pierwiastków należących do poszczególnych grup układu okresowego.
Zad.31 Przy pomocy równań reakcji przedstaw równania poniższych przemian:
Mn0 → Mn2+
Mn2+ ↔ MnO2
MnO2 → Mn4+
MnO2 → MnO32-
MnO2 → MnO42-
MnO42- ↔ MnO4-
Zad. 32
Odszukaj w układzie okresowym i zapisz symbole pierwiastków o liczbach atomowych 8, 11 i 16. Napisz wzory oraz nazwy sześciu związków chemicznych: tlenku metalu, tlenku niemetalu, nadtlenku metalu, soli kwasu beztlenowego, soli kwasu tlenowego słabego oraz mocnego, w których pierwiastki te występują jako jedyne. Zapisz równania reakcji zaproponowanych związków z wodą. Jeśli uznasz, że reakcja nie zachodzi to zaznacz dlaczego
Zad. 33
a/ Przedstaw graficznie (schemat klatkowy) konfigurację elektronową atomu chromu i podaj jakie możliwe stopnie utlenienia może przyjmować chrom w związkach oraz określ jak ze zmianą stopnia utlenienia zmienia się charakter chemiczny tlenków chromu.
b/ Siarczan(VI) chromu(III) reaguje w środowisku alkalicznym (KOH) z nadtlenkiem wodoru. Produktem reakcji jest między innymi chromian(VI) potasu, i woda. Napisz równanie zachodzącej reakcji, dobierając współczynniki metodą bilansu elektronowego. Wskaż utleniacz i reduktor.
Zad. 34
Poniżej przedstawiono szereg problemów związanych z połączeniami fosforu.
Fosfor otrzymuje się ogrzewając ortofosforan(V) wapnia z tlenkiem krzemu(IV) i węglem w piecach elektrycznych bez dostępu tlenu. Otrzymuje się wtedy fosfor w postaci pary (P4) , tlenek węgla(II) i metakrzemian wapnia (CaSiO3). Napisz równanie powyższej reakcji oraz oblicz, ile kilogramów fosforu można otrzymać z 1 tony minerału zawierającego 60% fosforanu(V) wapnia. Należy przyjąć, że wydajność reakcji wynosi 100%.
Fosfor biały (P4) jest bardzo aktywny. Reaguje on przykładowo z roztworem siarczanu(VI) miedzi(II). W reakcji tej powstaje wolna miedź, a także kwas siarkowy(VI) i kwas ortofosforowy(V). Napisz równanie tej reakcji. Wśród substratów należy uwzględnić wodą.
Fosfor spalany na powietrzu tworzy P4O10 który w reakcji z wodą tworzy kwas ortofosforowy(V). Kwas ten można również otrzymać działając na ortofosforan(V) wapnia kwasem siarkowym(VI). Napisz równania trzech opisanych procesów oraz wyjaśnij dlaczego kwas ortofosforowy(V) można otrzymać działając kwasem siarkowym(VI) na ortofosforan(V) wapnia.
Sole kwasu ortofosforowego(V) są stosowane jako nawozy sztuczne jednym z nich jest tzw. Superfosfat podwójny o wzorze Ca(H2PO4)2. Oblicz zawartość procentową fosforu w tym związku.
Fosfor posiada różne odmiany alotropowe - wyjaśnij na czym polega zjawisko alotropii i wymień dwa inne pierwiastki posiadające również odmiany alotropowe.
Ortofosforan(V) srebra to sól praktycznie nierozpuszczalna w wodzie. Opisz doświadczenie w wyniku którego powstaje osad tej soli. W formie cząsteczkowej i jonowej skróconej zapisz równania odpowiednich reakcji.
Fosfor reaguje z wodorem tworząc fosforiak PH3 Związek ten można również otrzymać działając gorącym roztworem KOH na fosfor (P4) Powstaje wtedy PH3 i diwodorofosforan(I)potasu (KH2PO2). Napisz powyższe równanie reakcji. Wśród substratów należy uwzględnić wodę. Określ co jest utleniaczem i co reduktorem w tej reakcji.
Zad. 35
Poniżej przedstawiono szereg problemów związanych z właściwościami chloru
a/ Określ budową atomu chloru (35Cl) podając: skład jądra atomowego, konfigurację elektronową
b/ Do celów laboratoryjnych chlor można otrzymać między innymi działając w podwyższonej temperaturze kwasem solnym na tlenek manganu(IV). Produktami tej reakcji oprócz chloru są chlorek manganu(II) i woda. Napisz równanie opisanej reakcji uzgadniając je metodą bilansu elektronowego.
c/ Chlor reaguje z wieloma pierwiastkami. Między innymi z sodem, który spalany w chlorze tworzy chlorek sodu. Napisz równanie reakcji syntezy chlorku sodu. Pisząc konfigurację atomów i jonów obydwu pierwiastków uwzględnij ich elektroujemność, wyjaśnij jak dochodzi do utworzenia wiązania i określ rodzaj powstałego wiązania.
d/ Chlor w pewnych warunkach tworzy tlenki, w których występuje na I, III, IV, V i VII stopniu utlenienia
Napisz wzory tlenków chloru na I, III i VII stopniu utlenienia.
Tlenki chloru mają charakter kwasowy. Reagują w określonych warunkach z zasadami. Napisz równania reakcji tlenku chloru(III) i tlenku chloru(VII) z zasadą sodową i podaj nazwy powstałych soli. Uwaga - tlenowe kwasy chloru są jednoprotonowe.
e/ na skalę techniczną chlor otrzymuje się w wyniku elektrolizy wodnego roztworu chlorku sodu - omów na przykładzie równań reakcji przebieg elektrolizy wodnego roztworu chlorku sodu.
f/ przeprowadzono następujące doświadczenie - do trzech probówek zawierających odpowiednio fluorek, bromek i jodek potasu dodano wodę chlorową. Za pomocą równań reakcji zapisz przemiany zachodzące w probówkach lub zaznacz, że reakcja nie zachodzi.
Zad. 36
Pomimo występowania olbrzymich ilości azotu w powietrzu do początku XX wieku nie znano metody przemysłowej jego związania w połączenia chemiczne. Dopiero z początkiem tego wieku F. Haber i C. Bosch opracowali stosowaną do dziś metodę syntezy amoniaku, który jest z kolei surowcem do otrzymywania kwasu azotowego i nawozów sztucznych. Proces otrzymywania kwasu azotowego(V) przebiega w kilku etapach
Etap I - synteza amoniaku z wodoru i azotu przebiegająca pod ciśnieniem i w podwyższonej temperaturze w obecności żelaza jako katalizatora
Etap II - utlenianie katalityczne amoniaku do tlenku azotu(II) i dalsze jego samorzutne utlenienie do tlenku azotu(IV)
Etap III - absorpcja powstałego tlenku azotu(IV) w wodzie. Innym kwasem tlenowym tworzonym przez azot jest kwas azotowy(III)
A/ Napisz równania reakcji obrazujące cały opisany proces otrzymania kwasu azotowego(V)
B/ przedstaw wzór elektronowy kwasu azotowego(V) i omów charakter wiązań występujących w cząsteczce tego kwasu
C/ Napisz równania reakcji jakie będą zachodzić jeżeli cynk i miedź będą reagowały z rozcieńczonym i stężonym kwasem azotowym(V)
Zad. 37
Dane są tlenki pierwiastków znajdujących się w trzecim okresie układu okresowego: Na2O; Al2O3; Cl2O7;
Podaj jaki typ wiązania występuje w tych tlenkach
Określ charakter chemiczny tych tlenków
Napisz odpowiednie równania reakcji stwierdzające ich charakter chemiczny
Liczba atomowa pierwiastka E wynosi Z= 30
Określ położenie pierwiastka w układzie okresowym
Rozpisz pełna konfigurację elektronową pierwiastka E oraz podaj nazwę bloku energetycznego do którego należy
Zaprojektuj doświadczenie, które jednoznacznie powoli określić charakter chemiczny tego pierwiastka
Zad. 38
Żelazo tworzy związki na różnych stopniach utlenienia. Poniżej podano kilka informacji opisujących zachowanie jego połączeń w różnych warunkach. Napisz równania odpowiednich reakcji:
sproszkowane żelazo w podwyższonej temperaturze reaguje z parą wodną dając magnetyt (Fe3O4) i wodór
żelazo w typowy sposób reaguje z kwasem siarkowym(VI) tworząc sól żelaza(II)
chlorek żelaza(III) otrzymuje się przepuszczając chlor nad rozgrzanymi opiłkami żelaza
działając na roztwór chlorku żelaza(III) otrzymuje się tetrachlorożelazian(III) sodu
szczawian żelaza(II) otrzymuje się działając na chlorek żelaza(II) kwasem szczawiowym
żelazian(V) potasu o wzorze KFeO3 otrzymuje się ogrzewając tlenek żelaza(III) w obecności tlenu i tlenku potasu
Żelazian(VI) sodu o wzorze Na2FeO4 otrzymuje się stapiając wodorotlenek żelaza(III) z wodorotlenkiem sodu w obecności chloru. Produktami tej reakcji sa również chlorek sodu i woda
ROZWIĄZANIA PRZYKŁADOWYCH ZADAŃ
Zad. 1
Konfiguracje elektronowe:
a/ Atom żelaza: 26Fe atom żelaza posiada więc 26 elektronów
Zapis pełny: 1s22s22p63s23p64s23d6
Zapis skrócony (od poprzedzającego gazu szlachetnego): [Ar]4s23d6
b/ Zapisy skrócone dla jonów żelaza:
Fe2+ [Ar] 3d6
Fe3+ [Ar] 3d5
Zad. 2
1/ żelazo → chlorek żelaza(III)
2Fe + 3Cl2 → 2FeCl3 gdyby na żelazo podziałano kwasem solny, który nie posiada właściwości utleniających produktem byłby chlorek żelaza(II), jednak ze względu na silne właściwości utleniające gazowego chloru powstaje chlorek żelaza(III)
2/ chlorek żelaza(III) → wodorotlenek żelaza(III)
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
Fe3++ 3OH- → Fe(OH)3(↓)
3/ wodorotlenek żelaza(III) → tlenek żelaza(III)
2Fe(OH)3 → Fe2O3 + 3H2O
4/ tlenek żelaza(III) → żelazo
Na tlenek żelaza należy podziałać reduktorem np. wodorem, węglem lub tlenkiem węgla(II)
Fe2O3 + 3H2 → 2Fe + 3H2O
Fe2O3 + 3C → 2Fe + 3CO
Fe2O3 + 3CO → 2Fe + 3CO2
Zad. 3
2Fe(OH)2 + H2O2 → 2Fe(OH)3
5 Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O
Zad. 4
Mg → MgO
2Mg + O2 → 2MgO (Równanie reakcji spalania magnezu)
MgO → MgCl2
MgO + 2HCl → MgCl2 + H2O
Zakładając 100% wydajność
Z 1 mola czyli 24 g Mg powstaje 1 mol czyli 95 g MgCl2
Z 48 g Mg powstaje x g MgCl2 x = 190 g MgCl2
Wydajność całkowita (W) procesu równa się iloczynowi wydajności etapów składowych:
W = 75% ∙ 75% = 56%
Przy 100% wydajności powstaje 190 g MgCl2
Przy 56% wydajności powstaje x g MgCl2
x = 106,4 g MgCl2
Zad. 5
Glin + Cl2 → A 2 Al + 3Cl2 → 2 AlCl3 (A)
A + NaOH → B AlCl3 + 3NaOH → Al(OH)3 (B) + 3NaCl
B + H2SO4 → C 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 (C) + 6H2O
Zapis jonowy H+ + OH- → H2O
4. B + NaOH → D Al(OH)3 + 3NaOH → Na3AlO3 + 3H2O
Zapis jonowy: Al(OH)3 + 3OH- → AlO33- + 3H2O
5. Al + O2 → E 4Al + 3O2 → 2Al2O3
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Zad. 6
ZnS + 1,5 O2 → ZnO + SO2
ZnO + H2SO4 → ZnSO4 + H2O
Elektroliza: równanie dysocjacji siarczanu(VI) cynku: ZnSO4 ↔ Zn2++SO42-
Katoda: (redukcja kationu) Zn2++ 2ē → Zn0
Anoda: (utlenienie wody) H2O - 2 ē → 2H+ + 1/2O2 ponieważ woda ulega łatwiej elektroutlenianiu niż reszta kwasowa kwasu tlenowego [siarkowego(VI)]
Zad. 7
A/ NH4HCO3 → NH3 + H2O + CO2 przy 333 K gazami będą jedynie CO2 i NH3
woda w tej temperaturze jest cieczą (600C)
Z 1 mola czyli 79 g NH4HCO3 powstają 2 mole gazów czyli 44,8 dm3
z 31,6 g NH4HCO3 powstaje x dm3
x = 17,92 dm3 gazów
B/ NH3 + H2O → NH4OH jonowo NH3+ H2O →NH4+ + OH-
Zad. 8
I/ CaSO4 + 4 C → CaS + 4 CO
II/ CaS + 2H2O → H2S + Ca2+ + 2OH-
III/ Ca(OH)2+ 2 CO2 → Ca(HCO3)2
Zapis sumaryczny procesu: CaS + 2H2O + 2CO2 → Ca(HCO3)2 + H2S
Zad. 9
NH4Cl + NaOH → NH3(↑) + NaCl + H2O
N2+ 3H2 → 2NH3 - reakcja redoks
3Mg + N2 → Mg3N2 - reakcja redols
2NH3+ H2SO4 → (NH4)2SO4
2NH3 + 2,5 O2 → 2NO + 3H2O - reakcja redoks
2 NO + O2 → 2NO2 - reakcja redoks
2 NO2 + H2O → HNO3+ HNO2 - reakcja redoks
Zad. 10
1. Cr + H2SO4 → CrSO4 + H2 -reakcja redoks
2. 2CrSO4 + 0,5 O2+ H2SO4 → Cr2(SO4)3 + H2O - reakcja redoks
Cr2(SO4)3 + 6NaOH → 3Na2SO4 + 2Cr(OH)3(↓)
2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O
2Cr(OH)3 → Cr2O3 + 3H2O
Cr(OH)3 + NaOH → Na[Cr(OH)4]
2Na[Cr(OH)4] + 3H2O2 → Na2Cr2O7 + 7H2O - reakcja redoks
Cr2O3 + 2KOH + 3H2O2 → K2Cr2O7+ 4 H2O - reakcja redoks
K2Cr2O7 + 3 K2SO3 + 4H2SO4 → Cr2(SO4)3 + 4K2SO4+ 4H2O - reakcja redoks
Cr2O3 + 3C → 2Cr + 3CO - reakcja redoks
Zad. 11
Zachodzi reakcja hydrolizy, gdyż jest to sól mocnego kwasu (H2SO4) i słabego wodorotlenku Cr(OH)3
- zapis półjonowy: Cr2(SO4)3 + 6H2O ↔ 2Cr(OH)3(↓) + 3SO42- + 6H+
zapis jonowy: Cr3+ + 3H2O → Cr(OH)3 + 3H+
Jest to przykład hydrolizy kationowej, odczyn roztworu kwaśny ( pH < 7)
Zad. 12
1/ CrO + 2HCl → CrCl2 + H2O - ten tlenek chromu ma charakter zasadowy
2/ Cr2O3 + 3H2SO4→ Cr2(SO4)3 + 3 H2O - charakter zasadowy
Cr2O3 + 2NaOH → 2NaCrO2 + H2O - charakter kwasowy. Tlenek ten posiada więc charakter amfoteryczny, gdyż reaguje zarówno z mocnymi kwasami jak i mocnymi zasadami
3/ CrO3 + 2NaOH → Na2CrO4 + H2O ten tlenek ma charakter kwasowy.
Wniosek - gdy metal posiada kilka możliwych stopni utlenienia to odpowiednie tlenki w miarę wzrostu wartości stopnia utlenienia zmieniają charakter od zasadowego przez amfoteryczny to kwasowego.
Zad. 13
Pb(NO3)2 + H2CO3 → PbCO3(↓) + 2HNO3
Pb2+ + CO32- → PbCO3
Pb(NO3)2 + Na2S → PbS (↓) + 2NaNO3
Pb2+ + S2- → PbS
Pb(NO3)2 + 2NaOH → Pb(OH)2(↓) + 2NaNO3
Pb2+ + 2OH- → Pb(OH)2
Pb(NO3)2 + Na2SO4→ PbSO4(↓) + 2NaNO3
Pb2+ + SO42-→ PbSO4
Zad. 14
Fe3O4 + 4 CO → 3Fe + 4CO2
Reakcja powyższa posiada co najmniej dwa możliwe określenia:
Reakcja redukcji magnetytu
Reakcja redoks
Zad. 15
1/ Fe2++ 2Cl- + 2Na+ + 2 OH- → Fe(OH)2(↓) + 2Na++ 2Cl-
Fe2+ + 2 OH- → Fe(OH)2
2/ 2Fe(OH)2 + H2O2 → 2Fe(OH)3
3/ 2 Fe(OH)3 (ogrzewanie) → Fe2O3 + 3H2O
4/ 2Fe(OH)3 + 3 H2SO4 → Fe2(SO4)3 + 6 H2O
Fe(OH)3+ 3 H+ → Fe3+ + 3H2O
5/ Fe2O3 + 3SO3 → Fe2(SO4)3 lub Fe2O3+ 3H2SO4→ Fe2(SO4)3+ 3H2O
Zad. 16
Schematyczny rysunek przedstawia trzy kolejne sytuacje
rysunek probówki w której znajduje się zielona ciecz - roztwór siarczanu(VI) chromu(III), z góry strzałka określająca wprowadzenie do probówki roztworu wodorotlenku sodu ( na strzałce wzór wodorotlenku sodu)
etap II w probówce zielony, galaretowaty osad wodorotlenku chromu(III)
zawartość tej probówki rozdzielenie do dwóch, z których do jednaj strzałką sygnalizujemy dodanie roztworu kwasu siarkowego(VI) - w probówce zielona klarowna (przeźroczysta) ciecz z zaznaczeniem - roztwór siarczanu(VI) chromu(III), do drugiej zaś strzałką oznaczamy dodanie roztworu wodorotlenku sodu. Zawartość probówki przyjmuje klarowny zielony kolor z zaznaczeniem wzoru powstałego roztworu tetrahydroksochromianu(III) sodu Na[Cr(OH)4
Objawy reakcji
wodorotlenek chromu(III) tworzy galaretowaty zielony osad
pod wpływem kwasu siarkowego(VI) osad roztwarza się i powstaje zielony roztwór siarczanu(VI) chromu(III)
pod wpływem wodorotlenku sodu osad również ulega roztworzeniu z utworzeniem rozpuszczalnego tetrahydroksokompleksu
WNIOSEK - Wodorotlenek chromu(III) ma charakter amfoteryczny
Zad. 17
PbS + 1,5 O2 → PbO + SO2
PbO + CO → Pb + CO2
Obliczenia przy założeniu 100% wydajności
Z 1 kmola (kilomola) czyli 239 kg PbS powstaje 207 kg ołowiu
Z 100 kg PbS powstaje x kg ołowiu
x = 86,6 kg ołowiu
UWAGA - Stosujemy kilomol jako jednostkę, gdyż w zadaniu ilości substancji zostały podane w kilogramach.
Całkowita wydajność procesu W = W1∙ W2=0,9 ∙ 0,9 = 0,81 ≡ 81%
Uwzględniając wydajność obliczymy rzeczywistą ilość powstałego ołowiu
86,6 kg Pb - 100%
x kg Pb - 81%
x = 70,15 kg Pb
Zad.18
Ba + 2H2O → Ba(OH)2 + H2
2Fe(OH)2 + H2O2 → 2Fe(OH)3
reakcja nie zachodzi
2FeS2 + 5,5 O2 → Fe2O3 + 4SO2
CaSO4∙2H2O (prażenie) → CaSO4+ 2H2O
Reakcja nie zachodzi gdyż ECu> 0 a kwas fosforowy nie jest utleniający
Dokończyć zapis równań reakcji
4 Zn + 9HNO3 stęż. → 4Zn(NO3)2 + NH3 + 3H2O
Cr(OH)3 + NaOH → Na[Cr(OH)4] - tetrahydroksochromian(III) sodu
Fe + 2HCl → FeCl2 + H2
2MnO4- + SO32- + 2OH-→ 2 MnO42- + SO42-+ H2O
Zad. 19
1. Zn + HCl → ZnCl2 + H2 chlorek cynku
2. Zn + H2SO4 → ZnSO4 + H2 siarczan(VI) cynku
3. ZnSO4 + 2NaOH → Zn(OH)2 + Na2SO4 wodorotlenek cynku
4. Zn(OH)2 + 2NaOH → Na2[Zn(OH)4] tetrahydroksocynkan sodu
5. Zn + 2 AgNO3 → Zn(NO3)2 + 2 Ag azotan(V) cynku
Zad. 20
1. Konfiguracja elektronowa atomu krzemu 14Si (14 elektronów)
| 1s2 | 2s2 | 2p6 | 3s2 | 3p2 |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑ |
↑ |
|
2. Cztery elektrony walencyjne, więc możliwe wartościowości w połączeniu z bardziej elektroujemnym tlenem to +II (pozostaje dublet) oraz + IV (pozostaje oktet elektronów z powłoki przedostatniej), tworzy więc tlenki: SiO - tlenek krzemu(II) oraz SiO2 - tlenek krzemu(IV) zwany również krzemionka (nazwa zwyczajowa)
CO2 - gaz, cięższy od powietrza o charakterze kwasowym (bezwodnik kwasu węglowego)
SiO2 - ciało stałe (krzemionka) o charakterze słabo kwasowym. Reaguje z zasadaami w podwyższonej temperaturze.
4NaOH + SiO2 →Na4SiO4 + 2H2O
Na4SiO4 + 4H2O → H4SiO4 + 4Na+ + 4OH-
H4SiO4 + SiO2 + H2O → H6Si2O7
Zad. 21
Konfiguracja elektronowa baru (skrócona) - [Rn] 6s2
Metal aktywny z racji położenia w drugiej grupie a ponadto z powodu znacznych rozmiarów atomu (położenie w siódmym okresie) i z tego powodu jest aktywniejszy od wapnia. Tworzy zasadę ( dobrze rozpuszczalny wodorotlenek) podczas gdy wodorotlenek wapnia posiada ograniczoną rozpuszczalność. Odwrotnie jest z rozpuszczalnością soli, np. odpowiednich siarczanów. Siarczan(VI) baru jest praktycznie nierozpuszczalny w wodzie.
Zad. 22
24Cr - 1s22s22p63s23p64s13d5 - posiada sześć elektronów niesparowanych
Uwaga - proszę zwrócić uwagę na nietypowy zapis końcówki 4s13d5 zamiast tradycyjnego 4s23d4 Wynika to z faktu, że energetycznie preferowana jest ilość 5 lub 10 elektronów na podpowłoce d, (po jednym lub po dwa elektrony na orbitalu typu d). Dla osiągnięcia takiego stanu, dochodzi do przeniesienie elektronu z podpowłoki s na d. Podobnie jak z chromem dzieje się z miedzią, której atom miałby konfigurację powłoki walencyjnej 4s23d9 a w związku z powyższym będzie miał konfigurację 4s13d10.
Zapis klatkowy konfiguracji walencyjnej - 4s13d5
↑ |
↑ |
↑ |
↑ |
↑ |
↑ |
4s1 3d5
II stopień utlenienia w CrO tlenek chromu(II) wykazuje charakter zasadowy
CrO + 2HCl → CrCl2 + H2O
CrO + NaOH - reakcja nie zachodzi
III stopień utlenienia w Cr2O3 -wykazuje charakter amfoteryczny
Cr2O3 + 6HCl → 2CrCl3+ 3H2O
Cr2O3 + 2NaOH → 2NaCrO2 + H2O
VI stopień utlenienia w CrO3 - wykazuje charakter kwasowy
CrO3 + 2NaOH → Na2CrO4 + H2O
CrO2 + HCl → reakcja nie zachodzi
Uzgodnienie równania reakcji redoks:
K2Cr2O7 + 3 CH3-CH(OH)-CH3 + 4H2SO4→ Cr2(SO4)3 +K2SO4+3CH3-CO-CH3+7H2O
Bilans elektronowy:
2 Cr+VI → 2Cr3++ 6ē
3x | C3-VI- 2 ē→ C3-IV
Uwaga - przyjęto łączną elektrowartościowość dla trzech atomów węgla gdyż w fazie końcowej (w propanolu) atomy węgla miałyby elektrowartościowość ułamkową(!)
Zad. 23
Identyczność konfiguracji elektronów walencyjnych ns2 świadczy to, że należą do tej samej grupy, są dwuwartościowe a aktywność ich rośnie w grupie w miarę wzrostu wartości promienia atomowego (wyższa wartość głównej liczby kwantowej) gdyż ułatwia to oddawanie elektronów czyli zwiększa aktywność.
Ca → Ca(OH)2 Ca + 2H2O → Ca(OH)2+ H2
Ca(OH)2 → CaCO3 Ca(OH)2 + CO2 → CaCO3+ H2O
CaCO3→ Ca(HCO3)2 CaCO3+ H2O +CO2 →Ca(HCO3)2
Ca(HCO3)2 → CaCO3 Ca(HCO3)2[ogrzanie] → CaCO3+H2O+CO2
CaCO3→ CaO CaCO3[prażenie] → CaO + CO2
CaO → CaCl2 CaO + 2HCl → CaCl2 + H2O
Twardość wody jest spowodowana obecnością jonów wapnia i magnezu oraz w pewnej mierze jonów innych metali. Ze względu na współwystępujące aniony rozróżnia się twardość trwałą (gdy są to aniony dające rozpuszczalne sole z tymi jonami np. azotany, siarczany czy chlorki). Twardość przemijającą spowodowana jest obecnością wodorowęglanów, które pod wpływem ogrzewania rozkładają się tworząc nierozpuszczalny węglan (CaCO3) lub wodorotlenek np. Mg(OH)2.
Zad. 24
Ogólne wzory struktur walencyjnych:
litowce ns1- aktywne metale o stopniu utlenienia +I (jednowartościowe) ich aktywność w grupie rośnie ze wzrostem promienia atomowego (czyli numeru okresu w którym występuje)
fluorowce ns2np5- aktywne niemetale o głównym stopniu utlenienia -I. W grupie ze wzrostem masy atomowej ich aktywność maleje
Rodzaje wiązań chemicznych: w Rb Cl - wiązanie jonowe (typowe dla soli); w cząsteczce HBr wiązanie atomowe spolaryzowane
Zad. 25
Fluorowiec aktywniejszy wypiera z soli fluorowiec mniej aktywny przykłady:
2NaI + Br2 aq → 2NaBr + I2 lub 2NaBr + Cl2→ 2NaCl +Br2aq
Zad. 26
Na + O2(spalanie) → Na2O2 nadtlenek sodu
Na2O2 + 2Na → 2Na2O tlenek sodu
Na2O + H2O → 2NaOH wodorotlenek sodu
NaOH + SO2→ NaHSO3 wodorosiarczan(IV) sodu
2NaOH + SO2→ Na2SO3 + H2O siarczan(IV) sodu
Cl2 + H2 → 2HCl chlorowodór
HCl + NaOH → NaCl + H2O chlorek sodu
Zad. 27
Twardy metal o połysku srebrzystym, łatwo ulega pasywacji.
III - stopień utlenienia zielony tlenek chromu(III) katalizator wielu procesów chemicznych, zielony pigment. Wykazuje właściwości amfoteryczne
VI - stopień utlenienia, tlenek kwasowy tworzy chromiany(VI) i dichromiany(VI). Bardzo silne utleniacze.
Zad. 28
2 FeCr2O4 + 4Na2CO3 + 3,5 O2 → 4 Na2CrO4 + Fe2O3 + 4CO2
2Na2CrO4 + 2H+ → Na2Cr2O7 + H2O + 2Na+
Na2Cr2O7 + 2C → Cr2O3 + CO + Na2CO3
Cr2O3 + 2Al → 2Cr + Al2O3
Zad. 29
Struktury elektronowe pełne:
Mn0 1s22s22p63s23p64s23d5 pięć elektronów niesparowanych
Mn2+ 1s22s22p63s23p63d5
Równania reakcji:
Mn + H2SO4 → MnSO4+ H2
MnSO4 + 2NaOH → Mn(OH)2+ Na2SO4
Mn(OH)2+ H2O2 → MnO2 + 2H2O
4. MnSO4 + 4 C → MnS + 4CO
MnO2 + 4HCl → Cl2 + MnCl2 + 2H2O
Mn + S → MnS
MnS + 2HCl → MnCl2+ H2S (↑)
3MnCl2 + 2Na3PO4 → Mn3(PO4)2(↓) + 6NaCl
Zad. 30
Strukturę elektronową manganu podano w poprzednim zadaniu (Zad.29)
Grupa 1 ns1 litowce
Grupa II ns2 berylowce
Grupa III ns2(n-1)d1 skandowce
Grupa IV ns2(n-1)d2 tytanowce
Grupa V ns2(n-1)d3 wanadowce
Grupa VI ns2(n-1)d4 chromowce
Grupa VII ns2(n-1)d5 manganowce
Grupa VIII ns2(n-1)d6 żelazowce
Grupa IX ns2(n-1)d7 kobaltowce
Grupa X ns2(n-1)d8 niklowce
Grupa XI ns2(n-1)d9 miedziowce
Grupa XII ns2 (n-1)d10 cynkowce
Grupa XIII ns2 (n-1)d10 np1 borowce
Grupa XIV ns2 (n-1)d10 np2 węglowce
Grupa XV ns2 (n-1)d10 np3 azotowce
Grupa XVI ns2 (n-1)d10np4 tlenowce
Grupa XVII ns2 (n-1)d10 np5 fluorowce
Grupa XVIII ns2 (n-1)d10 np6 helowce tzw. gazy szlachetne
Do tego dochodzą pierwiastki bloku energetycznego f (uzupełniające elektronu na powłoce drugiej od końca) są to lantanowce i aktynowce
Zad. 31
Mn + H2SO4 → MnSO4+ H2
MnO + H2O2 → MnO2+ H2O
MnO2 + 2H2SO4 → Mn(SO4)2 + 2H2O
MnO2 + 2NaOH → Na2MnO3 + H2O
MnO2 + H2O2 → MnO42- + 2H+
Fe3+ + MnO4-2 → Fe2+ + MnO4-
MnO4-+Fe2+ → Fe3+ + MnO42-
Zad. 32
Szukane pierwiastki 8X = O (tlen); 11Y = Na (sód); 16Z = S (siarka) zostały zidentyfikowane w układzie okresowym na podstawie podanych liczb atomowych (zwanych również inaczej porządkowymi). Oto wzory i nazwy połączeń:
tlenek metalu - Na2O tlenek sodu
tlenek niemetalu - SO2 tlenek siarki(IV)
nadtlenek metalu - Na2O2 nadtlenek sodu
sól kwasu beztlenowego - Na2S siarczek sodu
sól słabego kwasu beztlenowego - Na2SO3 siarczan(IV) sodu
sól mocnego kwasu tlenowego - Na2SO4 siarczan(VI) sodu
Równania reakcji z wodą:
Na2O + H2O → 2NaOH
SO2 + H2O → H2SO3
Na2O2 + H2O → 2NaOH + 0,5O2
Na2S + 2H2O → H2S + 2Na++ 2OH- hydroliza anionowa; odczyn zasadowy
Na2SO3 + 2H2O → H2SO3 + 2Na+ + 2OH- hydroliza anionowa; odczyn zasadowy
Na2SO4 + H2O → reakcja hydrolizy nie zachodzi gdyż jest to sól mocnego kwasu i mocnej zasady
Zad. 33
Konfiguracja elektronowa atomu chromu i zapis klatkowy: (pytanie bardzo często pojawiające się w testach prawdopodobnie ze względu na nietypowy zapis - przeniesienie elektronu z orbitalu s na orbital d podobnie jak w atomach miedzi) 26Cr - 1s22s22p63s23p64s13d5
1s2 |↑↓|
2s2 2p6 |↓↑| |↑↓|↑↓|↑↓|
3s2 3p6 3d5 |↓↑| |↓↑|↓↑|↓↑| |↑ |↑ |↑ |↑ |↑ |
4s1 |↑ |
Stopnie utlenienia chromu to: +II, +III, +VI
W miarę wzrostu wartości stopnia utlenienia związków chromu:
Wzrastają właściwości utleniające
Związki chromu zmieniają charakter z zasadowego przez amfoteryczne do kwasowego (przy stopniu utlenienia +VI)
Uwaga - ta prawidłowość dotyczy wszystkich metali o wielu stopniach utlenienia takich jak np. żelazo, mangan czy chrom
Uzgodnienie równania reakcji metodą bilansu elektronowego
Cr2(SO4)3 + 10 KOH + 3H2O2 → 2K2CrO4 + 3K2SO4 + 8H2O
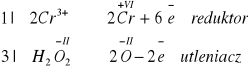
Zad. 34
2 Ca3(PO4)2 + 6SiO2 + 10C → P4 + 10 CO + 6CaSiO3
Obliczenia:
Ilość fosforanu(V) wapnia - 60% z 1000 kg = 600 kg
Z równania reakcji wynika, że
Z 2 kmoli Ca3(PO4)2 czyli 624 kg powstaje 124 kg P4
Z 600 kg powstaje x kg P4
X = 119,2 kg P4
Dalsze równania reakcji:
16 H2O + P4 + 10CuSO4 → 10Cu + 10 H2SO4 + 4H3PO4
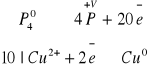
2P2 + 5 O2 → P4O10
P4O10 + 6H2O → 4H3PO4
Ca3(PO4)2 + 3H2SO4 → 3CaSO4 + 2H3PO4
Reakcja powyższa zachodzi ponieważ kwas siarkowy(VI), w przeciwieństwie do ortofosforowego, jest kwasem mocnym
Obliczenie zawartości procentowe fosforu w superfosracie (M = 234 g/mol)
1 mol superfosfatu czyli 234 g stanowi 100 %
2 mole fosforu czyli 62 g stanowi x %
x = 26,5% fosforu
Alotropia to zjawisko polegające na występowaniu pierwiastków w różnych formzch krystalicznych i cząsteczkowych. Przykładowymi pierwiastkami wykazującymi alotropię:
Fosfor biały i czerwony
Węgiel - diament, grafit, sadza i fullereny
Tlen - tworzy tradycyjnie cząsteczki dwuatomowe oraz trójcząsteczkowe O3 - ozon
Otrzymanie ortofosforanu srebra - do rozpuszczalnego ortofosforanu sodu dodać roztwór azotanu(V) srebra. Wytrąci się żółty osad ortofosforanu srebra
Zapis cząsteczkowy - Na3PO4 + 3AgNO3 → Ag3PO4 (↓)+ 3NaNO3
Zapis jonowy skrócony - PO43- + 3Ag+ → Ag3PO4
Otrzymanie fosforiaku
12 H2O + 12 KOH + 4P4 → 4PH3 + 12 KH2PO2
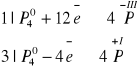
rolę utleniacza i reduktora pełni fosfor. Tego typu reakcje redoks, w których ta sama substancja pełni rolę utleniacza i reduktora nazywamy reakcjami dysproporcjonowania.
Zad. 35
A/ ![]()
- to pełny zapis nuklidu Cl - 35, z zapisu wynika że atom ten składa się z 17 elektronów, zaś jądro tworzą nukleony czyli 17 protonów I 18 neutronów
B/ Otrzymanie chloru:
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
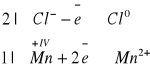
C/ 2 Na + Cl2 → 2 NaCl
Nao 1s22s22p63s1 elektroujemność 0,9
Cl- 1s22s22p63s23p5 elektroujemność 3,0
Różnica elektroujemności (3,0 - 0,9) = 2,1 > 1,7 wskazuje na utworzenie wiązania jonowego, czyli na przeniesienie pary elektronów tworzących wiązanie do sfery elektronowej atomu chloru, wskutek czego atom chloru przekształca się w jon chlorkowy posiadający oktet na ostatniej powłoce. Również atom sodu oddając elektron walencyjny przyjmuje ośmioelektronową powłokę zewnętrzną.
Na+ 1s22s22p6
Cl - 1s22s22p63s23p6
D/ Wzory tlenków
- na +I stopniu utlenienia Cl2O
- na + III stopniu utlenienia Cl2O3
- na + VII stopniu utlenienia Cl2O7
Cl2O3 + 2NaOH → 2NaClO2 + H2O chloran(III) sodu
Cl2O7 + 2NaOH → 2NaClO4 + H2O chloran(VII) sodu
E/ Elektroliza wodnego roztworu NaCl
NaCl → Na+ + Cl-
KATODA - woda ulega łatwiej elektroredukcji niż kation sodu
H2O + ē → ½ H2 + OH-
ANODA - elektroutlenianiu ulegają jony chlorkowe
Cl- →Cl0 + ē
Na katodzie wydziela się wodór zaś na anodzie chlor. W roztworze pozostaje więc wodorotlenek sodu. Jest to metoda otrzymania wodorotlenku sodu na skalę techniczną.
F/ KF + Cl2aq → reakcja nie zachodzi ponieważ chlor jest mniej aktywny od fluoru
2KBr + Cl2aq → 2KCl + Br2 ponieważ chlor jest aktywniejszy od bromu
2 KI + Cl 2aq → 2KCl + I2 ponieważ chlor jest aktywniejszy od jodu
Zad. 36
A/ N2 + 3H2 → 2NH3 2NH3+ 21/2 O2→ 2NO + 3H2O
2NO + O2 → 2NO2 2NO2 + H2O →HNO3 + HNO2
B/ Wzór elektronowy kwasu azotowego(V) pokazano na płycie I -wiązania chemiczne. W cząsteczce występują cztery wiązania atomowe spolaryzowane i jedno wiązanie koordynacyjne)
C/ Reakcja cynku i miedzi z rozcieńczonym kwasem azotowym(V)
3Cu + 8HNO3 → 3Cu (NO3)2 + 2NO + 4H2O
Zn + 2HNO3 → Zn(NO3)2 + H2
Reakcje miedzi i cynku ze stężonym kwasem azotowym(V)
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
4Zn + 9HNO3 →4 Zn(NO3)2 + NH3 +3 H2O
Zad. 37
1/ Na2O - różnica elektroujemności (3,5 - 0,9 =2,6) jako, że 2,6> 1,7 w cząsteczce występuje wiązanie jonowe, tlenek metalu I grupy ma właściwości zdecydowanie zasadowe
Na2O + CO2→ Na2CO3 lub Na2O + H2O → 2NaOH
Al2O3 - różnica elektroujemności (3,5 - 1,5 =2) jako, że 2> 1,7 w cząsteczce występuje wiązanie jonowe, glin jest metalem grupy III, więc tlenek ma właściwości amfoteryczne:
Al2O3 + 6HCl → 2AlCl3 + 3H2O Al2O3 + 6NaOH → 2Na3AlO3 + 3H2O
Cl2O7 - różnica elektroujemności (3,5 - 3,0 = 0,5) jako, że 0,5> 0,4 wiązanie o bardzo słabym charakterze polarnym, chlor typowy niemetal, więc tlenek ma charakter kwasowy
Cl2O7 + 2NaOH → 2NaClO4 + H2O
2/ 30E => Zn pierwiastek grupy XII ; blok energetyczny d
1s22s22p63s23p64s23d10 - blok energetyczny d więc pierwiastek ma charakter amfoteryczny. Aby to udowodnić, do probówki z roztworem azotanu(V) cynku dodać kroplę roztworu wodorotlenku sodu do wytrącenia białego, galaretowatego osadu wodorotlenku cynku. Zawartość probówki rozdzielamy do dwóch probówek i kolejno na jedną działamy roztworem wodorotlenku sodu do roztworzenia osadu a na zawartość drugiej działamy roztworem kwasu solnego aż do roztworzenia osadu. Wodorotlenek cynku reaguje zarówno z mocną zasadą jak i mocnym kwasem - wykazuje więc właściwości amfoteryczne
Zad. 38
Poniżej podano równania odpowiednich reakcji z udziałem połączeń żelaza:
3Fe + 4H2O → Fe3O4 + 4H2
Fe + H2SO4→ FeSO4 + H2
2Fe + 3Cl2 → 2FeCl3
FeCl3 + NaCl → Na[FeCl4] - tetrachlorożelazian(III) sodu
FeCl2 + H2C2O4 → FeC2O4 + 2HCl
Fe2O3 + O2 + K2O → KfeO3
Fe(OH)3 + 5NaOH + 1,5Cl2 → Na2FeO4 + 3NaCl + 4H2O
1
18
Wyszukiwarka
Podobne podstrony:
ISE powtorka z chemii, ISE zwiazki organiczne zawierajace azot, P 8 Związki organiczne zawierając az
ISE powtorka z chemii, ISE aldehydy i ketony, P 5
ISE powtorka z chemii, ISE p 1 analiza elementarna, P
ISE powtorka z chemii, ISE ZADANIA Przeliczanie stezen roztworow, Przeliczanie stężeń roztworów
ISE powtorka z chemii, ISE charakterystyka litowców i berylowców, Charakterystyka litowców i berylow
ISE powtorka z chemii, ISE alkohole i fenole, P
ISE powtorka z chemii, ISE a.a. slowo wstepne, Słowo wstępne
ISE powtorka z chemii, ISE fluorowce, M Fluorowce
ISE powtorka z chemii, ISE otrzymywanie i wlasciwosci najwazniejszych kwasow, O
ISE powtorka z chemii, ISE analiza chem i rozpuszczalnosc, Propozycje na stroną Internetową CEŚ
ISE powtorka z chemii, ISE metale i elektrochemia, Propozycje tematyki do strony internetowej CEŚ
zestaw51 04, WIiTCH, semestr I, podstawy chemii, zestawy obliczenia chemiczne
I POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ, Technologia chemiczna, Chemia organiczna, 4 semestr, organ
własności chemiczne proszków
Praca powtórzeniowa z chemii 3
Odp 21 54, WIiTCH, semestr I, podstawy chemii, zestawy obliczenia chemiczne
zestaw47 04, WIiTCH, semestr I, podstawy chemii, zestawy obliczenia chemiczne
zestaw46 04, WIiTCH, semestr I, podstawy chemii, zestawy obliczenia chemiczne
zestaw43 03, WIiTCH, semestr I, podstawy chemii, zestawy obliczenia chemiczne
więcej podobnych podstron