UWALNIANIE PRODUKTÓW WEWNĄTRZKOMÓRKOWYCH
Wstęp teoretyczny
Ze względu na problemy z wydzielaniem Lipaz wewnątrzkomórkowych poza komórkę, są one poznane w dużo mniejszym stopniu. Aby wydzielić je poza komórkę stosuje się liczne metody:
Mechaniczne (bezpośrednie rozrywanie komórek)
- rozcieranie biomasy
- homogenizacja biomasy
Chemiczne (czynnik chemiczny nie może działać negatywnie na nasz produkt)
- ekstrakcja detergentami
- rozpuszczalniki organiczne (np. aceton)
- antybiotyki ( w celu zahamowania syntezy ściany
komórkowej)
Fizyczne - zamrażanie i rozmrażanie
- szok osmotyczny
- sonifikacja
- ultradźwięki
Enzymatyczne - lizozymy
- peptydoglikany
- drożdże
- glukanaza
W praktyce najczęściej stosowanymi metodami uwalniania składników wewnątrzkomórkowych są: ultradźwięki ( dobrze rozrywają bakterie „gram-”, ścinanie pod wpływem drgań)
mielenie w specjalnych młynkach ( z dodatkiem materiałów ściernych)
działanie wysokich ciśnień w stanie zamrożenia, stosuje się tzw. X-prasy ( przetłaczanie zamrożonej „pasty” przez małe otwory pod ciśnieniem 1000-6000 atm i gwałtowna dekompresja, co powoduje pękanie ścian komórkowych)
enzymatyczna liza ściany komórkowej, jest to dosyć kosztowna metoda ( najstarszym sposobem jest stosowanie enzymów litycznych ze ślimaka winniczka Helix pomatia lub lizozymu z białka kurzego)
Lipazy są enzymami z klasy hydrolaz, które rozkładają wiązania estrowe w tłuszczach. Końcowym produktem ich aktywności są wolne kwasy tłuszczowe i glicerol, a produktami pośrednimi - diglicerydy i monoglicerydy. W organizmie człowieka występują: lipaza żołądkowa i trzustkowa. Lipazy występują również u roślin i drobnoustrojów.
Cel ćwiczenia
.
Materiały i metody.
1. Materiał biologiczny.
Szczep grzybów nitkowatych Mucor circinelloides z kolekcji Instytutu Biochemii Technicznej hodowano na wstrząsarce w czasie 72 godzin w temp. 30oC na podłożu zawierającym namok kukurydziany i olej oliwkowy. Do kolby o pojemności 1000 cm3 wprowadzono 300 cm3 podłoża hodowlanego i szczepiono kulturą mateczną za pomocą ezy. Nagromadzoną w wyniku hodowli biomasę sączono na przegrodzie celulozowej i przemywano wodą destylowaną.
2. Wykonanie ćwiczenia
2.1 Wydzielanie lipazy Mucor circinelloides z komórki:
2.1.1 Metoda I
Odważyć i gram biomasy przemytej wodą destylowaną. Osad przenieść do naczynia i zalać 5 cm3 0,05 M buforu fosforanowego o pH 7,0. Inkubować w temperaturze 37oC w czasie 15 minut. Następnie przesączyć na przegrodzie celulozowej. W przesączu oznaczyć aktywność lipazy.
2.1.2 Metoda II
Odważyć i gram biomasy przemytej wodą destylowaną. Osad przenieść do naczynia i zalać 4,5 cm3 0,05 M buforu fosforanowego o pH 7,0 i 0,5 cm3 roztworu cholanu sodu. Inkubować w temperaturze 37oC o czasie 15 minut. Następnie przesączyć na przegrodzie celulozowej. W przesączu oznaczyć aktywność lipazy.
2.1.3 Metoda III
Odważyć i gram biomasy przemytej wodą destylowaną. Osad przenieść do moździerza, dosypać bezołowiowych kulek szklanych i zalać 4,5 cm3 0,05 M buforu fosforanowego o pH 7,0. Rozcierać w czasie 10 minut. Całość przenieść do naczynia szklanego, dodać 0,5 cm3 roztworu cholanu sodu. Inkubować w temperaturze 37oC o czasie 15 minut. Następnie przesączyć na przegrodzie celulozowej. W przesączu oznaczyć aktywność lipazy.
2.1.4 Metoda IV
Odważyć i gram biomasy przemytej wodą destylowaną. Osad przenieść do naczynia i zalać 4,5 cm3 0,05 M buforu fosforanowego o pH 7,0. Homogenizować w czasie 2 minut zanurzając naczynie homogenizera w łaźni lodowej. Całość przenieść do naczynia szklanego, dodać 0,5 cm3 roztworu cholanu sodu. Inkubować w temperaturze 37oC o czasie 15 minut. Następnie przesączyć na przegrodzie celulozowej. W przesączu oznaczyć aktywność lipazy.
2.1.5 Metoda V
Odważyć i gram biomasy przemytej wodą destylowaną. Osad przenieść do naczyńka wykonanego z folii aluminiowej, dodać 4,5 cm3 0,05 M buforu fosforanowego o pH 7,0 i dwukrotnie zamrozić do temperatury -20oC i rozmrozić. Całość przenieść do naczynia szklanego, dodać 0,5 cm3 roztworu cholanu sodu. Inkubować w temperaturze 37oC o czasie 15 minut. Następnie przesączyć na przegrodzie celulozowej. W przesączu oznaczyć aktywność lipazy.
2.1.6 Metoda VI
Odważyć i gram biomasy przemytej wodą destylowaną. Osad przenieść do naczynia szklanego i zalać 5 cm3 acetonu. Mieszać w czasie 5 minut i odsączyć dobrze odciskając na przegrodzie ceramicznej. Operację przemywania acetonem powtórzyć 3 razy. Odwodnioną grzybnię rozłożyć pod wyciągiem na bibule i suszyć w czasie 15 minut. Całość przenieść do naczynie szklanego, dodać 4,5 cm3 0,05 M buforu fosforanowego o pH 7,0 i 0,5 cm3 roztworu cholanu sodu. Inkubować w temperaturze 37oC o czasie 15 minut. Następnie przesączyć na przegrodzie celulozowej. W przesączu oznaczyć aktywność lipazy.
2.2 Oznaczenie aktywności esterazowej lipazy
Substratem do oznaczenia aktywności jest octan p-nitrofenolu, który pod działaniem esteraz i lipaz ulega hydrolizie z wydzieleniem p-nitrofenolu. Maksimum pochłaniania światła dla tego związku występuje przy długości fali 399nm. Sam octan p-nitrofenolu nie wykazuje pochłaniania przy tej długości światła. Bezpośrednio przed użyciem substrat o stężeniu 50 μmoli/cm3 w acetonitrylu rozcieńczyć bezpośrednio przed użyciem pięciokrotnie wodą destylowaną.
2.2.1 Wykonanie oznaczenia
Do probówki wprowadzamy: 0,1 cm3 rozcieńczonego roztworu p-nitrofenoly, 0,8 cm3 buforu fosforanowego 0,05 M o pH 7,0 i 0,1 cm3 ekstraktu lipazy. Inkubujemy w temperaturze pokojowej w czasie 15 minut. Szybkość uwalniania p-nitrofenolu mierzymy za pomocą fotokolorymetru przy długości fali 399 nm. Stężenie uwolnionego p-nitrofenolu odczytać z krzywej kalibracyjnej.
Obliczenia
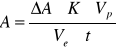
[ (μmol)/(ml*min)=U/ml]
∆A - różnica absorbancji
K - 0,076 [μmol/ml]
Vp - objętość próbki =1ml
Ve - objętość preparatu enzymatycznego = 0,1ml
t - czas inkubacji = 15 minut
Wyniki i ich omówienie
Tabela wyników wszystkich grup.
Wyniki naszej grupy zostały zaznaczone.
Obliczenia aktywności wykonałem dla wyników naszej grupy.
Wnioski
Wyszukiwarka
Podobne podstrony:
sprawko 6 Rafała, studia, bio, 3rok, 6sem, biotechnologia, lab
spr6, studia, bio, 3rok, 6sem, biotechnologia, lab
spr11, studia, bio, 3rok, 6sem, biotechnologia, lab
sprawozdanko moje - 7, studia, bio, 3rok, 6sem, biotechnologia, lab
spr9, studia, bio, 3rok, 6sem, biotechnologia, lab
spr8, studia, bio, 3rok, 6sem, biotechnologia, lab
ćwiczenie nr 10, studia, bio, 3rok, 6sem, biotechnologia, lab
metody dezintegracji komórek, studia, bio, 3rok, 6sem, biotechnologia, wyklad
pomoc od Jakubowskiego, studia, bio, 3rok, 6sem, biotechnologia, wyklad
mutagenizacja, studia, bio, 4rok, 8sem, biotechnologia2, lab
enzymologia w8, studia, bio, 3rok, 6sem, enzymologia, enzymologia wykłady
Biotechnologia II immobilizacja poprawa spr, studia, bio, 4rok, 8sem, biotechnologia2, lab
wyklad w11, studia, bio, 3rok, 6sem, enzymologia, enzymologia wykłady
Przykłady zastosowania enzymów, studia, bio, 3rok, 6sem, enzymologia
iMMOBILIZACJA BIOkatalizatorów, studia, bio, 4rok, 8sem, biotechnologia2, lab
Base Form, studia, bio, 3rok, 6sem, ang
enzymologia w10, studia, bio, 3rok, 6sem, enzymologia, enzymologia wykłady
więcej podobnych podstron