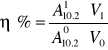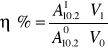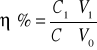Laboratorium z biotechnologii
Ćwiczenie 6
Temat:
Wyodrębnianie preparatów enzymów z cieczy pohodowlanej bakterii
Data wykonania ćwiczenia: 7.04.2009 r.
Cel ćwiczenia
Ćwiczenie służy poznaniu niektórych metod stosowanych w produkcji przemysłowej preparatów enzymatycznych uzyskiwanych z bakterii na przykładzie proteinaz produkowanych przez Bacillus subtilis.
Wykonanie
Aby porównać efektywność różnych metod oddzielania biomasy i wydzielania produktu, każda grupa stosowała inną metodę.
Usuwanie biomasy B. subtilis z podłoża pohodowlanego
Pobrano 20 ml (V0) cieczy po hodowli B. subtilis. Odmierzony płyn wstawiono do łaźni z lodem i mieszając, dodano 0,1 g KH2PO4 oraz 0,8 ml 50% roztworu CaCl2. Po 10 min pozostawania w łaźni z lodem przeniesiono do kuwety wirówkowej. Do drugiej kuwety wprowadzono odpowiednią ilość wody w celu zrównoważenia. Następnie odwirowano w wirówce laboratoryjnej przez 10 min przy prędkości 4000 rpm. Po wirowaniu zmierzono objętość supernatantu (V1).
oznaczanie zmętnienia
Próbkę cieczy pohodowlanej pobraną przed oddzieleniem biomasy rozcieńczono 20-krotnie i dokonano pomiaru absorbancji na „Specolu” wobec wody destylowanej przy długości fali 660 nm. Oznaczono również zmętnienie supernatantu po oddzieleniu biomasy (w tym przypadku nie było potrzeby wykonywania rozcieńczenia).
oznaczanie aktywności proteolitycznej metodą Ansona
Próby właściwe:
Ciecz pohodowlaną (przed oddzieleniem biomasy) oraz supernatant rozcieńczono 10-krotnie. Do 2 probówek wprowadzono po 1 ml hemoglobiny, a następnie dodano 0,2 ml 10-krotnie rozcieńczonego enzymu pochodzącego z prób pobranych przed i po oddzieleniu biomasy. Po wymieszaniu inkubowano 10 min w temperaturze otoczenia.
Po tym czasie do każdej z prób dodano 2 ml kwasu trójchlorooctowego w celu zatrzymania reakcji enzymatycznej, wymieszano i pozostawiono na 15 min. Następnie przefiltrowano na sączku z bibuły.
Próby kontrolne:
Do 2 probówek zawierających po 1 ml hemoglobiny dodano po 2 ml kwasu trójchlorooctowego, następnie do każdej probówki dodano 0,2 ml 10-krotnie rozcieńczonego enzymu pochodzącego z prób pobranych po przed i po oddzieleniu biomasy. Po wymieszaniu pozostawiono na 20 minut, po czym przesączono przez sączek z bibuły.
Pobieramy po 1 ml filtratów i przenosimy do podpisanych probówek, następnie dodajemy po 2 ml 0,6n NaOH i 0,6 ml odczynnika Folina (1:2), natychmiast mieszamy i pozostawiamy na 10 minut. Po tym czasie mierzymy absorbancję badanych prób na „Specolu” wobec odpowiednich prób kontrolnych przy długości fali 690 nm.
Wydzielanie subtilizyny z filtratu po oddzieleniu biomasy
Odmierzono 30 ml (V0) cieczy pohodowlanej otrzymanej po oddzieleniu biomasy (pH cieczy wynosi 7,4; jest to punkt izoelektryczny produktu - subtilizyny) i przeniesiono do zlewki o pojemności 100 ml umieszczonej w łaźni z lodem. W celu wysolenia białka enzymatycznego z roztworu, małymi porcjami dodano 12 g stałego (NH4)2SO4 , mieszając na mieszadle magnetycznym. W ten sposób osiągnięto stężenie soli 40% w/v. Zaprzestano mieszania i pozostawiono roztwór na 15 min w łaźni z lodem.
Po tym czasie przeniesiono ciecz do kuwety wirnikowej. Do drugiej kuwety wprowadzono taką ilość wody, aby zrównoważyć obydwa pojemniki. Odwirowano na wirówce laboratoryjnej (10 min, 4000 rpm). Ciecz nadosadową usunięto. Ponieważ jony wapnia stabilizują białko subtilizyny, osad rozpuszczono w 15 ml 0,1% roztworu (CH3COO)2Ca. Zmierzono końcową objętość otrzymanego roztworu (V1).
oznaczanie stężenia białka metodą Lowry'ego
Ciecz pohodowlaną po oddzieleniu biomasy rozcieńczono 20-krotnie. Uzyskany roztwór subtilizyny rozcieńczono 40-krotnie. Do podpisanych probówek wprowadzono po 2 ml odczynnika C, a następnie dodano po 0,4 ml odpowiednich badanych roztworów. Całość inkubowano 10 min w temperaturze otoczenia. Potem dodano 0,2 ml odczynnika Folina (1:1), wymieszano i umieszczono w cieplarce o temperaturze 37˚C. Równolegle wykonano próbę odczynnikową, zawierającą wodę destylowaną zamiast roztworu enzymu.
Po ok. 30 min zmierzono absorbancję prób badanych wobec próby kontrolnej na „Specolu” przy λ = 650 nm.
oznaczanie aktywności proteolitycznej metodą Ansona
Ciecz pohodowlaną po oddzieleniu biomasy rozcieńczono 10-krotnie. Uzyskany roztwór subtilizyny rozcieńczono 20-krotnie. Następnie wykonano oznaczenia analogicznie jak w punkcie 2.1. b)
Opracowanie wyników
Tabela 1. Wyniki zbiorcze - etap 1.
grupa |
I ETAP - oddzielenie biomasy |
objętość [ml] |
OD660 = E660 · R |
aktywność proteolityczna [mjA/ml] |
|
1. |
ciecz wyjściowa V0 |
30 |
14,6 |
2,25 |
66 |
|
po wirowaniu V1 |
26 |
0,85 |
1,72 |
|
2. |
ciecz wyjściowa V0 |
20 |
9,4 |
2,5 |
15 |
|
po koagulacji i wirowaniu V1 |
19 |
0,15 |
0,4 |
|
3. |
ciecz wyjściowa V0 |
20 |
14,8 |
1,8 |
29 |
|
po koagulacji i filtracji V1 |
16 |
0,14 |
0,65 |
|
4. |
ciecz wyjściowa V0 |
20 |
10,4 |
1,28 |
29 |
|
po filtracji V1 |
19 |
7,2 |
0,55 |
|
Tabela 2. Wyniki zbiorcze - etap 2.
gru-pa |
II ETAP - wydzielenie białka enzymat. |
objętość [ml] |
aktywność proteolit. [mjA/ml] |
stężenie białka C [mg/ml] |
wydajność aktywności |
wydajność białka |
stopień oczyszcze-nia |
1. |
ciecz wyjściowa V0 |
30 |
2,07 |
6,2 |
28,5 |
26,5 |
1,1 |
|
roztwór enzymatyczny (wysolone białko) V1 |
17 |
1,04 |
2,9 |
|
|
|
2. |
ciecz wyjściowa V0 |
30 |
2,6 |
5,3 |
100 |
54,5 |
1,8 |
|
roztwór enzymatyczny (wysolone białko) V1 |
17 |
4,62 |
5,1 |
|
|
|
3. |
ciecz wyjściowa V0 |
20 |
2,0 |
4,2 |
75,5 |
32 |
2,4 |
|
roztwór enzymatyczny (wytrącanie etanolem)V1 |
10 |
3,11 |
2,7 |
|
|
|
4. |
ciecz wyjściowa V0 |
20 |
2,0 |
8,0 |
41 |
40 |
1,0 |
|
roztwór enzymatyczny (wytrącanie etanolem) V1 |
11 |
1,5 |
5,8 |
|
|
|
przykładowe obliczenia:
stężenie biomasy (gęstość optyczna przy długości fali 660 nm)
OD 660 nm = E660 · R
E660 - absorbancja przy długości fali 660 nm
R - rozcieńczenie
OD 660 nm = 0,47 · 20 = 9,4
aktywność proteolityczna
A10.2 = k · E690 · R
k - współczynnik przeliczający absorbancję na jednostki Ansona wynikający z krzywej wzorcowej, równy 0,69 μmol Tyr / (min · ml)
E690 - absorbancja przy długości fali 690 nm
R - rozcieńczenie
A10.2 = 0,69 · 0,36 · 10 = 2,5 [μmol Tyr / (min · ml)] = 2,5 [mjA/ml]
Jednostka Ansona oznacza taką aktywność enzymu, która powoduje uwalnianie produktów rozpuszczalnych w TCA w ilości odpowiadającej jednemu milimolowi tyrozyny (określanej za pomocą odczynnika Folina-Ciocalteau) w czasie 1 minuty w 6 ml mieszaniny reakcyjnej zawierającej 1 ml roztworu enzymu i 5 ml 2% (w/v) roztworu hemoglobiny. Warunki standardowe reakcji: 25˚C, 10 min.
wydajność aktywności
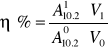
A110.2 - aktywność próby właściwej
A010.2 - aktywność próby wyjściowej
V1 - objętość próby właściwej
V0 - objętość próby wyjściowej
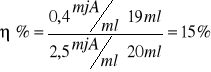
stężenie białka
C = K · E650 · R
K - współczynnik wynikający z nachylenia krzywej wzorcowej, równy 0,5 mg/ml
E650 - absorbancja przy długości fali 650 nm
R - rozcieńczenie
C = 0,5 · 0,53 · 20 = 5,3 [mg/ml]
wydajność białka
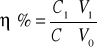
C1- stężenie białka w próbie właściwej
C0 - stężenie białka w próbie wyjściowej
V1 - objętość próby właściwej
V0 - objętość próby wyjściowej

stopień oczyszczenia
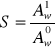
Aw - aktywność właściwa: ![]()
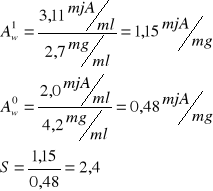
Wnioski
Najlepsze wyniki w procesie separacji biomasy uzyskuje się, stosując koagulację i filtrację (a także koagulację i wirowanie). Te operacje pozwalają na uzyskanie najbardziej klarownego roztworu. Wstępna koagulacja biomasy bardzo poprawia efektywność procesu (bez zastosowania koagulacji separacja biomasy jest dużo gorsza). Sama filtracja daje zdecydowanie najgorsze wyniki spośród badanych metod oddzielania biomasy, dla uzyskania lepszego efektu musi być wspomagana dodatkowymi operacjami poprzedzającymi.
Wyniki uzyskane dla drugiego etapu oczyszczania (wysalanie białka i wytrącanie etanolem) wskazują, że skuteczność obu metod jest porównywalna.
1
Wyszukiwarka
Podobne podstrony:
sprawko 6 Rafała, studia, bio, 3rok, 6sem, biotechnologia, lab
spr11, studia, bio, 3rok, 6sem, biotechnologia, lab
sprawozdanko moje - 7, studia, bio, 3rok, 6sem, biotechnologia, lab
Sprawko 7, studia, bio, 3rok, 6sem, biotechnologia, lab
spr9, studia, bio, 3rok, 6sem, biotechnologia, lab
spr8, studia, bio, 3rok, 6sem, biotechnologia, lab
ćwiczenie nr 10, studia, bio, 3rok, 6sem, biotechnologia, lab
metody dezintegracji komórek, studia, bio, 3rok, 6sem, biotechnologia, wyklad
pomoc od Jakubowskiego, studia, bio, 3rok, 6sem, biotechnologia, wyklad
mutagenizacja, studia, bio, 4rok, 8sem, biotechnologia2, lab
enzymologia w8, studia, bio, 3rok, 6sem, enzymologia, enzymologia wykłady
Biotechnologia II immobilizacja poprawa spr, studia, bio, 4rok, 8sem, biotechnologia2, lab
wyklad w11, studia, bio, 3rok, 6sem, enzymologia, enzymologia wykłady
Przykłady zastosowania enzymów, studia, bio, 3rok, 6sem, enzymologia
iMMOBILIZACJA BIOkatalizatorów, studia, bio, 4rok, 8sem, biotechnologia2, lab
Base Form, studia, bio, 3rok, 6sem, ang
enzymologia w10, studia, bio, 3rok, 6sem, enzymologia, enzymologia wykłady
więcej podobnych podstron