Laboratorium z biotechnologii
Ćwiczenie 3
Doskonalenie szczepów produkcyjnych.
Mutagenizacja promieniami UV bakterii rodzaju Bacillus.
data wykonania ćwiczenia: 23 III 2010
data oddania sprawozdania: 30 III 2010
Cel ćwiczenia
Poznanie techniki mutagenizacji bakterii za pomocą promieniowania UV, a także określenie częstości pojawiania się mutantów opornych na streptomycynę i mutantów o zwiększonej produktywności α-amylazy.
Wstęp teoretyczny
Od przemysłowych szczepów drobnoustrojów wymagana jest wyraźna nadprodukcja pożądanego metabolitu. Drobnoustroje izolowane ze środowiska zwykle takiej nadprodukcji nie wykazują, gdyż charakteryzują się zbilansowanym metabolizmem. Do opracowania ekonomicznie opłacalnego procesu technologicznego konieczne jest podwyższenie produkcji interesującego nas związku, co można osiągnąć:
metodami naturalnymi - odpowiednio zmieniając parametry hodowli (temperaturę, skład pożywki, natlenienie itp.)
poprzez modyfikację genotypu - powodowanie zmian w DNA (mutagenizacja)
Dużo częściej wykorzystywany jest proces mutagenizacji. Polega on na wywoływaniu przypadkowych mutacji poprzez zastosowanie czynników denaturujących DNA - tzw. czynników mutagennych.
Do najczęściej stosowanych chemicznych czynników mutagennych należą kwas azotowy (III), iperyt gazowy, związki alkilujące (np. metylometanosulfonian), analogi zasad azotowych, barwniki akrydynowe. Czynniki fizyczne to np. promieniowanie ultrafioletowe, rentgenowskie, promieniowanie γ, prędkie neutrony. Czynniki te zwiększają częstość powstawania mutacji kilka do kilkudziesięciu tysięcy razy.
Ponieważ mutacje pojawiają się w sposób przypadkowy, poszukiwania odbywają się metodą prób i błędów, wymagającą testowania bardzo dużej liczby pojedynczych kultur. Często zabieg należy powtarzać wielokrotnie, aby zwiększyć szansę znalezienia pożądanego mutanta.
Najważniejsza w poszukiwaniu pożądanych mutantów jest dobrze skonstruowana metoda selekcji. Selekcja mutantów odbywa się w oparciu o cechy fenotypowe, co nie gwarantuje, że szczep wyizolowany z określonej populacji reprezentuje jej najlepszy genotyp.
Najłatwiej jest wyizolować mutanty wykazujące oporność na określony antybiotyk - odbywa się to poprzez wysiew na pożywkę z dodatkiem antybiotyku. Łatwa jest również selekcja, gdy mutacja skutkuje zmianami morfologicznymi widocznymi makroskopowo (np. wygląd kolonii). W przypadku mutacji nie ujawniających się fenotypowo selekcja jest utrudniona lub niemożliwa.
W tym ćwiczeniu dokonujemy mutagenizacji szczepu Bacillus licheniformis za pomocą promieniowania UV. Celem jest uzyskanie kolonii o zwiększonej aktywności amylazotwórczej. Selekcja mutantów odbywa się poprzez poszukiwanie szczepów streptomycynoopornych (geny α-amylazy i oporności na streptomycynę leżą blisko siebie, zatem prawdopodobne wystąpienie mutacji w obu tych genach jednocześnie). Następnie wśród tych mutantów szukamy szczepów wykazujących zwiększoną produktywność α-amylazy.
Literatura: A. Chmiel - „Biotechnologia”
Wykonanie ćwiczenia
Z 18-godzinnej hodowli wstrząsanej Bacillus licheniformis wykonujemy rozcieńczenia - najpierw 10-krotne, następnie 1000-krotne.
Z 1000-krotnego rozcieńczenia pobieramy po 5 ml i przenosimy na dwie szalki Petriego, które poddajemy naświetlaniu. W tym celu umieszczamy pierwszą płytkę w pudełku z lodem na mieszadle magnetycznym pod lampą UV, którą włączamy na 15 s. Tak samo postępujemy z drugą płytką, przedłużając jedynie czas naświetlania do 30 s. Lód zapobiega wzrostowi temperatury pod wpływem naświetlania (inaczej mogłaby nastąpić termiczna śmierć komórek), natomiast mieszadło zapewnia równomierny dostęp wszystkich komórek do czynnika mutagennego.
Po naświetleniu próbki pozostawiamy na kilkanaście minut bez dostępu światła, aby wywołane mutacje ujawniły się fenotypowo. Brak światła uniemożliwia fotoreaktywację (naprawę zmutowanego DNA).
Z każdej próbki po naświetlaniu wysiewamy 0,1 ml, 0,2 ml i 0,5 ml na płytki z podłożem wzrostowym „W” oraz na płytki z podłożem „W + S” (z dodatkiem antybiotyku streptomycyny). Płytki inkubujemy w 37˚C w ciągu 2 dni.
W celu oznaczenia przeżywalności komórek sporządzamy kolejne rozcieńczenia hodowli wyjściowej: 105, 106, 107, 108 i wysiewamy z każdego po 0,1 ml na płytki z podłożem „W”. Płytki inkubujemy w 37˚C w ciągu 2 dni.
Po 2 dniach liczymy kolonie, jakie wyrosły na płytkach. W celu zbadania, czy nastąpił wzrost aktywności amylazotwórczej, zalewamy kolonie płynem Lugola i porównujemy wielkość odbarwionego obszaru w wysiewach z prób poddanych i niepoddanych naświetlaniu promieniami UV.
Zestawienie wyników
Tabela 1. Odczyty z posiewów po mutagenizacji.
podłoże |
czas naświetlania |
liczba kolonii w poszczególnych wysiewach [jtk] |
||
|
|
0,1 ml |
0,2 ml |
0,5 ml |
„W” |
15 s |
22 |
dużo, nie liczone |
niepoliczalne, zakażenie |
|
30 s |
3 |
3 |
niepoliczalne |
„W + S” |
15 s |
0 |
1 |
2 |
|
30 s |
1 ? |
7 ? |
1 |
? - odczyt orientacyjny, możliwe zakażenie
Tabela 2. Odczyty z posiewów kultury nie poddanej mutagenizacji.
rozcieńczenie |
105 |
106 |
107 |
108 |
liczba kolonii [jtk] |
dużo, nie liczone |
20 |
3 |
mało, nie liczone |
Do obliczenia miana wyjściowej zawiesiny uwzględniamy rozcieńczenie 106.
Opracowanie wyników
Tabela 3. Miano komórek poddanych i niepoddanych mutagenizacji.
posiew |
kultura wyjściowa |
po mutagenizacji |
|||||
|
|
„W” |
„W + S” |
||||
|
|
15 s |
30 s |
15 s |
30 s |
||
miano [jtk/ml] |
2 ∙ 108 |
2,2 ∙ 105 |
3 ∙ 104 |
średnia: |
5 · 103 |
średnia: |
2 · 103 |
|
|
|
1,5 · 104 |
|
4 · 103 |
|
|
Przykładowe obliczenia:
![]()
gdzie: M - miano [jtk/ml]
N - liczba kolonii [jtk]
V - objętość wysiana na płytkę [ml]
R - rozcieńczenie
dla kultury wyjściowej:
![]()
obliczenie średniej dla przypadków, gdy więcej niż jedna płytka była policzalna:
podłoże „W”, 30 s: 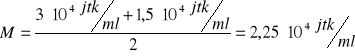
podłoże „W + S”, 15 s: 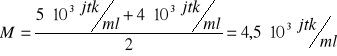
Tabela 4. Wyniki obliczeń przeżywalności i częstości pojawiania się mutantów opornych na streptomycynę.
czas naświetlania |
przeżywalność |
częstość pojawiania się mutantów |
15 s |
-2,95861 |
2,05 · 10-2 |
30 s |
-3,95861 |
0,89 · 10-1 |
Przykładowe obliczenia
obliczenie przeżywalności:
![]()
gdzie: M - miano komórek po naświetlaniu wyrosłych na podłożu „W” [jtk/ml]
M0 - miano komórek nienaświetlonych [jtk/ml]
dla 15 s:
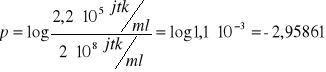
obliczenie częstości pojawiania się mutantów streptomycynoopornych:
![]()
gdzie: Ms - miano komórek po naświetlaniu wyrosłych na podłożu „W + S” [jtk/ml]
M - miano komórek po naświetlaniu wyrosłych na podłożu „W” [jtk/ml]
dla 15 s:
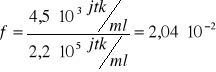
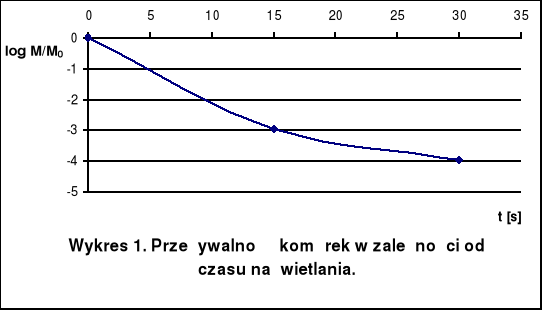
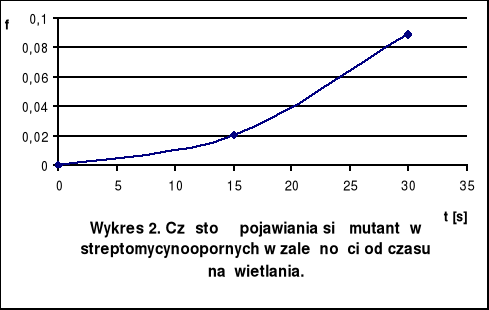
Wnioski
Przeżywalność komórek naświetlanych przez 15 s wynosi -2,96, a naświetlanych przez 30 s: -3,96. Dla czasu naświetlania 15 s mutanty streptomycynooporne pojawiały się z częstością 2,05 · 10-2, a dla czasu naświetlania 30 s z częstością 0,89 · 10-1. Zatem częstość pojawiania się mutantów streptomycynoopornych jest większa po zastosowaniu dłuższego czasu naświetlania, ale równocześnie mniejsza jest wtedy przeżywalność komórek.
Wśród przebadanych mutantów nie obserwujemy znaczącego wzrostu aktywności amylazotwórczej. Jedynie jedna kolonia wykazuje się zwiększoną produktywnością
(o ok. 50 %).
2
Wyszukiwarka
Podobne podstrony:
Biotechnologia II immobilizacja poprawa spr, studia, bio, 4rok, 8sem, biotechnologia2, lab
iMMOBILIZACJA BIOkatalizatorów, studia, bio, 4rok, 8sem, biotechnologia2, lab
B II W03, studia, bio, 4rok, 8sem, biotechnologia2, wykład
B II W12, studia, bio, 4rok, 8sem, biotechnologia2, wykład
B II W01, studia, bio, 4rok, 8sem, biotechnologia2, wykład
B II W02, studia, bio, 4rok, 8sem, biotechnologia2, wykład
koło lab, studia, bio, 4rok, 7sem, biotechnologia środowiska, lab, teoria
Mikro lab coll 1, studia, bio, 4rok, 8sem, mikrobiologia przemysłowa, lab
inżynieria genetyczna, studia, bio, 4rok, 8sem, inzynieria genetyczna, lab
spr6, studia, bio, 3rok, 6sem, biotechnologia, lab
sprawko 6 Rafała, studia, bio, 3rok, 6sem, biotechnologia, lab
spr11, studia, bio, 3rok, 6sem, biotechnologia, lab
sprawozdanko moje - 7, studia, bio, 3rok, 6sem, biotechnologia, lab
czesc-wykladow, studia, bio, 4rok, 7sem, biotechnologia środowiska, wykład
Sprawko 7, studia, bio, 3rok, 6sem, biotechnologia, lab
spr9, studia, bio, 3rok, 6sem, biotechnologia, lab
spr8, studia, bio, 3rok, 6sem, biotechnologia, lab
ćwiczenie nr 10, studia, bio, 3rok, 6sem, biotechnologia, lab
spr-kofeina, studia, bio, 4rok, 7sem, fakultet chemia żywności, lab
więcej podobnych podstron