Wydział Biotechnologii i Nauk o Żywności
Ćwiczenie Nr 21
OZNACZENIE STAŁEJ SZYBKOŚCI HYDROLIZY ESTRU W ŚRODOWISKU KWAŚNYM.
Ćwiczenie wykonano:28.11.2005 r.
Sprawozdanie złożono:05.12.2005 r.
Ćwiczenie wykonał:
Hassan Kassassir
Podstawy teoretyczne.
Celem ćwiczenia jest wyznaczenie stałej szybkości reakcji hydrolizy estru w obecności jonów H+.
Możemy zapisać równanie reakcji hydrolizy estru w środowisku kwaśnym następująco:
H+
CH3COOC2H5 + H2O → CH3COOH + C2H5OH
Ogólnie reakcja hydrolizy estru polega na przyłączeniu cząsteczki H2O do atomu węgla C g grupie karbonylowej, przy czym w środowisku obojętnym reakcja ta zachodzi bardzo wolno i dopiero dodanie kwasu pełniącego rolę katalizatora przyśpiesza znacznie ta reakcję.
Szybkość powyższej reakcji możemy zapisać równaniem II rzędu:
![]()
a ponieważ w roztworach wodnych stężenie wody jest na tyle duże, znacznie przekraczające stężenie estru, i nie ulega zmianie podczas reakcji hydrolizy szybkość tej reakcji możemy zapisać równaniem I rzędu:
![]()
rozwiązując powyższe równanie różniczkowe otrzymujemy wzór pozwalający nam wyznaczyć eksperymentalną stałą szybkości kexp z zależności logarytmu stężenia substratu ct od czasu reakcji t:
lnct = lnc0 - kexp ⋅ t
gdzie c0 oznacza początkowe stężenie estru dla t = t0
2. Opis postępowania podczas wykonywania ćwiczenia:
do badania wykorzystujemy roztwór powstały w wyniku zmieszania 40 ml HCL o stężeniu 0,5 M i 4 ml estru ( octanu etylu)
kolbę z roztworem umieszczamy w termostacie o temp. 25°C
dokonujemy pierwszego pomiaru: pobieramy 5 ml roztworu reagującego i umieszczamy w kolbie napełnionej uprzednio 25 ml schłodzonej wody destylowanej ( schłodzenie i rozcieńczenie próbki zatrzymuje reakcję hydrolizy) - czas pobrania pierwszej próbki (t0) traktujemy jako czas rozpoczęcia reakcji
powyżej przygotowaną próbkę miareczkujemy roztworem NaOH wobec fenoloftaleiny aż uzyskamy trwale różowe zabarwienie - zużytą objętość NaOH traktujemy jako V0
w jednakowych odstępach czasu ( co 15 minut ) pobieramy tą samą ilość roztworu reagującego ( 5 ml ) i postępujemy identycznie jak z próbką pierwszą. Zapisujemy każdorazowo czas t pobrania próbki i objętość Vt zużytej do miareczkowania zasady. Powinniśmy otrzymywać coraz większe wartości Vt wraz z upływem czasu trwania pomiaru gdyż wzrasta stężenie kwasu octowego jako produktu reakcji.
po wykonaniu pierwszego miareczkowania pobieramy 10 ml roztworu reagującego z kolby umieszczonej w termostacie o temp. 25°C i umieszczamy w oddzielnej kolbie w termostacie o temp. 60°C
pomiędzy kolejnymi miareczkowaniami możemy wyznaczyć miano NaOH - w tym celu miareczkujemy określoną ilość HCl ( np. 10 ml ) o znanym stężeniu roztworem NaOH w obecności fenoloftaleiny
po 3 godzinach trwania pomiaru pobieramy próbki z roztworu umieszczonego w termostacie o temp. 60°C, dodajemy do schłodzonej wody i miareczkujemy jak wszystkie poprzednie próbki - zapisujemy objętość V∞ zużytej zasady
3. Zestawienie wyników
tabela pomiarowa:
t (min.) |
0 |
15 |
30 |
45 |
60 |
75 |
∞ |
Vt (ml) |
15,5 |
16,9 |
18,2 |
19,3 |
22 |
23,4 |
53 |
- Wyznaczam miano wodorotlenku :
podczas miareczkowania 10 ml kwasu HCl o stęż . 0,5 mol/dm3 przy użyciu NaOH zużyłem 47 ml zasady
NaOH + HCl → NaCl + H2O
mamy Cmol = 0,5mol/dm i VHCl = 10 ml = 0,01 dm3
zatem ![]()
![]()
ponieważ mamy stosunek molowy 1 : 1 kwasu i zasady to:
![]()
![]()
- Wyznaczam wartości ( V∞ - Vt )⋅cNaOH dla poszczególnych pomiarów:
⋅ dla t = 0, Vt = V0 = 15,5 ml mamy: ( V∞ - Vt )⋅ cNaOH = 0,003975 mola
⋅ dla t = 15 min., Vt = 16,9 ml mamy: ( V∞ - Vt )⋅ cNaOH = 0,003826 mola
⋅ dla t = 30 min., Vt = 18,2 ml mamy: ( V∞ - Vt )⋅ cNaOH = 0,003688 mola
⋅ dla t = 45 min., Vt = 19,3 ml mamy: ( V∞ - Vt )⋅ cNaOH = 0,003572 mola
⋅ dla t = 60 min., Vt = 22 ml mamy: ( V∞ - Vt )⋅ cNaOH = 0,003286 mola
⋅ dla t = 75 min., Vt = 23,4 ml mamy: ( V∞ - Vt )⋅ cNaOH = 0,003137 mola
⋅ dla t = ∞ min., Vt = V∞ = 53 ml mamy: ( V∞ - Vt )⋅ cNaOH = 0
rachunek jednostek : [ (dm3 - dm3)⋅mol/dm3 ] = [ mol ]
obliczone wyniki wstawiam do tabeli pomiarowej:
t(min.) |
0 |
15 |
30 |
45 |
60 |
75 |
∞ |
Vt (ml) |
15,5 |
16,9 |
18,2 |
19,3 |
22 |
23,4 |
53 |
( V∞ - Vt)⋅cNaOH |
0,003975 |
0,003826 |
0,003688 |
0,003572 |
0,003286 |
0,003137 |
0 |
- Obliczam wartości stałych szybkości k. dla poszczególnych pomiarów w celu sporządzenia wykresu:
⋅ dla t = 15 min., Vt = 16,9 ml mamy: ![]()
![]()
15 min = 900s
![]()
![]()
![]()
⋅ dla t = 30 min., Vt = 18,2 ml mamy: ![]()
![]()
30 min = 1800s
![]()
![]()
![]()
⋅ dla t = 45 min., Vt = 19,3 ml mamy: ![]()
![]()
45 min = 2700s
![]()
![]()
![]()
⋅ dla t = 60 min., Vt = 22 ml mamy: ![]()
![]()
60 min = 3600s
![]()
![]()
![]()
⋅ dla t = 75 min., Vt = 23,4 ml mamy: ![]()
![]()
75 min = 4500s
![]()
![]()
![]()
rachunek jednostek: [![]()
] = [![]()
]
- Wyznaczam wartości ln[( V∞ - Vt )⋅cNaOH] dla poszczególnych pomiarów:
⋅ dla t = 0, Vt = V0 = 15,5 ml mamy: ln[( V∞ - Vt )⋅ cNaOH] = - 5,53 mola
⋅ dla t = 15 min., Vt = 16,9 ml mamy: ln[( V∞ - Vt )⋅ cNaOH] = - 5,56 mola
⋅ dla t = 30 min., Vt = 18,2 ml mamy: ln[( V∞ - Vt )⋅ cNaOH ] = - 5,60 mola
⋅ dla t = 45 min., Vt = 19,3 ml mamy: ln[( V∞ - Vt )⋅ cNaOH ] = - 5,63 mola
⋅ dla t = 60 min., Vt = 22 ml mamy: ln[( V∞ - Vt )⋅ cNaOH ] = - 5,72 mola
⋅ dla t = 75 min., Vt = 23,4 ml mamy: ln[( V∞ - Vt )⋅ cNaOH ] = - 5,76 mola
rachunek jednostek : [ (dm3 - dm3)⋅mol/dm3 ] = [ mol ]
Sporządzam wykres f(t) = ln[( V∞ - Vt )⋅ cNaOH]
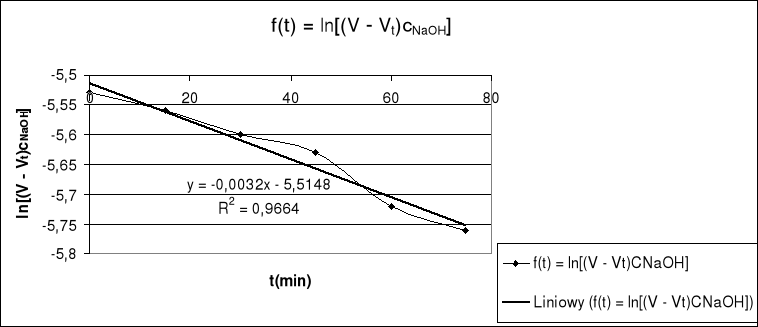
Sporządziłem wykres funkcji f(t) = ln[(V∞ - Vt)⋅cNaOH] i otrzymałem równanie prostej: y = - 5,5148 - 0,0032x a ponieważ funkcji tej odpowiada zależnośc: ln[(V∞ - Vt)⋅cNaOH] = ln[(V∞ - Vt)⋅cNaOH] - kexp⋅t zatem współczynnik kierunkowy tej prostej odpowiada stałej szybkości reakcji:
k = 0,0032 min-1
4. Wnioski.
Sporządzenie wykresu pozwoliło mi odczytać stałą szybkości dla tej reakcji: k = 0,0032 min-1 . Stała ta jest rzędu 10-3 min-1 a więc odpowiada wartości stałej szybkości hydrolizy estru w temp. 25°C. Na podstawie pomiarów mogłem zauważyć także, że temperatura i czas wpływają na szybkość tej reakcji - na zmiareczkowanie próbki umieszczonej w termostacie o temp. 60°C musiałem zużyć znacznie więcej zasady.
Wyszukiwarka
Podobne podstrony:
Tabelka pomiarowa do 21, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
obliczenia i wnioski, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
konsp15, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
konspekt 53, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
sprawozdanie 45miki, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Ch.f.44, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
hasz, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
SPRAWOZDANIE 54, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Cwiczenie 5, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
lab chem fiz 23, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
sprawko 77, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Ćwiczenie 45 kula, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
inż 16, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
więcej podobnych podstron