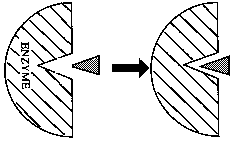
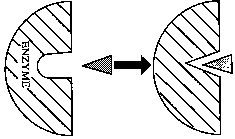
Enzymy: biokatalizatory, przyspieszają osiągnięcie równowagi reakcji, których zajście jest możliwe w z termodynamicznego punktu widzenia; katalizatory przyspieszające specyficzne reakcje chemiczne poprzez obniżenie ich energii aktywacji; w większości białka; zawierają centrum aktywne enzymu(dodatkowo miejsce wiązania części nie białkowej np. konfaktorów); aktywność enzymów uwarunkowana jest przez jego strukturę IV rzędową.
Apoenzym + Konfaktor = Holoenzym (złożony)
Rodzaje enzymów:
-oksydoreduktazy: przenoszenie elektronów, np. dehydrogenaza alkoholowa;
-transferazy: przenoszenie grup funkcyjnych(P i inne), np. kinaza fosforanowa;
-hydrolazy: rozpad przy pomocy wody(hydroliza), np. trypsyna;
-liazy: reakcje rozpadu wiązań (C-C, C-O, C-N i inne), np. dekarboksylaza pirogronianowa;
-izomerazy: przenoszą grupę w obrębie cząsteczki, np. izomeraz malenianowa;
-ligazy: tworzenie wiązań sprzężonych z hydrolizą ATP (synteza), np. karboksylaza pirogranianowa.
Katalizatory: mają sprawność katalityczna(przyspieszają przebieg reakcji); swoistość(względem substratów lub reakcji); działają w odpowiednich warunkach temperatury, pH i ciśnienia parcjalnego substancji; regulacja aktywności zależnie od czynników wewnętrznych i środowiskowych.
Centrum aktywne enzymu:
-niewielka część całkowitej objętości;
-struktura dominowa III rzędu obejmująca odległe sekwencje aminokwasów;
-wiąże substrat po przez liczne oddziaływanie niekowalencyjne jonowe, hydrofobowe, wodorowe Van der Wasala;
-stanowi niszę, zagłębienie w strukturze enzymu
Konfaktory:
-grupa prostetyczna: jon metalu, cząsteczki nieorganiczne kowalencyjnie, na stałe związane z enzymami np. jony cynku, hem;
-koenzym: nie białkowe cząsteczki organiczne związane tylko na czas reakcji enzymatyczne np. koenzym NADH z reduktaza cytochromu B5
Koenzym |
Prekursor |
Choroby niedoboru |
A |
Kwas pantotenowy |
Zapalenie skórne |
FAD, FMN |
Ryboflawina (B2) |
Niedobór wzrostu |
NAD+, NADP+ |
Niacyna |
Pelagra |
Fosforana timiny |
Tiamina (B1) |
Beri-beri |
Tetrahydrofolion |
Kwas foliowy |
Niedokrwistość |
Deoksyadenozynokobalamina |
Kobalamina (B12) |
Niedokrwistość złośliwa |
Kosubstraty do hydroksylacji praliny w kolagenie |
Kwas askorbinowy (C) |
Szkorbut |
Fosforan pirydoksylu |
Pirydoksyna (B6) |
Zapalenie skóry |
Działanie enzymów:
-entalpijne(energetyczne): obniżenie energii aktywacji po przez zmiany mechanizmu reakcji(inne stany przejściowe niż w reakcji niekatalizowanej); kataliza obejmuje tylko reakcje egzoergiczne; reakcje endoergiczne są sprzęgane z rekcjami egzoergicznymi np. hydroliza ATP daje sumarycznie reakcje egzoergiczną.
-entropijne(porządkowe): uporządkowanie atomów; lokalne zagęszczenie substratów przez wiązanie w bliskim sąsiedztwie; odpowiednie ustawienie substratów i grup katalitycznych względem siebie; związanie z substratem w konformacji ułatwiającej odkształcenie wiązań np. ułatwienie zdarcia otoczki hydratacji
Modele katalizy enzymatycznej: enzym + substrat → kompleks enzym-substrat
|
|
Kinetyka reakcji enzymatycznych:
-odwracalne: enzym + substrat ↔ kompleks enzym-substrat
-nieodwracalne: kompleks enzym-substrat → enzym + produkt
Czynniki wpłwające na zmiany szybkości reakcji:
-zewnętrzne: temperatura, pH(optimum sprzyja), inhibitory(zmniejszają)
Inhibitor: kontrolują aktywność enzymów w organizmie: modulując ekspresje genów kodujących enzym, aktywując zymogenowy-enzym w postaci nieaktywnego proenzymu, poprzez efektory allosteryczne, czy modyfikacje kowalencyjne

Inhibicja:
-nieodwracalna: np. leki-bakterie
-odwracalna:

I kompetycyjna: inhibitor zajmuje miejsce w centrum aktywnym i uniemożliwia przyłączenie substratu i przeprowadzenie reakcji, występuje, gdy stężenie produktu jest za duże.
![]()
II niekompetycyjna: inhibitor po przyłączeniu zmienia strukturę enzymu modyfikując centrum aktywne, co uniemożliwia przyłączenie substratu, reakcja możliwa po odblokowaniu inhibitora.
III akompetycyjna: inhibitor przyłącza się w momencie, gdy substrat jest przyłączony do enzymu i tworzy nieaktywny kompleks enzym-inhibitor-substrat.
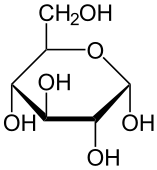
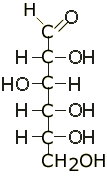
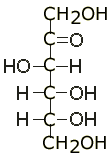
Cukry: związki organiczne złożone z C, H, O; posiadają grupę aldehydową(-CHO); związki optycznie czynne, skręcają płaszczyznę światła spolaryzowanego(+ w prawo; - w lewo); ogólny wzór sumaryczny CnH2nOn; cukry w organizmie należą do szeregu D; podział:
-proste(wedle liczby C w cząsteczce): C3 triozy, C4 tertrozy, C5 pentozy, C6 heksozy, C7 heptozy; np. C6H12O6 glukoza, fruktoza, galaktoza
-złożone:
a)oligosacharydy(do 10 reszt cukrowych): dwucukry(disacharydy)[C12H22O11
sacharoza, laktoza, maltoza]; trisacharydy;
b)polisacharydy(>10 reszt cukrowych): wielocukry[(C6H10O5)n
skrobia, celuloza, chityna, glikogen]
-obecność grup funkcyjnych:
a)aldozy(polichydroksy aldehydy): grupy -OH i -CHO, np. glukoza
b)ketozy(polichydroksy ketozy): grupy -OH i -CO, np. fruktoza
-forma cząsteczki: łańcuchowa; pierścieniowa:
a)piranozy(heterocykliczne, 6 elementów): anomery α i β, np. glukoza
b)faranozy(heterocykliczne, 5elementów): anomery α i β, np. fruktoza
-homoglikany: te same reszty cukrowe
-heteroglikany: różne reszt cukrowe
-ulegające hydrolizie: kwasowej; enzymatycznej
-mające właściwości redukcyjne: posiadają w formie pierścieniowatej wolny hydroksyl glikozydowy, mogą otwierać forme pierścieniową w łańcuchową, np.:
glukoza + Ag2O → kwas glukozowy + 2Ag [O przyłącza się do H od C1 tworząc OH;
reduktor(elektrono dawca) C+1 - 2e → C+3 reakcja utlenienia;
utleniacz(elektrono biorca) 2Ag+1 + 2e → 2Ag0 reakcja redukcji]
-nie mające właściwości redukcyjnych
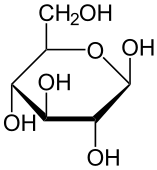
Glukoza: OH po prawej D/OH po lewej L
Stopnie utlenienia*: C1→+1; C5→ -1; C2-4→ 0; *stopień utlenienia H→+1; O→-2; C→ równoważy przyłączone H i O
|
|
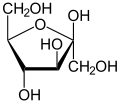
Fruktoza: β-D(-)fruktofaranoza
Stopnie utlenienia:
C2→+2
C3-4→0
C5→ -1
Redoks: sprzężone reakcje utleniania/redukcji
-utlenianie: reakcja chemiczna atom przechodzi z niższego na wyższy stopień utlenienia (oddanie elektronów, przyłączenie O lub odłączenie H)
-redukcja: reakcja chemiczna atom przechodzi z wyższego na niższy stopień utlenienia (pobranie elektronów, odłączenie O lub przyłączenie H)
IG(indeks glikemiczny): określa o ile podniesie się poziom glukozy we krwi ponad poziom podstawowy po przyjęciu pokarmu zawierającego 50g węglowodanów; produkty o wysokim IG to takie są szybko trawione i wchłaniane, oraz wpływają gwałtownie na wzrost glukozy we krwi oraz wydzielanie insuliny; produkty o niskim IG są wolno trawione i wchłaniane jest rozłożony w czasie (wpływają na stopniowy wzrost glukozy w krwi)
Poziom glukozy we krwi: regulują hormony insulina, glukagon, adrenalina
Prawidłowe poziomy cukrów:
-na czczo: 80-110 mg/dl - prawidłowy 110-125 mg/dl - nieprawidłowa tolerancja glukozy 126-300 mg/dl - cukrzyca >300 mg/dl- hiperglikemia
|
-dwie godziny po posiłku:
|
Metabolizm: ogół zachodzących w komórce procesów, które umożliwiają wymianę materii i energii pomiędzy komórką, a środowiskiem.
-anabolizm: reakcje syntez związków prostych w złożone(wzrost, różnicowanie) wymagające dostarczenia energii(endoergiczne), np. biosyntezy, redukcja(pobieranie H+)
-katabolizm: reakcje rozpadu związków złożonych na drobno cząsteczkowe, uwalniają energie(egzoergiczne) np. utlenianie(oddawanie H+)
Nośniki energii: ATP(adenozynotrójfosforan), PCr(fofokreatyna), FAD(dinukleotyd flaminoadeinowy[pochodna witaminy B2-ryboflawiny], koenzym), NAD+(dinukleotyd nikotynoamidoadeinowy[pochodne witaminy PP-niacyny], koenzym), GTP(guanocytotrójfosforan)
ATP(adenozynotrójfosforan): nukleotyd złożony z 3 części: zasady amonowej adeiny, monosacharydu rybozy(cukier prosty) i 3x grupy kwasów ortofosforowego(V)[Pα, Pβ, Pγ]; powstaje przez połączenie fosforanu nieorganicznego do ADP przy udziale energii(ADP + Pi + E ↔ ATP; E = 7,3 kcal reakcja odwracalna przez hydrolizę, co powoduje uwolnienie energii); Mg 2+ stabilizuje cząsteczki P~P~P-Adeina/Ryboza(~ wiązanie wysoko energetyczne bezwodnikowi, - wiązanie estrowe, /wiązanie N-glikozydowe); bierze udział w biosyntezie kwasów tłuszczowych; reagując z aktyną i miozyną powodując skurcz mięśni.
Fosforylacja: reakcja przyłączania reszty fosforowej(synteza ATP, wymaga dostarczenia przez synteza ATP z cytoplazmy do wnętrza mitochodrium 4H+; resynteza)
-substratowa: wymaga substratu o wysokim potencjale energetycznym, bez O2, intensywny wysiłek, krótki;
-oksydacyjna: wymaga O2 do uzyskanie energii z łańcucha oddechowego, wysiłek o niskiej intensywności długi
Hydroliza ATP: rozpad wiązań wysoko energetycznych bezwodnikowych;
ATP + H2O ↔ ADP + Pi + H+ + E lub ATP + H2O ↔ AMP + PPi + H+ + E
-E(energia): do transportu aktywnego, pracy mięśni, tworzenia błony komórkowej, procesów naprawczych, biosyntezy, ciepło, po.
PCr(fofokreatyna): w mięśniach dodatkowy nośnik energii prócz ATP, stężenie PCr kilkukrotnie przewyższa stężenie ATP; główna funkcja to odbudowa ATP
CPr + ADP ↔ ATP + Cr (→cytoplazma, ←mitochondria)
Substraty energetyczne do resyntezy w mięśniach szkieletowych:
-warunki anaerobowe: PCr, glikogen w mięśniach i krwi
-warunki tlenowe aerobowe: glikogen w krwi, kwasy tłuszczowe, aminokwasy
Utlenianie biologiczne: utlenianie związków organicznych(cukry, tłuszcze, białka) do CO2 i H2O i E(magazynowana w postaci ATP), przebiega stopniowo:
-I etap: rozbicie dużych cząsteczek pożywienia na prostsze jednostki monomeryczne, białka hydrolizowane na aminokwasy, polisacharydy do cukrów prostych, tłuszcze są rozkładane do glicerolu i kwasów tłuszczowych(trawienie pokarmowe); w tej fazie energia nie zostaje uwolniona.
-II etap: rozbicie prostych wielowęglowych jednostek monomerycznych na acetylo-CoA (acetylo-koenzym A) z jednoczesnym wytworzeniem niewielkich ilości NADH i ATP(fosforylacja substratowi: glikoliza/betaoksydacja); pozyskanie E=10% procesu.
-III etap: całkowite utlenienie w mitochondriach acetylo-CoA do CO2 i H2O z jednoczesnym wytworzeniem dużych ilości NADH, FADH2 i ATP(fosforyzacja oksydacyjna: cykl krebsa, synteza ATP); pozyskanie E=90% procesu.
Pozyskiwanie Energii z glukozy:
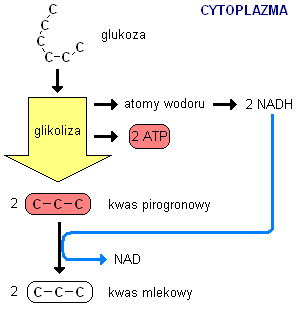
Beztlenowa: aktywacja: -2ATP, wygenerowanie: 4ATP, suma: 2ATP
-I etap(glikoliza): glukoza [ATP → ADP] → glukozo-6-fosforan → fruktozo-6-fosforan → fruktozo-1,6-bisfosforan [ATP → ADP]→
2x cząsteczki aldehydu 3-fosfoglicerydowego [2NAD+ → 2NADH]→ 1,3-difosfoglicerynian [2ADP → 2ATP] →
3-fosfoglicerynian [H2O]→2-fosfoglicerynian → fosfoenolopirogronian [2ADP → 2ATP] → pirogronian
-II etap(redukcja): [dehydrogenaza mleczanowa] pirogronian → mleczan / przerwa regeneracja NAD+ kwas mlekowy dyfunduje z komórek mięśniowych w formie jonów wodorowych i aminowo-mleczanowych: 2/3 transportowane jest prze krwioobieg do wątroby(proces glukoneogenezy: kwas mlekowy → glukoza); 1/3 do mięśni typu wolno-kurczliwego (czerwonych) nierekrutowanych podczas wysiłku.
Tlenowa: aktywacja: -2ATP, wygenerowanie: 32ATP, suma: 30ATP
-I etap(glikoliza): glukoza + 2Pi + 2ADP + 2NAD+ → 2x cząsteczki pirogronianu + 2H2O + 2ATP + 2NADH + 2H+ [2ATP]
-II etap(oksydacyjna dekarboksylacja): pirogronian → acetylo-CoA katalizuje dehydrogenaza pirogronianowa [10ATP]
-III etap(cykl Krebsa): acetylo-CoA → fumaran i powtórzenie cyklu[20 ATP]
-IV etap(fosforyzacja oksydacyjna) CO2 i H2O
1.utlenienie substratów energetycznych: NAD+ → NADH lub FAD→ FADH2
2.utlenienienie NADH lub FADH2 na łańcuchu oddechowym: przeniesienie elektronówka przenośniki elektronowe w łańcuchu oddechowym, a ostatecznie na O2; wydzielenie E służącej do wypompowania H+ z macierzy do przestrzeni między błonowej.
3.wytworzenie siły protonomotorycznej: gradient pH i transbłonowego potencjału elektronowego; powrót H+ do macierzy przez synteza ATP
4.synteza ATP.
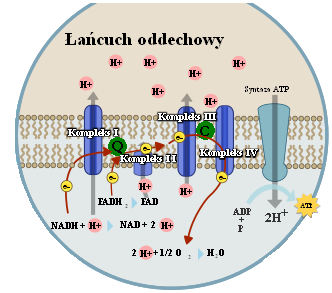
Komplek I: dehydrogenazy NADH
Q: ubihinom(koenzym Q)
Kompleks II: dehydrogenazy bursztynianowej
Komplek III: cytokinów b-c1
C: cytochrom C
Komplek IV: oksydacji cytochromowej
NADH i FADH2: nośniki elektronów o wysokim potencjale przenoszenia, substraty łańcucha oddechowego, przeniesienie elektronów na tlen
Koenzym dehydrogenazy: odłączanie i przyłączanie atomów H+
H2O: woda metaboliczna powstaje przez redukcje tlenu i połączenia z H+
Łańcuch oddechowy: ostatni etap oddychania wewnątrzkomórkowego, przebiegający na wewnętrznych błonach mitochondrium i polegający na przenoszeniu elektronów i protonów na kolejne przenośniki, wydzielona E zostaje wykorzystana do syntezy ATP z ADP. Ostatecznym akceptorem elektronów i H+ jest O, a reakcja ta prowadzi do utworzenia cząsteczki H2O, jest podstawową reakcją dostarczającą energii komórkom w warunkach tlenowych.
NADH→I→Q→III→C→IV FADH2 →II→Q→III→IV XH2 + NAD+↔X + NADH + H+ XH2 + FAD↔X + FADH2 → redukcja; ← utlenienie |
Siła protonomotoryczna: 4H+=ATP NADH → 10H+ = synteza 2,5ATP FADH2 → 6H+ = synteza 1,5ATP |
Przechodzenie NADH przez błonę mitochodrialną(cytoplazma → macierz):
-czółenko glicerolo-fosforanowe: NADH → FADH2(mięśnie szkieletowe)
-czółenko jabłczanowo-asparginianowe: NADH → NADH(hepatocyty w wątrobie)
Glukoneogeneza: proces anaboliczny, resynteza glukozy z substratów nie węglowodanowych, albuminy, glicerolu, kwasów mlekowego; przebiega w mitochondrium mięśni i cytoplazmie wątroby; wymaga 6x wysokoenergetycznych wiązań; przebiega przy dużym stężeniu ATP w komórkach, po wysiłku i przy niedoborze glukozy w organizmie(wynika z głodzenia lub raku węglowodanów w diecie)
Glikogen: polisacharyd zbudowany z glukozy gromadzony w wątrobie i w tkance mięśniowej.
Synteza/rozkład glikogenu:
-mięśnie: po każdym treningu, dostarczenie węglowodanów o wysokim IG/wysiłek
-wątroba: gdy stężenie glukozy we krwi nie przekracza górnej granicy normy/głodzenie, niedobór węglowodanów w diecie
Mitochondrium: organella komórkowa wyspecjalizowane w przemianach, tlenowych (fosforylacja oksydacyjna, łańcuch oddechowy), owalne, otoczone dwiema błonami, z których wewnętrzna tworzy grzebienie (głębokie uwypuklenia), wnętrze wypełnione jest bezpostaciową substancją macierzą
Wyszukiwarka
Podobne podstrony:
Metabolizm i Enzymy
Enzymy i terapia metaboliczna, !!♥ TUTAJ DODAJ PLIK ⇪⇪⇪⇪⇪⇪⇪⇪⇪⇪⇪⇪⇪⇪
Związki organiczne, metabolizm, enzymy, fotosynteza
METABOLIZM GALAKTOZY ENZYMY, ZNACZENIE
enzymy
Metabolizm kkw tł stud
pros 4 Enzymy 1
Metabolizm
(2,3) Działania nieporządane, toksytczne leków Metabolizm, czynniki wpływające na działanie substanc
metabolizm witaminy D3
inhibicja enzymy wykresy
ENZYMY prezentacja biochemia
Enzymy
Zespół metaboliczny tarczyca wykład8
więcej podobnych podstron