Przemiany anaboliczne i kataboliczne
Anabolizm jest to proces syntezy złożonych związków organicznych z substancji prostych np. proces syntezy białek z aminokwasów, cukrów z dwutlenku węgla i wody, synteza glikogenu z glukozy. Warunkiem do prawidłowego zajścia tych reakcji jest stałe pochłanianie energii, ponieważ związki o niewielkich zasobach energetycznych przekształcane są w związki wysokoenergetyczne, co wiąże się z przejściem na wyższy stopień energetyczny.
Biosynteza DNA (replikacja),
Biosynteza RNA (transkrypcja)
Katabolizm jest to proces rozpadu złożonych związków organicznych na związki prostsze o znacznie mniejszych zasobach energetycznych. W tych przemianach produkty znajdują się na niższym poziomie energetycznym niż substraty. Najważniejszym procesem katabolicznym jest oddychanie w czasie, którego utlenianie cukrów prowadzi do powstania dwutlenku węgla i wody z równoczesnym uwalnianiem energii zmagazynowanej w wysokoenergetycznych wiązaniach chemicznych.
Cykl Krebsa (cykl kwasu cytrynowego),
Łańcuch oddechowy
Związki makroergiczne - to związki pełniące rolę nośników energii w komórce. Mają one w swoich cząsteczkach pewne szczególne wiązania - wiązania makroergiczne (wiązania wysokoenergetyczne). Charakterystyczny rozkład elektronów wokół takich wiązań powoduje, że ich rozpad dostarcza dużych ilości energii. Związki makroergiczne mogą mieć różną strukturę chemiczną. Dzielimy je na cztery grupy w zależności od typu wiązania makroergicznego. Są to związki o wiązaniach:
1. bezwodnikowych fosforanowo-fosforanowych,
2. bezwodnikowych karboksylo-fosforanowych,
3. guanidyno-fosforanowych,
4. tioestrowych.
Związki o wiązaniach z trzech ostatnich wymienionych grup nie odgrywają szczególnej roli w metabolizmie.
Atp - adenozynotrójfosforan, nukleotyd, zawiera 3 reszty kwasu ortofosforowego(V), resztę adeniny i rybozy. ATP wchodzi w reakcje tylko w obecności kationów metali dwuwartościowych (np. Mn2+,, Mg2+), z którymi tworzy kompleksy. ATP powstaje w wyniku fosforylacji substratowej (fosforylacja) oraz w procesie chemiosmozy (fosforylacja oksydacyjna i fosforylacja fotosyntetyczna).
ATP jest aktywnym czynnikiem fosforylującym - łatwo odszczepia jedną resztę kwasu ortofosforowego(V) przekształcając się w ADP. Wydzielana jest przy tym znaczna ilość niezbędnej dla organizmu energii. ATP bierze udział w biosyntezie kwasów tłuszczowych. Reagując z aktyną i miozyną powoduje skurcz mięśni.
Fosforylacja - reakcja chemiczna zachodząca w organizmach żywych przy udziale enzymów, prowadząca do wytworzenia związku wysokoenergetycznego - ATP z ADP i reszty ortofosforanowej(V), będącego bezpośrednim źródłem energii we wszystkich procesach endoergicznych. Fosforylacja jest podstawowym mechanizmem gromadzenia i przechowywania energii chemicznej.
Fosforylacja fotosyntetyczna - powstawanie ATP w świetlnym etapie fotosyntezy; energia do syntezy ATP uwalniana jest stopniowo, gdy elektron wybity z chlorofilu przechodzi przez szereg przenośników o coraz wyższym potencjale oksydoredukcyjnym. Wyróżnia się f.f. cykliczną i niecykliczną. F.f. cykliczna jest związana z → fotosystemem I (P700) i zachodzi zarówno w fotosyntezie roślinnej, jak i bakteryjnej. Polega na przekazaniu elektronu z ferredoksyny z powrotem na P700 poprzez m.in. cytochrom b₆. F.f. niecykliczna związana jest z fotolizą wody; zachodzi w trakcie przekazywania elektronów z fotosystemu II (P680) na fotosystem I, w momencie utlenienia plastocyjaniny przez cytochrom f. F.f. niecykliczna zachodzi tylko w fotosyntezie roślin i sinic.
Fosforylacja oksydacyjna - proces syntezy ATP z ADP i fosforanu nieorganicznego zachodzący w mitochondriach, sprzężony z transportem wodoru na tlen w łańcuchu oddechowym. Mechanizm f.o. jest oparty na oddzielnym transportowaniu elektronów i protonów (te pierwsze przekazywane są przez system przenośników białkowych); protony wypompowywane są poza mitochondrium, co prowadzi do powstania gradientu protonów w poprzek błon mitochondrialnych. Powrót protonów wywołany tym gradientem jest możliwy tylko w określonych miejscach, w których działa enzym syntetaza ATP, otwierająca specyficzne kanały błonowe dla wodoru, a zarazem katalizująca syntezę ATP. Ostatecznie energia niezbędna do syntezy ATP pochodzi bezpośrednio z dyfuzyjnego ruchu protonów do wnętrza mitochondrium.
Fosforylacja substratowa - reakcja chemiczna, która ma miejsce, gdy reszta fosforanowa zostanie przeniesiona ze związku ufosforylowanego - substratu - bezpośrednio na ADP przez enzymy, najczęściej z grupy kinaz. Ten sposób wytwarzania ATP nie wymaga udziału tlenu i zachodzi np. w glikolizie oraz cyklu Krebsa. Ten sposób wytwarzania ATP jest ewolucyjnie najstarszy, jednak ilość związków, które mogą wejść w reakcję fosforylacji substratowej jest ograniczona.
Substrat wysokoenergetyczny(ufosforylowany) + ADP → produkt niskoenergetyczny + ATP.
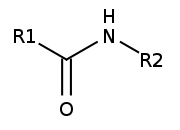
Wiązania peptydowe - umowna nazwa wiązania amidowego występującego między aminokwasami peptydów i białek. Wiązanie peptydowe łączy grupę α-aminową jednego aminokwasu z grupą α-karboksylową drugiego aminokwasu.
Rys. 1. Wiązanie peptydowe
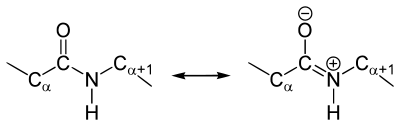
Występuje ono w dwóch formach izomerycznych: cis i trans. W wiązaniu peptydowym wyróżnić można dwie formy mezomeryczne (rezonansowe), nadające wiązaniu węgiel-azot częściowy charakter wiązania podwójnego. Efekt ten wzmacnia siłę wiązania oraz silnie hamuje rotację wokół wiązania C-N, dzięki czemu wiązanie jest płaskie. Możliwa natomiast jest rotacja wokół wiązań z grupami bocznymi.
Rys. 2. Formy mezomeryczne wiązania peptydowego
Aminokwasy połączone wiązaniami peptydowymi tworzy oligopeptydy (umownie, do 10 reszt aminokwasowych), polipeptydy (do 100 reszt) oraz białka (powyżej 100 reszt).
Najczęściej obiema cząsteczkami są α-aminokwasy naturalne. Polimery naturalne powstałe z połączenia aminokwasów wiązaniami peptydowymi to białka. Wiązania peptydowe występują też w polimerach syntetycznych zwanych poliamidami, w tym przypadku jednak identyczne chemicznie wiązania są nazywane wiązaniami amidowymi.
Rys. 3. Fragment białka z zaznaczonym na niebiesko wiązaniem peptydowym
Wiązanie peptydowe tworzą też często łańcuchy boczne aminokwasów w białkach, takich jak lizyna, z cząsteczkami przyłączonymi do białka (koenzymami).
Rys. 4. Połączenie lizyny białka z kwasem liponowym
Struktury i wiązania występujące w białkach
Struktura pierwszorzędowa:
to liniowe ułożenie aminokwasów połączonych wiązaniami peptydowymi. Sekwencję tę wyznacza się na podstawie kolejności ułożenia zasad azotowych w genie kodującym dane białko. W strukturze pierwszorzędowej zawarte są również położenia innych wiązań kowalencyjnych. Są to głównie wiązania dwusiarczkowe między resztami cysteiny sąsiadującymi ze sobą w przestrzeni, ale nie w sekwencji liniowej aminokwasów. Owe wiązania poprzeczne między odrębnymi łańcuchami polipeptydowymi lub między częściami tego samego łańcucha powstają na skutek utlenienia grup SH w resztach cysteiny, sąsiadujących ze sobą w przestrzeni.Struktura drugorzędowa:
to regularne pofałdowanie regionów łańcucha polipeptydowego. Mamy tu dwie konformacje: α helisa i struktura β.
W helisie alfa aminokwasy ustawiają się tak, że tworzą spiralę. Wszystkie łańcuchy boczne aminokwasów znajdują się na zewnątrz helisy. Wiązanie które stabilizuje tę strukturę to wiązanie wodorowe występujące między tlenem grupy karboksylowej jednego aminokwasu a wodorem grupy aminowej aminokwasu drugiego w tym samym łańcuchu polipeptydowym.
W strukturze beta również wiązanie wodorowe umożliwia istnienie takiej konformacji białka, jednak tu wiązanie to występuje między wiązaniami peptydowymi różnych łańcuchów polipeptydowych. Płaskie wiązanie peptydowe sprawia, że struktura beta ma postać pofałdowanej kartki, gdzie łańcuchy boczne aminokwasów znajdują się powyżej lub poniżej jej płaszczyzny. Łańcuchy sąsiadujące ze sobą mogą być równoległe lub antyrównoległe.
Struktura trzeciorzędowa:
dotyczy przestrzennego ułożenie aminokwasów, zarówno odległych od siebie w sekwencji liniowej, jak i tych, które ze sobą sąsiadują. Ta konformacja białka jest utrzymywana przez siły elektrostatyczne, wiązania wodorowe i jeśli obecne kowalencyjne wiązania dwusiarczkowe.
Struktura czwartorzędowa:
dotyczy białek, które mają więcej niż jeden łańcuch pokipeptydowy, np. hemoglobina. To najwyżej uorganizowana struktura białka. Dotyczy przestrzennego ułożenia polipeptydowych podjednostek i oddziaływań między nimi. Mogą to być oddziaływania niekowalencyjne lub kowalencyjne.
Enzymy - budowa i mechanizm działania
Budowa:
enzymy występujące jako białko proste, zbudowane wyłącznie z łańcuchów polipeptydowych, np. amylaza.
enzymy jako białka złożone, posiadające kofaktor:
enzymy, w których część białkowa i niebiałkowa, są połączone ze sobą. Takie cząsteczki niebiałkowe to grupy prostetyczne, np. cukry.
enzymy będące białkami złożonymi, których niebiałkowe grupy aktywne są luźno związane z białkiem enzymu.
Mechanizm działania:
Działanie biokatalizatorów polega na tworzeniu przez enzym przejściowego kompleksu z substratem lub substratami; powoduje to przesuwanie się określonych elektronów między reagującymi substratami i powstanie nowych wiązań bądź rozrywanie istniejących; w ten sposób powstaje określony produkt, a enzym wychodzi z reakcji niezmieniony i może wiązać kolejne substraty:
SUBSTRAT + ENZYM a KOMPLEKS
ENZYM-SUBSTRAT >PRODUKT + ENZYM.
Rys. Mechanizm działania enzymu
Podział enzymów i zadana każdej z klas:
Oksyreduktazy:
dehydrogenazy - przenoszą protony i elektrony z substratu na koenzym lub odwrotnie
reduktazy - katalizują przeniesienie protonów i elektronów lub samych elektronów z przenośników na dalsze układy oksydoredukcyjne
oksydazy - aktywują tlen cząsteczkowy przez przeniesienie nań elektronów
hydroksylazy - katalizują przyłączenie tlenu do związku organicznego z jednoczesnym przeniesieniem protonów i elektronów z udziałem koenzymu
peroksydazy - działają utleniająco na związki organiczne w obecności H2O2
Transferazy - enzymy tej klasy katalizują przeniesienie grup pomiędzy związkami z udziałem specyficznych koenzymów, np. glikozylotransferazy - katalizują przeniesienie grupy aminowej, fosforanowej, arylowej, glikozydowej
Hydrolazy - enzymy katalizują reakcje hydrolizy, czyli rozkładu wiązań z udziałem cząsteczki wody:
esterazy - rozkładające wiązania estrowe
glikozydazy - działające na wiązania glikozydowe
peptydazy - rozkładające wiązania peptydowe
amidazy - rozkładające wiązania amidowe
Liazy - enzymy, które nieodwracalnie lub odwracalnie katalizują odłączenie grup od substratu bez udziału wody. Enzymy katalizujące rozerwanie wiązań -C-C-, deoksyrybozy, aminokwasów lub katokwasów oraz enzymy przyłączające lub odłączające cząsteczki wody.
Izomerazy - enzymy katalizujące reakcje izomeryzacji-recenizacje, epimeryzację, cis-trans oraz wewnątrz cząsteczkowe przemiany oksyredukcyjne oraz przeniesienia grup
Ligazy - enzymy katalizują wytworzenie wiązań między dwiema cząsteczkami, co wiąże się z rozpadem związku makroergicznego, a więc, np. z udziałem ATP (enzymy aktywujące powstawanie wiązania -C-O- , wiązanie cis-trans, -C-N-, np. ADP).
Koenzymy - budowa, podział, funkcje
Budowa:
prawie wszystkie koenzymy zawierają kwas fosforowy jako główny składnik , często w takim połączeniu, które określamy jako nukleotyd.
Podział:
Koenzymy przenoszące H
NAD+, NADP+
FMN, FAD
Kwas liponowy
Koenzym Q
Koenzymy przenoszące inne grupy niż H
CoASH
Pirofosforany pirydyksalu
Fosforany cukrów
Biotyna
Koenzymy kobamidowe (B12)
Funkcje:
przenoszenie grup atomów
procesy oksyredukcyjne
izomeryzacja związków chemicznych
w reakcjach syntezy prowadzących do powstania wiązań kowalencyjnych podczas powstawania różnych połączeń w komórce
Budowa kwasów nukleinowych: nukleotyd, nukleozyd, komplementarność zasad
Kwasy nukleinowe są związkami organicznymi, których zawartość w organizmie, choć niewielka, jest bardzo istotna, ponieważ warunkują one zjawiska dziedziczności. Zapisana jest w nich genetyczna informacja dotycząca cech i właściwości organizmu.
kwasy nukleinowe to polimery, co oznacza, że są zbudowane z podjednostek (monomerów), nazwanych nukleotydami. Każdy taki nukleotyd złożony jest z:
zasady azotowej - pochodnej puryny (adenina, guanina) lub pirymidyny (cytozyna, tymina, uracyl);
cukru - pentozy, czyli posiadającego szkielet pięciowęglowy (ryboza, deoksyryboza);
reszty kwasu fosforowego.
Nukleotyd jest to podstawowy składnik budulcowy kwasów nukleinowych (DNA i RNA). Jest on zbudowanyz cukru - pentozy (w DNA wystepuje deoksyryboza, zaś w RNA ryboza), co najmniej jednej reszty fosforanowej i zasady azotowe.
Nukleozyd to glikozoamina powstała w wyniku połączenia zasady azotowej z rybozą. Nukleozydy mogą być fosforyzowane przez specyficzne kinazy. Powstające w ten sposób nukleotydy są elementami budulcowymi RNA. Trifosforany nukleozydów służą jako przenośniki energii w komórce.
Komplementarność zasad - pary zasad występujące w przeciwległych łańcuchach dwuniciowej cząsteczki DNA, połączone wiązaniami wodorowymi. Adenina łączy się komplementarnie za pomocą dwóch wiązań wodorowych z tyminą, a cytozyna, za pomocą trzech, z guaniną. Stosunek C:G oraz A:T wynosi więc w cząsteczce DNA: 1. Nici (łańcuchy) DNA są ułożone względem siebie antyrównolegle.
Rodzaje kwasów nukleinowych, rola Dna i Rna - budowa, lokalizacje, funkcje
Kwas deoksyrybonukleinowy Dna
Zbudowany jest z dwóch skręconych spiralnie w postać helisy nici, w skład których wchodzą:
zasady azotowe - adenina, guanina, cytozyna i tymidyna;
cukier - deoksyryboza;
reszty fosforanowe.
Zasady azotowe połączone są zgodnie z zasadą komplementarności, co oznacza, że tworzą określone pary: adenina z tymidyną (połączone dwoma wiązaniami) oraz guanina z cytozyną (połączone trzema wiązaniami).
W komórce zawiera:
jądro komórkowe - pod postacią chromatyny, która kondensuje się do postaci chromosomów;
mitochondria - mtDNA (mitochondrialny DNA) to 1 - 2% całkowitej ilości DNA pod postacią kolistej cząsteczki;
chloroplasty (w komórkach roślinnych) - chlDNA (chloroplastowy DNA) to 1 - 5%
całkowitej ilości DNA w postaci kolistej cząsteczki.
Lokalizacja:
Jądro komórkowe, mitochondria, plastydy
Funkcje:
jest źródłem informacji genetycznej (geny są fragmentami DNA kodującymi informację do syntezy białka lub kwasu RNA)
również kieruje syntezą białek, dzięki czemu steruje wszystkimi procesami, jakie zachodzą w organizmie.
Kwas rybonukleinowy Rna
cząsteczka jednoniciowa, w składzie której - w porównaniu do DNA - znajduje się, zamiast tymidyny, uracyl oraz ryboza, zamiast deoksyrybozy.
W komórce RNA zawiera:
jądro komórkowe;
rybosomy;
cytoplazma.
Lokalizacja:
Cytoplazma komórki, różne fragmenty komórkowe (rybosomy)
Funkcje:
pośredniczenie pomiędzy DNA i rybosomami w trakcie biosyntezy białek.
Rodzaje:
informacyjny RNA (mRNA) - zawierający kopię kodu genetycznego (matryca do syntezy białek);
transportujący RNA (tRNA) - przenoszący aminokwasy do rybosomów;
rybosomalny RNA (rRNA) - będący składnikiem rybosomów.
Kod genetyczny - cechy :
Trójkowy, czyli trzy kolejne nukleotydy, tzw. kodony (triplety), zawarte w kwasie nukleinowym wyznaczają określony aminokwas w białku.
Niejednoznaczny - trojek kodujących 20 aminokwasów jest 61; niektóre trojki są synonimami oznaczającymi ten sam aminokwas. Oznacza to, ze aminokwas może być wyznaczony (zapisany) przez więcej niż 1 kodon (nawet do 6 zapisów, np. leucyna). Najczęściej kodony wyznaczające ten sam aminokwas maja dwie pierwsze zasady takie same, a różnią sie jedynie trzecia zasada.
Bezprzecinkowy, kod nie posiada specjalnych oznaczeń odgraniczających jeden kodon od drugiego. Koniec zapisu danego białka zapisuje trojka nonsensowna (terminator): UAA, UAG lub UGA, której nie odpowiada żaden aminokwas.
Niezachodzący, czyli trojki odczytywane są kolejno, jedna nie zachodzi na druga.
Uniwersalny: u rożnych organizmów ten sam kodon oznacza ten sam aminokwas.
Podział cukrów:
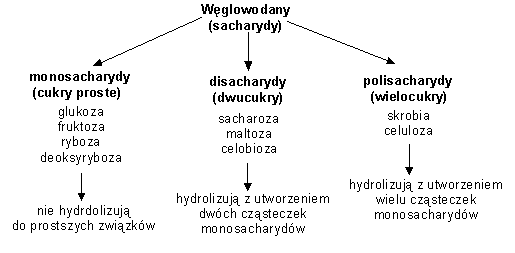
Znaczenie i funkcje:
Białek
Funkcje:
budulcowa,
energetyczna,
transportująca (chemoglobina),
odpornościowa (przeciwciała),
wzmacniająca i uelastyczniająca (kolagen),
enzymatyczna
Znaczenie:
stanowią element budulcowy i wzmacniający (podporowy, osłaniający, spajający), np. keratyna naskórka, kolagen tkanki łącznej, białka błon komórkowych.
występują też białka kurczliwe np. aktyny i miozyny z miofibryli tkanki mięśniowej, które łącząc się powodują skurcz mięśnia realizując jego ruch.
we wszystkich komórkach występują białka katalityczne tzw. enzymy, które przyspieszają reakcje chemiczne.
w płynach ustrojowych występuje wiele białek transportujących, które wiążą i przenoszą różne cząsteczki np. hemoglobina transportuje tlen, a inne transportują jony metali hormony, składniki pokarmowe.
do białek regulujących należą hormony.
do białek obronnych należą immunoglobuliny, tworzące różne przeciwciała.
białka sensoryczne (nerwowe) z narządów zmysłowych np. rodopsyna mają zdolność odbierania i przesyłania sygnałów z środowiska.
włosy i pióra okrywające ciała zwierząt są zbudowane z keratyny. W tym przypadku białko pełni funkcje izolacyjną od wpływów środowiska zewnętrznego.
u roślin białka pełnią też funkcję magazynującą substancje zapasowe i energetyczne odkładane w nasionach.
jady i toksyny zwierzęce w dużej mierze oparte są na substancjach białkowych. W tym wypadku białka pełnia funkcje toksyczne.
Lipidów
Funkcje:
są energetycznym składnikiem dostarczającym organizmowi energii cieplnej na utrzymanie stałej temperatury ciała.
nadmiar odkładany jest w postaci tkanki podskórnej która izoluje przed zimnem oraz stanowi materiał zapasowy energetyczny
Znaczenie:
tłuszcze są źródłem energii.
dostarczają ponad 9kcal z 1 grama.
są magazynem energii.
pełnią też funkcję termoizolacyjną.
warstwa tłuszczu pomaga chronić przed urazami mechanicznymi.
Węglowodanów
Funkcje:
są składnikiem energetycznym,
dostarczają organizmowi energii mechanicznej na ruch i pracę narządów.
celuloza jest składnikiem budulcowym ścian komórkowych roślin.
Znaczenie:
Znaczenie cukrów w przyrodzie:
Cukry są bardzo rozpowszechnione w świecie organicznym, a w szczególności roślinnym. Służą głównie jako materiał budulcowy i zapasowy, źródło energii oraz intermediaty w szlakach metabolicznych (fosforanowe estry węglowodanów).Znaczenie cukrów dla gospodarki:
Cukry stanowią surowiec do produkcji:
-żywności (m.in. glukoza, sacharoza, skrobia)
-leków (m.in. glukoza, sacharoza)
-tkanin (m.in. glukoza, celuloza)
-papieru (celuloza)
-włókien sztucznych (m.in. celuloza)
-materiałów wybuchowych
-lustra i bańki choinkowe (glukoza)
-klej (skrobia)
-krochmal (skrobia)
-proch bezdymny (celuloza)
-lakiery (celuloza)Łańcuch oddechowy
Cykl Krebsa
Proces replikacji
Dwie nici podwójnej helisy w pewnym miejscu rozplatają się; powoduje to rozerwanie par zasad komplementarnych
W pobliżu miejsca rozplecenia zawsze znajduje się dostateczna ilość wolnych nukleotydów; do każdej z zasad w rozplecionych niciach dołącza zasada komplementarna, stanowiąca część wolnego nukleotydu - jednostki budulcowej DNA
Między nowo dołączonymi nukleotydami powstają trwałe połączenia - w ten sposób tworzy się nowa nić DNA.
Transkrypcja, translacja
Proces fotosyntezy
b-oksydacja kwasów tłuszczowych
Proces glikolizy
Pierwszą reakcją jest fosforylacja glukozy do glukozo-6-fosforanu. Jest to reakcja praktycznie nieodwracalna. Proces ten odbywa się przy udziale enzymu heksokinazy w komórkach obwodowych, a w wątrobie reakcję katalizuje enzym glukokinaza. Kofaktorem reakcji jest adenozyno trójfosforan (ATP) w kompleksie z jonami magnezu Mg2+. Glukokinaza wątrobowa wymaga dużych stężeń glukozy - ma to znaczenie po posiłkach. Heksokinaza obwodowa - wychwytuje glukozę do tkanek również przy jej niskich stężeniach w osoczu, zapewniając komórkom stałe dostarczanie substratu do glikolizy. Zużyciu ulega wiązanie wysokoenergetyczne i powstaje ADP. Glukozo-6-fosforan jest związkiem chemicznym, który wchodzi również do innych szlaków metabolicznych: szlak pentozowy, przemiany glikogenu i in.
Druga reakcja glikolizy to izomeryzacja aldozowo-ketozowa. Reakcję katalizuje izomeraza fosfoheksozowa. Powstaje fruktozo-6-fosforan.
Następuje kolejna fosforylacja z udziałem ATP, katalizowana przez fosfofruktokinazę-1. Powstaje fruktozo-1,6-bifosforan i ADP.
Fruktozo-1,6-bifosforan jest rozkładany przez aldolazę na dihydroksyacetonofosforan (fosfodihydroksyaceton) i gliceraldehydo-3-fosforan (aldehyd glicero-3-fosforanowy).
Dihydroksyacetonofosforan ulega izomeryzacji do gliceraldehydo-3-fosforanu. Reakcję katalizuje izomeraza fosfotriozowa. W efekcie z jednej cząsteczki glukozy powstają dwie cząsteczki trioz.
Gliceraldehydo-3-fosforan ulega utlenieniu do 1,3-bifosfoglicerynianu. Koenzymem jest NAD+ w obecności nieorganicznego fosforanu. Reakcję katalizuje enzym dehydrogenaza gliceraldehydo-3-fosforanowa. Wśród produktów jest obecny NADH, który w obecności tlenu w łańcuchu oddechowym prowadzi do powstania 3 cząsteczek ATP a w warunkach beztlenowych jest zużywany do syntezy mleczanu z pirogronianu.
Kinaza fosfoglicerynianowa katalizuje następną reakcję w obecności ADP. 1,3-bifosfoglicerynian przechodzi w 3-fosfoglicerynian. Powstaje ATP. Jest to fosforylacja bez udziału łańcucha oddechowego - fosforylacja substratowa.
Arsen - trucizna - może rozsprzęgać na tym etapie reakcję współzawodnicząc z fosforem nieorganicznym.
Mutaza fosfoglicerynianoiwa przekształca 3-fosfoglicerynian w 2-fosfoglicerynian.
Enolaza w obecności jonów Mg2+, odszczepiając wodę, przekształca 2-fosfoglicerynian w fosfoenolopirogronian. Ten etap jest hamowany przez fluorki.
Kinaza pirogronianowa w obecności jonów Mg2+ przenosi fosforan z fosfoenolopirogronianu na ADP. Powstaje ATP i pirogronian w formie enolowej, która samorzutnie przechodzi w formę ketonową. Do dalszych przemian pirogronian wchodzi po przekształceniu w Acetylo-CoA.
W warunkach beztlenowych (deficyt tlenu, "dług tlenowy") pirogronian przechodzi w mleczan przy udziale dehydrogenazy mleczanowej odtwarzając NAD+ potrzebny na etapie dehydrogenazy gliceraldehydo-3-fosforanowej.
chityna buduje pancerze stawonogów.
ostatni etap oddychania wewnątrzkomórkowego, przebiegający na wewnętrznych błonach mitochondrium i polegający na przenoszeniu elektronów i protonów na kolejne przenośniki. Kolejnym etapom tej wędrówki elektronów towarzyszy wydzielanie się energii, która zostaje wykorzystana do syntezy ATP z ADP. Ostatecznym akceptorem elektronów i protonów jest tlen, a reakcja ta prowadzi do utworzenia cząsteczki wody. Tworzenie wody jest podstawową reakcją dostarczającą energii komórkom w warunkach tlenowych.
W reakcje łańcucha oddechowego wchodzą cząsteczki NADH i FADH, syntezowane w poprzednich etapach oddychania (glikoliza i cykl Krebsa). Przejściu jednej cząsteczki NADH w NAD i przebiegowi elektronów przez łańcuch oddechowy towarzyszy synteza 3 cząsteczek ATP. Głównymi składnikami łańcucha oddechowego są poza tym: dwa kompleksowe enzymy flawoproteinowe zawierające żelazo niehemowe - dehydrogenaza nukleotydów pirydynowych i dehydrogenaza bursztynianowa, ubichinon (Q) oraz cytochromy b, c1, c i a. Ostatnim ogniwem łańcucha oddechowego jest enzym oksydaza cytochromowa, odpowiedzialny za wytworzenie jonu tlenowego O2, który łączy się z dwoma protonami i tworzy cząsteczkę wody.
Cykl Krebsa, czyli cykl kwasu cytrynowego to cykl przemian metabolicznych, który przebiega w komórkach wszystkich organizmów oddychających tlenem. Został on odkryty w 1937 roku przez Hansa Krebsa i to od nazwiska tego biochemika bierze się jego nazwa.
Cykl Krebsa u eukariontów zlokalizowany jest wewnątrz mitochondriów - ważnych organelli komórkowych (u prokariontów przebiega w cytoplazmie). Składa się on z 9 etapów, katalizowanych przez 8 odrębnych enzymów (dwa etapy katalizuje ten sam enzym).
Zadaniem cyklu Krebsa jest utlenić związek o nazwie: acetylokoenzym A (acetylo-CoA) do 2 cząsteczek dwutlenku węgla (CO2), a pozyskaną w tym procesie energię ulokować w chemicznych nośnikach energii: GTP, NADH i FADH2.
Sumaryczny wzór cyklu Krebsa to:
acetylo-CoA + GDP + Pi + 3NAD+ + FAD + 2H20 → koenzym-A + GTP + 3NADH + 3H+ + FADH2 + 2CO2
Podczas jednego, pełnego obrotu cyklu Krebsa powstają 3 cząsteczki NADH, jedna cząsteczka FADH2 i jedna cząsteczka GTP. Najbardziej wszechstronnym nośnikiem energii w komórce jest ATP. GTP jest łatwo zamieniany na ATP przez odpowiedni enzym.
Natomiast NADH i FADH2 biorą udział w mitochondrialnym łańcuchu oddechowym - przemianie, która zamienia energię tych zredukowanych związków na energię wiązań ATP. Niezbędnym uczestnikiem łańcucha oddechowego jest tlen.
Jedna cząsteczka NADH pozwala wyprodukować 3 cząsteczki ATP, a jedna cząsteczka FADH2 - 2 cząsteczki ATP. Nietrudno więc obliczyć, że jeden pełny obrót cyklu Krebsa pozwala wytworzyć 12 cząsteczek ATP - uniwersalnego nośnika energii dla komórki (3 x 3 + 1 x 2 + 1 = 12).
Schemat całego cyklu przedstawiono poniżej (z pominięciem enzymów):
Acetylokoenzym A jest cząsteczką centralną dla metabolizmu tlenowców. Jest on produktem katabolizmu wielu aminokwasów, cząsteczką końcową tzw. beta-oksydacji kwasów tłuszczowych, a także związkiem, w który przeprowadzany jest pirogronian - produkt glikolizy monocukrów.
A więc to dzięki tej "zbiorczej" cząsteczce, komórka może uzyskiwać energię zarówno z aminokwasów (składniki białek), jak i z tłuszczów i cukrów.
Zauważmy, że drugim substratem, do którego przyłączany jest acetylo-CoA na początku cyklu Krebsa, jest szczawiooctan. Ale mamy tu do czynienia z cyklem, czyli szczawiooctan jest także jednym z produktów końcowych. Cały cykl bierze zatem udział w utlenianiu acetylokoenzymu A, ale pozostaje on niezmienny dzięki swojej cykliczności (koniec przechodzi w początek). Jeśli coś uczestniczy w reakcji, a mimo to nie zmienia się, to jest to katalizator. A więc możemy traktować cały cykl Krebsa jak jeden, złożony katalizator.
Replikacja DNA to proces, w którym podwójna nić DNA ulega skopiowaniu. Replikacja jest semikonserwatywna - w każdej z dwóch uzyskanych podwójnych nici DNA będzie jedna nić macierzysta i jedna nowa. Nie licząc niewielkiej szansy wystąpienia błędu obie cząsteczki DNA będą identyczne.
Transkrypcja - przepisywanie informacji z DNA na mRNA odbywa się na matrycy DNA przy udziale polimerazy RNA. Jest to konieczne ponieważ DNA nie może opuszczać jądra komórki a mRNA tak. Polimerazy DNA katalizuję transkrypcja. Składa się z:
- części rdzeniowej
- katalitycznej
W procesie transkrypcji wyróżnia się trzy etapy: inicjację, elongację i terminację
Zapoczątkowanie procesu polega na związaniu się polimerazy RNA z promotorem. W miejscu, w którym polimeraza natknie się na promotor z dużym powinowactwem związuje się z tym rejonem i rozsuwa nici DNA na odcinku kilkunastu nukleoidów umożliwia to ich ustawienie i łączenie ze sobą.
Proces inicjacji biosyntezy RNA przy końcu 5' rozpoczyna się od usunięcia czynnika sigma. Enzym dołącza rybonukleotydy według nici matrycowej DNA i reguły parowania zasad. Wyzwala się pirofosforan.
W procesie emolegacji (wydłużenia łańcuch RNA). Polimeraza RNA przesuwa się wzdłuż heliksu DNA w którym rozwija się spirala na tyle aby był zapewniony dostęp do zasad na jego nici matrycowej odcinek rozwinięty liczy 17 par zasad na cząsteczkę polimerazy. Nowo powstały fragment RNA odłącza się szybko od matrycowej nici DNA. Nić DNA powraca w tym miejscu do pierwotnej struktury podwójnej spirali. Transkrypcja zachodzi w sposób ciągły postępuje wzdłuż nici matrycowej DNA w miarę przesuwania się polimerazy (wydłuża się łańcuch mRNA. Powstające hybrydowy kompleks DNA - RNA ulega rozpadowi, DNA powraca do swojej pierwotnej dwuniciowej struktury a łańcuch powstającego mRNA oddziela się.)
Proces zakończenia syntezy RNA czyli terminacja polega na odłączeniu rdzenia polimerazy od matrycy DNA. Odłączeniu polega także nowo zsyntetyzowana nić RNA. Cały proces transkrypcji może być rozpoczęty od nowa. Transkrypcje kończy czynnik ro, polimerazy RNA zatrzymuję się i oddysocjowuje.
Pierwotny transkrypt jest natychmiast wykorzystywany do translacji. Z jednej strony wynika to z konieczności, ponieważ organizmy te nie majš białek informomerowych, które chronią od działania enzymów nukleolitycznych. Z drugiej strony istnieje możliwości natychmiastowej translacji bowiem transkrypcja nie jest ograniczona do obszaru jądra.
Translacja - to proces gdzie odbywa się właściwe odczytywanie kodu genetycznego i przepisywanie go na sekwencję aminokwasową białka
zaczyna się ona od kodonu startowego, zapewniającego dalsze odczytywanie mRNA we właściwej kolejności - najczęściej jest to kodon AUG lub GUG, a kończy się kodonem symbolizującym ostatni aminokwas (u prokariotów są to kodony nonsensowne - nie oznaczające żadnego aminokwasu)
Fotosynteza to bardzo ważny proces biochemiczny, który przebiega w organizmach roślin, jednokomórkowych glonów, sinic i niektórych bakterii. W procesie tym, prosty cukier - glukoza, syntetyzowany jest z wody i dwutlenku węgla, dzięki energii słonecznej. Dodatkowo wydziela się tlen.
Proces ten ma ogromne i podstawowe znaczenie w ekosystemach ziemskich, bo dzięki niemu powstaje materia organiczna, z której korzystają też te organizmy, które same pokarmu nie potrafią sobie wyprodukować (zwierzęta, grzyby). Poza tym, dwutlenek węgla, będący produktem oddychania, nie kumuluje się w nieskończoność, lecz jest z powrotem wykorzystywany przez fotosyntezę, która ponadto regeneruje zasoby tlenu.
W tym artykule zajmiemy się procesem fotosyntezy, zachodzącym u zielonych eukariontów, czyli organizmów posiadających już w swoich komórkach jądro i chloroplasty. W ich przypadku, fotosynteza umiejscowiona jest w całości w chloroplastach.
Składa się ona z dwóch wyraźnych faz. Są to: faza jasna i faza ciemna. Do przebiegu tej pierwszej niezbędne jest światło, natomiast ta druga zachodzi bez względu na warunki oświetleniowe.
Faza jasna przebiega w błonach tylakoidów gran - struktur, znajdujących się wewnątrz chloroplastów. Uczestniczą w niej dwa, powiązane ze sobą rodzaje układów: fotosystem I i fotosystem II.
Fotosystem II rozbija wodę na tlen, jony wodorowe i elektrony. W tym procesie uczestniczy ciekawe białko, zawierające jako kofaktor 4 jony manganu. Jony wodoru pompowane są do wnętrza tylakoidów, dzięki czemu tworzy się gradient ich stężenia. Wykorzystywany on jest do napędzania produkcji ATP - związku niosącego dużo energii chemicznej.
Natomiast elektrony przekazywane są na chlorofil, gdzie zostają wzbudzone przez padające fotony światła słonecznego. Przy powrocie ze stanu wzbudzenia, elektrony, za pośrednictwem specjalnych białek i cząsteczek (plastochinony, cytochrom bf), dalej pompują jony wodoru do wnętrza tylakoidów, co później zamieniane jest również na energię wiązań ATP.
Oto sumaryczny zapis reakcji w fotosystemie II:
2 H2O + fotony światła → 4 H+ + 4 elektrony + O2(tlen)
Następnie, elektrony z fotosystemu II przechodzą do fotosystemu I, gdzie znów trafiają na cząsteczki chlorofilu i znów zostają wzbudzone. Ale tym razem ich powrót do stanu normalnego odbywa się z pomocą białka - ferredoksyny, która redukuje NADP+ do związku o wysokiej energii - NADPH. Sumaryczny zapis reakcji w fotosystemie I wygląda następująco:
2 H+ + 4 elektrony + 2 NADP+ → 2 NADPH
Podsumowując: w fazie jasnej woda rozbijana jest na tlen, elektrony i jony wodoru. Te dwa ostatnie produkty służą do syntezy wysokoenergetycznego NADPH. Reakcje tej fazy możemy zbiorczo zapisać:
2 H2O + 2 NADP+ + fotony światła → 2 H+ + 2 NADPH + O2(tlen)
Wiemy też, że jony wodoru, które nie zostały związane przez NADP+, a są produktami tej reakcji (prawa strona), służą do syntezy wysokoenergetycznego ATP (3 cząsteczki ATP na 2H+).
Dlaczego obydwa związki wysokoenergetyczne: ATP i NADPH są tak ważne? Otóż biorą one dalej udział w fazie ciemnej fotosyntezy.
W fazie ciemnej następuje wiązanie dwutlenku węgla (CO2) i NADPH przez skomplikowany system fosfocukrów, zwany cyklem Calvina. Cały ten proces zlokalizowany jest w tzw. stromie, czyli macierzy wypełniającej chloroplasty. W jego wyniku powstaje glukoza, a energię do jego przebiegu zapewnia dodatkowo 18 cząteczek ATP na jedną produkowaną cząsteczkę glukozy.
Przebieg fazy ciemnej możemy zapisać następująco:
6 CO2 + 12 NADPH + 12 H+ → C6H12O6(glukoza) + 6 H2O + 12 NADP+
Z naszego sumarycznego zapisu fazy jasnej wynika, że z dwóch cząsteczek wody produkowane są tylko 2 cząsteczki NADPH. Jako, że do wyprodukowania 1 molekuły glukozy potrzeba w fazie ciemnej 12 NADPH, to naszą wcześniejszą reakcję fazy jasnej pomnóżmy obustronnie przez 6. Oto wynik:
12 H2O + 12 NADP+ + fotony światła → 12 H+ + 12 NADPH + 6 O2(tlen)
Teraz możemy "zgrać" ze sobą dwa ostatnie zapisy reakcji dwóch faz fotosyntezy: jasnej i ciemnej. Dokonamy tego, dodając do siebie osobno lewe, a osobno - prawe strony reakcji i skreślając składniki, które wystąpią po obydwu stronach scalonego równania. Otrzymamy nareszcie sumaryczny, wypadkowy zapis fotosyntezy:
6 CO2 + 6 H2O + fotony światła → C6H12O6(glukoza) + 6 O2(tlen)
Z wody i dwutlenku węgla, przy udziale światła, produkowane są: glukoza i tlen.
Trzeba tu jeszcze dodać, że w świecie roślin wyższych występują zawsze 2 rodzaje chlorofilów: a i b. Chlorofil a wchodzi w skład fotosystemów I i II, a chlorofil b - tylko fotosystemu II.
Obydwa rodzaje chlorofilów absorbują wydajnie światło czerwone i niebieskie, zatem w świetle odbitym od nich przeważa kolor zielony. A więc to właśnie chlorofil nadaje zieloną barwę liściom i niezdrewniałym łodygom roślinnym.
Cząsteczki tłuszczu są w całości przekształcane w związki biorący bezpośredni udział w oddychaniu komórkowym. Glicerol utleniany jest do aldehydu 3-fosfoglicerynowego, natomiast kwasy tłuszczowe do dwuwęglowych grup acetylowych, które łączą się z koenzymem A tworząc acetylo-CoA (produkt drugiego etapu oddychania komórkowego, czyli powstawania acetylo koenzymu A z pirogronianiu). Odłączanie kwasów tłuszczowych od glicerolu oraz dzielenie długich, wielowęglowych kwasów tłuszczowych na dwuwęglowe grupy acetylowe (proces utleniania) wiąże się z powstawaniem wielu atomów wodoru, które są donorami elektronów w łańcuchu oddechowym. Dlatego utlenianie tłuszczy jest bardzo korzystnym energetycznie procesem - 1 gram tłuszczów (energetycznie) = 2 gramy glukozy (energetycznie). Utlenienie jednej sześciowęglowej cząsteczki kwasu tłuszczowego powoduje powstanie 44 cząsteczek ATP (odpowiednio ze spalania 6-węglowej cząsteczki glukozy otrzymamy maksymalnie do 38 cząsteczek ATP).
Cząsteczka tłuszczu → glicerol + 3 kwasy tłuszczowe Glicerol (utlenianie i fosforylacja) → aldehyd 3-fosfoglicerynowy grupy acetylowe; grupy acetylowe + koenzym A →◊Kwas tłuszczowy acetylo-CoA
Glikoliza jest podstawowym procesem wytwarzającym energię w żywym organizmie. Substratem jest glukoza, a produktem jest pirogronian, który w warunkach tlenowych przechodzi poprzez acetylo-CoA do cyklu kwasu cytrynowego, a w warunkach beztlenowych ulega redukcji do mleczanu. Bilans glikolizy w warunkach beztlenowych to 2 mole ATP z jednego mola glukozy, a w warunkach tlenowych 8 moli ATP oraz z dalszego przebiegu reakcji cyklu kwasu cytrynowego 30 moli ATP z jednego mola glukozy. Substratem wyjściowym procesu glikolizy jest glukoza.
Regulacja glikolizy:
Heksokinaza jest hamowana allosterycznie przez glukozo-6-fosforan - produkt reakcji z udziałem tego enzymu. Dehydrogenaza pirogronianowa jest hamowana przez Acetylo-CoA oraz NADH. Insulina zwiększa aktywność tego enzymu w tkankach obwodowych. Funkcję regulacyjną ma również fosfofruktokinaza.
Wyszukiwarka
Podobne podstrony:
AMINOKWASY, Ogrodnictwo, II semestr, biochemia
Oceny Kolokwium II Owoce świata, Ogrodnictwo, II Semestr MGR
Wymień poziomy organizacji życia organizmów, Ogrodnictwo, II semestr, ekologia i ochrona środowiska
II kolokwium - rośliny dwuliścienne, Ogrodnictwo, II semestr, botanika
Surowce olejkowe i olejki roślinne, Ogrodnictwo, II Semestr MGR
kolokwium - odpowiedzi, Ogrodnictwo, II semestr, ekologia i ochrona środowiska
Oceny Kolokwium I Owoce świata, Ogrodnictwo, II Semestr MGR
PYTANIA EGZAMIN BIOCHEMIA, BIOLOGIA UJ, ROK II, Semestr 1, Biochemia, egzamin
Materialy do cw lab II semestr, studia, Zdrowie Publiczne, II rok, Biochemia
Plan ćwiczeń-II semestr, BIOCHEMIA, Biochemia plany
7327016krotkoterm rach dec, Ogrodnictwo, Magisterskie, Semestr II mgr, Fakultet - Zarządzanie
Gerbera nakolosanotatki 13-01-2014, OGRODNICTWO UP LUBLIN, ROŚLINY OZDOBNE, ozdobne II semestr
Grupa II 41C, OGRODNICTWO inż, Semestr 7, Przetwórstwo, sprawozdanie nr 3
Doniczki test, OGRODNICTWO UP LUBLIN, ROŚLINY OZDOBNE, ozdobne II semestr
ostatni kolos, Ogrodnictwo, Ogrodnictwo UP Wro, ROK II, semestr IV, Ochrona roślin (z Fitopatopogia)
Szkółkarstwo - wykład II - semestr IV - 05.03.2013, Ogrodnictwo, Semestr IV, Szkółkarstwo
więcej podobnych podstron