Warszawa 2003
Szkoła Główna
Służby Pożarniczej
SPRAWOZDANIE Z ĆWIECZENIA NR 2
Wyznaczanie stosunku C p / C v dla powietrza metodą
Clementa i Desormesa .
ĆWICZENIE LABORATORYJNE Z FIZYKI
|
|
Ćwiczenie nr 2
|
|
Temat : Wyznaczanie stosunku C p / C v dla powietrza metodą Clementa i Desormesa . |
|
Marcin Babula Artur Bazylak Piotr Bryzek |
DSZ-PK1 PL.2 |
Data : 12.03.2003 |
Ocena:
|
I Wstęp teoretyczny dotyczący omawianego ćwiczenia.
CIEPŁO WŁAŚCIWE Cp (lub Cv) - ilość ciepła potrzebna do podniesienia temperatury jednostki masy o 1 K (1 °C) pod stałym ciśnieniem (odpowiednio objętością).
CIEPŁO MOLOWE cp (lub cv) - ilość ciepła potrzebna do podniesienia temperatury 1 mol gazu o 1 K (1 °C) pod stałym ciśnieniem (odpowiednio objętością).
PRZEMIANA IZOTERMICZNA - temperatura gazu nie zmienia się, pozostaje również niezmienna masa gazu. Zmianie ulega ciśnienie i objętość. Zachowanie się gazu opisuje prawo Boyle'a - Mariotte'a, które stwierdza: iloczyn ciśnienia przez objętość gazu pozostaje stały. pv = nRT
p [Pa]
W przemianie tej pozostaje niezmienna energia wewnętrzna gazu, która wyraża się wzorem:
ΔU = cv m ΔT = C n ΔT
ΔU = 0 ,bo ΔT = 0
Z pierwszej zasady termodynamiki:
ΔU = Q + W Q = - W
![]()
Q - ciepło dostarczone (oddane) do gazu
![]()
W - praca wykonana nad układem (przez układ)
Możemy odczytać to następująco: dostarczone do gazu ciepło w 100% zostaje zużyte na pracę rozprężania gazu.
PRZEMIANA IZOCHORYCZNA - objętość gazu nie zmienia się. Zmieniają się ciśnienie i temperatura. Gaz podlega prawu Charlesa:
![]()
= const.
W przemianie tej gaz nie wykonuje pracy:
W = - p ΔV ( ΔV = 0), to W = 0
Dlatego ciepło dostarczone do gazu zostaje zużyte na wzrost energii wewnętrznej.
Q = ΔU = Cv n ΔT
PRZEMIANA IZOBARYCZNA - ciśnienie gazu nie zmienia się, zmieniają się temperatura i objętość. Gaz podlega prawu Gay - Lussaca:
![]()
= const.
W przemianie izobarycznej gaz wykonuje pracę, która wyraża się wzorem: W = - p ΔV
Z I zasady dynamiki: Q = ΔU + (- W)
Część dostarczonego ciepła powoduje przyrost energii wew. ΔU a pozostała ilość ciepła zostaje zużyta na pracę (-w), wykonaną przez gaz na pokonanie ciśnienia zewnętrznego podczas rozpręzania gazu.
Q = Cp n ΔT Qp > QV
PRZEMIANA ADIABATYCZNA - w tym procesie gaz nie wymienia ciepła z otoczeniem. Q = 0
Z I zasady termodynamiki: ΔU = W W = - p ΔV, zwiększając ciśnienie powodujemy wzrost temperatury gazu.
W rzeczywistości przemiana ta musi być przeprowadzana bardzo szybko, aby gaz nie zdążył wymienić ciepła z otoczeniem. Wtedy gaz zachowuje się zgodnie z równaniem adiabaty:
p Vκ = const. ,gdzie κ = ![]()
κ > 1 ,bo Cp > CV
Wyznaczanie stosunku C p / C v dla powietrza metodą Clementa i Desormesa - opis metody pomiaru:
W celu wyznaczenia k gaz poddajemy trzem przemianom .
W balonie szklanym znajduje się powietrze pod ciśnieniem atmosferycznym, otwieramy zawór K 1 a zamykamy zawór K2, za pomocą pompki zwiększamy ciśnienie o około 20 cm słupa cieczy. Gdy temperatura gazu w balonie się wyrówna z temperaturą otoczenia odczytuję na manometrze różnicę poziomu cieczy. Otwierając na kilka sekund zawór K 2 łączący balon z powietrzem atmosferycznym powodujemy jego rozprężanie ; wskutek czego temperatura gazu obniża się , gdyż praca rozprężania odbywa się kosztem obniżenia energii wewnętrznej gazu . Po kilku sekundach zamykam zawór K 2 wskutek czego gaz powoli ogrzewa się do temperatury otoczenia .Wzrasta w tedy jego ciśnienie . Gdy poziom cieczy się ustali odczytuję różnicę poziomu cieczy na manometrze.
Wykonanie obliczeń do ćwiczenia:
Obliczenie różnicy poziomu h 1- h 2 oraz współczynnika adiabaty K ze wzoru K1 =
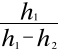
zawarto w tabeli
Obliczenie wartości średniej arytmetycznej K śr:
K śr= ![]()
![]()
![]()
Kśr = ![]()
Kśr = ![]()
= 1,32
Obliczenie odchyleń poszczególnych wartości K od K śr.
ΔK - bezwzględna wartość odchyleń
ΔK1= K śr - K1 =1,32-1,33= 0,01
ΔK2= K śr - K2 =1,32-1,32= 0
ΔK3= K śr - K3 =1,32-1,30= 0,02
ΔK4= K śr - K4 =1,32-1,32= 0
ΔK5= K śr - K5 =1,32-1,30= 0,02
ΔK6= K śr - K6 =1,32-1,31= 0,01
ΔK7= K śr - K7 =1,32-1,30= 0,02
ΔK8= K śr - K8 =1,32-1,33= 0,01
ΔK9= K śr - K9 =1,32-1,31= 0,01
ΔK10= K śr - K10=1,32-1,33= 0,01
Obliczenie błędu średniej arytmetycznej ΔKśr:
ΔKśr= 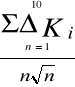
= ![]()
=
0,01+0+0,02+0+0,02+0,01+0,02+0,01+0,01+0,01 0,11
= = = 0,0035
31,6 31,6
Obliczenie wartości K metodą różniczki zupełnej
dla pomiarów 1,5,10 :
ΔK= ![]()
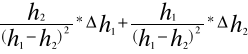
Δh -dokładność pomiaru Δh1= Δh2=2mm
ΔK1= ![]()
![]()
=0,02
ΔK5 =![]()
![]()
=0.02
ΔK10 =![]()
![]()
=0,02
Obliczenie błędu względnego δ:
δ=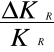
=![]()
=0.002
Wnioski z przeprowadzonego ćwiczenia:
Metoda Clementa i Desormesa pozwoliła nam obliczyć stosunek Cp do Cv powietrza. W tym celu musieliśmy je poddać trzem przemianom, kolejno: adiabatycznej, izochorycznej oraz izotermicznej. Do wyznaczenia tego stosunku wystarczyły jedynie wskazania manometru cieczowego h1 i h2, dlatego błąd wartości K oraz względny zależą głównie od niedokładności pomiaru.
Wyszukiwarka
Podobne podstrony:
O3-4gs, SGSP, Fizyka, Fizyka lab, laborki fizyka
laborki J1, SGSP, Fizyka, Fizyka lab, laborki fizyka
C4-7, SGSP, Fizyka, Fizyka lab, laborki fizyka
Zeimer, SGSP, Fizyka, Fizyka lab, laborki fizyka
J1-1, SGSP, Fizyka, Fizyka lab, laborki fizyka
J1-6, SGSP, Fizyka, Fizyka lab, laborki fizyka
fire, SGSP, Fizyka, Fizyka lab, laborki fizyka
J1-6Krzychu cwiczenia J!, SGSP, Fizyka, Fizyka lab, laborki fizyka
Tabela2, SGSP, Fizyka, Fizyka lab, laborki fizyka
Tabele1i3, SGSP, Fizyka, Fizyka lab, laborki fizyka
Laboty krztychu C4, SGSP, Fizyka, Fizyka lab, laborki fizyka
laborki O3 GAJOS, SGSP, Fizyka, Fizyka lab, laborki fizyka
laborki J1-jaiczeski, SGSP, Fizyka, Fizyka lab, laborki fizyka
Laboratorium fizyki, SGSP, Fizyka, Fizyka lab, laborki fizyka
sprawozdanie c1, SGSP, Fizyka, Fizyka lab, laborki fizyka
fiza, SGSP, Fizyka, Fizyka lab, laborki fizyka
więcej podobnych podstron