Nr ćwiczenia: 12 |
Data: 05.05.2011r. |
Imię i nazwisko: |
Wydział: Technologia Chemiczna Kierunek: Technologia Chemiczna |
Semestr: II |
Prowadzący: dr inż.. Bogdan Wyrwas |
Przygotowanie: |
Wykonanie: |
Ocena: |
|
Temat: Rozdział przez strącanie
Wstęp teoretyczny
Jeżeli jon ![]()
reaguje z jonem ![]()
tworząc trudno rozpuszczalny związek MA to reakcje oraz równowagi tworzenia oraz rozpuszczania się osadu możemy zapisać następująco:
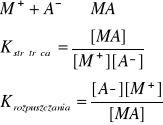
w przypadku osadów trudno rozpuszczalnych szczególnie duże znaczenie ma stała reakcji rozpuszczania, którą można uprościć do następującej postaci:
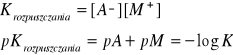
wielkość tą nazywamy iloczynem rozpuszczalności.
Iloczyn rozpuszczalności - iloczyn odpowiednich potęg stężeń jonów (stężeniowy) lub aktywności jonów (termodynamiczny) znajdujących się w nasyconym roztworze elektrolitu. Ma charakter stałej równowagi dynamicznej i zależy od temperatury. W zależności od tego, czy reakcja rozpuszczania soli jest egzoenergetyczna, czy endoenergetyczna, rozpuszczalność albo maleje, albo rośnie ze wzrostem temperatury, zgodnie z regułą przekory Le Chateliera-Brauna.
Efekt solny- Jeżeli w roztworze znajdzie się duże stężenie soli obojętnych (nie mających jonów wspólnych z daną solą trudno rozpuszczalną) wówczas na skutek zmiany (zmniejszenia) współczynników aktywności, stężeniowy iloczyn rozpuszczalności zmieni się (wzrośnie) (iloczyn termodynamiczny pozostanie stały) w wyniku czego wzrośnie także rozpuszczalność soli.
W analizie chemicznej reakcje kompleksowania współdziałają z reakcjami strącenia trudno rozpuszczalnych osadów.
Najważniejsze to:
-strącenie jonu w obecności czynnika kompleksującego
-rozpuszczenie trudno rozpuszczalnego osadu za pomocą czynnika kompleksującego
-zapobieganie strąceniu składnika towarzyszącego temu, który należy strącić(maskowanie)
Iloczyn rozpuszczalności służy do ilościowego przewidywania wpływu składu roztworu na rozpuszczalność.
Rozpuszczalność -ilość substancji tworzącej roztwór nasycony w określonej ilości (najczęściej w 100g) rozpuszczalnika w określonej temperaturze i ciśnieniu.
Czynniki wpływające na rozpuszczalność osadów
Rozpuszczalność osadów zależy od:
temperatury,
rodzaju rozpuszczalnika,
wartości pH roztworu,
obecności jonów wspólnych z osadem,
hydrolizy jonów na które rozpada się w roztworze rozpuszczona część osadu,
tworzenia się w roztworze związków kompleksowych.
Procesy i czynniki towarzyszące wytrącaniu osadów
tworzenie połączeń z innymi jonami
Wykonanie ćwiczenia:
1.1 Strącanie soli jako funkcja Ir.
1.1.1 ![]()
po dodaniu ![]()
wytrącił się biały osad
![]()
Po dodaniu Na3PO4
nie widać żadnych zmian.
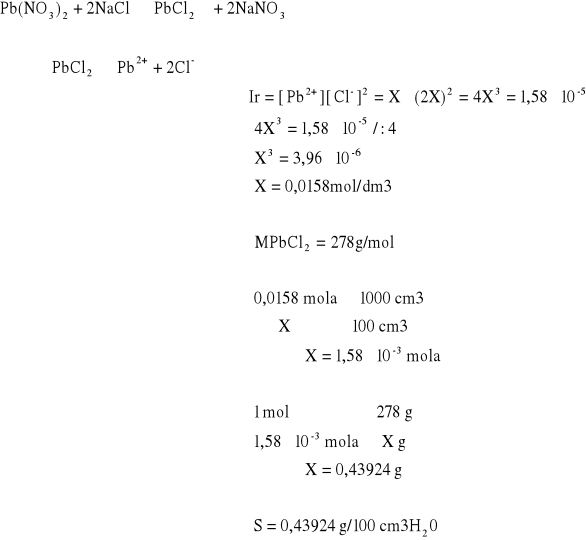

1.1.2 Przygotować 2 probówki z 1 - 2 cm3 0,01 M roztworu jonów Ba2+. Do pierwszej probówki dodać 2 - 3 cm3 buforu octanowego, a następnie 0,5 M K2CrO4. Do drugiej probówki dodać tylko roztwór chromianu potasu. To samo ćwiczenie wykonać dla 0,01 M roztworu soli Sr2+.
![]()
żółto mleczny roztwór, z wolno wytrącającym się osadem
![]()
jasno żółty roztwór, wytrąca się jasno żółty osad
Podobne doświadczenie wykonaliśmy dla 0,01 M roztworu ![]()
. W pierwszej próbówce obserwujemy pomarańczowy kolor do góry i bezbarwny na dole, osad nie wytrącił się z powodu obecności kwasu octowego w roztworze. W drugiej próbówce otrzymaliśmy natomiast jasno żółty roztwór i wytrącił się osad.
![]()
Iloczyn rozpuszczalności ![]()
wynosi 9,67, natomiast ![]()
jest równy 4,65.
BaCrO4 x : x : x Ir= [Ba2+ ][CrO42-]=x2 x2=10-9,67 x=1,46210-5mol/dm3
1 mol BaCrO4 - 253g/mol 1,46210-5mol -y y= 3,69910-3g
3,69910-3g BaCrO4 - 1000ml roztw. z - 100ml z=3,69910-4g BaCrO4 w 100 ml
|
SrCrO4 x : x : x Ir= [Sr2+ ][CrO42-]=x2 x2=10-4,65 x=4,7310-3mol/dm3
1 mol SrCrO4 - 204g/mol 4,7310-3mol -y y= 0,969g
0,969g BaCrO4 - 1000ml roztw. z - 100ml z=0,0969 SrCrO4 w 100 ml
|
Rozpuszczalność soli wynosi:
3,69910-4g BaCrO4 w 100 ml roztworu
0,0969 SrCrO4 w 100 ml roztworu
1.1.3 Strącanie wodorotlenku glinu roztworem soli słabych kwasów. Przygotowujemy probówkę z 1 - 2 cm3 jonów Al3+ i dodajemy roztwór, Na2CO3.
Po dodaniu Na2CO3 roztwór zmętniał i wytrącił się osad.
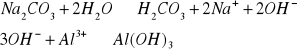
Reakcje kompleksowania a strącanie osadów.
1.2.1
![]()
osad brunatny (miedziany)
![]()
roztwór gęstnieje, kolor maślany, lekki osad
![]()
osad mleczno pomarańczowy
![]()
roztwór bezbarwny z białym osadem
![]()
roztwór gęstnieje z niebieskim osadem
Amfoteryczność a reakcje strącania.
Do probówki wprowadzić kilka kropel roztworu jonów Al3+. Następnie dodawać po kropli roztwór 0,1 M NaOH. Wytrącony osad rozpuścić dodając 0,1 M NaOH.
Po dodaniu do jonów Al3+ małej ilości NaOH wytrącił się biały osad, który podczas dalszego dodawania zasady rozpuszcza się. Tak samo dzieje się z Zn2+ i Pb2+.
Zmiana stopnia utlenienia a strącanie osadów.
Strącanie osadów MnO(OH)2 w wyniku reakcji redoks.
Do probówki wprowadzamy roztwór soli Mn2+, a następnie NaOH i 1 - 2 krople H2O2. Zanotować obserwacje.
![]()
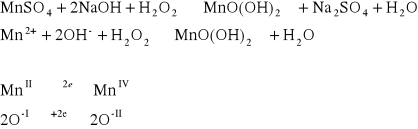
Po dodaniu NaOH do roztworu soi zawierającej jon Mn2+ (beżowa barwa roztworu), następnie dodano 2 krople H2O2 i po pewnym czasie wytrącił się dwuwarstwowy osad. Pierwsza warstwa miała kolor brązowy, druga była beżowa.
Kation |
pH występowania w postaci |
||
|
Men+ |
Me(OH)n |
hydroksokompleks |
Al3+ |
Al3+ |
Al(OH)3 |
[Al(OH)6]3- |
Zn2+ |
Zn2+ |
Zn(OH)2 |
[Zn(OH)4]2- |
Pb2+ |
Pb2+ |
Pb(OH)2 |
[Pb(OH)4]2- |
Wnioski
O rozpuszczalności związków decyduje iloczyn rozpuszczalności. Najpierw strącają się związki o małym iloczynie rozpuszczalności. W zależności od iloczynu rozpuszczalności możemy zaliczyć daną sól do soli słabo lub dobrze rozpuszczalnych. Możemy zauważyć, że przy pH kwasowym osad chromianu baru strąca się w małych ilościach. Reakcje strącania osadów dzięki powstawaniu barwnych osadów mogą być reakcjami charakterystycznymi dla danego pierwiastka oraz pomocnymi w jego wykrywaniu.
→
→
→
3
OH
Pb
OH-
Pb
OH
Zn
OH-
Zn
OH
Al
OH-
Al
)
(
2
)
(
2
)
(
3
2
2
2
2
3
3
Wyszukiwarka
Podobne podstrony:
Ćw. 13 - rozdział przez ekstrakcję - sprawko, Chemia ogólna i nieorganiczna
Ćw. 10 i 11 - reakcje utleniania i redukcji - sprawko, Chemia ogólna i nieorganiczna
ćw. 2 - reakcje w układzie kwas - zasada SPRAWOZDANIE, Chemia ogólna i nieorganiczna
Ćw.3 - odczyn wodnych roztworów soli - sprawozdanie, Chemia ogólna i nieorganiczna
Cw12 Rozdzial przez stracanie, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
Ćw. 5 Rozdział metodą chromatografii bibułowej - sprawozdanie, Chemia ogólna i nieorganiczna
Ćw.4 - roztwory buforowe - sprawozdanie, Chemia ogólna i nieorganiczna
Ćw. 6 - Chromatografia jonowymienna - sprawozdanie, Chemia ogólna i nieorganiczna
Chemia ogolna i nieorg 12 2010
ćw 1 - skala PH SPRAWOZDANIE, Chemia ogólna i nieorganiczna
11 i 12, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Egzamin chemia
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
rownowagi1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
Teoria do I i II gr. anionów, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kati
28, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Egzamin chemia
Chemia ogolna i nieorg 13 2010
więcej podobnych podstron