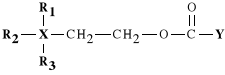Parasympatykomimetyki (parasympatykotoniki, leki cholinergiczne) - s* to takie zwi*zki, które pobudzaj* uk*ad parasympatyczny (przywspó*czulny).
Mediatorem w tym uk*adzie jest acetylocholina. Jest syntetyzowana w zakończeniach neuronów cholinergicznych z choliny, która tworzy si* w w*trobie i przenika do zakończeń nerwów cholinergicznych. Cholina pod wp*ywem acetylo- koenzymu A (CH3-CO-CoA) przy wspó*udziale acetylotransferazy choliny ulega acetylacji (acetylocholina jest wi*c estrem choliny i kwasu octowego).
Otrzymywanie acetylocholiny
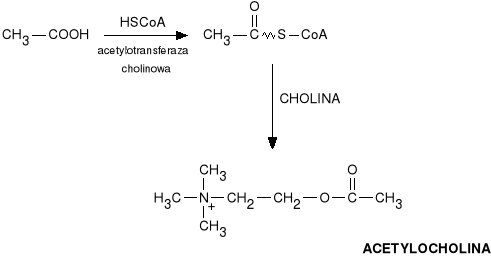
Acetylocholina jest gromadzona i przechowywana w p*cherzykach synaptycznych w postaci kompleksu z ATP i bia*kiem ocharakterze kwasowym - wesikulin*. Pod wp*ywem impulsu kompleksy te zostaj* rozerwane i acetylocholina zostaje uwolniona i **czy si* z receptorami cholinergicznymi.
W uk*adzie parasympatycznym (cholinergicznym) obecne s* dwa typy receptor*w tj.:
* receptory muskarynowe ( receptory M );
* receptory nikotynowe ( receptory N );
Nazwy tych receptor*w zwi*zane s* z nazwami substancji, kt*re wybiórczo pobudzaj* te receptory. Receptory M pobudzane s* przez muskaryn*, natomiast receptory N pobudza nikotyna.
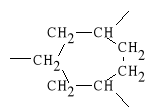
M u s k a r y n a (odleg*o** pomi*dzy tlenem i azotem wynosi 0,44 nm)
|
N i k o t y n a (odleg*o** pomi*dzy azotami wynosi 0,47 nm)
|
W acetylocholinie, w zale*no*ci od konformacji, odleg*o** mi*dzy heteroatomami waha si* od 0,4 nm do 0,7 nm. Oznacza to, *e acetylocholina mo*e pobudza* obydwa typy receptor*w.
RECEPTORY MUSKARYNOWE
Wyr**niamy dwa typy receptor*w muskarynowych:
- receptory M1 - (proteina G0)
- receptory M2 - (proteina Gi)
Podstaw* podzia*u farmakologicznego tych receptor*w jest lek Pirenzepina, kt*ry wybi*rczo blokuje receptor M1 (jest wi*c jego antagonist*, czyli wykazuje w*a*ciwo*ci cholinolityczne w stosunku do receptora M1). Receptory M1 dzielimy na dwa podtypy: M1α i M1β. Analogiczny podzia* istnieje tak*e dla receptor*w M2 - M2α i M2β. Poszczeg*lne podtypy receptor*w M1 oraz M2 r**ni* si* mi*dzy sob* sekwencj* aminokwasow*, lokalizacj*, a tak*e efektem wykonawczym.
|
-agonsta receptora M1 mo*e by* stosowany w chorobie Alzheimera -antagonista receptora M1 mo*e by* stosowany w chorobie wrzodowej *o**dka, a tak*e w chorobie Parkinsona |
|
Pobudzenie receptorów muskarynowych powoduje:
Zwolnienie akcji czynno*ciowej serca poprzez zwolnienie szybko*ci przewodzenia impuls*w w uk*adzie bod*coprzewodz*cym serca;
Niewielkie rozszerzenie naczy* krwiono*nych a w rezultacie nieznaczny spadek ci*nienia krwi;
Wzmo*enie czynno*ci motorycznej i wydzielniczej wskutek skurczu mi**ni g*adkich oskrzeli, przewodu pokarmowego i przewodu moczowego;
Zwi*kszenie czynno*ci wydzielniczej wszystkich gruczo**w;
Zw**enie *renicy i obni*enie ci*nienia *r*dga*kowego;
RECEPTORY NIKOTYNOWE
Acetylocholina jest nie tylko neuromediatorem w zako*czeniach neuron*w uk*adu przywsp**czulnego, ale jest tak*e przeka*nikiem impuls*w na mi**nie poprzecznie pr**kowane (p*ytka motoryczna). Acetylocholina przekazuje tak*e impulsy w synapsach zwoj*w autonomicznych, pobudzaj*c odpowiednie receptory N-cholinergiczne (receptory nikotynowe).
Receptory N s* zlokalizowane w zwojach uk*adu autonomicznego oraz w p*ytkach ruchowych. Receptory nikotynowe zbudowane s* z pi*ciu *a*cuch*w, kt*re sk*adaj* si* z czterech podjednostek: α, β, χ, δ; po**czonych wi*zaniami dwusiarczkowymi ( -s-s- ). Integraln* cz**ci* tego receptora jest kana* sodowy.
Antagonistami receptora N-cholinergicznego w zwojach uk*adu autonomicznego s* leki ganglioplegiczne, natomiast w p*ytce ruchowej antagonist* jest tubokuraryna.
Pobudzenie receptorów muskarynowych powoduje:
Skurcz mi**ni poprzecznie pr**kowanych;
PODZIA* LEKÓW PARASYMPATYKOTONICZNYCH
ZE WZGLĘDU NA MECHANIZM DZIA*ANIA
1). Dzia*aj*ce bezpo*rednio - leki **cz*ce si* z receptorem muskarynowym i posiadaj*ce si** wewn*trzn*, np: Acetylocholina i jej pochodne tj.: Pilocarpina.
2). Dzia*aj*ce po*rednio: leki hamuj*ce acetylocholinoesteraz*, tzw. inhibitory acetylocholinoesterazy (enzym ten powoduje rozk*ad acetylocholiny na cholin* i kwas octowy, a gdy jest on zablokowany to wzrasta st**enie acetylocholiny w przestrzeni synaptycznej, przez co wyd*u*one zostaje jej dzia*anie); leki te podra*niaj* te*, w mniejszym lub wi*kszym stopniu, zwoje autonomiczne i receptory zlokalizowane w mi**niach poprzecznie pr**kowanych - efekt dzia*ania nikotynowego.
Acetylocholina
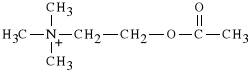
ester choliny i kwasu octowego
Leki b*d*ce wodorotlenkiem, chlorkiem lub bromkiem acetylocholiny stosowano w postaci iniekcji. Musz* by* przygotowane bezpo*rednio przed podaniem, poniewa* bardzo szybko ulega*y rozk*adowi.
Z A L E Ż N O Ś C I M I Ę D Z Y B U D O W Ą
A D Z I A * A N I E M L E K Ó W
|
Budowa pochodnych acetylocholiny |
|
W szkielecie acetylocholiny wyr**ni* mo*na dwa zasadnicze centra:
-centrum kationowe - zlokalizowane przy czwartorz*dowym atomie azotu;
-centrum estrowe;
Lek dzia*a najkorzystniej, je*eli dwa centra s* oddalone od siebie *a*cuchem zawieraj*cym dwa atomy w*gla. Je*eli *a*cuch ten zostanie wyd*u*ony lub skrócony, to lek wykazuje s*absze dzia*anie parasympatykotoniczne.
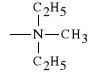
Warunkiem koniecznym aby lek wykazywa* dzia*anie parasympatykotonicznie jest to, *eby w centrum kationowym obecne by*y co najmniej dwie grupy metylowe (CH3-). Zast*pienie grupy metylowej atomem wodoru lub grup* etylow* (C2H5-) powoduje drastyczny spadek dzia*ania parasympatykotonicznego. Na si** dzia*ania leku wp*ywa tak*e atom stanowi*cy centrum kationowe:
|
R1 |
R2 |
R3 |
X |
Ach |
|
|
-CH3 -CH3 -CH3 -C2H5 -CH3 -CH3 |
-CH3 -CH3 -C2H5 -C2H5 -CH3 -CH3 |
-CH3 -C2H5 -C2H5 -C2H5 -CH3 -CH3 |
N N N N P As |
1 1/3 1/400 1/2000 1/3 1/40 |
|
Na dzia*anie lek*w b*d*cych pochodnymi acetylocholiny wp*ywa nie tylko uk*ad i rodzaj atom*w znajduj*cych si* przy centrum kationowym, ale tak*e uk*ad podstawnik*w przy grupie estrowej. Je*eli np. ugrupowanie kwasowe zostanie zamienione na pochodn* propylow* lub butylow*, to obserwowany b*dzie spadek w*a*ciwo*ci parasympatykotonicznych. Je*eli natomiast podstawione zostan* dwa atomy wodoru w grupie acetylowej acetylocholiny du*ymi ugrupowaniami, zw*aszcza aromatycznymi lub cykloalkilowymi (np. benzen, cykloheksan), to wywo*ane zostanie przeciwne dzia*anie na skutek blokady receptora - dzia*anie cholinolityczne.
Nieodzownym elementem warunkuj*cym licz*ce si* dzia*anie parasympatykotoniczne leku jest po**czenie azotu amoniowego z pi*cioatomowym *a*cuchem (jest to tzw. regu*a pi*ciu atom*w). Przyk*adem mo*e by* tu halogenek pentylotrimetyloamoniowy, kt*ry jest zwi*zkiem r*wnie czynnym, jak odpowiedni ester.
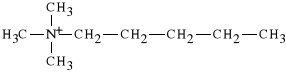
halogenek pentylotrimetyloamoniowy
Bardzo korzystne jest zast*pienie w acetylocholinie grupy acetylowej reszt* kwasu karbaminowego (utworzenie estr*w kwasu karbaminowego). Taka modyfikacja wp*ywa korzystnie, poniewa* zmniejsza wra*liwo** lek*w na hydroliz* enzymatyczn* (leki takie mog* by* stosowane doustnie w przeciwie*stwie do acetylocholiny, kt*r* mo*na podawa* tylko w iniekcji). Poza tym estry choliny i kwasu karbaminowego wykazuj* os*abione dzia*anie muskarynowe na uk*ad sercowo-naczyniowy, natomiast silniej dzia*aj* w stosunku do narz*d*w wewn*trznych, przy czym to wzmocnione dzia*anie jest szczeg*lnie widoczne w przypadku *o**dka, jelit, oraz p*cherza moczowego.
Leki z tej grupy s* stosowane w atonii przewodu pokarmowego i p*cherza moczowego, a tak*e w okulistyce w leczeniu jaskry (zmniejszaj* ci*nienie *r*dga*kowe).
ad. 1. Leki dzia*aj*ce bezpo*rednio:
a. estry choliny:
Carbacholi chloridum (synonim: Carbachol, Isopto Carbachol)
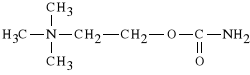
chlorek karbamoilocholiny
Lek ten ma wiele zalet - jest odporny na enzymy hydrolityczne (mo*e by* stosowany doustnie), nie powoduje widocznych efekt*w sercowo-naczyniowych, wykazuje dzia*anie muskarynowe w odniesieniu do *renicy oka - obni*a ci*nienie *r*dga*kowe, jest wi*c stosowany w leczeniu jaskry (w przypadku ma*ej skuteczno*ci Pilocarpiny). Poza tym jest stosowany przy atonii mi**ni g*adkich przewodu pokarmowego. Jest tak*e u*yteczny w badaniu krzywej dobowej ci*nienia *r*dga*kowego. Carbachol jest lekiem maj*cym d*ugi okres dzia*ania ok. 8h.
b. zwi*zki heterocykliczne:
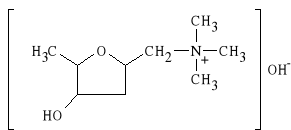
Pilocarpini hydrochloridum
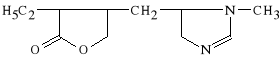
chlorowodorek 3-etylo-4-(1-metylo-5-imidazolilo-metylo)-2-tetrahydrofuranu
Jest to alkaloid wyst*puj*cy w li*ciach krzewu Pilocarpus jaborandi. Lek ten ma dzia*anie muskarynowe acetylocholiny. Dzia*a do** d*ugotrwale; pobudza czynno** wydzielnicz* gruczo*ów, zw*aszcza *linianek, a tak*e gruczo*ów potowych. Wywo*uje skurcz zwieracza *renicy, efektem czego jest spadek ci*nienia *ródga*kowego oka. Jest podawany w przypadku zatrucia atropin* (jest antagonist* atropiny).
ad. 2. Leki dzia*aj*ce po*rednio:
Po*rednio opó*niaj* hydroliz* acetylocholiny. Hydroliza acetylocholiny przez acetylocholinoesteraz* odbywa si* przy udziale centrum aktywnego obecnego w tym enzymie. Acetylocholinoesteraza zawiera 48 centrów aktywnych. Ka*de z nich posiada dwa zaczepy:
* zaczep anionowy;
* zaczep estrowy.
Zaczep anionowy stanowi tryptofan, który cechuje si* wysokim stopniem aromatyczno*ci. Jest to uk*ad bogaty w elektrony, co umo*liwia ich przeniesienie na elektrododatni atom azotu wyst*puj*cy w lekach posiadaj*cych czwartorz*dow* grup* amoniow*.
Zaczep estrowy zbudowany jest z trzech aminokwasów, które tworz* tzw. triad*. Tymi aminokwasami s*: kwas glutaminowy, histydyna, seryna.
Etapy hydrolizy acetylocholiny:
1). Polaryzacja wi*zania karbonylowego w acetylocholinie - *adunek dodatni zostaje przeniesiony na w*giel. Polaryzacja zachodzi pod wp*ywem histydyny. Powstaje acetyloenzym i cholina;
2). Acetyloenzym ulega hydrolizie i tworzy si* acetylocholinoesteraza (ACHE) i kwas octowy.
Proces ten trwa bardzo krótko (mikrosekundy). Podobny przebieg reakcji zachodzi z inhibitorami acetylocholinoesterazy, ale proces acylowania tymi enzymami jest znacznie trwalszy. Hydroliza mo*e przebiega* kilka minut, godzin, a nawet dni.
Ten zró*nicowany czas dzia*ania inhibitorów sta* si* podstaw* podzia*u inhibitorów na:
1). Inhibitory o dzia*aniu odwracalnym:
a. naturalne i syntetyczne metylouretany - karbaminiany;
b. bis-czwartorz*dowe zwi*zki amoniowe;
c. inne;
2). Inhibitory o dzia*aniu nieodwracalnym:
a. zwi*zki fosforoorganiczne;
ad. 1. Inhibitory o dzia*aniu odwracalnym:
a. naturalne i syntetyczne metylouretany - karbaminiany:
Zawieraj* trzecio- i czwartorz*dow* grup* amoniow*. Przy pomocy tej grupy **cz* si* z centrum anionowym enzymu. Ugrupowanie karbaminianowe wi**e si* z zaczepem estrowym acetylocholiny.
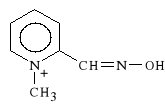
Physostigmini salicylas
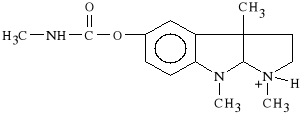
salicylan metylokarbaminianu eseroliny
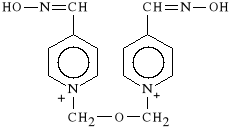
W stanie naturalnym wyst*puje w nasionach Physostigma venenosum. Jest to pochodna eseroliny. Jest to najstarszy z inhibitorów ACHE, po*rednio dzia*aj*cy sympatykotonicznie. Powoduje zw**enie *renic (jest antagonist* atropiny). Jest to lek nietrwa*y, ulega rozk*adowi w roztworach wodnych i na *wietle. Dawka *miertelna wynosi 10 mg.
Neostigmini methysulfas
(prep. Polstigminum - Polfa)
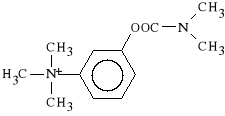
metylosiarczan dimetylokarbaminianu m-hydroksy-fenylo-N,N,N-trimetylo-
-amoniowego
Hamuje aktywno** ACHE, pot*guj*c muskarynowe i nikotynowe dzia*anie acetylocholiny. Dzia*a mniej toksycznie ni* Physostigmini salicylas. Stosowany w diagnostyce i leczeniu ci**kiego niedow*adu mi**ni (myasthemia gravis), w leczeniu jaskry, w zatruciach lekami zwiotczaj*cymi, a tak*e w pooperacyjnej atonii jelit i p*cherza moczowego.
Pyridostigmini bromidum (synonim: Mestinon)
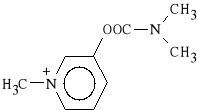
bromek dimetylokarbaminianu 3-hydroksy-1-metylopirydyny
Jest inhibitorem ACHE, stosowanym w niedow*adzie mi**ni, atonii jelit, w zatruciach zwi*zkami zwiotczaj*cymi. Nie jest lekiem pierwszego wyboru, poniewa* dzia*a zbyt wolno i ma*o energicznie.
b. bis-czwartorz*dowe zwi*zki amoniowe:
Nale** do odwracalnych inhibitorów ACHE. Reaguj* z zaczepem anionowym enzymu, hamuj*c kompetycyjnie ACHE.
Distigmini bromidum (synonim: Ubretid)
Stosowany w niedow*adzie mi**ni jako lek wspomagaj*cy, w pooperacyjnej atonii jelit i p*cherza moczowego.
Ambenoni chloridum (synonim: Mytelase)
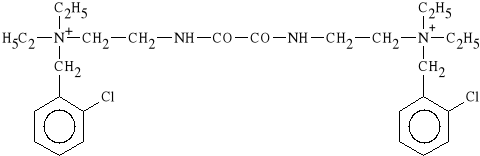
dichlorek oksamido-N,N`-bis-(etylo-N,N-dietylo-2-chlorobenzylo)-amoniowy
Lek hamuje odwracalnie aktywno** ACHE. Dzia*a dziesi** razy silniej i d*u*ej ni* neostygmina. Stosowany w pooperacyjnej atonii jelit i p*cherza moczowego oraz w niedow*adzie mi**ni.
c. inne:
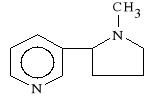
Galantamini hydrobromidum (synonim: Nivalin)
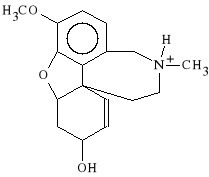
bromowodorek 4a,5,9,10,11,12-heksahydro-3-metoksy-11-metylo-6H-benzenofuro-[3a,3,2ef] [2]-benzazepin-6-ol
Lek dzia*a parasympatykotonicznie, podobnie do neostygminy, odwracalnie blokuj*c ACHE. Odwraca dzia*anie o*rodkowe leków parasympatykolitycznych. Stosowany w chorobach mi**ni, niedow*adzie mi**ni i pora*eniu nerwów.
ad. 2. Inhibitory o dzia*aniu nieodwracalnym:
a. zwi*zki fosforoorganiczne:
Estry kwasu ortofosforowego tworz* trwa*e kompleksy z hydrolaz* acetylocholiny. Zwi*zki te trwale fosforyluj* cz*** estrow* enzymu. S* one u*ywane g*ównie jako zwi*zki owadobójcze (pestycydy).
Zwi*zki te powoduj* *atwe do rozpoznania objawy zewn*trzne oraz wp*ywaj* na czynno** wi*kszo*ci narz*dów. Powoduj* zw**enie *renic, *zawienie, *linienie i pocenie si*. Towarzysz* temu dr*enia mi**niowe, duszno*ci oraz zaburzenie czynno*ci oddechowej. Ponadto obserwowany jest znaczny spadek ci*nienia krwi, zw**enie oskrzeli, zwolnienie czynno*ci serca, nasilenie perystaltyki jelit. Wyst*puje tak*e znaczny wp*yw na o*rodkowy uk*ad nerwowy - uczucie l*ku, niepokój, drgawki.
W zatruciach zwi*zkami fosforoorganicznymi stosuje si* atropin*, która znosi objawy pobudzenia receptora M. Obok atropiny podaje si* tak*e tzw. reaktywatory hydrolazy acetylocholiny. Maj* one powinowactwo do cz**ci anionowej enzymu. Po**czenia reaktywatorów z estrami ulegaj* odszczepieniu od hydrolazy i w ten sposób nast*puje uwolnienie enzymu. Najcz**ciej stosowanymi reaktywatorami s*: Pralidoksym oraz Obidoksym.
PRALIDOXIM (2-PAM)
|
jodek N-metylo-2-[(hydroksyimino)-metylo]-pirydyniowy |
OBIDOXIM CHLORIDE (TOXOGONIN)
|
dichlorek N,N`-oksydimetylo-1,3-bis- (4-hydroksyiminometylo)-pirydyny |
Parasympatykolityki (cholinolityki) - s* to takie zwi*zki, które blokuj* konkurencyjnie muskarynowe receptory cholinergiczne, w wyniku czego nast*puje wy**czenie uk*adu parasympatycznego. To z kolei powoduje:
Rozkurcz *renic, *wiat*owstr*t, dalekowzroczno** i pora*enie akomodacji.
Wzrost ci*nienia *ródga*kowego.
Hamowanie wydzielania *ez, *liny, potu, soku *o**dkowego i *ó*ci.
Rozkurcz oskrzeli.
Zwiotczenie mi**ni g*adkich przewodu pokarmowego, p*cherza *ó*ciowego oraz *o**dka.
Zwiotczenie mi**ni g*adkich uk*adu moczowego.
Tachykardia - tak jak po adrenalinie (efekt hamowania nerwu b**dnego).
Skurcz naczyń krwiono*nych jako nast*pstwo dominacji uk*adu adrenergicznego przy zablokowanym uk*adzie parasympatycznym.
Nasilenie procesów przemiany materii i energii.
Zastosowanie leków parasympatolitycznych:
Stany skurczowe oskrzeli.
Stany skurczowe uk*adu trawiennego, dróg moczowych i *ó*ciowych.
Choroba wrzodowa *o**dka i dwunastnicy.
Diagnostyka chorób oczu.
Zahamowanie nadmiernej sekrecji *ez, *liny, soku *o**dkowego itd.
Zatrucia parasympatykomimetykami.
Choroba Parkinsona.
Przeciwskazania:
Leki z tej grupy nie powinny by* podawane pacjentom z jaskr*, atoni* przewodu pokarmowego, chorob* niedokrwienn* serca, tachykardi*, nadci*nieniem oraz osobom prowadz*cym pojazdy mechaniczne.
__________________________________
|
Rodnik anionowy |
Mostek karboksylowy |
*ańcuch w*glowy |
Cz*** zasadowa |
Wzór ogólny |
R- |
-COO- |
-CH2-CH2- |
-N+(CH3)3 |
Acetylocholina |
CH3- |
-COO- |
-CH2-CH2- |
-N+(CH3)3 |
Oxyphenonium |
|
-COO- |
-CH2-CH2- |
|
Atropina |
|
-COO- |
|
|
W budowie lek*w nale**cych do grupy parasympatykolityk*w na szczeg*ln* uwag* zas*uguje du*a r**norodnos* podstawnika -R znajduj*cego si* przy grupie estrowej. Dla pojawienia si* dzia*ania blokuj*cego receptory muskarynowe konieczna jest obecno** du*ych podsawnik*w przy ugrupowaniu estrowym. Je*eli tymi podstawnikami s* ugrupowania aromatyczne, to dochodzi zazwyczaj do silniejszego wi*zania si* leku z receptorem (jest to mo*liwe dzi*ki obecno*ci zdelokalizowanych elektron*w w pier*cieniu aromatycznym). Poza tym du*e podstawniki os*aniaj* receptor, uniemo*liwiaj*c kontakt acetylocholiny z receptorem. Si*a wi*zania leku z receptorem mo*e by* wydatnie zwi*kszona poprzez wprowadzenie grupy hydroksylowej do ugrupowania **cz*cego uk*ad pier*cieniowy z grup* estrow*. Wzrost si*y dzia*ania w tym przypadku t*umaczy si* mo*liwo*ci* utworzenia dodatkowego wi*zania wodorowego mi*dzy grup* hydroksylow* a receptorem. Je*eli w leku znajduje si* asymetryczny atom w*gla, to enancjomer lewoskr*tny dzia*a obwodowo i o*rodkowo dwa razy silniej ni* racemat.
PODZIA* LEKÓW PARASYMPATOLITYCZNYCH
POD WZGLĘDEM CHEMICZNYM
1). Naturalne i pó*syntetyczne estry tropiny - atropina i jej pochodne oraz syntetyczne analogi;
2). Naturalne i pó*syntetyczne estry skopiny;
3). Zwi*zki syntetyczne o dzia*aniu atropinopodobnym - dzia*aj* obwodowo i nie wykazuj* dzia*ania na o*rodkowy uk*ad nerwowy.
ad.1. Naturalne i pó*syntetyczne estry tropiny - atropina i jej pochodne:
Tropina |
|
Pseudotropina |
|
Atropina - alkaloid wyst*puj*cy w rodzinie Solanaceae - psiankowate. Jest to ester tropiny i kwasu tropowego, w którym grupa hydroksylowa jest po*o*ona w pozycji trans w stosunku do grupy metyloaminowej. W pseudotropinie grupa metyloaminowa i hydroksylowa u*o*one s* w pozycji cis. Tropina i kwas tropowy tworz* aktywny ester, a pseudotropina z kwasem tropowym tworzy ester ma*o aktywny. W atropinie wyst*puje racemiczny kwas tropowy.
Atropini sulfas
ester tropiny i kwasu tropowego
Wyst*puje w:
- Belladonnae folium;
- Belladonnae tincturae;
- Belladonnae extractum;
* usuwa bolesne skurcze;
* spowalnia perystaltyk* jelit;
* rozszerza *renic* oka;
* dzia*a o*rodkowo, powoduj*c pobudzenie ruchowe;
Stwierdzono, *e uczwartorz*dowienie azotu zwi*ksza dzia*anie parasympatykolityczne i znosi dzia*anie o*rodkowe. Odmetylowanie atropiny powoduje 10-krotny spadek jej aktywno*ci. Preparaty z*o*one:
SPASTIKOL (czopki): suchy wyci*g z li*ci pokrzyku; chlorowodorek papaweryny; olej kakaowy;
BELLADRINAL (tabletki): suchy wyci*g z li*ci pokrzyku; chlorowodorek efedryny; kofeina; teofilina;
BELLERGOT (dra*etki): zespó* alkaloidów pokrzyku; winian ergotaminy; fenobarbital; → lek stosowany pomocniczo w bólach g*owy oraz w nerwicach narz*dowych.
Azotan N-metyloatropiny
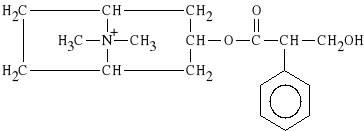
Wykazuje wy**cznie dzia*anie obwodowe. Blokuje receptory muskarynowe silniej od atropiny. Preparatem z*o*onym jest TOLARGIN (czopki), zawieraj*cy azotan N-metyloatropiny, chlorowodorek papaweryny oraz pyralgin*. Stosuje si* go w kamicy nerkowej, w stanach skurczowych w obr*bie jamy brzucha oraz w chorobie wrzodowej *o**dka.
Ipratropii bromidum (synonim: Atrovent)
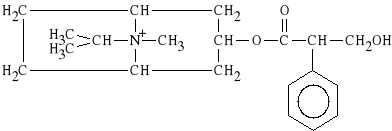
bromek N-izopropyloatropiny
Wykazuje silne dzia*anie spazmolityczne, muskarynowe na mi**nie oskrzeli. St*d znalaz* zastosowanie w duszno*ciach, w skurczach oskrzeli, w dychawicy oskrzelowej. Preparatem z*o*onym jest BERODUAL, zawieraj*cy bromek N-izopropyloatropiny oraz bromowodorek fenoterolu.
Homatropini hydrobromidum
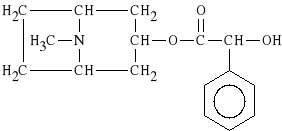
bromowodorek estru tropiny i kwasu migda*owego
Znalaz* zastosowanie g*ównie w okulistyce w diagnostyce chorób oczu.
Tropenzilini bromidum
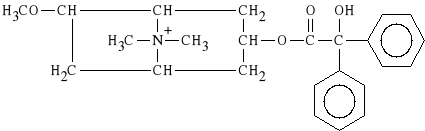
bromek 3-[(difenylo-hydroksy-acetylo)-oksy]-6-metoksy-N-metyloatropiny
Dzia*a spazmolitycznie na narz*dy w jamie brzusznej. Znalaz* zastosowanie w leczeniu kamicy *ó*ciowej. Preparatem z*o*onym jest PALEROL (dra*etki), w sk*ad którego wchodz*: bromek tropenzyliny oraz jab*czan piperylonu.
ad. 2. Naturalne i pó*syntetyczne estry skopiny:
Hyoscini hydrobromidum (synonim: Scopolaminum hydrobromicum)
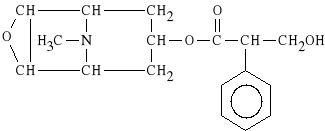
ester skopiny i kwasu tropowego
Dzia*a o*rodkowo na kor* mózgow* i o*rodki podkorowe. Wykazuje w*a*ciwo*ci narkotyczne. Powoduje rozszerzenie *renic, dzia*a p/wymiotnie. Jest podawany przed narkoz*. Preparat z*o*ony - SCOPHEDA (mite i forte), zawiera bromowodorek hioscyny, chlorowodorek oksykodonu oraz chlorowodorek efedryny.
Hyoscini butylbromidum (synonim: Scopolan, Buscolysin)
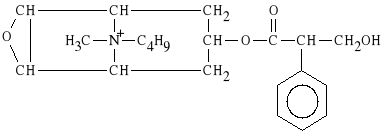
bromek estru N-n-butyloskopiny i kwasu tropowego
Jest to lek o dzia*aniu obwodowym, stosowany w chorobie wrzodowej *o**dka. Hamuje skurcze i perystaltyk* jelit. Stosowany jest tak*e w stanach skurczowych woreczka *ó*ciowego. Nie wykazuje dzia*ania o*rodkowego. Preparatem z*o*onym jest SCOPOLAN, zawieraj*cy: bromek N-butyloscopolaminy oraz pyralgin*.
ad. 3. Zwi*zki syntetyczne o dzia*aniu atropinopodobnym:
Adiphenini hydrochloridum (synonim: Vegantin)
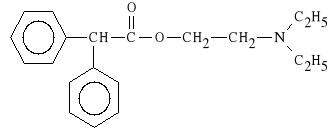
chlorowodorek estru β-dietylo-amino-etylowego kwasu difenylooctowego
Wykazuje dzia*anie parasympatykolityczne na mi**nie g*adkie, s*absze od atropiny. Stosowany jest w bolesnych skurczach, przy kamicy nerkowej, chorobie wrzodowej *o**dka i dwunastnicy. Preparatem z*o*onym jest: VEGANTALGIN, zawieraj*cy: chlorowodorek adyfeniny, allobarbital i aminofenazon.
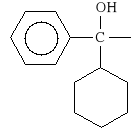
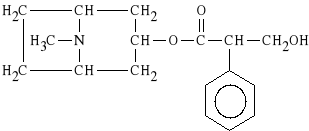
Oxyphenoni bromidum (synonim: Spasmophen, Spasmophen Duplex)
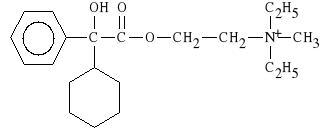
bromek 2-[(cykloheksylo-fenylo-hydroksyacetylo)-oksy]-N,N-dietylo-N-metyloetyloamoniowy
Wykazuje dzia*anie parasympatykolityczne, rozkurczaj*ce. Lekiem z*o*onym jest SPAZMOBAMAT, zawieraj*cy: spazmophen i meprobamat (lek p/l*kowy). Stosowany w zaburzeniach czynno*ciowych dróg *ó*ciowych.
Oxyphencyclimini hydrochloridum (synonim: Daricon, Daritan)
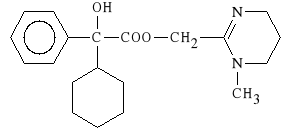
chlorowodorek estru 1,4,5,6-tetrahydro-1-metylo-2-pirymidynylometylowego
kwasu α-cykloheksylo-α-hydroksy-fenylooctowego
Lek dzia*a do 12 godzin. Stosowany jest objawowo w leczeniu choroby wrzodowej *o**dka. Preparatami z*o*onymi s*:
DARICON - chlorowodorek oxyfencykliminy i fenobarbital;
DARITAN - chlorowodorek oxyfencykliminy i meprobamat;
Denaverini hydrochloridum (synonim: Spasmalgon)
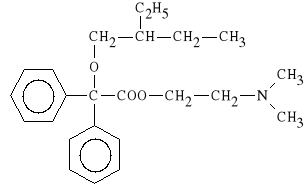
ester 2-(dimetyloamino)-etylowy
kwasu α-(2-etylobutyloksy)-α,α-difenylooctowego
Spazmolityk dzia*aj*cy bezpo*rednio na mi**nie g*adkie. Powoduje wzrost st**enia cAMP, poprzez hamowanie aktywno*ci enzymatycznej fosfodiesterazy. Jest lekiem stosowanym w chorobie wrzodowej *o**dka i dwunastnicy. Wykazuje dzia*anie atropinowe i papawerynowe.
Oxybutynini hydrochloridum (synonim: Ditropan)
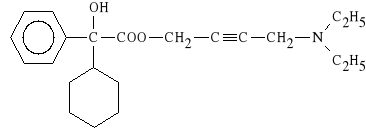
chlorowodorek estru 4-dietyloamino-2-butynylowego
kwasu α-fenylocykloheksyloglikolowego
Lek stosowany w urologii jako p/skurczowy. Wykazuje dzia*anie atropinowe i papawerynowe. U*ywany w diagnostyce i leczeniu stanów skurczowych p*cherza moczowego.
Cyclopentolati hydrochloridum (synonim: Oftan-Syklo)
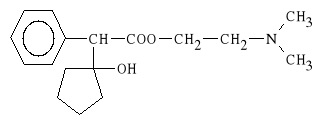
chlorowodorek estru 2-dimetyloaminoetylowego
kwasu α-(1-hydroksycyklopentylo)-fenylooctowego
Lek powoduje rozszerzenie *renic oczu. Dzia*a szybciej i krócej od atropiny. Jest stosowany w okulistyce, w stanach zapalnych t*czówki i rogówki. Zapobiega tak*e zrostom t*czówki.
Tropicamidum (synonim: Mydriacyl)
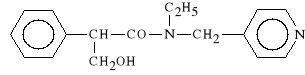
N-(4-pirydynylometylo)-N-etylo-2-fenylo-3-hydroksy-propionamid
Dzia*a jak leki dotychczas omówione. Znalaz* zastosowanie w okulistyce - diagnostyka dna oka, a tak*e jako *rodek stosowany przed zabiegami okulistycznymi.
Leki inne:
Pirenzepini hydrochloridum (synonim: Pirengast, Gastrozepin)
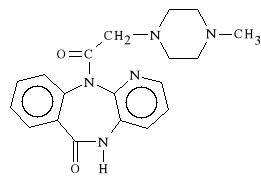
chlorowodorek 5,11-dihydro-11-[(4-metylo-1-piperazynylo)-acetylo]-6H-pirydo-[2,3-b] [1,4] benzodiazepin-6-on
Wykazuje selektywne dzia*anie na receptor M1 wyst*puj*cy w *o**dku i dwunastnicy. Lek ten powoduje tym samym spadek wydzielania soku *o**dkowego o ok. 80 %, nie wp*ywaj*c przy tym na motoryk* jelit. Stosuje si* go w chorobie wrzodowej *o**dka, dwunastnicy oraz w polekowych zaburzeniach pracy *o**dka. Jest stosowany tak*e jako *rodek p/wymiotny.
LEKI ZWIOTCZAJĄCE MIĘŚNIE SZKIELETOWE
(POPRZECZNIE PRĄŻKOWANE)
PODZIA* LEKÓW ZWIOTCZAJĄCYCH
MIĘŚNIE SZKIELETOWE
1. Leki dzia*aj*ce obwodowo - leki kuraryzuj*ce.
2. Leki dzia*aj*ce o*rodkowo o rdzeniowym i pozardzeniowym mechani*mie dzia*ania.
3. Leki dzia*aj*ce bezpo*rednio na komórki mi**niowe.
ad. 1. Leki dzia*aj*ce obwodowo - leki kuraryzuj*ce:
Ś R O D K I K U R A R Y Z U J Ą C E
Środki kuraryzuj*ce s* stosowane pomocniczo w chirurgii. Ich podanie sprawia, *e nie jest konieczne podanie pe*nej dawki *rodka znieczulaj*cego. Ponadto stosuje si* je w laryngologii, ortopedii, przy zatruciu strychnin* oraz w t**cu.
Środki kuraryzuj*ce podaje si* pozajelitowo, gdy* nie wch*aniaj* si* z przewodu pokarmowego. Nale*y uwa*a*, gdy* s* to tak*e silne trucizny. Podanie du*ej dawki mo*e spowodowa* pora*enie mi**ni oddechowych.
A. kuraryny (leki wywo*uj*ce blok polaryzacyjny):
a. pochodne izochinoliny:
Tubocurarini chloridum (synonim: Tubarin, Tubocurarin)
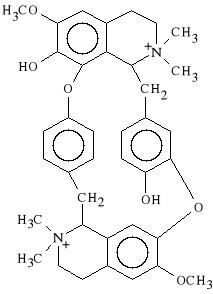
Jest to lek wyodr*bniony z Hondrodendron tormentosum. Aktywne s* tylko izomery (+). Lek s*u*y do zwiotczania mi**ni szkieletowych, pora*a zwoje uk*adu autonomicznego. Po za*yciu mog* wyst*pi* skutki uboczne, w postaci uwalniania histaminy co z kolei prowadzi do skurczu oskrzeli, zapa*ci itp.
Atracurii besilas
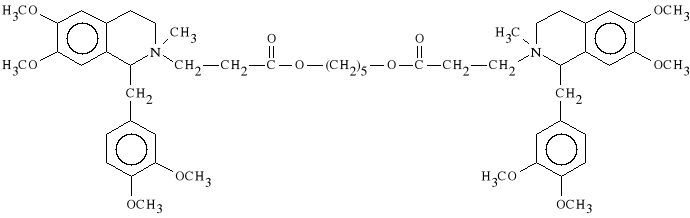
dibenzenosulfonian 2,2`-[3,3`-(pentametylenodioksy)-bis-(1-oksopropylo)]-bis-
-(1,2,3,4-tetrahydro-6,7-dimetoksy)-1-(3,4-dimetoksybenzylo)-
-2-metyloizochinolinowy
Dzia*a podobnie jak tubokuraryna. Jest stosowany przy znieczuleniu ogólnym. Mo*na go podawa* pacjentom z chorobami nerek i w*troby, gdy* lek ten jest ca*kowicie metabolizowany w osoczu krwi.
b. pochodne indolowe:
Alcuronii chloridum (synonim: Alloferin)
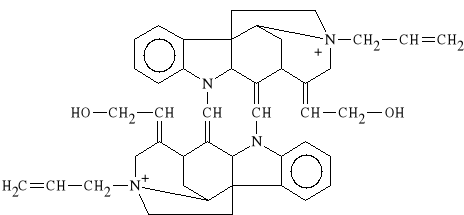
dichlorek N,N`-diallilonortoksyferyniowy
Lek stosowany w celu zniesienia napi*cia mi**niowego w zabiegach chirurgicznych. Dzia*a silnie.
c. pochodne androstandiolu-3,17:
Pancuronii bromidum (synonim: Pancuronium, Pavulon)
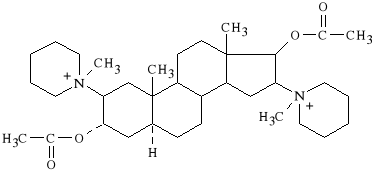
dibromek 1,1-(3α,17β-diacetoksy-5α-androstan-2β,16β-ylo)-
-bis-(1-metylopiperydyniowy)
Jest to lek silnie dzia*aj*cy tubokurarynopodobnie. Czas dzia*ania leku od 30 do 40 minut. Nie wykazuje on dzia*ania steroidowego. Ma s*aby wp*yw na uk*ad sercowo-naczyniowy, nieznacznie zwi*ksza ci*nienie t*tnicze i szybko** t*tna. Wykazuje niewielkie w*a*ciwo*ci histaminotw*rcze.
Lek stosowany jest w anestezjologii w celu zwiotczenia mi**ni szkieletowych, w chirurgii oka, w po*o*nictwie przy cesarskim ci*ciu.
Pipercuronii bromidum (synonim: Arduan)
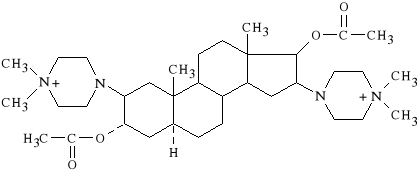
dibromek 1,1-(3α,17β-diacetoksy-5α-androstan-2β,16β-ylo)-
-bis-(4,4-dimetylopiperazyniowy)
Lek dzia*a kompetycyjnie na receptor cholinergiczny p*ytki motorycznej, powoduj*c blok nerwowo-mi**niowy. Nie wp*ywa istotnie na u*ad kr**enia, rzadko powoduje uwalnianie histaminy. Dzia*a silniej i d*u*ej ni* Pancuronium (45-120 min).
Stosowany w celu zwiotczenia mi**ni podczas d*ugotrwa*ych zabieg*w chirurgicznych; nie jest polecany przy cesarskim ci*ciu (zbyt d*ugi czas dzia*ania).
Vecuronii bromidum (synonim: Norcuron)
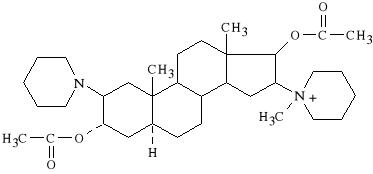
bromek 1-(3α,17β-diacetoksy-2β-piperydylo-5α-androstan-16β-ylo)-
-1-metylopiperydyniowy
Lek wywo*uje blok polaryzacyjny p*ytki motorycznej. Stosowany jest do zwiotczania mi**ni podczas znieczule* w zabiegach chirurgicznych. Dzia*a silniej i kr*cej ni* Pancuronium.
B. pseudokuraryny (leki wywo*uj*ce blok depolaryzacyjny):
Suxamethonii chloridum (synonim: Chlorsuccillin)
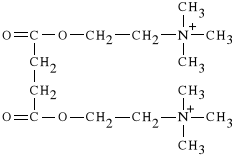
dichlorek N,N-[2,2-(sukcynylodioksy)-dietylo]-bis-trimetyloamoniowy
Lek ten zosta* po raz pierwszy zastosowany w roku 1951. Jest to *rodek zwiotczaj*cy mi**nie szkieletowe o bardzo kr*tkim czasie dzia*ania. Ponadto powoduje wzrost ci*nienia *r*dga*kowego i *r*dczaszkowego, dzia*aj*c na zwoje wsp**czulne mo*e przy*piesza* akcj* serca i powodowa* wzrost ci*nienia krwi. Ulega rozk*adowi pod wp*ywem acetylocholinoesterazy. Rozpad ten przebiega w dw*ch etapach:
- w pierwszym etapie tworzy si* sukcynylomonocholina (ten etap przebiega bardzo szybko);
- w drugim etapie tworzy si* kwas bursztynowy i cholina (ten etap zachodzi sze** razy wolniej ni* etap pierwszy).
Powstaj*cy w pierwszym etapie nietrwa*y intermediat (sukcynylomonocholina) dzia*a oko*o dwadzie*cia razy s*abiej ni* Suxamethonium.
Podobnie dzia*a tak*e Dexamethonium, ktory jednak powoduje trwa** depolaryzacj* p*ytki nerwowo-mi**niowej (trwa*e zwiotczenie mi**ni). Brak jest odtrutki na ten lek.
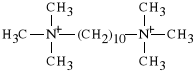
dijodek dekametyleno-bis-trimetyloamoniowy
ad. 2. Leki dzia*aj*ce o*rodkowo:
Mechanizm dzia*ania tych lek*w polega na hamowaniu polisynaptycznych impuls*w nerwowych i pora*eniu interneuron*w rdzeniowych, po*rednicz*cych w przekazywaniu bod*c*w (mechanizm jest wi*c skierowany na o*rodkowy uk*ad nerwowy), w nast*pstwie czego os*abieniu ulega aktywno** neuronu ruchowego i spadek napi*cia mi**niowego. Niekt*re z nich, poza dzia*aniem miorelaksacyjnym, wykazuj* tak*e dzia*anie uspokajaj*ce oraz anksjolityczne.
S* stosowane w skurczach i przykurczach mi**ni szkieletowych wywo*anych przez stany zapalne i urazy, a tak*e w schorzeniach reumatycznych.
PODZIA* LEKÓW ZWIOTCZAJĄCYCH MIĘŚNIE SZKIELETOWE,
O DZIA*ANIU OŚRODKOWYM,
POD WZGLĘDEM CHEMICZNYM
1. Pochodne alkoholi alifatycznych i ich karbaminianów.
2. Pochodne fenylopropanolu (tworz* trzeciorz*dowe aminoalkohole).
3. Pochodne propiofenonu.
4. Pochodne oksazolidynonu.
5. Pochodne kwasu χ-aminomas*owego (GABA).
6. Pochodne benzodiazepiny.
ad. 1. Pochodne alkoholi alifatycznych i ich karbaminianów:
Mephenesin (synonim: Mefenesina, Cresoxydiol)
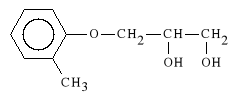
3-(o-toliloksy)-propan-1,2-diol
lub
3-(2-metylofenoksy)-1,2-propanodiol
Mefenezyna zmniejsza napi*cie mi**niowe i dlatego jest u*yteczna w leczeniu stan*w spowodowanych wzmo*onym i bolesnym napi*ciem mi**ni szkieletowych.
Lek stosowany jest przy zatruciu strychnin*, w parkinsoni*mie na tle mia*d*ycowych zmian naczy* m*zgowych, a tak*e w epilepsji.
Mephenesin carbamat
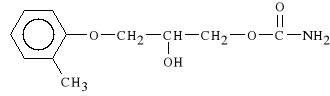
1-karbaminian 3-(2-metylofenoksy)-1,2-propanodiolu
Wprowadzenie ugrupowania karbaminowego spowodowa*o, *e lek dzia*a d*u*ej ni* Mefenesina. Dzia*anie i zastosowanie jak leku omówionego wcze*niej.
Methocarbamolum (synonim: Metocarbamol)
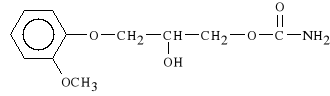
1-karbaminian 3-(o-metoksyfenoksy)-1,2-propanodiolu
Lek stosowany w stanach zwi*zanych z bolesnym, nadmiernym napi*ciem mi**ni szkieletowych na tle pourazowym i zwyrodnieniowym, w stanach spastycznych ko*czyn. Jest u*ywany jako lek pomocniczy w leczeniu t**ca. Wchodzi w sk*ad preparatu z*o*onego MESPEFAN (metocarbamol i kwas acetylosalicylowy), stosowanego przy zwi*kszonym napi*ciu mi**ni w stanach zapalnych.
ad. 2. Pochodne. fenylopropanu:
Phenprobamatum (synonim: Proformiphen)
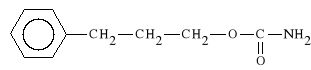
karbaminian 3-fenylo-1-propanolu
Lek wp*ywa zwiotczaj*co na mi**nie szkieletowe, wykazuje dzia*anie przeciwdrgawkowe oraz uspokajaj*ce. Stosowany jest w bolesnych skurczach mi**ni np: szyi, przykurczach pourazowych itp.
Wchodzi w sk*ad leku z*o*onego PFENQUIL P, który zawiera fenprobamat, propylofenazon o dzia*aniu p/gor*czkowym i p/b*lowym, kwas askorbinowy, kofein*)
Pridinoli hydrochloridum (synonim: Pridinol)
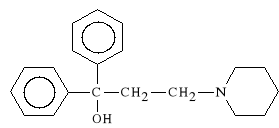
chlorowodorek 1,1-difenylo-3-piperydyno-1-propanolu
Pridinol stosowany jest w postaci chlorowodorku jak i metanosulfonianu (Pridinoli mesylas), przy czym chlorowodorek pridinolu wykazuje silniejsze dzia*anie na o*rodkowy uk*ad nerwowy. Lek wykorzystywany jest w celu obni*enia bolesnego napi*cia mi**niowego, w przygotowaniach do zabieg*w rehabilitacyjnych, w przypadku silnych skurcz*w *ydek. Stosowany jest tak*e w objawowym leczeniu parkinsonizmu (ale wy**cznie w postaci chlorowodorku).
ad. 3. Pochodne propiofenonu:
Tolperisoni hydrochloridum (synonim: Mydocalm)
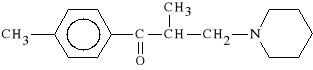
chlorowodorek 2,4-dimetylo-3-piperydynopropiofenonu
Jest to bardzo popularny *rodek w neurologii i reumatologii, stosowany w nadmiernym napi*ciu mi**niowym, w stwardnieniu rozsianym, w leczeniu szcz*ko*cisku po zabiegach stomatologicznych. Korzystnie dzia*a na b*le kr*gos*upa.
ad. 4. Pochodne oksazolidynonu:
Mephenoxalonum (synonim: Moderamin, Dorsiflex)
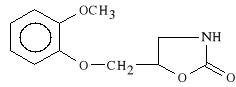
5-[(2-metoksyfenoksy)-metylo]-2-oksazolidynon
Lek dzia*a uspokajaj*co, w wi*kszych dawkach nasennie. Zmniejsza napi*cie mi**ni szkieletowych. Stosowany jest wi*c w stanach niepokoju i napi*cia, w przykurczach mi**ni.
ad. 5. Pochodne kwasu χ-aminomas*owego:
Baclofenum (synonim: Baclofen)
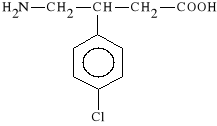
kwas 4-amino-3-(4-chlorofenylo)-mas*owy
Pochodna GABA o silnym p/skurczowym dzia*aniu na mi**nie szkieletowe. Dzia*a na poziomie rdzenia kr*gowego, gdzie hamuje przewodzenie odruch*w mono- i polisynaptycznych poprzez stymulacj* receptor*w GABA-ergicznych. Zmniejsza odruchowe wzmo*one napi*cie ruchowe i *agodzi bolesne przykurcze. Wykazuje tak*e dzia*anie spazmolityczne na mi**nie g*adkie.
*rodek jest stosowany jako relaxans w stanach skurczowych mi**ni szkieletowych pochodzenia rdzeniowego (m.in. w stwardnieniu rozsianym, na tle urazowym i zwyrodnieniowym).
ad. 6. Pochodne benzodiazepiny:
Tetrazepam (synonim: Myolastan)
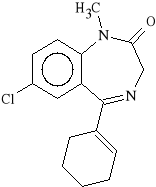
7-chloro-5-(1-cykloheksenylo)-2,3-dihydro-1-metylo-2H-1,4-benzodiazepin-2-on
Lek wykazuje silne dzia*anie zwiotczaj*ce mi**nie szkieletowe, dzia*a te* uspokajaj*co, p/l*kowo i p/drgawkowo. Stosowany jest w pourazowych i pooperacyjnych przykurczach mi**ni, w przykurczach na tle choroby zwyrodnieniowej (b*le krzy*a, grzbietu, barku).
Lek pobudza zesp** receptor*w benzodiazepinowo-GABA-ergiczych rozmieszczonych w tkance m*zgowej. O dzia*aniu farmakologicznym decyduje obecno** atomu chloru w pozycji siedem rodnika fenylowego.
Diazepam (synonim: Relanium, Valium)
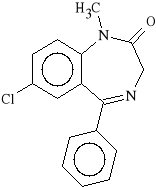
7-chloro-5-fenylo-1-metylo-1,2-dihydro-3H-1,4-benzodiazepin-2-on
Lek dzia*a podobnie jak Tetrazepam, ale silniej zw*aszcza p/drgawkowo, nasennie i miorelaksacyjnie. Jednym z jego metabolit*w jest Oksazepam. Stosowany jest w stanach l*kowych, zaburzeniach psychosomatycznych, w zwalczaniu wzmo*onego napi*cia mi**niowego np. w t**cu.
ad. 3. Leki działające bezpośrednio na komórki mięśniowe:
Bezpośrednio działają na mięśnie gładkie. W efekcie powodują rozkurcz oskrzeli, naczyń krwionośnych, naczyń wieńcowych serca, zwolnienie perystaltyki jelit, rozkurcz pęcherza moczowego i moczowodów, pęcherzyka żółciowego i macicy.
PODZIAŁ SPAZMOLITYKÓW MUSKULOTROPOWYCH
POD WZGLĘDEM CHEMICZNYM
1. Związki nieorganiczne - np.: Natrii Nitris (NaNO2); Natrii Nitroferricyanas Na2[Fe(CN)5 NO];
2. Estry kwasu azotowego - np.: Glyceroli trinitras;
3. Pochodne izochinoliny - np.: Papaverini hydrochloridum;
4. Estry aminoalkoholi i dwupodstawionego kwasu octowego i glikolowego - np.: Adiphenini hydrochloridum;
5. Pochodne pirymidyny - np.: Minoxidilum;
pochodne pirymidynopirymidopirymidyny - np.: Diphyridamolum;
6. Pochodne 7H-puryny (naturalne i półsyntetyczne metyloksantyny) - np.: teofilina, teobromina;
7. Pochodne 9H-puryny - np.: Adenosini triphosphas;
8. Pochodne chinazoliny - np.: Prazosini hydrochloridum;
9. Pochodne pirydyny:
a. pochodne - i -pikoliny;
b. pochodne kwasu nikotynowego;
c. pochodne kwasu 1,4-dihydro-pirydyno-3,5-dikarboksylowego;
10. Pochodne benzodiazepiny - np.: Diltiazemum;
11. Pochodne - i -benzopironu - np.: Carbo;
12. Pochodne kwasu tetrahydrofurano-karboksylowego - np.: Naftydrofuryli dioxalas;
13. Pochodne fenyloetyloaminy i analogi strukturalne - np.: Bencyclani fumaras;
14. Inne:
a. ester kwasu fenyloglikolowego;
b. indolowy alkaloid z Vinca minor;
c. pochodne benzhydrylopiperazyny;
ad. 3. Pochodne izochinoliny:
Papaverini hydrochloridum
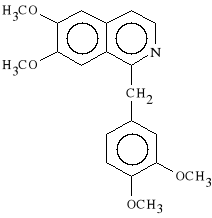
chlorowodorek 6,7-dimetoksy-1-(3,4-dimetoksybenzylo)-izochinoliny
Papaweryna jest alkaloidem wyodrębnionym z torebek maku lekarskiego Papaver somniferum. W opium występuje w ilości 0,5 - 0,8 %. Nie wykazuje charakteru narkotycznego i p/bólowego. W małych dawkach powoduje skurcz mięśni gładkich, w dużych zaś poraża mięśnie poprzecznie prążkowane i mięsień sercowy. Działa p/skurczowo w obrębie dróg żółciowych, przewodu pokarmowego, naczyń krwionośnych i oskrzeli. Preparaty złożone:
- EUCARDIN (papaweryna, aminofilina, fenobarbital, nitrogliceryna);
- ISALGIN (papaweryna, aminofenazon, fenobarbital);
-THEOPAVERIN (papaweryna, teobromina);
-TOLARGIN (papaweryna, metyloazotan atropiny, pyralgin);
Drotaverini hydochloridum (synonim: No-spa)
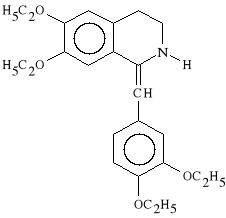
chlorowodorek 6,7-dietoksy-1-(3,4-dietoksybenzylideno)-tetrahydroizochinoliny
Działa silniej i szybciej od papaweryny. Lek ten jest stosowany w kolkach żółciowych, w stanach skurczowych oskrzeli i przewodu pokarmowego.
ad. 4. Estry dwupodstawionego kwasu octowego i glikolowego:
a. Adiphenini hydrochloridum
b. Denaverini hydrochloridum
c. Oxybutynini hydrochloridum
Leki te wykazują działanie atropinowe i papawerynowe. Są spazmolitykami neurotropowymi i muskulotropowymi. Działają bezpośrednio na mięśniówkę gładką pęcherza moczowego. Działanie atropinopodobne skierowane jest na inne mięśnie gładkie. Są stosowane w leczeniu objawowym stanów skurczowych pęcherza moczowego, jak również w diagnostyce chorób związanych z pęcherzem moczowym.
ad. 6. Pochodne 7H-puryny (naturalne i półsyntetyczne metyloksantyny):
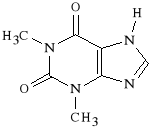
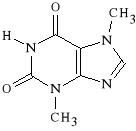
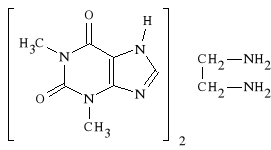
T E O F I L I N A |
T E O B R O M I N A |
|
|
Teofilina i teobromina wykorzystywane są jako spazmolityki muskulotropowe. Teobromina wykazuje silne działanie spazmoliotyczne na naczynia krwionośne, zaś teofilina działa rozszerzająco na mięśnie gładkie oskrzeli.
Mechanizm działania metyloksantyn jest następujący. Zwiększają one stężenie cAMP poprzez hamowanie aktywności fosfodiesterazy. Zwiększają także zewnątrzkomórkowe stężenie adenozyny, poprzez hamowanie jej wychwytu zwrotnego.
Leki te rozszerzają naczynia obwodowe i wieńcowe, przez co zmniejszają obciążenie mechaniczne mięśnia sercowego - działanie kardiotoniczne. Zwiększając pobudliwość i kurczliwość mięśnia sercowego, zwiększają jego zapotrzebowanie na tlen.
Teobromina i teofilina nie rozpuszczają się w wodzie, dlatego nie można stosować ich drogą pozajelitową. Często podaje się je z solubilizatorami - związkami, które zwiększają rozpuszczalność. Należą do nich etylenodiamina, etanoloamina, salicylan sodu, benzoesan sodu. Innym sposobem zwiększenia rozpuszczalności jest wprowadzenie w pozycję 1 teobrominy lub w pozycję 7 teofiliny podstawników hydrofilowych.
P O C H O D N E T E O B R O M I N Y |
|
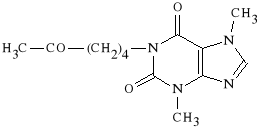
Pentoxifyllinum
3,7-dimetylo-1-(5-oksoheksylo)-ksantyna
Rozszerza naczynia włosowate. Jest stosowany w zaburzeniach krążenia w obrębie kończyn, siatkówki oka i mózgu. Działa p/zakrzepowo; przywraca elastyczność czerwonych krwinek. |
Protheobrominum
1-(2,3-dihydroksypropylo)-teobromina
Lek zawiera podstawnik 2,3-dihydroksypropylowy, co sprawia, że jest rozpuszczalny w wodzie.
|
P O C H O D N E T E O F I L I N Y |
|
Aminophyllinum
połączenie addycyjne teofiliny i etylenodiaminy
Spazmolityk działający na mięśnie gładkie oskrzeli. Jest stosowany w nadciśnieniu, chorobie wieńcowej, obrzękach pochodzenia sercowego i dychawicy oskrzelowej. Pobudza ośrodkowy układ nerwowy. |
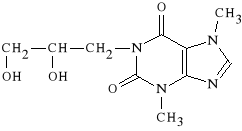
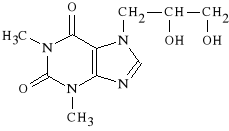
Diprophyllinum
7-(2,3-dihydroksypropylo)-teofilina
Lek rozszerza oskrzela i naczynia krwionośne. Wykazuje działanie moczopędne. Ze względu na obecność ugrupowania polarnego jest rozpuszczalny w wodzie.
|
ad. 7. Pochodne 9H-puryny:
Adenosini triphosphas (synonim: Fosfobion)
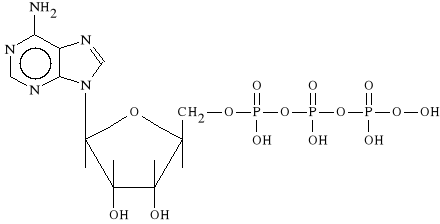
Kwas adenozynotrifosforowy i jego sól sodowa działają spazmolitycznie na mięśnie gładkie obwodowych naczyń krwionośnych i na naczynia wieńcowe. Tym samym obniżają ciśnienie tętnicze. Działają także antyagregacyjnie i wzmagają perystaltykę jelit.
Sama adenozyna powoduje krótkotrwałe (o ok. 150 %) zwiększenie przepływu krwi przez naczynia wieńcowe. Adenozyna w Polsce nie jest stosowana.
ad. 8. Pochodne chinazoliny:
a. Prazosini hydrochloridum
b. Terazosini hydrochloridum
c. Doxazosini hydrochloridum
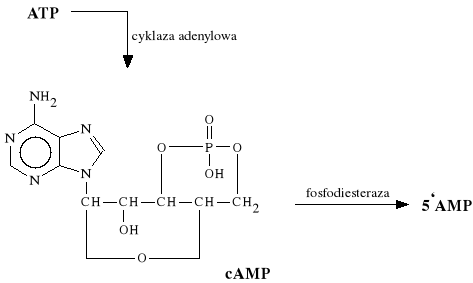
Są to leki zaliczane do 1-adrenolityków. Rozszerzają naczynia krwionośne powodując spadek ciśnienia krwi. Wykazują podwójny mechanizm działania - są spazmolitykami neuro- i muskulotropowymi. Leki te są inhibitorami fosfodiesterazy - enzymu rozkładającego ATP do cAMP - co z kolei prowadzi do zwiotczenia mięśni.
ad. 9. Pochodne pirydyny:
a. pochodne -pikoliny:
Nicotynyli tartras (synonim: Nicotol, Radecol)
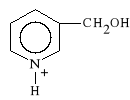
winian 3-hydroksymetylo-pirydyny
Lek rozszerza naczynia mózgowe i wieńcowe. Poprawia ukrwienie tkanek. Stosowany jest w chorobach obwodowych naczyń krwionośnych. Obniża także stężenie cholesterolu.
c. pochodne kwasu nikotynowego:
Xantinoli nicotinas (synonim: Sadamin, Sadamin prolongatum)
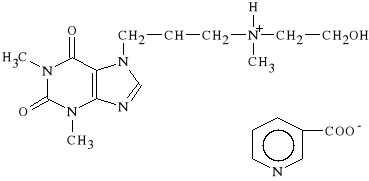
nikotynian 7-[2-hydroksy-3-(2-hydroksyetylo)-metyloamino]-propyloteofiliny
Stosowany w zaburzeniach krążenia obwodowego i mózgowego. Wskutek synergistycznego działania obu składników dochodzi do zmniejszenia napięcia mięśni naczyń krwionośnych mózgu, kończyn i skóry.
Nicametati citras (synonim: Provasan)
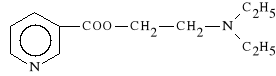
cytrynian estru 2-(dietyloamino)-etylowego kwasu nikotynowego
Jako ester ulega w organiźmie powolnej hydrolizie, w wyniku której uwalniany jest kwas nikotynowy, który działa spazmolitycznie na mięśnie gładkie. Zwiększa przepływ krwi, zwłaszcza w naczyniach mózgowych. W dużych dawkach obniża stężenie cholesterolu i lipidów w surowicy krwi.
Nicofuranosum
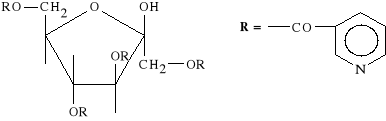
1,3,4,6-tetranikotynian D-fruktofuranozy
Podobnie jak lek poprzedni, wskutek hydrolizy uwalnia kwas nikotynowy. Działa spazmolitycznie na mięśnie gładkie obwodowych naczyń krwionośnych. Stosowany w zaburzeniach krążenia obwodowego oraz w okulistyce w stanach zwyrodnieniowych plamki żółtej siatkówki.
ad. 12. Pochodne kwasu tetrahydrofuranopropionowego:
Naftydrofuryli dioxalas (synonim: Dusodril)
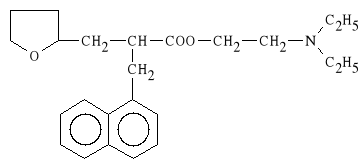
szczawian estru -dietyloaminoetylowego kwasu 2-(1-naftylo)-2-
-tetrahydropurpurylo-propionowego
Lek jest stosowany w takich samych przypadkach jak sole i estry kwasu nikotynowego.
ad. 13. Pochodne fenyloetyloaminy i analogi strukturalne:
Bencyclani fumaras (synonim: Halidor)
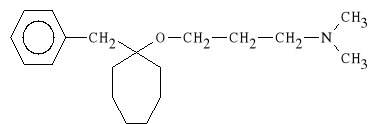
fumaran 3-[(1-benzylocykloheptylo)-oksy]-N,N-dimetylopropyloaminy
Działa spazmolitycznie na mięśnie gładkie dwa razy silniej od papaweryny. Wykazuje ośrodkowe działanie uspokajające; działa miejscowo znieczulająco. Jest stosowany w zaburzeniach krążenia mózgowego i obwodowego, jak również w stanach skurczowych mięśni kończyn i dróg moczowych.
LEKI PORAŻAJĄCE SYNAPSY ZWOJOWE
UKŁADU AUTONOMICZNEGO
(ŚRODKI GANGLIOPLEGICZNE - JADY ZWOJOWE)
Leki te konkuruj* z acetylocholin* w synapsach zwojowych. Dochodzi do zablokowania cholinergicznych receptorów nikotynowych, w synapsach uk*adu wspó*czulnego i przywspó*czulnego. Acetylocholina nie dociera do b*ony postsynaptycznej i nie powstaje impuls - dochodzi do przerwania przewodnictwa. Pora*enie zwojów uniemo*liwia w*drówk* impulsu z cz**ci przedzwojowej do zazwojowej, a tym samym nast*puje wy**czenie narz*dów spod wp*ywu uk*adu autonomicznego. Skutek pora*enia zwojów nie rozk*ada si* równomiernie na oba uk*ady autonomiczne (jeden z nich jest blokowany silniej). I tak w uk*adzie kr**enia dochodzi do parasympatykotonii (efektem jest spadek ci*nienia krwi), a w uk*adzie pokarmowym sympatykotonii (efektem jest spadek motoryki).
Leki te tak*e os*abiaj* czynno** wydzielnicz* gruczo*ów wydzielania zewn*trznego i powoduj* rozkurcz *renicy oka.
ZASTOSOWANIE LEKÓW GANGLIOPLEGICZNYCH
1. Jako leki hipotensyjne.
2. W chirurgii (ale bardzo rzadko) w celu wywo*ania kontrolowanego podci*nienia.
CZWARTORZĘDOWE SOLE BIS-AMONIOWE
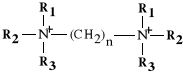
(lek dzia*a najsilniej, gdy n = 5 - 6; lek nie dzia*a, gdy n = 10)
Pentamethonii biiodidum
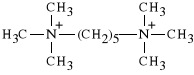
dijodek pentametyleno-1,5-bis-trimetyloamoniowy
Hexamethonii bibromidum
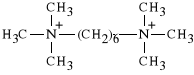
dibromek heksametyleno-1,6-bis-trimetyloamoniowy
Pentoloni tartras
(prep. Ansolysen - Stany Zjednoczone Ameryki Pó*nocnej)
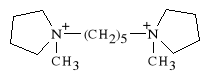
diwinian pentametyleno-1,5-bis-(1`-metylopirolidoniowy)
SOLE TIONIOWE
Trimethaphani camsilas (synonim: Arfonad)
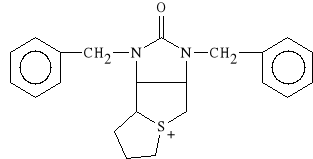
D-kamforosulfonian D-[3,4-(1,3-dibenzylo-2-oksoimidazolidyno)-
-1,2-trimetyleno-tiofaniowy
DRUGO- I TRZECIORZĘDOWE POLIMETYLOAMINY
Mecamylamini hydrochloridum
(prep. Inversine - Stany Zjednoczone Ameryki Pó*nocnej)
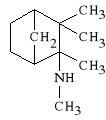
chlorowodorek 3-metyloamino-izokamfanu
Dempidini tartras
(prep. Polorysen - Zjednoczone Królestwo Wielkiej Brytanii i Irlandii P*n.)
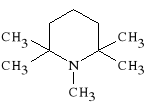
winian 1,2,2,6,6-pentametylenopiperydyniowy
36
Środki zwiotczaj*ce drugiego stopnia
(pseudokuraryny)
Wywo*uj* blok depolaryzacyjny p*ytki motorycznej. Mechanizm dzia*ania polega na **czeniu si* leku z receptorem zamiast ACh. Po po**czeniu si* leku z receptorm dochodzi do depolaryzacji p*ytki, jednak nie nast*puje repolaryzacja, poniewa* receptory s* silniej blokowane ni* w przypadku ich po**czenia z acetylocholin*.
Inhibitory acetylocholinoesterazy nie tylko nie znosz* dzia*ania leków, ale jeszcze je pot*guj*.
Środki zwiotczaj*ce pierwszego stopnia
(kuraryny)
Wywo*uj* labilny blok polaryzacyjny. Dzia*aj* na zasadzie antagonizmu konkurencyjnego z ACh o dost*p do receptorów p*ytki motorycznej. ACh nie mo*e po**czy* si* z receptorem nikotynowym i zwi*kszy* przepuszczalno*ci b*ony dla jonów sodowych i potasowych (nie dochodzi do depolaryzacji i repolaryzacji).
Nast*puje zahamowanie przewodnictwa i zwiotczenie mi**ni. Blok mo*na znie** podaj*c inhibitory acetylocholinoesterazy
Wyszukiwarka
Podobne podstrony:
UK SYMPA, farmacja cm umk, Farmacja III rok, chemia leków
KWASY KARBOKSYLOWE I ICH SOLE, farmacja cm umk, Farmacja III rok, chemia leków
tabelka pochodne kwasow karboksylowych, farmacja cm umk, Farmacja III rok, chemia leków
tabelka sulfonamidy i ich sole, farmacja cm umk, Farmacja III rok, chemia leków
tabelka zasady organiczne i ich sole, farmacja cm umk, Farmacja III rok, chemia leków
pytania leki, Płyta farmacja Poznań, III rok, Chemia leków, egzamin
kolo 1 podzial, Płyta farmacja Poznań, III rok, Chemia leków, seminaria, kolokwiaa, kolo 1
pytania leki 3 kolo sem 914, Płyta farmacja Poznań, III rok, Chemia leków, seminaria, kolokwiaa, kol
text prezentacji, Płyta farmacja Poznań, III rok, Chemia leków, seminaria, seminaria mix
pytania 2008 i 2009, Płyta farmacja Poznań, III rok, Chemia leków, egzamin
Produkt homeopatyczny, Płyta farmacja Poznań, III rok, Chemia leków, seminaria, seminaria mix
leki iii koo sem sc 1 117, Płyta farmacja Poznań, III rok, Chemia leków, seminaria, kolokwiaa, kolo3
pytania ch lekow adam 160 egzamin, Płyta farmacja Poznań, III rok, Chemia leków, egzamin
zagadnienia egzam, Płyta farmacja Poznań, III rok, Chemia leków, egzamin
DIURETYKI kolor, Płyta farmacja Poznań, III rok, Chemia leków
Receptory dopaminergiczne- tekst, Płyta farmacja Poznań, III rok, Chemia leków, seminaria, seminaria
pytania kolokwia, Płyta farmacja Poznań, III rok, Chemia leków, seminaria
więcej podobnych podstron