Dysocjacja elektrolityczna
Dysocjacja elektrolityczna to proces rozpadu cząsteczek związków chemicznych na jony np.
NaCl → Na+ + Cl-
Dysocjacja może następować jako końcowy etap solwatacji w rozpuszczalnikach polarnych (np: woda) lub może być incjowana w inny sposób (np: łukiem elektrycznym). Dysocjacja może też przebiegać w fazie gazowej pod wpływem wyładowań elektrycznych, lub bezpośredniego bombardowania gazu elektronami.
Do dysocjacji są zdolne związki, w których występują wiązania jonowe lub bardzo silnie spolaryzowane kowalencyjne. Zdysocjowany roztwór związku chemicznego nazywa się elektrolitem.
W roztworach dysocjacja jest zawsze procesem odwracalnym. Między formą niezdysocjowaną i zdysocjowaną związku występuje w tych warunkach równowaga. W zależności od własności rozpuszczalnika i związku chemicznego, temperatury, oraz występowania jonów pochodzących z innych związków równowaga ta może być bardziej przesunięta w stronę formy niezdysocjowanej lub zdysocjowanej związku.
Dysocjacji elektrolitycznej w wodzie ulegają prawie wszystkie rozpuszczalne sole większość kwasów i wodorotlenki. Stopień dysocjacji kwasów i zasad w wodzie, wyrażany zwykle jako logarytm ze stałej równowagi dysocjacji, jest miarą ich mocy chemicznej.
Wiele związków chemicznych w stanie ciekłym i gazowym ulega też samorzutnej dysocjacji, choć jej stopień jest zazwyczaj dość niski. Np. woda ulega samorzutnej dysocjacji wg schematu:
H2O + H2O → H3O+ + OH-
Stała tej dysocjacji warunkach normalnych wynosi ok 10-14, co oznacza że na każde 1014 (100 000 000 000 000) cząsteczek wody tylko jedna ulega samorzutnej dysocjacji. Stała ta jest podstawą skali pH.
Dysocjacja elektrolityczna
Dysocjacja elektrolityczna - inaczej zwana jonową. Jest to rozpad cząsteczek wody na jony pod wpływem wody. Dysocjacji elektrolitycznej ulegają cząsteczki związku o wiązaniu jonowym lub atomowym spolaryzowanym. |
Podział; substancji pod względem przewodnictwa.
Pod koniec XIX w Szwedzki uczony Svante Arrhenius zaobserwował; że substancje chemiczne. można podzielić pod względem przewodnictwa prądu na: elektrolity Substancje. które
w roztworze wodnym (lub po stopieniu) przewodzą prąd elektryczny Do elektrolitów zaliczamy: kwasy, wodorotlenki, sole nie elektrolity Substancje które nie przewodzą prądu w stanie stopionym lub nie przewodzą
Rola wody w procesie rozpuszczania elektrolitów Podczas rozpuszczania w wodzie elektrolitów następuje oddziaływanie elektrostatycznego przyciągania po między dipolami (cząsteczki wody) a jonami zawartymi w sieci krystalicznej elektrolitów. Na skutek tych oddziaływań następuje wyrywanie jonów sieci krystalicznej - proces taki nosi nazwę dysocjacji. Dysocjacja Rozpad elektrolitów na jony w wyniku oddziaływania między substancjami rozpuszczano w wodzie a rozpuszczalnikiem. W roztworze elektrolitu występują swobodne jony (kationy, aniony) które poruszają się w różnych kierunkach. Pomiędzy jonami występują oddziaływania: - Jony różnoimienne przyciągajo się- Jony równoimienne odpychają się. Jeżeli do roztworu elektrolitu podłączymy ˇródło prądu to następuje uporządkowany ruch jonów w kierunku odpowiednich elektrod
Jony dodatnie -Kationy ---> Kationy (-)
Jony ujemne -Aniony ---> Aniony (+)
Dysocjacja kwasów: Kwasy to zw. chemiczne. które dysocjują na jedno-dodatnie kationy i aniony reszty kwasowej
Dysocjacja zasad Zasady to zw. chemiczne które dysocjują na kationy metalu i jedo-nujemne grupy wodorotlenowe
W każdym równaniu reakcji dysocjajcji jeżeli dysocjuje cząsteczka suma ładunków dodatnich odpowiada sumie ładunków ujemnych, liczba ładunków jakie posiada dany jon odpowiada wartościowości tego pierwiastka (lub grupy) z którego powstaje jon. liczba powstałych jonów odpowiada ilości atomów lub (grup) w danym zwiozku.
Dysocjacja elektrolityczna
Dysocjacja elektrolitów
W drugiej połowie XIX wieku szwedzki chemik S.A. Arrhenius doświadczalnie udowodnił, że substancje chemiczne można podzielić na dwie grupy.
Do grupy I można zaliczyć takie, których roztwory wodne przewodzą prąd elektryczny, a do grupy II te, które w tych samych warunkach praktycznie nie przewodzą prądu. Substancje grupy I nazwał Arrhenius elektrolitami, grupę II nieelektrolitami.
Zdolności przewodzenia prądu elektrycznego przez roztwory wodne elektrolitów, tłumaczył Arrhenius obecnością w nich cząstek zdolnych do przenoszenia ładunków elektrycznych, a więc obdarzonych ładunkami.
Teorię Arrheniusa można ująć ogólnie w postaci czterech podstawowych opartych na doświadczeniu założeniach.
elektrolity, a więc kwasy, zasady i sole podczas rozpuszczania w wodzie rozpadają się na elementy naładowane elektrycznie, czyli ulegają tzw. dysocjacji elektrolitycznej. Elementy te nazwano jonami. Jony naładowane dodatnio nazywa się kationami, a ujemne anionami.
suma ładunków elektrycznych kationów i anionów, powstających na skutek dysocjacji elektrolitycznej elektrolitów jest zawsze równa zeru.
nieelektrolity tzn. substancje, które w roztworach i w stanie stopionym nie przewodzą prądu elektrycznego, nie ulegają dysocjacji elektrolitycznej.
właściwości chemiczne jonów różnią się zupełnie od własności obojętnych atomów i cząsteczek
W 1887 r. Arrhenius podał definicję kwasów, zasad i soli.
Kwasami są związki chemiczne, które podczas rozpuszczania w wodzie dysocjują całkowicie lub częściowo na kationy wodorowe i aniony reszt kwasowych. Dysocjację tą można przedstawić następująco:
HNO3 --> H+ + NO3-
H2SO4 --> H+ + HSO4-
HSO4- --> H+ + SO42-
Kwasy takie jak HNO3, które w czasie dysocjacji odczepiają jeden kation wodorowy nazywamy jednoprotonowymi. Kwasy posiadające w cząsteczkach dwa atomy wodoru zdolne do oddysocjowania w postaci kationów - dwuprotonowymi, trzy-, trójprotonowymi
Zasady są to związki chemiczne, które podczas rozpuszczania w wodzie dysocjuja całkowicie lub częściowo na aniony wodorotlenowe OH- i kationy metali. A oto równania dysocjacji niektórych zasad.
NaOH --> Na+ + OH-
KOH --> K+ + OH-
Ca(OH)2 --> Ca2+ + 2OH-
Sole są produktami rakcji kwasów z zasadami. Związki te w temperaturze pokojowej występują na ogół w stanie stałym, krystalicznym i mają budowę jonową, czyli składającą się z kationów metali lub kationu amonowego i anionów reszt kwasowych. Proces rozpuszczania soli w wodzie polega zatem na przechodzeniu do roztworu istniejących już w krysztale kationów i anionów. Jonowa budowa soli tłumaczy również zdolności przewodzenia prądu przez stopione sole.
Stopień dysocjacji
Rys. 1 Przewodzenie prądu przez roztwory elektrolitów |
Badania jakie prowadzono nad elektrolitami wykazały, że mimo takiego samego stężenia molowego różnych elektrolitów w roztworze, różnią się one zdolnością przewodzenia prądu elektrycznego. Za przykład może nam posłużyć badanie zdolności przewodzenia prądu elektrycznego przez roztwory kwasu HCl i kwasu octowego (CH3COOH). Do badania możemy wykorzystać zestaw przedstawiony na rys.1 z tą różnicą, gdzie w obwód włączony jest miliamperomierz. Porównujemy wartości natężeń prądów płynących w obwodzie. Tak przeprowadzone badanie wykazuje, że przez roztwór kwasu octowego płynie prąd o znacznie mniejszym natężeniu niż w roztworze HCl. Dowodzi to, że w roztworze kwasu octowego znajduje się znacznie mniej nośników prądu elektrycznego, którymi są jony. A to oznacza, że w roztworze kwasu octowego dysocjacji uległa znacznie mniejsza ilość cząsteczek. Takie elektrolity, które w roztworach wodnych dobrze przewodzą pršd elektryczny noszą nazwę elektrolitów mocnych a elektrolity, które przy tym samym stężeniu co elektrolity mocne wykazują znacznie słabsze przewodnictwo elektryczne nazywane są elektrolitami słabymi. Do elektrolitów mocnych należą prawie wszystkie sole oraz niektóre kwasy i zasady (H2SO4, HNO3, HCl, NaOH, KOH ). Elektrolitami słabymi są; kwasy - HF, HNO2, H2S, CH3COOH, H2CO3, zasady - Cu(OH)2, NH4OH. |
Wielkością opisującą w sposób ilościowy dysocjację elektrolitów w roztworze jest stopień dysocjacji. Pojęcie to po raz pierwszy wprowadził Arrhenius i jest ono często wykorzystywane do porównywania mocy elektrolitów.
Stopień dysocjacji elektrolitu określa się stosunkiem liczby moli cząsteczek zdysocjowanych na jony do liczby moli cząsteczek substancji rozpuszczonej.
gdzie: () - stopień dysocjacji, x - liczba moli cząsteczek zdysocjowanych na jony, n - liczba moli cząsteczek substancji rozpuszczonej
Wartość stopnia dysocjacji jest mniejsza lub równa jedności, można ją również wyrażać w procentach. Jeżeli stopień dysocjacji jest równy lub bliski jedności, wtedy elektrolit jest prawie całkowicie zdysocjowany na jony a przewodnictwo elektryczne takiego roztworu jest znaczne. Okazuje się, że całkowicie dysocjują elektrolity mocne ( = 1) natomiast elektrolity słabe mają < 1. Dla elektrolitów słabych, wartości stopnia dysocjacji wynoszą kilka procent.
Stopień dysocjacji zależy:
od rodzaju elektrolitu i rodzaju rozpuszczalnika
od stężenia roztworu
nieznacznie od temperatury
od obecności innych elektrolitów w roztworze
Rodzaj elektrolitu. Podstawowym czynnikiem decydującym o wartości stopnia dysocjacji jest siła wiązania w cząsteczce, która podlega dysocjacji. Przykładem może być cząsteczka HF. Mimo że wiązanie H-F jest znacznie bardziej polarne jak wiązanie H-Cl, HF jest słabym elektrolitem a HCl jest mocnym elektrolitem. Częściowo odpowiedzialne za to jest bardzo silne wišzanie H-F, w wyniku czego wodór oddziela się z trudnością.
Rodzaj rozpuszczalnika. Zmiana rozpuszczalnika może w sposób znaczący wpłynąć na wartość stopnia dysocjacji. Na przykład, w porównywalnych warunkach, HCl w wodzie jest w 100% zdysocjowany, a w benzenie dysocjacja HCl jest mniejsza niż 1%.
Stężenie roztworu. Pomiary wykazały, że stopień dysocjacji wzrasta z rozcieńczeniem elektrolitu i w roztworach bardzo rozcieńczonych wszystkie elektrolity wykazują stopień dysocjacji zbliżony do jedności, tzn. niemal wszystkie cząsteczki lub zgrupowania jonów substancji rozpuszczonej ulegają zdysocjowaniu na jony.
Stała dysocjacji
Dysocjację słabych elektrolitów można traktować jako odwracalną reakcje chemiczną. Słaby elektrolit, o wzorze ogólnym AB, ulega w roztworze wodnym dysocjacji według równania:
AB <=> A+ + B-
W stanie równowagi równanie można wyrazić zależnością:
gdzie: Kc nosi nazwę stałej dysocjacji.
Stała Kc jest wielkością praktycznie biorąc stałą w określonej temperaturze, niezależną od stężenia. Dlatego może służyć jako miara mocy elektrolitów. Im elektrolit jest mocniejszy, tym wartość stałej Kc jest większa.
Przykład dla kwasu octowego CH3COOH, który jak wiemy jest zaliczany do słabych kwasów.
CH3COOH <=> CH3COO- + H+
Odpowiednio dla elektrolitu mocnego wartość Kc > 1. Przyjęto umownie, że dla elektrolitów słabych wartości Kc wynoszą odpowiednio - 10-7 < Kc < 10-3.
Związek pomiędzy stopniem dysocjacji a stałą dysocjacji ujmuje ogólnie tzw. prawo rozcieńczeń Oswalda
gdzie m - stężenie molowe [mol/dm3]
Dla elektrolitów słabych wartość stopnia dysocjacji jest bardzo mała. Wtedy wynik odejmowania [1- ] jest bliskie 1 i możemy zapisać:
Związek pomiędzy stopniem dysocjacji a stałą dysocjacji ujmuje ogólnie tzw. prawo rozcieńczeń Oswalda
gdzie m - stężenie molowe [mol/dm3]
Dla elektrolitów słabych wartość stopnia dysocjacji jest bardzo mała. Wtedy wynik odejmowania [1- ] jest bliskie 1 i możemy zapisać:
Stopień dysocjacji słabego elektrolitu jest zatem odwrotnie proporcjonalny do pierwiastka kwadratowego stężenia molowego tego elektrolitu i wprost proporcjonalny do pierwiastka kwadratowego jego stałej dysocjacji. Prawo rozcieńczeń Oswalda słuszne jest jedynie w przypadku roztworów elektrolitów słabych i bardzo rozcieńczonych.
Teorie kwasów i zasad
Teoria dysocjacji elektrolitycznej Arrheniusa wprowadziła definicję kwasu jako związku odczepiającego w roztworach wodnych kationy wodorowe H+ i zasady związku odczepiającego w tych warunkach aniony wodorotlenowe OH-. Definicje te tłumaczą w sposób zadowolający większość zjawisk zachodzących z udziałem kwasów lub zasad w roztworach wodnych.
Poczyniono jednak obserwacje, które wykazały braki istniejące w teorii Arrheniusa.
Na przykład opierając się na niej nie można w sposób przekonujący wyjaśnić zasadowych włąściwości amoniaku i amin w wodzie, a zwłaszcza zachowania się elektrolitów w roztworach niewodnych. Nie można wyjaśnić także, dlaczego jon wodorowy w roztworach wodnych nie istnieje jako swobodny proton lecz jako zwiazany z co najmniej jedną cząsteczką wody i występuje jako jon hydronowy H3O+.
Te i wiele innych faktów doprowadziły w 1923 roku chemika duńskiego Bronsteda i niezależnie od niego anglika Lowry'ego do bardziej ogólnej teorii, zwanej protonową teorią kwasów i zasad.
Kwasami w/g Bronsteda nazywamy związki chemiczne lub jony zdolne do oddawania protonów, a zasadami związki chemiczne lub jony zdolne do przyłączania protonów. |
HA <=> H+ + A-
kwas <=> proton + zasada
Związek A- jest zatem zasadą sprzężoną z odpowiednim kwasem HA, a kwas HA jest sprzężony z zasadą A-.
Przykłady tak zdefiniowanych kwasów i zasad są następujące
Kwas |
Zasada |
Kwas |
Zasada |
HCl |
+ H2O |
<=> H3O+ |
+ Cl- |
Według protonowej teorii kwasów i zasad, kwas może wykazywać swoje własności kwasowe tylko wobec zasady, która przyjmuje proton i odwrotnie zasada może nią być tylko w obecności kwasu, który proton oddaje.
Z przedstawionych przykładów widoczne jest, że woda zachowuje się obojnaczo, raz jak kwas, innym razem jak zasada w zależności od rodzaju rozpuszczonej w niej substancji. Podobnie do wody zachowuje się wiele innych rozpuszczalników, między innymi alkohol i kwas octowy.
Według teorii Bronsteda rozpuszczalnik jest nie tylko ośrodkiem, w którym odbywa się dysocjacja kwasów lecz odgrywa on przede wszystkim role kwasu wobec rozpuszczonej zasady lub zasady wobec rozpuszczonego kwasu.
Teoria Bronsteda tłumaczy zatem w sposób prosty i przekonujący wpływ rozpuszczalnika na moc kwasów i zasad.
Zgodnie z protonową teorią kwasów i zasad wyróżnić możemy trzy rodzaje kwasów oraz trzy rodzaje zasad.
1. Kwasy cząsteczkowe
Kwas |
Zasada |
Zasada |
Kwas |
HCl |
+ H2O |
<=> Cl- |
+ H3O+ |
2. Kwasy anionowe
Kwas |
Zasada |
Zasada |
Kwas |
H2PO4- |
+ H2O |
<=> HPO42- |
+ H3O+ |
3. Kwasy kationowe
Kwas |
Zasada |
Zasada |
Kwas |
NH4+ |
+ H2O |
<=> NH3 |
+ H3O+ |
1. Zasady cząsteczkowe
Zasada |
Kwas |
Kwas |
Zasada |
NH3 |
+ H2O |
<=> NH4+ |
+ OH- |
2. Zasady anionowe
Zasada |
Kwas |
Kwas |
Zasada |
CH3COO- |
+ H2O |
<=> CH3COOH |
+ OH- |
3. Zasady kationowe
Zasada |
Kwas |
Kwas |
Zasada |
N2H5+ |
+ H2O |
<=> N2H62+ |
+ OH- |
Równanie dysocjacji kwasów i zasad oraz wyrażenia na stałe równowagi zgodnie z koncepcją Bronsteda zapisuje się w następujący sposób.
Dysocjacja kwasów
ZasadaII |
KwasI |
KwasII |
ZasadaI |
H2O(c) |
+ HA(aq) |
<=> H3O+(aq) |
+ A-(aq) |
Dysocjacja zasad
ZasadaI |
KwasII |
KwasI |
ZasadaII |
B(aq) |
+ H2O(c) |
<=> BH+(aq) |
+ OH-(aq) |
Teoria Lewisa. Bardziej ogólną definicję kwasów i zasad podał Lewis.
Według lewisa kwasem nazywamy związek lub jon, który przyjmując parę elektronową tworzy wiązanie kowalencyjne spolaryzowane, a zasadą zwiazek lub jon, który dostarcza pary elektronowej do utworzenia tego wiązania. H+ + NH3 <=> NH4+ |
Przykłady kwasów i zasad według Lewisa
Kwas |
Zasada |
|
H+ |
+ Cl- |
<=> HCl |
H+ |
+ NH3 |
<=> NH4+ |
AlCl3 |
+ Cl- |
<=> AlCl4- |
BF3 |
+ F- |
<=> BF4- |
Ag+ |
+ 2NH3 |
<=> Ag(NH3)2+ |
Woda może być kwasem i zasadą
(kwas)H+ + (zasada)HOH <=> H3O+
(kwas)HOH + (zasada)NH3 <=> NH4+ + OH-
Aktywność jonów w roztworach. Skala pH
Woda ulega autoprotolizie w/g równania:
H2O + H2O <=> H3O+ + OH-
Równowaga pomiędzy jonami H3O+ + OH- a niezdysocjowaną wodą można wyrazić stałą równowagi
Ponieważ stężenie czystej wody w wodzie jest wielkością stałą to iloczyn K * [H2O] jest również wielkością stałą i nazywany jest iloczynem jonowym wody Kw.
Kw = K * [H2O] = [H3O+] * [OH-] = 10-14 (mol/dm3)
W temperaturze 298,15oK stężenie jonów hydroniowych w czystej wodzie jest równe stężeniu jonów wodorotlenowych i wynosi:
[H3O+] = [OH-] = 1,00 * 10-7 mol/dm3
Podobnie jak w czystej wodzie, również we wszystkich roztworach obojętnych [H3O+] = 10-7 mol/dm3. W roztworach kwaśnych [H3O+] > 10-7 mol/dm3 a w roztworach zasadowych [H3O+] < 10-7 mol/dm3.
Posługiwanie się tak małymi stężeniami jest niewygodne w zapisach i obliczeniach. Dlatego przyjęto wyrażać aktywność jonów wodorowych w roztworze w tzw. skali pH.
pH definiujemy jako ujemny logarytm dziesiętny z wartości liczbowej stężenia jonów hydroniowych pH = - lg[H3O+] |
analogicznie
pOH = - lg[OH-]
Roztwory, których pH jest niższe od 7 mają odczyn kwaśny, tym bardziej kwaśny, im niższe jest pH roztworu, np. roztwór o pH = 1 ma w jednostce objętości 1000 razy więcej jonów wodorowych niż roztwór o pH = 4.
Roztwory, których pH jest wyższe od 7 mają odczyn zasadowy, tym bardziej zasadowy im wyższe jest pH rotworu.
Skala pH obejmuje roztwory od pH = 0 do roztworów silnie alkalicznych o pH = 14. W roztworach obojętnych pH = 7.
pH |
0 |
3 |
7 |
11 |
14 |
[H3O+] |
100 |
10-3 |
10-7 |
10-11 |
10-14 |
Wskaźniki kwasowo-zasadowe
W celu stwierdzenia, czy roztwór jest kwaśny, obojętny czy zasadowy, można stosować wskaźniki. Najprostszym wskaźnikiem, który możemy zrobić w warunkach domowych jest wywar z czerwonej kapusty. Wskaźniki tym charakteryzują sie, że zmieniają swoje zabarwienie przy określonym pH. Na przykład fioletowe zabarwienie wywaru z czerwonej kapusty zmienia się na różowe w obecności kwasu.
Wskaźnikiem (indykatorem) pH są substancje ulegające przemianom lub modyfikacjom strukturalnym przy zmianie stężenia jonów H+ (H3O+) a w konsekwencji tego wykazują zmiany pH w pewnych określonych granicach. Im te granice leżą bliżej siebie, tym lepszy jest wskaźnik. |
Do celów praktycznych obecnie używa się wskaźników otrzymanych syntetycznie (tablica 1).
Tablica 1
Charakterystyka wybranych wskaźników
Wskaźnik |
Zakres zmian barwy |
Barwa wskaźnika pH
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
|
Błękit tymolowy |
1,2 - 2,8 |
|
|
|
Oranż metylowy |
3,0 - 4,4 |
|
|
Błękit bromofenylowy |
3,0 - 4,6 |
|
|
Czerwień metylowa |
4,4 - 6,2 |
|
|
Lakmus |
5,0 - 8,0 |
|
|
Błękit bromotymolowy |
6,0 - 7,6 |
|
|
Błękit tymolowy |
8,0 - 9,6 |
|
|
|
Fenoloftaleina |
8,4 - 10,0 |
|
|
Wskaźniki są ogólnie słabymi kwasami lub słabymi zasadami organicznymi. Zmiana barwy wskaźnika ze zmianą pH roztworu nie jest ostra, lecz następuje w zakresie jednej lub dwóch jednostek pH (patrz tabela 1). Wynika to z istnienia równowagi chemicznej między dwiema różnie zabarwionymi postaciami wskaźnika. Na przykład wskaźnik będący słabym kwasem o ogólnym wzorze HIn w zależności od środowiska będzie miał postać kwasową lub zasadową.
HIn <=> H+ + In-
postać kwasowa postać zasadowa
Takim wskaźnikiem jest lakmus. Postać kwasowa HIn lakmusu ma zabarwienie czerwone, a postać niebieska opisana wzorem In- ma zabarwienie niebieskie. Działanie wskaźnika jest następujące;
w roztworach kwaśnych, w których stężenie [H+] jest duże, równowaga przesuwa się w lewo, wskaźnik przybiera postać kwasową (zabarwienie wskaźnika jest czerwone)
w roztworach zasadowych, o małym stężeniu [H+], równowaga jest przesunięta w prawo, a wskaźnik przechodzi niemal całkowicie w postać zasadową (zabarwienie wskaźnika jest niebieskie).
Obecnie są dostępne uniwersalne papierki wskaźnikowe, nasycone mieszaniną wskaźników i wykazujące szereg zmian barwy. Za pomocą tych papierków można ocenić pH roztworu z dokładnością ok. 1 jednostki w zakresie pH od 1 do 13.
Typy roztworów
Większość procesów chemicznych jest realizowana w układach wieloskładnikowych, w których co najmniej jeden składnik jest znacznie rozdrobniony. Układy takie stanowią, w zależności od stopnia rozdrobnienia składników:
mieszaniny niejednorodne
mieszaniny jednorodne (układy dyspersyjne)
Mieszaniny niejednorodne (heterogeniczne) są to układy, w których fazy poszczególnych składników zachowują swoje cechy makroskopowe (np. piasek + woda, piasek + siarka, woda + olej). Mieszaniny takie można stosunkowo łatwo rozdzielić metodami fizycznymi, takimi jak:
sączenie przez materiał porowaty
sedymentacja w polu grawitacyjnym ziemskim
dekantacja, tzn. ostrożne zlanie cieczy znad osadu
segregacja mechaniczna (jeżeli ziarna poszczególnych składników są dostatecznie duże)
Mieszaninami jednorodnymi (układami dyspersyjnymi) nazywa się takie układy, w których małe cząstki jednej substancji - fazy rozproszonej - są równomiernie rozmieszczone w innej substancji - fazie rozpraszającej. Ogólnie taki układ nazywamy roztworem.
W roztworach substancja znajdująca sie w przewadze nazywana jest rozpuszczalnikiem a substancja występująca w mniejszej ilości substancją rozpuszczaną. |
Roztwory mogą powstać w wyniku zmieszania;
gazu z gazem i powstaje roztwór gazowy
gazu z cieczą
substancji w stanie stałym z cieczą
cieczy z cieczą
substancji w stanie stałym z substancją w stanie stałym i powstaje roztwór stały.
Przykładem roztworu, który powstał w wyniku zmieszania gazów jest powietrze. Jest to mieszanina takich gazów jak; azot, tlen, dwutlenek węgla, argon i innych cząsteczek. Pod względem kinetycznym roztwór gazowy jest podobny do czystego gazu, z tą różnicą, że zawiera cząsteczki różnego rodzaju, które mieszają się ze sobą w dowolnych stosunkach. Oznacza to, że roztwory gazowe zawsze powstają podczas mieszania dowolnych gazów i w dowolnych stosunkach.
Roztwory, które powstają w wyniku zmieszania dowolnych substancji z cieczą, są cieczami. W wyniku zmieszania różnych substancji w stanie stałym powstają roztwory, które są ciałami stałymi. Przykładem są różnego rodzaju stopy metali, takie jak; mosiądz, brąz, stal, srebro monetarne, stopy glinu.
W zależności od stopnia rozdrobnienia fazy rozproszonej rozróżnia się:
Roztwory właściwe (rzeczywiste) - złożone z cząsteczek lub jonów o rozmiarach mniejszych niż 10-9m.
Roztwory koloidalne - złożone z cząstek o rozmiarach 10-7m - 10-9m widocznych dopiero pod mikroskopem elektronowym. Tak małe cząstki można rozdzielić dopiero w ultrawirówkach. Roztwory koloidalne intensywnie rozpraszają światło (efekt Tyndala)
Zawiesiny - złożone z cząstek o rozmiarach 10-6m - 10-7m widocznych pod mikroskopem optycznym. Można je rozdzielić przez sedymentację pod wpływem siły ziemskiego pola grawitacyjnego.
Przedstawiony podział nie jest "ostry". Zawiesiny takie jak dymy (ciało stałe rozproszone w gazie), mgły (ciecz rozproszona w gazie), emulsje (ciecz rozproszona w cieczy) oraz piany (gaz w cieczy), przy dostatecznie dużym rozdrobnieniu stają się koloidami. Podobnie białka i polimery nawet w rozdrobnieniu cząsteczkowym są układami koloidalnymi.
Najbardziej rozpowszechnionymi roztworami rzeczywistymi są roztwory ciekłe. Dlatego w wąskim znaczeniu roztwór definujemy jako mieszaninę substancji ciekłej (rozpuszczalnika) i jednej albo więcej stałych, ciekłych lub gazowych substancji rozpuszczonych, których cząsteczki są dokładnie przemieszane z cząsteczkami rozpuszczalnika. |
Tematem kolejnych rozważań będą ciekłe roztwory rzeczywiste, tj. roztwory z którymi spotykamy się codziennie. Najbardziej znanymi są wszelkiego rodzaju roztwory powstałe w wyniku rozpuszczenia dowolnych substancji w wodzie. Na przykład woda sodowa jest roztworem dwutlenku węgla w wodzie, woda oceanów jest roztworem wodnym zawierającym tysiące składników; jony metali i niemetali, złożone jony nieorganiczne, wiele różnych substancji organicznych.
Rzeczywiste roztwory ciekłe
Roztwory ciał stałych w cieczy
Roztwory rzeczywiste ciał stałych w cieczy powstają w wyniku:
rozproszenia substancji, która dąży do osiągnięcia stanu o maksymalnym uporządkowaniu, dzięki czemu rozproszenie substancji następuje przy całkowitym braku współdziałania pomiędzy cząsteczkami rozpuszczalnika a substancji rozproszonej.
reakcji chemicznej danej substancji z rozpuszczalnikiem, zwanej solwatacją, polegającej na rozerwaniu (zniszczeniu) wiązań istniejących pomiędzy cząsteczkami lub atomami substancji rozpuszczonej i izolowaniu ich od siebie przez cząsteczki rozpuszczalnika. Z takim mechanizmem tworzenia roztworów spotykamy się podczas rozpuszczania substancji o budowie polarnej w rozpuszczalnikach polarnych.
podwyższenie temperatury wrzenia
obniżenie temperatury krzepnięcia
obniżenie prężności par rozpuszczalnika nad roztworem
sól kuchenna (NaCl) bardzo dobrze rozpuszcza się w wodzie
wodorotlenek cynku (Zn(OH)2) słabo rozpuszcza się w wodzie
kreda (CaCO3) i gips (CaSO4) praktycznie nie rozpuszczają się w wodzie
wodę z octem możemy mieszać ze sobą bez ograniczeń. To samo dotyczy rozpuszczania alkoholu w wodzie.
rozpuszczając sole w wodzie zauważamy, że w pewnym momencie w czasie rozpuszczania na dnie naczynia pojawia się osad, który nie chce dalej rozpuszczać się mimo że intensywnie mieszamy.
wszystkie azotany są rozpuszczalne
wszystkie octany są rozpuszczalne
wszystkie chlorki, bromki i jodki są rozpuszczalne w wyjątkiem srebrowych, rtęci(I) i ołowiu(II)
wszystkie siarczany są rozpuszczalne z wyjątkiem siarczanów baru, strontu i ołowiu; CaSO4, Ag2SO4 i Hg2SO4 są słabo rozpuszczalne
wszystkie sole sodowe, potasowe i amonowe są rozpuszczalne z wyjątkiem NaSb(OH)6, K2PtCl6, KClO4
wszystkie wodorotlenki z wyjątkiem wodorotlenków metali alkalicznych, amonowego i barowego są nierozpuszczalne;
Ca(OH)2 i Sr(OH)2 są słabo rozpuszczalnewszystkie obojętne węglany i fosforany są nierozpuszczalne z wyjątkiem węglanów i fosforanów amonowych oraz metali alkalicznych
wszystkie siarczki z wyjątkiem siarczków amonowych, siarczków metali alkalicznych i metali ziem alkalicznych są nierozpuszczalne
temperatury
stopnia rozdrobnienia substancji
szybkości mieszania
inne rozpuszczalniki polarne
rozpuszczalniki niepolarne
destylację prostą - pary wytwarzane podczas wrzenia układu ciekłego mogą być natychmiast odprowadzone znad wrzącej cieczy i skraplane,
destylację frakcjonowaną - pary destylujących składników wprowadza się do odpowiedniego urządzenie (kolumny), w którym ulegają częściowemu skropleniu, przy czym skropliny, zwane również kondensatem, w przeciwprądzie spotykają się i wchodzą w ścisły kontakt na dużej powierzchni styku z parami destylujących składników.
procent masowy - podaje się liczbę gramów substancji zawartej w 100 g roztworu. Na przykład w 100 g roztworu NaCl znajduje się 10g NaCl i 90 g H2O. Dla roztworów cieczy w cieczy często stosuje się procent objętościowy, który określa liczbę cm3 substancji zawartej w 100 cm3 roztworu.
stężenie molowe (molowość) - określa liczbę moli danej substancji znajdującej się w 1 dm3 roztworu.
Na przykład roztwór o stężeniu 1 mola NaOH zawiera 40 g NaOH 1 dm3 roztworu.stężenie normalne (normalność) określa liczbę gramorównoważników substancji zawartej w 1 dm3 roztworu.
Na przykład roztwór 1 normalny H2SO4 zawiera 98,08 : 2 = 49,04 g H2SO4 w 1 dm3 roztworu. Stężenia normalne najczęściej stosowane są w alkali- i acydymetrii. Roztwory o jednakowej normalności zobojętniają się w jednakowych objętościach np. 100 cm3 1 n H2SO4 zobojetnia 100 cm3 1 n KOH.stężenie molarne (molarność) określa liczbę moli substancji rozpuszczonej w 1 kg rozpuszczalnika.
ułamek molowy oznacza względną zawartość substancji 1 w roztworze zawierającym n1 moli substancji 1 i n2 substancji 2. Ułamki molowe składnika 1 i 2 są odpowiednio równe:
Przykład: roztwór 20%-owy jest to roztwór zawierający 20 jednostek masowych (mg, g, kg, Mg) substancji rozpuszczonej w 100 jednostkach masowych (mg, g, kg, Mg) roztworu,
czyli jest to roztwór powstały ze zmieszania 10 jednostek masowych (mg, g, kg, Mg) substancji z 90 jednostkami masowymi (mg, g, kg, Mg) rozpuszczalnikaPrzykład 1
Oblicz stężenie procentowe roztworu otrzymanego ze zmieszania 20 soli NaCl i 140 g wody.
Rozwiązanie. Masa roztworu jest sumą masy substancji rozpuszczonej i masy rozpuszczalnika: 20 g + 140 g = 160 g
Stąd możemy zapisać że:
w 160 g roztworu znajduje się 20 g NaCl
a w 100 g roztworu znajduje się x g cukruPrzykład 2
Do 30 g 60%-owego roztworu dodano 50 g wody. Oblicz stężenie procentowe otrzymanego roztworu.
Rozwiązanie po dodaniu do roztworu wody jego stężenie zmniejszy się, ale masa substancji rozpuszczonej pozostanie bez zmiany. należy więc obliczyć masę substancji znajdującej się w 30 g 60% -owego roztworu:
100 g roztworu zawiera 60 g substancji
30 g roztworu zawiera x g substancjiPrzykład Roztwór 1 molowy jest to roztwór, który w 1 dm3 roztworu zawiera 1mol substancji (definicja mola).
Przykład1
Ile gramów NaOH znajduje się w 300 cm3 0,1 molowego roztworu?
RozwiązanieObliczamy masę molową M(NaOH) - wynosi ona 40 g/mol. Ponieważ roztwór jest 0,1 molowy, to 0,1 mola NaOH ma masę: 0,1 mola x 40g/mol = 4g. To oznacza, że w 1 dm3 roztworu znajduje się 4 g NaOH.
Układając równania na proporcję możemy napisać
w 1000 cm3 0,1 molowego znajduje się 4 g NaOH
a w 300 cm3 0,1 molowego roztworu zawiera x g NaOHPrzykład Ułamek molowy Xj = 0,2 oznacza, że dany składnik roztworu stanowi dwie dziesiące ogólnej liczby moli roztworu
Przykład 1 Roztwór składa się z dwóch moli kwasu siarkowego i trzech moli wody. Oblicz ułamki molowe obu składników roztworu
Rozwiązanie Liczba moli H2SO4 n1 = 2, liczba moli wody n,sub>2 = 3, liczba moli tworzących roztwór: n1 + n2 = 2 + 3 = 5. Ułamki molowe są odpowiednio równePrzykład 1
Oblicz stężenie molowe 13,45% roztworu Na2CO3, którego gęstość wynosi d = 1,14 g/cm3
Rozwiązanie Najpierw obliczamy masę 1 dm3 roztworu. Wynosi ona 1000 cm3*1,14 g/cm3 = 1140 g. Z równań na proporcję obliczamy masę Na2CO3.
100 g roztworu zawiera 13,45 g Na2CO3
w 1140 g roztworu jest x g Na2CO3Przykład 2
Oblicz stężenie procentowe 12,5 molowego roztworu KOH, ktorego gęstość wynosi d = 1,48 g/cm3
Rozwiazanie Masa molowa M(KOH) = 56,11 g/mol. Ponieważ roztwór jest 12,5 molowy, to w roztworze znajduje się 12,5 mol * 56,11 g/mol = 701.38 g KOH. Masa 1 dm,sup>3 roztworu ma masę 1000 cm3 * 1,48 g/cm3 = 1480 g.
Jeżeli 1480 g roztworu zawiera 701,38 g KOH
to 100 g roztworu zawiera x g KOH
αh - stopień hydrolizy
Kw - iloczyn jonowy wody
Ka, Kb - stałe dysocjacji kwasowej i zasadowej
Kh - stała równowagi hydrolizy i pKh = − log10Kh
dla sprzężonej pary kwas-zasadapKa + pKb = pKw, gdzie p jest operatorem: pX = -log10(X)
[OH − ] = [CH3COOH] = αhCsoli
pKa niektórych kwasów:
pKb niektórych zasad:
|
Reakcja solwatacji w przypadku wody jako rozpuszczalnika nosi nazwę reakcji hydratacji i polega na tym, że cząsteczki wody będące dipolami otaczają cząsteczkę rozpuszczonego związku. Rysunek 1 przedstawia rozpuszczanie chlorku sodu w wodzie. Dipolowe cząsteczki wody zbliżają się swym dodatnim i ujemnym biegunem do jonów. Dodatni biegun zbliża się do ujemnego jonu chloru a ujemny biegun do dodatniego jonu sodu. Dzięki temu jony Na+ i Cl- zostają oderwane z powierzchni kryształu. |
Siła przyciągania elektrostatycznego jonów w roztworze wyrażona równaniem /9-1/, w wodzie zmniejsza się 80 razy.
gdzie: - przenikalność dielelektryczna
Poza tym wydziela się znaczna ilość energii, zwana energią hydratacji związana z utworzeniem stosunkowo silnych wiązań koordynacyjnych pomiędzy cząsteczkami wody a jonami. Energia hydratacji kompensuje energię niezbędną do rozerwania sieci krystalicznej i rozsunięcia jonów rozpuszczonej substancji.
Tablica 1 podaje wartość energii sieci krystalicznej niektórych soli i ich energii hydratacji. Im bardziej energia hydratacji przewyższa energię sieci krystalicznej, tym łatwiej następuje rozpuszczanie.
Tablica 1
Wartość energii sieci krystalicznej Es i energii hydratacji Eh niektórych soli
Sól |
Es |
Eh |
M = Es - Eh |
LiCl |
831,8 |
836,o |
-4,2 |
Zgodnie z regułą przekory ze wzrostem temperatury zwiększa się rozpuszczalność soli. Wyjątek stanowią sole, które rozpuszczają się z wydzieleniem ciepła (Na2SO4).
W wyniku rozpuszczenia substancji ciał stałych w rozpuszczalnikach obserwuje się następujące zmiany;
Temperatura wrzenia roztworu jest wyższa niż temperatura wrzenia czystego rozpuszczalnika. Jest to spowodowane obniżeniem prężności par rozpuszczalnika nad roztworem a to oznacza, że moment w którym preżność pary nasyconej nad cieczą zrówna się ciśnieniu zewnętrznemu wymaga wyższej temperatury. Zmiana temperatury wrzenia jest opisana równaniem.
gdzie: m - masa substancji rozpuszczonej, M - masa molowa substancji rozpuszczonej, mo - masa rozpuszczalnika, E - stała ebulioskopowa
Ma to praktyczne zastosowanie do oznaczania mas cząsteczkowych substancji rozpuszczonej, szczególnie przy badaniach substancji organicznych.
Stwierdzono doświadczalnie, że obniżenie temperatury krzepnięcia roztworu jest proporcjonalne do stężenia substancji rozpuszczonej. Wyraża to równanie;
gdzie: K - stała krioskopowa.
Obniżenie temperatury krzepniecia roztworów można wykorzystać do oznaczania masy cząsteczkowej substancji rozpuszczonej, w ten sam sposób, jak podwyższenie temperatury wrzenia.
Woda jako rozpuszczalnik
Najbardziej rozpowszechnionymi roztworami z którymi mamy do czynienia w życiu codziennym są roztwory wodne. Są to bardzo ważne roztwory, zrówno z punktu widzenia praktycznego, jak i przemysłowego. Właśnie w roztworach wodnych rozwinęły się pierwsze organizmy żywe, które z biegiem czasu rozwinęły się w organizmy, które mogły opuścić to środowisko wodne i wyruszyć na ląd i w powietrze. Organizmy opuszczając środowisko wodne zabrały ze sobą roztwory wodne w płynach tkankowych, plazmie krwi i w płynach międzykomórkowych, zawierających niezbędny zasób jonów i cząsteczek.
Woda jest efektywnym rozpuszczalnikiem wielu soli a wynika to z jej właściwości. Właściwość ta związana jest z dużym momentem dipolowym cząsteczek wody, a to ułatwia oddziaływanie pomiędzy cząsteczkami wody a rozpuszczanymi solami, które są substancjami polarnymi.
W chemii często cytuje się pożyteczne uogólnienie "podobne rozpuszcza podobne". |
Badając proces rozpuszczania różnych soli w wodzie daje się zauważyć, że jedne rozpuszczają się bardzo łatwo i szybko a inne z trudnością lub wcale nie ulegają rozpuszczeniu. A ponadto okazuje się, że w określonej ilości wody można w danej temperaturze rozpuścić ograniczoną ( a nie dowolną) ilość soli. W zależności od rodzaju soli, ilość rozpuszczonej soli jest różna.
Przykłady
Najwięcej w określonej ilości wody rozpuści się soli kuchennej (NaCl) a najmniej kredy i gipsu.
Miarą zdolności substancji do rozpuszczania się w wodzie jest rozpuszczalność.
Jest to wielkość, którą wyznacza się doświadczalnie i wyraża ona masę substancji rozpuszczonej wyrażoną w gramach, którą możemy rozpuścić w 100 gramach rozpuszczalnika z utworzeniem roztworu nasyconego. Inaczej jest to stężenie substancji rozpuszczonej w jej roztworze nasyconym. |
Przykłady
Dla wody kryterium rozpuszczalności jest liczba gramów substancji rozpuszczona w 100 g wody. Na tej podstawie substancje dzielimy
Substancje dobrze rozpuszczalne to substancje, których można w 100 g wody rozpuścić więcej niż 1 g |
Wyznaczone doświadczalnie rozpuszczalności różnych substancji w wodzie w formie tabel rozpuszczalności dostępne w podręcznikach do chemii (patrz niżej).
Tabela rozpuszczalności soli i wodorotlenków w wodzie
Ustawiając kursor na kratce otrzymany barwę substancji
Tabela rozpuszczalności |
KATIONY |
||||||||||||
|
Na+ |
K+ |
Ag+ |
Mg2+ |
Ca2+ |
Ba2+ |
Zn2+ |
Cu2+ |
Pb2+ |
Fe2+ |
Fe3+ |
Al3+ |
|
A |
OH- |
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl- |
|
|
|
|
|
|
|
|
|
|
|
|
|
Br- |
|
|
|
|
|
|
|
|
|
|
|
|
|
I- |
|
|
|
|
|
|
|
|
|
|
|
|
|
S2- |
|
|
|
|
|
|
|
|
|
|
|
|
|
NO3- |
|
|
|
|
|
|
|
|
|
|
|
|
|
CO32- |
|
|
|
|
|
|
|
|
|
|
|
|
|
SO42- |
|
|
|
|
|
|
|
|
|
|
|
|
|
PO43- |
|
|
|
|
|
|
|
|
|
|
|
|
|
SiO44- |
|
|
|
|
|
|
|
|
|
|
|
|
LEGENDA
|
bardzo słabo rozpuszczalny |
|
słabo rozpuszczalny |
|
dobrze rozpuszczalny |
|
bardzo dobrze rozpuszczalny |
|
zachodzą skomplikowane reakcje |
Wyznaczone doświadczalnie wartości rozpuszczalności dla soli pozwoliły pogrupować sole grupami zgodnie z podanymi wcześniej kryteriami.
Grupa substancji rozpuszczalnych
Grupa substancji praktycznie nierozpuszczalnych
Od czego zależy rozpuszczalność substancji?
Otóż okazuje się, że rozpuszczalność substancji zależy od;
W każdym przypadku wzrost wymienionych parametrów zwiększa rozpuszczalność substancji. Możesz to przetestować rozpuszczając różnego rodzaju sole w wodzie.
Zależność rozpuszczalności od temperatury
Rozpuszczalność substancji może wzrastać albo maleć ze wzrostem temperatury a wpływ na to ma energia oddziaływania substancja rozpuszczona-rozpuszczalnik.
|
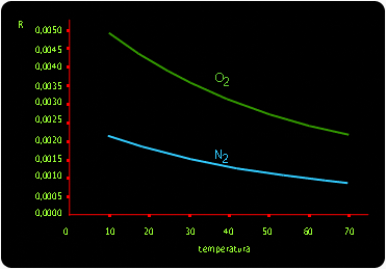
Jeżeli mamy do czynienia z procesem egzotermicznym, wtedy zgodnie z regułą przekory dostarczenie ciepła poprzez zwiększenie temperatury spowoduje przesunięcie równowagi w kierunku mniejszej rozpuszczalności. Natomiast dla procesów endotermicznych, rozpuszczalność będzie rosła wraz z temperaturą. Krzywe rozpuszczalności niektórych soli przedstawiono na rysunku 2. Sole wykazują przeważnie rozpuszczalność rosnącą ze wzrostem temperatury; znaczna liczba soli (NaCl, K2CrO4) przejawia niewielkie zmiany rozpuszczalności ze wzrostem temperatury; niektóre mają rozpuszczalność malejącą (Na2SO4, FeSO4*H2O). |
|
Rozpuszczalność uwodnionego siarczanu rośnie wraz z temperaturą (proces rozpuszczania jest procesem egzotermicznym). Powyżej temperatury 32,4oC rozpuszczaniu ulega bezwodny siarczan Na2SO4 którego rozpuszczalność maleje gdy rośnie temperatura (proces rozpuszczania jest procesem endotermicznym). Dla gazów wzrost temperatury zmniejsza rozpuszczalność - patrz rysunek 3. |
Rozpuszczalniki inne jak woda
Tymi innymi rozpuszczalnikami mogą być;
Do innych rozpuszczalników polarnych należą: nadtlenek wodoru, fluorowodór, ciekły amoniak i cyjanowodór. Podobnie jak woda, wszystkie te ciecze mają duże momenty dipolowe, stąd mechanizm rozpuszczania jest podobny.
Przykładem rozpuszczalnika niepolarnego jest benzyna, która jest mieszaniną węglowodorów. W odróżnieniu od wody, benzyna nie rozpuszcza soli kuchennej (NaCl), natomiast dobrze rozpuszcza benzen, naftalen i inne węglowodory. Podobnie jak woda, benzyna rozpuszcza alkohol etylowy.
Opisane zachowanie się rozpuszczalników jest potwierdzeniem reguły, że substancja rozpuszcza się w rozpuszczalnikach, które są do niej chemicznie podobne.
Fakt ten tłumaczy się oddziaływaniem międzycząsteczkowym. Na przykład sól kuchenna dlatego nie rozpuszcza się w benzenie ponieważ cząsteczki tego rozpuszczalnika słabiej oddziaływują na strukturę kryształu NaCl. Oddziaływanie to nie osłabia wzajemnego przyciągania jonów Na+ i Cl- i kryształ nie rozpada się. Odwrotnie w wodzie, wskutek oddziaływania polarnych cząsteczek wody osłabiamy wzajemne przyciąganie jonów Na+ i Cl- i tym samym powodujemy wyrwanie ich z sieci krystalicznej i rozpuszczenie w wodzie.
Substancje lub grupy, które przyciągają cząsteczki wody , nazywa się hydrofilowymi, a substancje lub grupy, które odpychają cząsteczki wody i przyciągają cząsteczki węglowodorów - hydrofobowymi. |
Roztwory cieczy w cieczy
Roztwory cieczy w cieczy są ważnymi roztworami z punktu widzenia ich zastosowania praktycznego i przemysłowego. Są to roztwory z którymi mamy codziennie kontakt. Na przykład takimi roztworami są różnego rodzaju paliwa (benzyna, olej napędowy), alkohole, rozpuszczalniki do farb, itp.
Podobnie jak i przy roztworach substancji stałych w cieczy również i przy przypadku roztworów cieczy w cieczy obserwujemy zmiany prężności par nad roztworem. Doświadczenia wykazały, że ogólna prężność pary nad roztworem będzie równa sumie cząstkowych prężności par obu ciekłych składników a cząstkowa prężność pary każdego ze składników będzie proporcjonalna do liczby cząsteczek tego składnika w roztworze.
Im bardziej lotny jest dany składnik roztworu i im większe jest jego stężenie w fazie ciekłej, tym większy jest jego udział w fazie gazowej. Zależność zmian prężności pary od składu roztworu ilustruje rysunek 4.
Na całkowitą prężność pary p roztworu o składzie x (rys.4a) składa się prężność pA bardziej lotnego składnika A oraz prężność pB mniej lotnego składnika B.
Jeżeli pod stałym ciśnieniem (zwykle atmosferycznym) podwyższymy temperaturę w układzie, to będzie także wzrastać prężność pary nad roztworem aż do osiągnięcia wartości odpowiadającej ciśnieniu panującemu w otoczeniu i roztwór przejdzie w stan wrzenia.
Dla warunków stałego ciśnienia, możemy sporządzić wykres (rys.4b) obrazujący zależność temperatury wrzenia roztworu od składu fazy ciekłej.
|
Roztwór o składzie x1 wrze w temperaturze T1, a para nad nim ma skład y1 tj. zawiera więcej lotnego składnika A. Para ta może być skierowana do chłodnicy i skroplona, a uzyskana ciecz (o składzie y1) powtórnie doprowadzona do wrzenia.
W wyniku destylacji skład cieczy wzbogaca się w mniej lotny składnik B (punkt x2) co powoduje wzrost temperatury wrzenia do wartości T2 oraz wzbogacenie składu pary w składnik B.
Jeżeli będziemy powtórzali wymienioną operację wielokrotnie (wrzenie, skraplanie, wrzenie, itd...) uzyskamy rozdzielenie roztworu na czysty, bardziej lotny składnik A oraz mniej lotny, czysty składnik B.
|
Ma to zastosowanie praktyczne w procesie rozdzialania mieszanin (roztworów) ciekłych. Proces ten nosi nazwę destylacji. W technice destylacyjnej istnieje szereg metod stosowanych zależnie od zamierzonego celu i charakteru substancji destylowanej. Do stosowanych metod zaliczamy; |
Największe zastosowanie przemysłowe ma metoda destylacji frakcjonowanej, która może odbywać się w sposób ciągły z zastosowaniem kolumn rektyfikacyjnych (rys.5).
Stężenia roztworów
Ilościowo skład roztworu określa się za pomocą stężenia. Do najczęściej stosowanych zalicza się:
Suma ułamków molowych w roztworze zawsze równa się jedności.
x1 + x2 = 1
Stężenie procentowe roztworu Cp
Stężenie procentowe roztworu Cp jest określane liczbą jednostek masowych (mg, g, kg, Mg) substancji rozpuszczonej zawartych w 100 jednostkach masowych (mg, g, kg, Mg) roztworu.
Związek między stężeniem procentowym roztworu Cp, liczbą jednostek masowych substancji rozpuszczonej a oraz liczbą jednostek rozpuszczalnika b wyprowadza się w następujący sposób: jeżeli w a + b jednostek masowych roztworu znajduje się a jednostek masowych substancji rozpuszczonej, to w 100 jednostkach masowych roztworu znajduje się Cp jednostek masowych substancji rozpuszczonej, czyli;
a + b j.mas. roztworu - a j. mas. substancji
100 j.mas.roztworu - Cp j. mas. substancji
Z powyższego otrzymujemy wzór na stężenie procentowe
x = 20*100 / 160 = 12,5 g
W 100 g otrzymanego roztworu znajduje się 12,5 g NaCl, a więc roztwór jest 12,5% - owy
x = 30*60 / 100 = 18 g
Masa roztworu po dodaniu wody wynosi: 30 g + 50 g = 80 g.Po rozcieńczeniu:
80 g roztworu zawiera 18 g substancji
100 g roztworu zawiera x g substancji
x = 18*100 / 80 = 22,5 g
Otrzymany roztwór jest 22,5%-owy
Stężenie molowe roztworu Cm
Stężenie molowe roztworu jest liczbą moli substancji rozpuszczonej w 1 dm3 roztworu
Stężenie molowe możemy wyrazić wzorem
gdzie; nj - ilość moli składnika j, V - objetość roztworu
Ilość moli składnika nj możemy obliczyć z wzoru
gdzie: mj - masa substancji j, Mj - masa molowa substancji j
Wstawiając wyrażenie na nj do wzoru na Cm otrzymamy
Przy obliczaniu stężeń molowych możemy korzystać z wzorów na stężenie molowe Cm lub z równań na proporcję
x = 4 x 300 / 1000 = 1,2 g NaOH
Rozwiązanie z wykorzystaniem wzoru W celu obliczenia masy NaOH wzór na Cm przekształcamy i otrzymujemy postać, która pozwala nam obliczenie masy NaOH.
mj = Cm*Mj*V
stąd wstawiając do wzoru dane otrzymamy.
mNaOH = 0,1 mol/dm3 * 40 g/mol * 0,3 dm3 = 1,2 g NaOH
W 300 dm3 0,1 molowego roztworu NaOH znajduje się 1,2 g NaOH
Uwaga Korzystając z równań na proporcję jak i z wzoru należy pamiętać o zastosowaniu właściwych jednostek. Jeżeli nie są zgodne, dokonujemy przeliczeń.
Ułamek molowy
Ułamek molowy Xj składnika nj w roztworze określa udział liczby moli danego składnika w całkowitej liczbie moli fazy mieszanej.
Zależność między ułamkiem molowym składnika Xj, liczbą moli tego składnika nj oraz ogólną liczbą moli składników tworzących roztwór (suma)nj jest następująca:
Dla dwuskładnikowego roztworu ułamki molowe obu komponentów są opisane równaniami:
czyli
X1 + X2 = 1
X1 = 2 / (2 + 3) = 0,4
X2 = 3 / (2 + 3) = 0,6
Odpowiedź Otrzymany roztwór składa się z 0,4 ułamka molowego H2SO4 i 0,6 ułamka molowego wody.
Przeliczanie jednostek stężenia
W praktyce chemicznej często zachodzi konieczność przeliczenia stężenia roztworu z jednych jednostek na inne, np. zamiana stężenia procentowego roztworu na stężenie molowe
W czasie przeliczania stężenia molowego na procentowe i odwrotnie wykorzystujemy równania na proporcje;
100 g - Cp (%)
1000 x d - x (g)
gdzie: d - gęstość roztworu (g/cm3)
Ponieważ stężenie molowe możemy wyrazić równaniem Cm = x / M, więc równania na proporcje możemy zapisać
100 g - Cp (%)
1000 x d - Cm*M(g)
gdzie - M - masa molowa substancji
Związek między stężeniem molowym i procentowym wyrażony wzorem (wyprowadzony z równań na proporcję), możemy zapisać.
x= (13,45 * 1140) / 100 = 153,33 g Na2CO3
Ponieważ masa molowa M Na2CO3 wynosi 106 g/mol to 153,33 g odpowiada 1,45 mola, ponieważ 153,33 : 106,0 = 1,45.
Rozwiązanie z wykorzystaniem wzoru
Cm = (10*d*Cp) / M = (10 * 1,14 * 13,45) / 106,0 = 1,45 mol/dm3
Odpowiedź Roztwór jest 1,45 molowy
x = (701,38 * 100) / 1480 = 47,4 g KOH
A to oznacza, że w 100 gramach roztworu jest 47,4 g KOH
Taki sam wynik osiągniemy korzystając z wzoru na przeliczanie jednostek stężenia (patrz wyżej)
Odpowiedź 12,5 molowy roztwór KOH jest 47,4%
Hydroliza soli
Powstające w wyniku dysocjacji elektrolitycznej soli jony są z punktu widzenia teorii kwasów Lewisa kwasami (kationy) lub zasadami (aniony), mogą więc one reagować z wodą tak, jakby były kwasami i zasadami w tradycyjnym rozumieniu (wg teorii Arrheniusa). To właśnie ta rekacja jest zwana reakcją hydrolizy elektrolitycznej. Przebiega podobnie do reakcji innych słabych elektrolitów, a więc (w przybliżeniu) zgodnie z prawem rozcieńczeń Ostwalda, gdzie stężeniem c jest stężenie wyjściowej soli. Jeżeli dana sól jest solą jednocześnie słabej zasady i słabego kwasu, wówczas podane poniżej rozwiązania komplikują się, gdyż wtedy powstające kationy i aniony są silnymi kwasami i zasadami Lewisa i prawo rozcieńczeń Ostwalda przestaje być dla nich spełnione.
Sól mocnego kwasu i słabej zasady
W przypadku soli mocnego kwasu i słabej zasady, jak np. chlorek amonowy, NH4Cl, kation NH4+ wchodząc w reakcję z wodą pełni funkcję kwasu odtwarzając w roztworze słabą zasadę, amoniak, NH3 (czyli NH4OH) oraz wytwarzając jony hydroniowe H3O+):
Stała hydrolizy
Stała równowagi tej reakcji jest równa stałej dysocjacji kwasowej jonu amonowego:
oraz po pominięciu produktów autodysocjacji wody (zob. prawo rozcieńczeń Ostwalda):
gdzie:
Sól słabego kwasu i mocnej zasady
Dla soli słabego kwasu i mocnej zasady (np. octan sodowy, CH3COONa), anion octanowy CH3COO- wchodzi w reakcję z cząsteczką wody z wytworzeniem cząsteczki kwasu octowego CH3COOH i anionu wodorotlenowego:
Stała równowagi hydrolizy jest równa stałej dysocjacji zasadowej jonu octanowego:
oraz jak powyżej:
gdzie:
Moc kwasu
Moc kwasu to ilościowa miara jego chemicznej „siły działania”. Miarą tej mocy jest zazwyczaj ujemny logarytm dziesiętny ze stałej dysocjacji kwasu w danych warunkach, oznaczany skrótem pKa.
pKa = - log10[Ka]
gdzie Ka to stała dysocjacji kwasu.
Czym pKa jest mniejsze tym moc kwasu jest większa.
Np: dla kwasu solnego w wodzie:
HCl + H2O -> H3O+ + Cl-
Ka = [H3O+][Cl-]/[HCl][H2O] = ~ 107
a zatem pKa kwasu solnego w wodzie wynosi -7.
Moc kwasów w tych samych warunkach zewnętrznych zależy od ich struktury chemicznej. W przypadku prostych kwasów nieorganicznych, zarówno w tych zawierających tlen w swojej strukturze (np: H2SO4, jak i beztlenowych (np: HCl), moc kwasu wzrasta wraz ze wzrostem elektroujemności centralnego atomu w reszcie kwasowej. W przypadku kwasów organicznych zależności te są bardziej złożone.
Nazwa kwasu |
pKa |
Kwas jodowy: (HI) |
-10 |
Kwas solny: (HCl) |
-7 |
Kwas azotowy (HNO3) |
-3.33 |
Kwas siarkowy: (H2SO4) |
-3 (x) |
Kwas fosforowy: (H3PO4) |
+2.12 (x) |
(x) = pKa1
Kwasy, które posiadają więcej niż jeden atom wodoru w cząsteczce posiadają zwykle więcej wartości pKa odpowiadające odrywaniu się kolejnych jonów hydroniowych (H+) w trakcie dysocjacji. Zazwyczaj pKa pierwszego etapu dysocjacji jest znacznie mniejsze od pozostałych, a zatem można powiedzieć, że pierwszy odrywający się atom wodoru jest „bardziej kwaśny” od pozostałych. Np: dla kwasu fosforowego (H3PO4), pKa1 = 2.12, pKa2 = 7.21, pKa3 = 12.67
Moc kwasu określa m.in zdolność do wypierania reszty kwasowej z soli. Kwas o większej mocy w reakcji z daną solą wypiera resztę kwasową pochodzącą ze słabszego kwasu. Kwas o mniejszej mocy nie będzie natomiast z solą mocniejszego kwasu w ogóle reagował.
Dane o pKa pochodzą z: Adam Bielański, Podstawy Chemii Nieorganicznej, PWN, W-wa 1994, T2, str. 356-361
Moc zasady
Moc zasady to ilościowa miara jej chemicznej "siły działania". Miarą tej mocy jest zazwyczaj ujemny logarytm dziesiętny ze stałej dysocjacji zasady w danych warunkach, oznaczany skrótem pKb.
pKb = - log10[Kb]
gdzie Kb to stała dysocjacji zasady.
Czym pKb jest mniejsze tym moc zasady jest większa.
Np: dla NaOH:
NaOH -> Na+OH-
Kb = [Na+][OH-]/[NaOH] > 1014, pKb < - 14.
Kb mocnych zasad (NaOH, KOH itp) w wodzie jest na tyle duże (powyżej 1014), że nie daje się ich zmierzyć żadnymi znanymi metodami, dlatego trudno jest porównywać ich moc i zazwyczaj przyjmuje się, że wszystkie silne zasady posiadają mniej więcej jednakową moc. Dopiero w przypadku słabszych zasad jest sens porównywać ich moc, jednak relacja między ich mocą i strukturą chemiczną jest dość złożona.
Nazwa zasady |
pKb |
3 |
|
4.7 |
|
13.8 |
Dane o pKb pochodzą z: Lech Pajdowski, Chemia Ogólna, PWN, W-wa 1981,
Obecnie najczęściej w tabelach podaje się zarówno dla zasad jak i kwasów wartości pKa, rzadko podając - a pozostawiając domyślności czytelnika - że podana dla zasady wartość pKa jest to wartość pKa dla kwasu sprzężonego do danej zasady. Np. dla amoniaku pKb> = 4.7, w tabeli znajdziemy pKa = 9.3, która to wartość odpowiada dysocjacji (jonizacji) kwasowej jonu amonowego NH4+ a także reakcji hydrolizy tegoż jonu.
Hydroliza
Hydroliza - reakcja chemiczna polegająca na rozpadzie cząsteczek związku chemicznego na dwa lub więcej mniejszych fragmentów pod wpływem kontaktu z wodą lub parą wodną - w szczególnym przypadku hydrolizy soli jest to reakcja z wodą jonów (z reguły z wytworzeniem odczynu kwaśnego lub zasadowego). Hydroliza jest szczególnym przypadkiem solwolizy.
Reakcje hydrolizy
Zazwyczaj, reakcja hydrolizy przebiega wg ogólnego schematu:
A-B + H2O → H-B + A-OH
choć są też możliwe bardziej złożone mechanizmy tej reakcji, np.
A-B + 2 H2O → A-OH + B-OH + H2
które zdarzają się w fazie gazowej w wysokiej temperaturze lub w warunkach elektrolizy.
Hydroliza jest procesem odwrotnym do kondensacji hydrolitycznej - tj. reakcji łączenia dwóch lub więcej cząsteczek z wydzieleniem cząsteczek wody.
Wiele reakcji hydrolizy ma charakter odwracalny, przy czym kierunek reakcji zależy od jej warunków:
Np. hydroliza estrów:
RCOOR' + H2O → RCOOH + R'OH
wymaga dostarczania do układu reakcyjnego odpowiedniej ilości wody, przy jej deficycie zaczyna zachodzić reakcja kondensacji dopiero co powstałego kwasu (RCOOH) i alkoholu (R'OH), która jest w gruncie rzeczy tą samą reakcją, tylko zapisaną odwrotnie:
RCOOH + R'OH → RCOOR' + H2O
Dysocjacja elektrolityczna i hydroliza soli
Reakcji hydrolizy nie należy mylić z dysocjacją elektrolityczną (w tym hydrolizą soli - lub ogólnie solwolizą soli - słabych kwasów i zasad) i solwatacją, której szczególnym przypadkiem jest hydratacja.
Dysocjacja polega na rozpadzie cząsteczki pod wpływem działania rozpuszczalnika (w tym również wody), ale bez tworzenia z nim wiązań kowalencyjnych, zaś hydratacja polega na tworzeniu się kompleksów z wodą poprzez wiązania wodorowe i inne oddziaływania słabe
www.student.e-tools.pl
Wyszukiwarka
Podobne podstrony:
Kolokwium I nieorganiczna- elektrochemia, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMI
PRZEWODNICTWO RÓWNOWAŻNIKWE ELEKTROLITÓW, studia, chemia, chemia fizyczna, sprawozdania
elektrochemia, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA laboratoriu
CHEMIA - LABORATORIUM - SPRAWOZDANIE - Wyznaczanie przewodnictwa granicznego elektrolitów, STUDIA
Dysocjacja elektrolityczna, AGH WIMiC, Rok II, Chemia Nieograniczna ROK II
ELEKTROLITY, Studia budownictwo pierwszy rok, Chemia budowlana, Chemia budowlana, Na Egzamin
w03 Dysocjacja elektrolity, Szkoła, penek, Przedmioty, Chemia, Laboratoria
8.Dysocjacja elektrolityczna - stopień i stała dysocjacji, Chemia ogólna ćwiczenia
elektrochemia, Studia, Mibm, semestr II, Chemia Fizyczna, Chemia fizyczna
Chemia XII Dysocjacja elektrolityczna
Chemia labolatorium, Dysocjacja elektrolityczna edycja, Rat
ćw9 - Elektrody jonoselektywne, studia, chemia fizyczna
Dysocjacja elektrolityczna, Chemia
CHEMIA - LABORATORIUM - SPRAWOZDANIE - Pomiar przewodności elektrolitycznej, STUDIA
Kinetyka reakcji elektroutlenienia 1-propanolu, studia, chemia, chemia fizyczna, sprawozdania, spraw
Elektronowe widma absorpcyjne, studia, chemia, chemia fizyczna, sprawozdania, sprawka
ELEKTROCHEMIA tekst, Studia, chemia
więcej podobnych podstron