|
|
|
|
|
|
|
|
|
WSTĘP
Elektrody jonoselektywne są to elektrochemiczne półogniwa, które selektywnie reagują na dany jon lub molekuły w obecności innych jonów zawartych w roztworze. Zasadniczą częścią elektrody jonoselektywnej jest membrana. Na granicy faz membrana - badany roztwór wytwarza się różnica potencjałów zależna od aktywności określonego jonu.
Jednym z istotniejszych parametrów charakteryzujących praktyczną przydatność elektrody jonoselektywnej jest współczynnik selektywności. Innym parametrem jest nachylenie krzywej kalibracji.
WYKONANIE ĆWICZENIA
Sporządzono osiem roztworów o stężeniach jonów Cl-: 10-2, 3*10-3, 10-3, 10-4, 3*10-5 , 10-5, 3*10-6, 10-6[mol/dm3]. Następnie zmierzono potencjał chlorkowej elektrody jonoselektywnej, względem elektrody odniesienia.
Lp. |
c Cl- [mol/dm3] |
-log c Cl- |
E [mV] |
1. |
0,000001 |
6,000000 |
380 |
2. |
0,000003 |
5,522879 |
409 |
3. |
0,00001 |
4,522879 |
381 |
4. |
0,00003 |
4,000000 |
360 |
5. |
0,0001 |
3,522879 |
330 |
6. |
0,001 |
3,000000 |
273 |
7. |
0,003 |
2,522879 |
244 |
8. |
0,01 |
2,000000 |
221 |
Na podstawie tabeli sporządzono wykres.
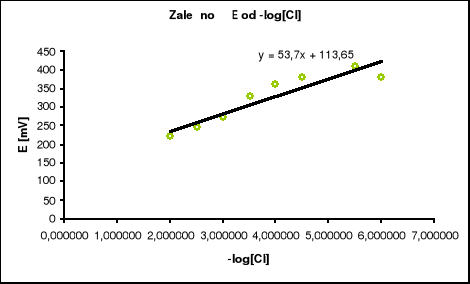
2. Na podstawie wykresu wyznaczono nachylenie krzywej kalibracji S, które wynosi 53,7
Potencjał standardowy elektrody E0 wyznaczony z równania prostej wynosi E0 = 113,65
3. Znając nachylenie krzywej kalibracji S, obliczono stężenie jonów Cl- w roztworze wyjściowym, korzystając ze zmierzonych wartości potencjałów:
V wzorca [cm3] |
E [mV] |
0,0 |
340 |
0,5 |
327 |
1,0 |
320 |
1,5 |
315 |
2,0 |
309 |
2,5 |
304 |
3,0 |
302 |
3,5 |
298 |
4,0 |
296 |
po dodaniu 0,5 cm3 roztworu wzorcowego o stężeniu 0,01 mol/dm3 (z pominięciem i uwzględnieniem efektu rozcieńczania)
![]()
= 0,01*0,01*(100,13 - 1)-1= 2,9*10-4 mol/dm3
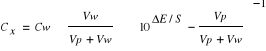
= 0,01 x 9,9*10-3 x (100,13 - 0,99)-1 = 2,84*10-4 mol/dm3
po dodaniu 3,0 cm3 roztworu wzorcowego o stężeniu 0.01 mol/dm3
![]()
= 6*10-4 (100,54 - 1) = 2,5*10-4 mol/dm3
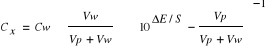
= 5,7*10-4 x (100,54 - 0,94)-1 = 2,25*10-4 mol/dm3
4. Obliczono stężenie jonów chlorkowych w roztworze wyjściowym według metody dwukrotnego dodatku wzorca:
dla

V = 0,5 cm3
![]()
E2=E2 - E1 = - mV
![]()
E3 = E3 - E1 = - mV
Z = ![]()
=1,
Cx = Z * ![]()
C =
dla

V = 2,0 cm3
![]()
E2=E2 - E1 = - mV
![]()
E3 = E3 - E1 = - mV
Z = ![]()
=1,
Cx = Z * ![]()
C =
5.
V wzorca [cm3] |
E [mV] |
Vp + Vw [cm3] |
Vp + Vw*10ES |
0,0 |
340 |
50,0 |
0,000023 |
0,5 |
327 |
50,5 |
0,000049 |
1,0 |
320 |
51,0 |
0,000067 |
1,5 |
315 |
51,5 |
0,000083 |
2,0 |
309 |
52,0 |
0,000109 |
2,5 |
304 |
52,5 |
0,000136 |
3,0 |
302 |
53,0 |
0,000149 |
3,5 |
298 |
53,5 |
0,000178 |
4,0 |
296 |
54,0 |
0,000196 |
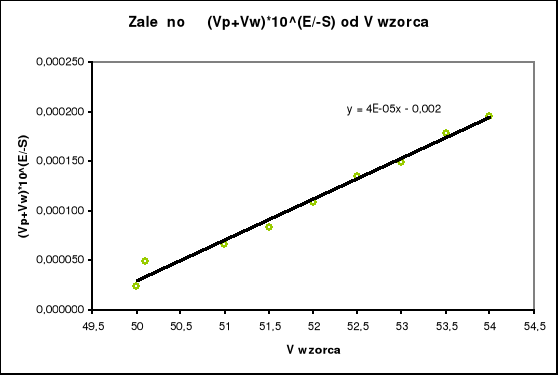
Na podstawie wykresu i tabeli obliczono stężenie jonów [Cl-] według równania:
![]()
Cx=0,000032*(0,01/0,05)=6,4*10-6 mol/dm3
WNIOSKI
Po dokonaniu obliczeń stężeń jonów Cl- metodą jednokrotnego i dwukrotnego dodatku wzorca widać, że uzyskane wyniki różnią się od siebie. Różnica ta może wynikać z niedokładności wykonywanych pomiarów oraz niedokładności używanego sprzętu pomiarowego. Ze zmierzonych wartości potencjału dla różnych roztworów wynika, że potencjał spada wraz ze wzrostem stężenia jonów Cl-
1
Wyszukiwarka
Podobne podstrony:
Elektrody jonoselektywne, Studia, Chemia fizyczna
Kinetyka reakcji elektroutlenienia 1-propanolu, studia, chemia, chemia fizyczna, sprawozdania, spraw
Elektrochemiczne utlenianie kwasu szczawiowego, Studia, Chemia fizyczna
chf wykład 6, Studia, Chemia, fizyczna, wykłady
ćw7 - Refrakcja i wyznaczanie momentu dipolowego, studia, chemia fizyczna
chf wykład 3, Studia, Chemia, fizyczna, wykłady
ćwiczeniee 43, materiały naukowe do szkół i na studia, chemia fizyczna moja, Chemia fizyczna, Opraco
chf wykład 8, Studia, Chemia, fizyczna, wykłady
chf wykład 1, Studia, Chemia, fizyczna, wykłady
chem fiz, Studia, Chemia, fizyczna, examin
chf wykład 5, Studia, Chemia, fizyczna, wykłady
7, Studia, Chemia fizyczna, Laborki
Sprawozdanie 12 do druku, Studia, Chemia fizyczna, Laborki, 12 - Równowaga fazowa ciecz-para
Chem fiz egz grupa A, Studia, Chemia fizyczna, Od Anki, egzaminy
2, Studia, Chemia fizyczna, Laborki
ćw2 - Napięcie powierzchniowe, studia, chemia fizyczna
chf wykład 4, Studia, Chemia, fizyczna, wykłady
Fizyczna I termin 22 VI 209, Studia, Chemia fizyczna, Od Anki
więcej podobnych podstron