Chemia Fizyczna wykład z dnia 1.04.2005
Termodynamika zajmuje się przemianami energetycznymi układów termodynamicznych.
Termodynamika klasyczna zajmuje się układami makroskopowymi
Granice układu - duże otoczenie względem układu
Faza - makroskopowo oddzielony podukład
Układ wybieramy tak aby był wyraźnie oddzielony od otocznia
Otoczenie jest zawsze duże w porównaniu z układem - dodanie/zabranie czegoś z otoczenia nie zmienia go - ma dużą pojemność
Energia - wielkość fizyczna charakteryzująca układ (ciało) związana z oddziaływaniami (siłami) zdolnymi do wywołania ruchu
Ecałk = Ekinet + Epot + U (energia wewnętrzna)
Różnorodność form energii powoduje niemożliwość określenia wartości całkowitej energii układu.
Termodynamika zajmuje się zmianami energii w układach (∆U, dU), a nie wartościami bezwzględnymi.
Energia układu jest funkcją parametrów stanu. Układ np. U(T.p.n) - jest jednoznaczna (jednemu zestawowi jedna wartość). Układ ma energię wewnętrzną zależną od temp. Ciśnienia, ilości moli substancji.
Energia wewnętrzna (U) - suma energii wszystkich cząsteczek w układzie.
Praca - to ilość energii przekazana poprzez uporządkowany (ukierunkowany) ruch.
Ciepło - ilość energii przekazanej poprzez nieuporządkowany (chaotyczny) ruch cząsteczek.
Temperatura - jest miarą średniej energii kinetycznej cząsteczek układu - żeby średnia wzrosła należy dodać energii (rozkład Boltzmana - rozkład zbliżony do rozkładu dzwonowego - średnie energie są najbardziej reprezentowane - jeśli zbiór jest dostatecznie duży.
Umownie:
+ zysk w stosunku do układu
- strata w stosunku do układu
Parametry stanu układu - wielkości fizyczne charakteryzujące stan układu, wielkości makroskopowe mierzalne takie jak: masa, gęstość, ciśnienie, temperatura, natężenie pola elektrycznego itp.
Parametry dzielimy na:
ekstensywne (addytywne) - zależne od masy (m, n, V)
intensywne - niezależne od masy (T, d, p)
Proces termodynamiczny to taka zmiana stanu układu, przy której zmienia się wartość choćby jednego parametru układu - zmiana parametru (∆) - różnica między wartością końcową i początkową
Termodynamika nie zajmuje się szybkością tego procesu ale stanem początkowym i końcowym.
Procesy:
Egzo - odpływ energii z układu ∆E<0
Endo - dopływ energii do układu ∆E>0
Klasyfikacja układów termodynamicznych
izolowane (odosobnione) - brak wymiany energii i masy z otoczeniem (np. naczynie termostatyczne) praktycznie niemożliwe do osiągnięcia.
Nieizolowane:
Otwarte - wymiana masy i energii z otoczeniem
Zamknięte - wymiana tylko energii z otoczeniem
Układy z punktu widzenia biologii
- komórka - układ otwarty - procesy mogą biegnąć stale. Wszystkie układy żywe są otwarte
Cechy układów biologicznych
wieloskładnikowość
wielofazowość (niejednorodność) są podukłady pomiędzy którymi są wyraźne granice.
Nieciągłośc
Otwartość
Nierównowagowość - w rownowadze nie ma procesów
Specyficzność
Funkcje termodynamiczne:
- Energia wewnętrzna (U) - suma wszystkich rodzajów energii wszystkich cząsteczek w układzie
U = Ecałk - Ekin - Epot
- Entalpia (H)
H = U + pV
∆H = ∆U + ∆(pV) = ∆U + p∆V + V∆p
- Entropia (S) - funkcja reprezentująca nieuporządkowanie układu.
∆S =![]()
im mniejsza entropia tym układ bardziej uporządkowany
- Entalpia swobodna (potencjał Gibbsa G)
G = H - TS
∆G = ∆H - T∆S - S∆T
Są to funkcje określające stan termodynamiczny układu, zależne tylko od tego stanu określone przez parametry stanu, niezależne od sposobu (drogi) dojścia do tego stanu (funkcje stanu)
Rodzaje procesów
izotermiczny - T = const ∆T = 0
izochoryczny - V = const ∆V = 0
izobaryczny - p = const ∆p = 0
adiabatyczny - Q = 0
Praca objętościowa:
W = F * dx
Gdy F(x) ≠ const
W = ∑ ( Fi*dxi) = 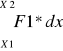
Gdy F(x) = const
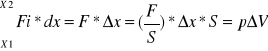
W= -p∆v PRACA OBJĘTOŚCIOWA (-) bo strata objętości czyli (∆V jest ujemne): wartość pracy dodatnia i wszystko ok.
I ZASADA TERMODYNAMIKI
Dla procesów izolowanych, niezależnie od procesów ∆U=0 - zasada zachowania energii
Dla układów zamkniętych ∆U = Q + Wobj + Wnieobj
Energia wewnętrzna układu zmienia się albo w procesach cieplnych, albo w wyniku pracy (zmieniającej objętość lub nie)
Praca nieobjętościowa to np. praca prądu elektrycznego
Dla układów otwartych ∆U = Q + Wobj + Wnieobj + ∆Um m - masa
Gdy Wnieob j= 0 a układ jest zamknięty to wtedy ∆U = Q + Wobj
∆U = Q - p∆V
Gdy proces jest izochoryczny ∆U = Qv V = const
Gdy p= const ∆U≠Q proces izobaryczny, wtedy wygodniejsza jest entalpia H=U+pV
∆H = ∆U + ∆(pV) = ∆U + p∆V +V∆p = Q - p∆V + p∆V + V∆p = Q + V∆p
gdy p=const : ∆H = Qp proces izobaryczny
Odwracalne i nieodwracalne rozprężanie gazu doskonałego
Jeśli proces biegnie powoli możliwe jest odwrócenie procesu (prawie)
Procesy quasistatyczne modeluję procesy odwracalne
Stan końcowy jest taki sam dla obu przypadków.
Odwracalność nie odnosi się do rodzaju układu, tylko do procesu.
Proces odwracalny - to proces po zajściu którego układ może powrócić do stanu początkowego tak aby i otoczenie powróciło do stanu początkowego.
Proces quasi - statyczny - proces, w którym nieskończenie mała zmiana wartości parametrów wystarcza do odwrócenia jego kierunku.
Realne procesy przebiegające bardzo powoli można traktować jako quasi - statyczne lub odwracalne.
Z notatek Tomka przepisał Mauryś - pozdro i miłej nauki
3
Wyszukiwarka
Podobne podstrony:
chf wykład 6, Studia, Chemia, fizyczna, wykłady
chf wykład 3, Studia, Chemia, fizyczna, wykłady
chf wykład 8, Studia, Chemia, fizyczna, wykłady
chf wykład 1, Studia, Chemia, fizyczna, wykłady
chf wykład 4, Studia, Chemia, fizyczna, wykłady
chf wykład 7, Studia, Chemia, fizyczna, wykłady
chf wykład 2, Studia, Chemia, fizyczna, wykłady
chf wykład 6, Studia, Chemia, fizyczna, wykłady
ćw7 - Refrakcja i wyznaczanie momentu dipolowego, studia, chemia fizyczna
ćwiczeniee 43, materiały naukowe do szkół i na studia, chemia fizyczna moja, Chemia fizyczna, Opraco
chem fiz, Studia, Chemia, fizyczna, examin
7, Studia, Chemia fizyczna, Laborki
Sprawozdanie 12 do druku, Studia, Chemia fizyczna, Laborki, 12 - Równowaga fazowa ciecz-para
Chem fiz egz grupa A, Studia, Chemia fizyczna, Od Anki, egzaminy
2, Studia, Chemia fizyczna, Laborki
ćw2 - Napięcie powierzchniowe, studia, chemia fizyczna
ćw9 - Elektrody jonoselektywne, studia, chemia fizyczna
Fizyczna I termin 22 VI 209, Studia, Chemia fizyczna, Od Anki
więcej podobnych podstron