ELEKTROCHEMIA
ELEKTROCHEMIA
Reakcje elektrochemiczne to reakcje utlenienia i redukcji zachodzące z udziałem elektronów wymienianych pomiędzy przewodnikiem elektronowym a elektrodą.
Reakcja utleniania substancji na powierzchni elektrody nosi nazwę reakcji anodowej, a elektroda na której zachodzi ta reakcja nosi nazwę anody.
Reakcja redukcji nazywa się reakcją katodową, a elektroda na której zachodzi nazywa się katodą.
Potencjał elektrochemiczny związany jest z reakcją utleniania lub redukcji metalu, bądź też orientacją cząsteczek z roztworu i jest równy różnicy potencjału na granicy faz metal/roztwór
Me ⇔ Me+n + ne
Jeżeli nie ma odpływu elektronów z elektrody, to między obu przeciwnie skierowanymi reakcjami (utleniania i redukcji) ustali się stan równowagi dynamicznej.
Powstanie różnica potencjałów między metalem a roztworem.
Jeżeli rozpatrujemy układ metal/ roztwór soli jonów własnych, to możemy zapisać równanie Nernsta
Równanie Nernsta
Rodzaje elektrod
Elektrody pierwszego rodzaju:
To elektrody metalowe i gazowe np. elektroda wodorowa.
Elektroda wodorowa zbudowana jest z platyny pokrytej czernią platynową (b. drobna platyna o dużej powierzchni), zanurzona w roztworze jonów własnych H+ (roztwór kwasu) i w strumieniu gazowego wodoru.
(Pt)H2 H+ Jeżeli ciśnienie gazowego H2 wynosi 1013 hPa, a aktywność jonów H+ = 1, to taką elektrodę nazywamy normalną elektrodą wodorową (NEW). Przyjęto, że jej potencjał jest równo zero.
Elektrody drugiego rodzaju, zbudowane są z metalu Me w kontakcie ze stałą trudno rozpuszczalną solą tego metalu MeA(s) i roztworu dobrze rozpuszczalnej soli dowolnego metalu Me1A z tym samym anionem.
Me MeA(s) Me1A
Hg Hg2Cl2 NaCl Ag AgCl Cl-
Cu Cu SO4 SO4-2
Szereg napięciowy metali
Metale zostały uszeregowane według rosnących wartości potencjału normalnego.
Potencjał normalny metalu jest to potencjał równowagowy, jaki wykazuje metal zanurzony w roztworze jonów własnych, gdy aktywność tych jonów wynosi 1 i mierzony jest względem normalnej elektrody wodorowej.
Szereg napięciowy metali informuje o wielu ważnych własnościach chemicznych metali.
1. Metale o niskim (ujemnym) potencjale normalnym są aktywne chemicznie, chętnie się pozbywają elektronów przechodząc w postać jonów. Łatwo się utleniają a trudno redukują.
2. Metale o dodatnich potencjałach normalnych są bierne chemicznie, tym bardziej im wyższy (bardziej dodatni) jest ten potencjał. Trudno jest je otrzymać w formie jonowej, łatwo się redukują (przyjmują elektrony), a trudno jest je utlenić.
3. Metal o niższym potencjale normalnym wypiera z roztworu pierwiastki o wyższym potencjale. Metale o bardziej ujemnych potencjałach mają zdolności redukujące względem innych metali mniej aktywnych:
Zn0 + Cu+2 = Zn+2 + Cu0
Ag0 + Au+ = Ag+ + Au0
4. Metale aktywne (o ujemnym potencjale normalnym) roztwarzając się w kwasach wypierają z nich wodór
Zn0 + HCl = ZnCl2 + H20
5. Metale o dodatnim potencjale normalnym roztwarzają się tylko w kwasach utleniających (stęż. kwas siarkowy, azotowy), nie wypierając przy tym wodoru z tych kwasów.
3Cu + 8HNO3 = 3 Cu(NO3)2 + 2 NO + 4H2O
Nie zachodzi reakcja Cu + HCl = CuCl2 + H2
Półogniwa
Półogniwo jest to przewodnik metaliczny zanurzony w roztworze
odpowiedniego elektrolitu lub w innym środowisku umożliwiającym przepływ ładunku przez granicę faz składających się na półogniwo.
Półogniwa I rodzaju są to metale zanurzone w elektrolicie zawierającym jony własne metalu (blaszka cynkowa zanurzona w roztworze chlorku cynku) Zn+2 + 2e- ⇔ Zn
Półogniwa II rodzaju tworzą metale np. Ag pokryte trudno roz-puszczalną solą tego metalu AgCl i zanurzone w roztworze o jonie Cl-
Półogniwa III rodzaju - gazowe składają się z metalu i roztworu nasyconego gazem Pt, H2 H+, Cl- Cl2, Pt (platyna obmywana wodorem i platyna obmywano chlorem pod ciśnieniem 1013 hPa)
Ogniwa
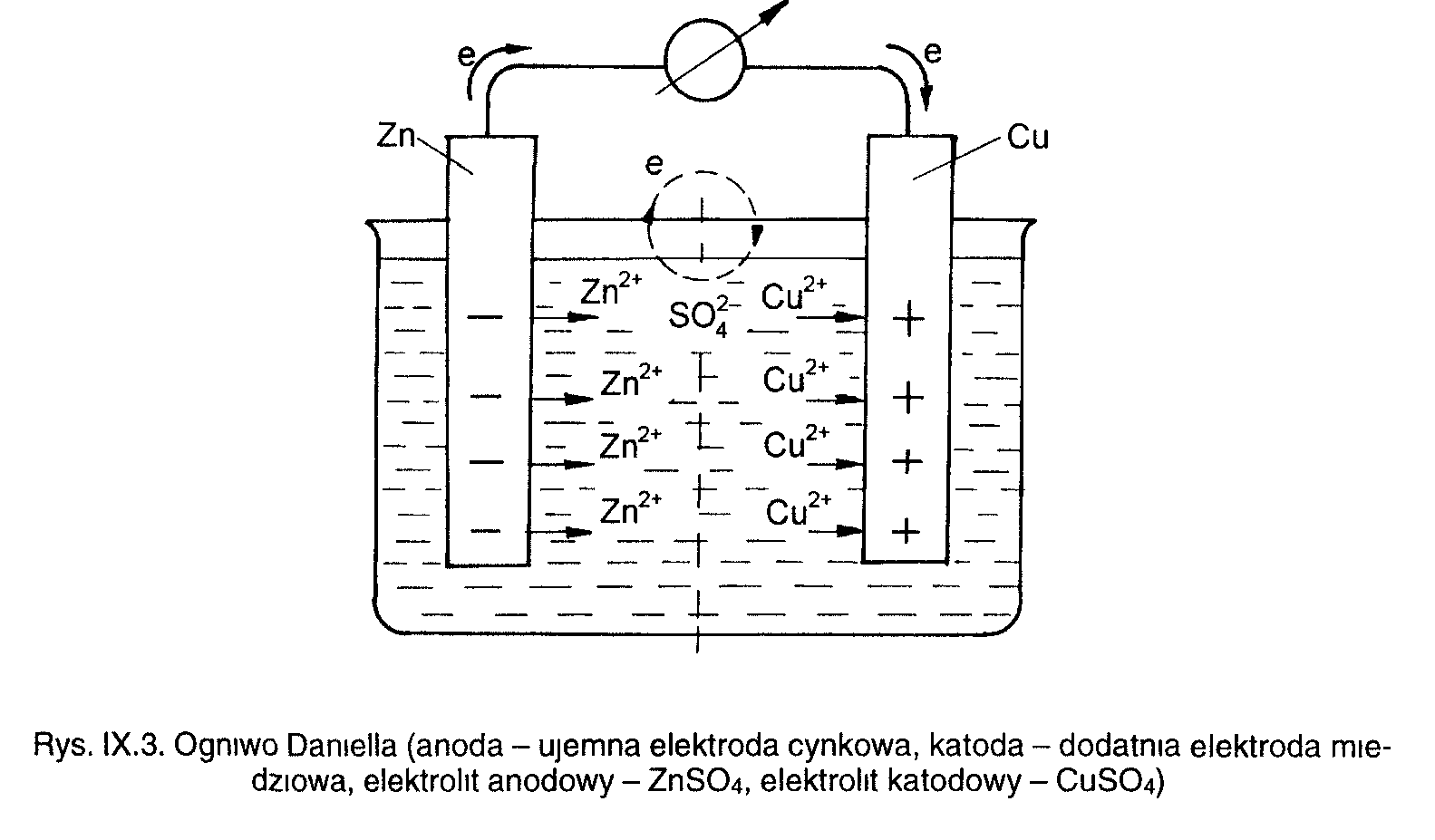
Układ dwóch elektrod spiętych przewodnikiem metalicznym, zanurzonych w elektrolicie nosi nazwę gniwa elektrochemicznego.
W ogniwie galwanicznym zużywając energię chemiczną uzyskujemy energię elektryczną.
Ogniwo stężeniowe
(-) Ag AgNO3 (c 1) AgNO3 (c 2) Ag (+)
Elektroda Ag zanurzona w rozcieńczonym roztworze c1 wysyła jony srebra do roztworu ładując się ujemnie (anoda - proces utleniania)
Na elektrodzie Ag zanurzonej w bardziej stężonym roztworze c2 redukują się jony srebra z roztworu (katoda - proces redukcji)
Akumulator niklowo - kadmowy
Cd Cd (OH)2 KOH, H2O NiOOH Ni
Elektroda ujemna -anoda - Cd, elektroda dodatnia - katoda - Ni pokryte NiOOH
Praca akumulatora - rozładowanie
A: Cd = Cd +2 + 2e
Cd +2 + 2OH ⇔ Cd(OH)2
K: 2NIOOH + 2 H2O + 2e = 2 Ni(OH)2 + 2OH-
Ładowanie akumulatora - praca jako ogniwo elektrolityczne
A: 2 Ni(OH)2 + 2OH- = 2NIOOH + 2 H2O + 2e
K: Cd(OH)2 ⇔ Cd +2 + 2OH-
Cd +2 + 2e = Cd
Ogniwo litowe
(-) Li LiClO4 Ti S2 (+)
w bezwodnym
rozpuszczalniku
Na elektrodzie litowej następuje utlenianie Li - e = Li+
Jony litu wędrują do drugiej elektrody, redukują się
Li+ + e = Li, wytworzony lit wbudowuje się w sieć krystaliczną TiS2
Ogniwa paliwowe
W których następuje przetworzenie energii uwalnianej
w procesie utleniania paliwa konwencjonalnego (wodoru, tlenku węgla, metanu) bezpośrednio w energię elektryczną
(-) H2gaz, Ni przewodnik jonowy Ni, O2 gaz (+)
(-) CO gaz M stopiony węglan M, O2 gaz (+)
gdzie M jest przewodnikiem metalicznym
Elektroliza
Elektrolizą określamy wszystkie procesy zachodzące w ogniwie elektrolitycznym pod wpływem prądu dostarczonego z zewnętrznego źródła prądu stałego.
I prawo Farada'ya - masa substancji wydzielonej na elektrodzie podczas elektrolizy jest proporcjonalna do natężenia prądu i czasu trwania elektrolizy.
II prawo Farada'ya - Masy różnych substancji wydzielone przez jednakową ilość elektryczności są proporcjonalne do równoważników chemicznych tych substancji.
Ogniwa elektrolityczne są stosowane w technologii chemicznej do otrzymywania chloru, fluoru, wodorotlenków metali alkalicznych, aluminium...
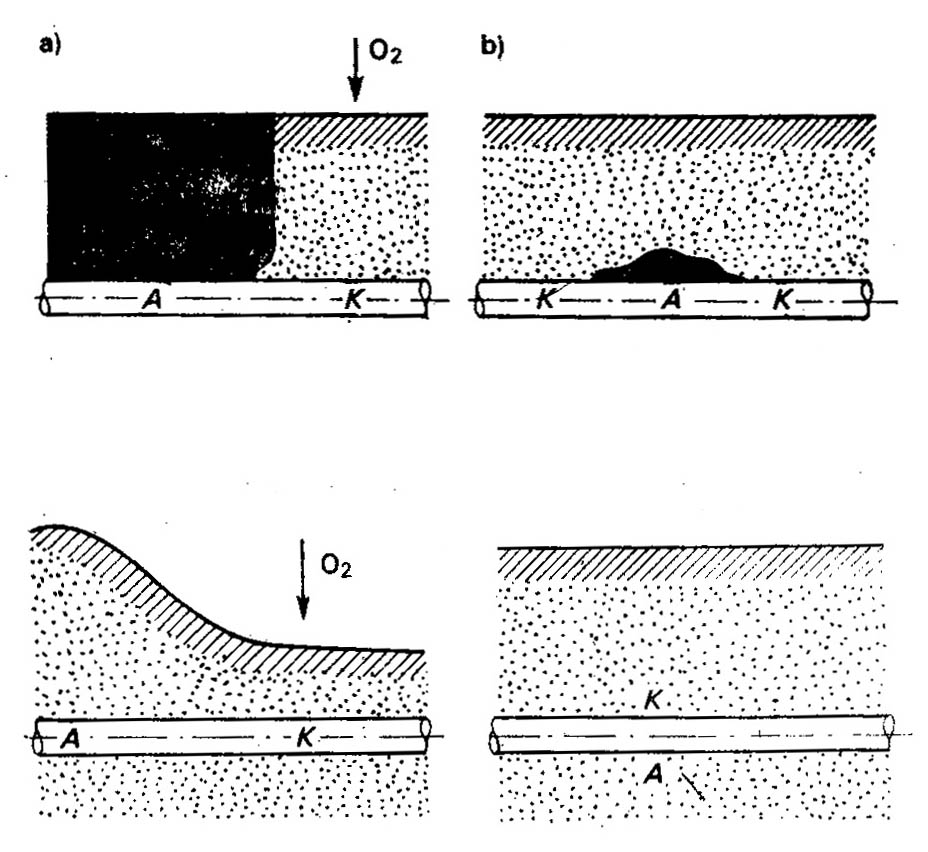
Korozja elektrochemiczna
W zależności od środowiska korozyjnego rozróżnia się:
- korozją atmosferyczną
- korozję gazową w gorących gazach,
- wodną w wodzie morskiej lub rzecznej,
- ziemną w glebie.
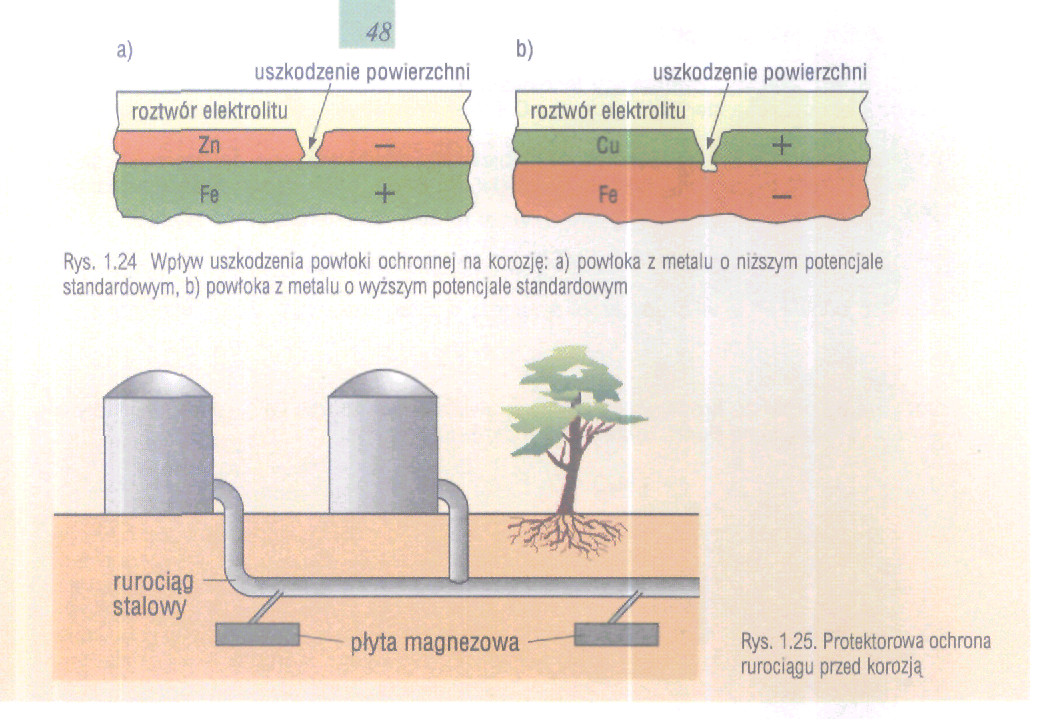
Ochrona przed korozją
Ochrona elektrochemiczna
1. Katodowa ochrona - oznacza, że przedmiot poddany ochronie spełnia rolę katody w korozyjnym ogniwie galwanicznym,
2. Anodowa ochrona stosowana jest dla metali, które ulegają pasywacji, tzn. na ich powierzchni możliwe jest utworzenie termodynamicznie trwałej warstewki tlenkowej lub solnej hamującej proces rozpuszczania.
Ogniwa geologiczne występują wyłącznie podczas korozji gruntowej, a przyczyną ich powstawania jest niejednorodność elektrolitu glebowego. Nierównomierne nawilgocenie gleb, różnice ich składu chemicznego sprzyjają trwałemu rozmieszczeniu ładunków elektrycznych na metalowej konstrukcji podziemnej.
|
Elektroda ujemna jest raz katodą -proces ładowania lub anodą - proces pracy.
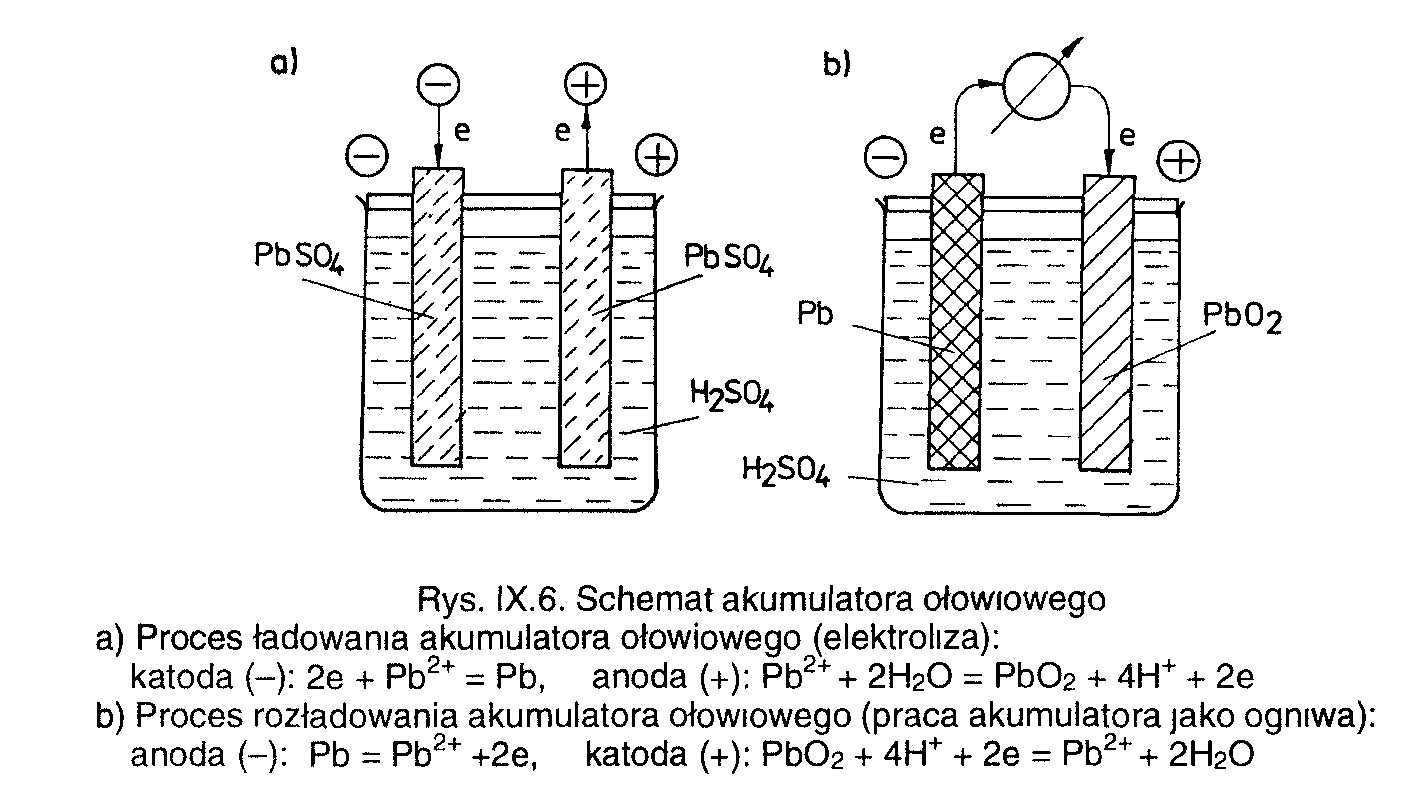
Elektroda ujemna jest raz katodą -proces ładowania lub anodą - proces pracy.
Elektroda ujemna jest raz katodą -proces ładowania lub anodą - proces pracy.
5
Wyszukiwarka
Podobne podstrony:
ćw9 - Elektrody jonoselektywne, studia, chemia fizyczna
Kinetyka reakcji elektroutlenienia 1-propanolu, studia, chemia, chemia fizyczna, sprawozdania, spraw
korozja chemiczna i elektrochemiczna metali, Studia, Chemia, chemia od Ines(1)
Elektrody jonoselektywne, Studia, Chemia fizyczna
Cwiczenie4 chemia ogolna- hydroliza elektroliza ogniwa, Studia, Chemia, Chemia laboratoria
Kolokwium I nieorganiczna- elektrochemia, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMI
PRZEWODNICTWO RÓWNOWAŻNIKWE ELEKTROLITÓW, studia, chemia, chemia fizyczna, sprawozdania
Elektroda szklana, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna c
Dysocjacja elektrolityczna, Studia, Chemia
elektrochemia, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA laboratoriu
Elektronowe widma absorpcyjne, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Elektrochemiczne utlenianie kwasu szczawiowego, Studia, Chemia fizyczna
Zestaw nr 6, Studia, chemia
elektra P4, Studia, SiMR, II ROK, III semestr, Elektrotechnika i Elektronika II, Elektra, Elektronik
Zestaw 7, Studia, chemia
tos2-2013d, Studia, chemia egzaminy
elektra M4, Studia, SiMR, II ROK, III semestr, Elektrotechnika i Elektronika II, Elektra, Elektronik
Głow2, Elektronika i telekomunikacja-studia, rok III, sem V, teo
wapno, Budownictwo-studia, chemia
więcej podobnych podstron