ZWIĄZKI KOMPLEKSOWE
Związek kompleksowy - związek, w którego skład wchodzą jony kompleksowe (składające się przynajmniej z dwóch rodzajów atomów) lub który jest cząsteczką kompleksową (składa się z więcej niż dwóch rodzajów atomów).
Składa się z atomu centralnego połączonego z ligandami wiązaniami koordynacyjnymi.
Atom centralny - jeden z atomów w jonie kompleksowym, który zajmuje w stosunku do pozostałych położenie centralne.
akceptor par elektronowych ligandów - dzięki nim łączy się z ligandami tworząc wiązania koordynacyjne
przeważnie jest to metal posiadający lukę elektronową
w szerszym ujęciu atom centralny może być niemetalem, np. NH4+, ClO4-, SO42-, PO43- lub SiO44-
Liczba koordynacyjna - liczba jonów lub cząsteczek (ligandów, addendów, podstawników) przyłączonych do atomu centralnego za pomocą wiązań koordynacyjnych.
zależy od średnicy atomu centralnego
najczęściej równa 4 lub 6 (rzadziej 2)
najczęściej jest zgodna z liczbą par elektronowych, które przyjmuje jon metalu uzyskując konfigurację elektronową zbliżoną do najbliższego gazu szlachetnego
Ligandy - cząsteczki lub jony wiążące się z atomem centralny tzw. atomem donorowym zawierającym wolną parę elektronową
pierwiastki IV, V, VI i VII grupy układu okresowego, jednak najczęściej są to: N,O,S
ligandy z tlenem donorowym nie są selektywne (tworzą kompleksy z większością metali); bardziej selektywne są ligandy z N, S lub C.
BUDOWA ZWIĄZKU KOMPLEKSOWEGO
są przykładem istnienia izomerii przestrzennej związków nieorganicznych
w kompleksach o liczbie koordynacyjnej 4 budowa tetraedryczna (hybrydyzacja sp3) lub płaska kwadratowa (hybrydyzacja dsp2)
w kompleksach o liczbie koordynacyjnej 6 budowa oktaedryczna (hybrydyzacja sp3d3 lub d2sp3)
ładunek jonu kompleksowego równa się sumie algebraicznej ładunków jonów zawartych w związku
sum algebraiczna ładunków jonu kompleksowego i jonów towarzyszących musi się równać 0
jony kompleksowe wykazują odmienne właściwości chemiczne od ich składników
TRWAŁOŚĆ JONU KOMPLEKSOWEGO:
Trwałość jonu kompleksowego zależy od:
stopnia osiągnięcia konfiguracji elektronowej gazu szlachetnego, np. jon Cu(CN)43- jest trwalszy niż jon Cu(NH3)42+, ponieważ:
Jon Cu2+ posiada 27 elektronów (29e - 2e = 27e). Od każdej cząsteczki amoniaku otrzymuje on 2 elektrony (łącznie 8 elektronów) i uzyskuje powłokę 35 elektronów, czyli konfigurację elektronową zbliżoną do atomu kryptonu (Z = 36).
Jon Cu+ posiada 28 elektronów (29e - e = 28e). Od każdego jonu CN- otrzymuje 2 elektrony (łącznie 8 elektronów) i uzyskuje powłokę 36 elektronów, czyli konfigurację tomu kryptonu (Z = 36).
Jon Cu(CN)43- posiada konfigurację elektronową „bliższą” atomowi kryptonu niż jon Cu(NH3)42+ i dlatego jest on trwalszy.
właściwości atomu centralnego:
klasa A - metale posiadające 8-elektronową powłokę zewnętrzną (litowce, berylowce i glin) - tworzą nietrwałe kompleksy
klasa B - metale posiadające 18-elektronową powłokę zewnętrzną (miedziowce, cynkowce, Ga, In, Tl, Ge, Sn, Pb, Sb i Bi) - tworzą kompleksy średniej trwałości
klasa C (metale przejściowe) - metale z niezapełnioną podpowłoką d (zewnątrzprzejściowe) lub z niezapełnioną podpowłoką f (wewnątrzprzejściowe) - tworzą najtrwalsze kompleksy
metale zewnątrzprzejściowe tworzą trwalsze kompleksy wraz ze wzrostem swojej liczby atomowej, np. Mn2+<Fe2+<Co2+<Ni2+<Cu2+>Zn2+
wzrost stopnia utlenienia metali zewnątrzprzejściowych zwiększa trwałość tworzonych przez nie kompleksów, np. kompleks Fe(III) będzie trwalszy niż kompleks Fe(II)
RODZAJE KOMPLEKSÓW:
Kompleksy proste - kompleksy utworzone tylko z ligandów jednofunkcyjnych (prostych, jednokoordynacyjnych, jednokleszczowych, jednopodstawnych), czyli takich, które zajmują tylko jedno miejsce w wewnętrznej strefie koordynacyjnej atomu centralnego.
zawierające jeden rodzaj ligandów, np. Cd(CN)42-, Co(NO2)63-, Cu(H2O)62+
zawierające dwa lub więcej rodzajów ligandów - kompleksy mieszane, np. [Co(NH3)2(NO2)4]-
z reguły rozpuszczalne w wodzie
kompleksy następcze (sukcesywne) - tworzą się w roztworach wodnych, gdy ligandy reagują z danym kationem stopniowo, mają coraz to większą liczbę ligandów, a pozostałe miejsca koordynacyjne zajmują cząsteczki wody
zazwyczaj związki nieorganiczne
Kompleksy nieorganiczne:
akwokompleksy, np. Cr(H2O)63+, Cu(H2O)42+, Al(H2O)63+
amminokompleksy - w roztworach wodnych i w stanie stałym, trwalsze niż akwokompleksy, np. Ag(NH3)2+, Cu(NH3)42+, Cd(NH3)42+, Co(NH3)62+, Zn(NH3)42+.
halogenokompleksy, np. BeF42-, HgCl42-, CuCl42-, CoCl42- (niebieski kompleks, przy zbyt małym stężeniu Cl- przechodzi w różowy akwokompleks)
cyjanokompleksy - nie ulegają zmianom w roztworach wodnych, np. Ag(CN)2-, Cu(CN)43-, Hg(CN)42-, Fe(CN)64-, Fe(CN)63-
kompleksy siarkocyjanianowe, np. Fe(NCS)2+, Fe(NCS)2+, Fe(NCS)4-, Fe(NCS)52-, Fe(NCS)63-, Hg(SCN)42-
kompleksy międzychlorowcowe - związki o ogólnym wzorze: X-n (gdzie n = 3,5,7), np. I3-, I5-, ICl4-, Br3-
kompleksy siarkosiarczkowe - jony siarczkowe łączą się z siarką tworząc polisiarczki o ogólnym wzorze Sn2- (gdzie n = 2,3,4…)
kompleksy siarczkowe - niektóre siarczki rozpuszczają się w roztworach siarczku sodu lub amonu z wytworzeniem kompleksu siarczkowego, np. HgS22-, AsS33-. AsS43-, SbS2-, SbS43-
kompleksy tiosiarczanowe, np.Ag(S2O3)23-, Bi(S2O3)33-, Pb(S2O3)22-
kompleksy tlenosiarczkowe, np. AsO3S3-, AsOS -, SbOS -, SnOS22-
kompleksy azotynowe, np. Co(NO2)63-
kompleksy szczawianowe, np. Fe(C2O4)33-, Pb(C2O4)22-, Al(C2O4)33-, Sn(C2O4)42-
hydroksokompleksy - kompleksy wodorotlenowe - wodorotlenki niektórych metali rozpuszczają się w nadmiarze roztworu NaOH tworząc kompleksy, np. Zn(OH)42-, Al(OH)4-, Cr(OH)4-
Kompleksy chelatowe - kompleksy, w których metal wchodzi w skład pierścienia heterocyklicznego; zawierają ligandy wielofunkcyjne (wielokleszczowe, wielopodstawne, wielokoordynacyjne), czyli takie, które posiadają więcej niż jeden atom donorowy i dzięki temu mogą zająć więcej niż jedno miejsce koordynacyjne metalu.
niemal wyłącznie związki organiczne
znacznie trwalsze niż kompleksy proste
największą trwałość wykazują chelaty z pierścieniami pięcioczłonowymi (nieco mniejszą z pierścieniami szcześcioczłonowymi) - mniejsza (4) lub większa (8) liczba atomów w pierścieniu jest powodem zbyt dużych naprężeń w cząsteczce i znacznym spadkiem trwałości takich kompleksów.
chelaty obdarzone ładunkiem są rozpuszczalne w wodzie, a chelaty obojętne (tzw. chelaty wewnętrzne) rozpuszczają się w rozpuszczalnikach niepolarnych
Chelaty wewętrzne - niektóre związki organiczne mogą zamknąć pierścień z wytworzeniem wiązania koordynacyjnego, np. między atomem wodoru w grupie hydroksylowej a atomem tlenu w grupie karbonylowej. Zastępując atom wodoru z grupy -OH atomem metalu można uzyskać chylat wewnętrzny, np. 8-hydroksychinolinę:
warunek powstania chelatów wewnętrznych: ligand organiczny musi zawierać w odpowiednim położeniu:
grupę kwasową, której atom wodoru może zostać zastąpiony atomem metalu, np. grupa karboksylowa (-COOH), hydroksylowa (-OH), oksymowi (-NOH), sulfonowa (-SO3H), tiulowa (-SH), iminowa (=NH)
grupę koordynującą wiążącą metal koordynacyjnie (musi ona zawierać atom donorowy z wolną parą elektronową), np. grupa karbonylowa (=CO), tiokarbonylowa (=CS), aminowa (-NH2) lub nitrozowa (-NO)
Kompleksony - kwasy aminopolikarbonowe i ich pochodne, np. kwas etylenodiaminotetraoctowy (EDTA), stosowane w kompleksonometrii
Kompleksy jonowo-asocjacyjne - związki powstające przez przyłączenie (asocjację) w wyniku przyciągania elektrostatycznego przeciwnie naładowanego jonu do połączenia koordynacyjnego będącego kationem lub anionem. Powstają wtedy kompleksy potrójne, gdzie wiązania między jonem centralnym a ligandem mają charakter jonowy.
Kompleksy wielordzeniowe - kompleksy zawierające więcej niż jeden atom centralny, powstają gdy ligand (organiczny lub nieorganiczny) wiąże dwa jony centralne tworząc między nimi mostek, np. bezwodny chlorek glinu:
polikwasy - kwasy zawierające wielordzeniowe aniony kompleksowe, w których rolę mostków pełnią jony O2-
izopolikwas - kwas tlenowy, w którym atom tlenu zastąpiono anionem tego samego kwasu, np. CrO42- Cr2O72- Cr3O102-
heteropolikwas - kwas tlenowy w którym atom tlenu zastąpiono anionem innego kwasu, np. kwas molibdenianofosforowy: H3P(Mo3O10)4 ∙ 29 H2O
Kompleksy labilne - kompleksy, w których równowaga pomiędzy składnikami kompleksu a utworzonym kompleksem ustala się bardzo szybko (mniej niż jedna minuta).
Kompleksy bierne - kompleksy, w których ta równowaga ustala się bardzo wolno (nieraz w ciągu wielu godzin), np. kompleksy glinu i żelaza z EDTA
NOMENKLATURA ZWIĄZKÓW KOMPLEKSOWYCH:
najpierw wymienia się ligandy, a dopiero potem atom centralny
liczbę ligandów określa się przedrostkiem di- tri- tetra- itd.
nazwy ligandów o ładunku ujemnym kończą się na -o; nazwy ligandów obojętnych nie zmieniają końcówek:
im większa wartość β1 tym kompleks jest trwalszy i tym mniejsza jest wartość K (β2);
określa w jakim stopniu dysocjuje jon kompleksowy
im mniejsza wartość β2 (lub K) tym trwalszy jon kompleksowy
wykorzystywana do maskowania jonów przeszkadzających w analizie chemicznej, tj, przeprowadzenia tych jonów w kompleks trwały, tak aby można wytrącić szukany jon w postaci osadu, np. maskowanie jonów Cu2+ podczas wykrywania jonów Cd2+ polega na dodaniu cyjanku, tak aby oba jony przeszły w kompleks o różnych stałych nietrwałości.jest równa odwrotności stałej trwałości:
często przedstawiana w postaci ujemnego logarytmu naturalnego: pK (tak samo jak pH) im większa wartość pK tym trwalszy jest jon kompleksowy
αM = 1, jeżeli jon metalu reaguje tylko z ligandem L tworząc kompleks
αM > 1, jeżeli jon metalu wchodzi w jakiekolwiek reakcje uboczne (konkurujące)
kwas czterozasadowy
słabo rozpuszczalny w wodzie stosowany w postaci kompleksonu III, czyli dwuwodnej soli sodowej: Na2H2Y ∙ 2H2O (Na2EDTA)
jest ligandem sześciokleszczowym
może tworzyć 5 pierścieni pięcioczłonowych
1 cząsteczka EDTA zawsze wiąże tylko 1 kation metalu niezależnie od jego wartościowości
najtrwalsze są połączenia EDTA z metalami czterowartościowymi, mniej trwałe z metalami trójwartościowymi, jeszcze mniej trwałe z metalami dwuwartościowymi, a z metalami jednowartościowymi tworzą się kompleksy zbyt mało trwałe, by móc je wykorzystać w chemii analitycznej:
tworzy również wodorokompleksy MHY oraz hydroksokompleksy MY(OH)n (w zakresie pH 5-9)stała trwałości kompleksu z metalu M z EDTA:
trwałość kompleksów wersenianowych zależy od pH, ponieważ jony H+ wiążą ligand Y4- w formy uwodornione (reakcje konkurencyjne)
dlatego w praktyce używa się warunkowej stałej trwałości:
Metalowskaźniki - barwne lub bezbarwne związki, mające zdolność do utworzenia w określonych warunkach miareczkowania barwnego kompleksu z jonami metalu oznaczanego lub użytego do odmiareczkowania nadmiaru kompleksonu.
mechanizm działania:
po dodaniu wskaźnika do miareczkowanego roztworu reaguje on z częścią jonów metalu znajdującą się w roztworze i przyjmuje zabarwienie typowe dla kompleksu metal-wskaźnik
podczas stopniowego dodawania EDTA reaguje on najpierw z wolnymi jonami metalu (tymi niezwiązanymi przez wskaźnik)
w pobliżu punktu końcowego miareczkowania EDTA zaczyna wypierać wskaźnik z kompleksu metal-wskaźnik i tworzy się kompleks metal-EDTA (ponieważ odznacza się on większą trwałością niż ten pierwszy)
pojawia się wtedy barwa wolnego wskaźnika (ewentualnie wskaźnik się odbarwia):
nazwy ligandów |
przykład kompleksu |
nazwa kompleksu |
H2O - akwa |
Cr(H2O)63+ |
kation heksaakwachromu(III) |
NH3 - amina |
[CoCl2(NH3)4]Cl |
chlorek tetraaminadichlorokobaltu (III) |
CN- - cyjano |
K3[Fe(CN)6] |
heksacyjanożelazian(III) potasu |
SCN - - tiocyjaniano |
Fe(SCN)4- |
tetratiocyjanianożelazian(III) |
NO3- - azotano |
Co(NO3)63- |
heksaazotanokobaltan(III) |
NO - nitrozyl |
K[Co(CN)(CO)2NO] |
cyjanodikarbonylnitrozylkobaltan(III) potasu |
CO - karbonyl |
|
|
CS - tiokarbonyl |
|
|
OH - - hydrokso |
Na[Al(OH)4] |
tetrahydroksoglinian sodu |
F - - fluoro |
BeF42- |
tetrafluoroberylan (?) |
Cl - - chloro |
HgCl42- |
tetrachlorortęcian(II) |
SO42- - siarczano |
|
|
S2O32- - tiosiarczano |
Ag(S2O3)23- |
ditiosiarczanosrebrzan(I) |
STAŁE RÓWNOWAGI REAKCJI KOMPLEKSOWANIA:
Każdy kompleks posiada dwie charakterystyczne dla siebie wielkości: stałą trwałości i stałą nietrwałości.
Dla ogólnej reakcji tworzenia kompleksu:
(M - atom centralny; L - ligand) zgodnie z prawem działania mas możemy napisać równanie na stałą trwałości kompleksu (czyli stałą równowagi reakcji tworzenia się kompleksu):
Dla reakcji odwrotnej - reakcji rozkładu jonu kompleksowego:
możemy napisać podobne równanie na stałą nietrwałości (stałą dysocjacji kompleksu) - często oznaczana także jako K:
Każdy kompleks dąży do tego, aby być jak najtrwalszy (mieć jak największą wartość pK) - ligandy bardziej kompleksotwórcze wypierają z kompleksu ligandy mniej kompleksotwórcze.
Najsłabsze kompleksy - akwokompleksy.
Sumaryczna (kumulatywna) stała trwałości - stała równowagi reakcji prowadzącej do wysycenia wszystkich miejsc koordynacyjnych atomu centralnego ligandami. Jest iloczynem kolejnych stałych trwałości (β1, β2, β3 itd.)
Ta sama zasada dotyczy stałej nietrwałości oraz pK (w tym wypadku poszczególne pk się sumują):
K = k1 ∙ k2 ∙ k3 ∙ k4 itd.
pK = pk1 + pk2 + pk3 + pk4 itd.
Najsilniej z atomem centralnym związany jest pierwszy ligand. Tworzeniu kompleksów o większej liczbie ligandów sprzyja zwiększenie stężenia ligandu i wyższe pH.
WARUNKOWE STAŁE TRWAŁOŚCI I NIETRWAŁOŚCI
Warunkowa stała trwałości - stała trwałości kompleksu w odniesieniu do konkretnych warunków (temperatury, siły jonowej, składu ilościowego i jakościowego) panujących w danym roztworze. Wyraża się wzorem:
[M'] - stężenie jonów metalu we wszystkich postaciach znajdujących się w roztworze z wyjątkiem kompleksu ML
[L'] - stężenie ligandu obecnego w roztworze we wszystkich postaciach z wyjątkiem kompleksu ML.
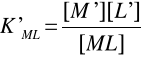
W podobny sposób można przedstawić warunkową stałą nietrwałości:
Współczynniki reakcji ubocznych α:
Stosunek stężenia jonów metalu (lub ligandu) we wszystkich postaciach w roztworze (z wyjątkiem kompleksu ML) do stężenia wolnych jonów metalu (lub ligandu):
Zależność między stałą trwałości a warunkową stałą trwałości:
Wartości αM i αL można także obliczyć znając stałe równowagi reakcji ubocznych:
[A] - stężenie konkurującego ligandu
KMA, KMA2 - kolejne stałe nietrwałości kompleksów metalu M z ligandem A
[B] - stężenie konkurującego jonu metalu
KBL, KB2L - kolejne stałe nietrwałości kompleksów metalu B z ligandem L
KOMPLEKSOMETRIA
Podstawą oznaczania jest reakcja tworzenia się trwałego, trudno dysocjującego i rozpuszczalnego związku kompleksowego. Najważniejszym działem kompleksometrii jest kompleksonometria - dział wykorzystujący metody oparte na stosowaniu tzw. kompleksonów.
KOMPLEKSONY - pochodne kwasu iminodioctowego, kwasy aminopolikarbonowe. Tworzą trwałe chelaty z różnymi kationami, dzięki ugrupowaniu grup karboksylowych i atomów azotu pozwalającemu na tworzenie pięcioczłonowych pierścieni chylatowych.
komplekson I - kwas nitrylotrioctowy (NTA)
komplekson IV - kwas heksametylenodiaminotetraoctowy (DCTA)
Komplekson II - kwas etylenodiaminotetraoctowy (EDTA, kwas wersenowy, H4Y):
Me2+ + H2Y- MeY2- + 2 H+
Me3+ + H2Y- MeY - + 2 H+
Me4+ + H2Y- MeY + 2 H+
Me+ - nietrwałe
Przykładowy kompleks metalu i EDTA:
KRZYWE MIARECZKOWANIA KOMPLEKSONOMETRYCZNEGO:
Krzywa ta ma przebieg analogiczny do przebiegu krzywej miareczkowania alkacymetrycznego.
pM - ujemny logarytm stężenia kationu
oś x - procent miareczkowania (objętość dodanego titrantu - roztworu EDTA)
Stężenie kationu początkowo zmniejsza się bardzo powoli, a w pobliżu punktu równoważnikowego zmniejsza się gwałtownie. Skok miareczkowania jest tym większy, im wyższy jest logarytm stałej trwałości pK.
Przed punktem równoważnikowym - cała ilość doprowadzonego ligandu (EDTA) została związana w kompleks MY. Stężenie jonów metalu powoli się zmniejsza.
W punkcie równoważnikowym - istnieje tylko kompleks MY oraz produkty jego dysocjacji - M oraz Y, których stężenia są sobie równe. Stężenie metalu w punkcie równoważnikowym miareczkowania zależy od stałej trwałości kompleksu oraz od początkowego stężenia jonów metalu - miareczkowanie kompleksonometryczne nie może dać dokładnych wyników, jeśli pK jest mniejsze niż 8 (jeżeli kompleks nie jest wystarczająco trwały nastąpi zbyt mały skok miareczkowania - patrz wykres wyżej).
Po przekroczeniu punktu równoważnikowego - w roztworze znajduje się nadmiar ligandu Y
SZYBKOŚĆ REAKCJI
Większość reakcji kompleksowania przebiega momentalnie, jednak niektóre kationy (głównie III wartościowe) tworzą trwałe akwokompleksy. Wobec tego ich reakcja z EDTA zachodzi wolniej (podstawienie cząsteczek wody z akwokompleksu ligandem Y zajmuje więcej czasu niż w przypadku innych reakcji).
Proces ten można przyspieszyć przez podgrzewanie. Stosuje się to m.in. w oznaczaniu jonów chromowych, w oznaczaniu glinu lub żelaza.
WSKAŹNIKI W KOMPLEKSONOMETRII
wskaźnik powinien spełniać odpowiednie wymagania w zakresie pH w jakim prowadzone jest miareczkowanie:
zabarwienie kompleksu metal-wskaźnik musi być silne nawet w pobliżu punktu końcowego miareczkowania, kiedy prawie cały metal jest związany z EDTA
specyficzna i selektywna reakcja barwna niezależna od czynników ubocznych
kompleks metal-wskaźnik musi być trwały (gdyż inaczej PK jest nieostry), ale nie może być trwalszy niż kompleks metal-EDTA
kompleks metal-wskaźnik musi pozostać w roztworze rzeczywistym (nie może wytrącić się jako osad, koloid, lak itp.)
wyraźna i łatwo dostrzegalna różnica barw między kompleksem metal-wskaźnik a wolnym wskaźnikiem
reakcja wskaźnika z metalem zachodzi natychmiastowo
czerń eriochromowa T (czerń ET): C20H18O7N2S
kwas trójzasadowysole sodowe dobrze rozpuszczalne w wodzie i różniące się od siebie barwą
- pH 6,3 i poniżej czerwony NaH2Ind
- pH 6,3 - 11,5 niebieski Na2HInd
- pH 11,5 i powyżej pomarańczowy Na3Ind
w zakresie 9-10,5 niebieska czerń ET tworzy winnoczerwone kompleksy z metalami (zwłaszcza Mg, Ca i Zn)
kompleks z magnezem trwalszy niż kompleks z wapniem
„dezaktywacja” czerni (powstaje zbyt trwały kompleks) - ślady Al, Co, Ni, Fe, Cu
kalces (wskaźnik Patrona i Reedera)
stosowany głównie do oznaczania wapniaw pH 12-13 niebieski kalce tworzy z wapniem winnoczerwony kompleks
należy do wskaźników orto-dihydroksyazowych (tak samo jak czerń ET)
mureksyd - sól amonowa kwasu purpurowego:
wzór przedstawia strukturę obojętną wskaźnikado pH ok. 6 (środowisko kwaśne) czerwonofioletowy
środowisko zasadowe (na skutek dysocjacji amidowych atomów wodoru) nebieskofioletowy
dawniej stosowany do oznaczania wapnia (przestano z powodu nieostrej zmiany barwy)
używany do oznaczania niklu, miedzi i kobaltu (mureksyd tworzy z nimi żółte kompleksy)
kwas salicylowy i kwas sulfosalicylowy:
bezbarwne związki tworzące czerwonofioletowy kompleks z jonami Fe3+ w środowisku kwaśnym
chromoforem jest zdeformowany kation
2. Wskaźniki red-oks
używane samodzielnie przy miareczkowaniu jonów metalu o dużym potencjale red-oks, np. Fe3+ lub Cu2+ - przed osiągnięciem PK roztwór ma barwę charakterystyczną dla formy utlenionej wskaźnika, w pobliżu PK, gdy prawie cały metal jest związany w kompleks potencjał red-oks jest zbyt niski by utlenić wskaźnik, więc przechodzi on w formę zredukowaną o odmiennej barwie
używane w połączeniu z układem Browna-Hayesa (tj. mieszaniną [Fe(CN)6]3- i [Fe(CN)6]4- przy odmiareczkowywaniu nadmiaru kompleksonu roztworem Zn2+ - po przekroczeniu PR w roztworze pojawiają się wolne jony Zn2+ (niezwiązane z kompleksonem), które reagują z jonami [Fe(CN)6]4- powodując zwiększenie się potencjału red-oks w roztworze, utlenienie wskaźnika i tym samym zmianę jego barwy
błękit wariaminowy (forma utleniona: niebieska, zredukowana: bezbarwna)
3,3'-dimetylonaftydyna (forma utleniona: czerwona, zredukowana: bezbarwna)
TYPY MIARECZKOWAŃ KOMPLEKSONOMETRYCZNYCH
Miareczkowanie bezpośrednie (miareczkowanie roztworu danego kationu roztworem kompleksonu) jest możliwe, jeżeli:
kompleks kation-EDTA jest dostatecznie trwały;
szybka reakcja kompleksowania
kation metalu nie ulega hydrolizie
dysponujemy odpowiednim wskaźnikiem (chelaty wielu wskaźników w środowisku kwaśnym i bardzo kwaśnym są bardzo zdysocjowane albo praktycznie nie istnieją miareczkowanie to przeprowadza się w środowisku zasadowym albo słabo kwasowym)
Miareczkowanie odwrotne (odmiareczkowywanie) - po dodaniu do analizy znanej ilości mianowanego roztworu kompleksonu odmiareczkowywujemy nadmiar tego kompleksonu (to co nie przereaguje z kationem z analizy) mianowanym roztworem soli magnezu lub cynku. Stosowane gdy:
brak odpowiedniego wskaźnika
kompleks kation-wskaźnik jest zbyt trwały
kompleks kation-EDTA tworzy się zbyt wolno
kompleks magnez-EDTA (lub cynk-EDTA) musi być mniej trwały niż kompleks z oznaczanym metalem
np. oznaczanie glinu - odmiareczkowywanie nadmiaru EDTA roztworem soli Fe3+ wobec kwasu sulfosalicylowego w środowisku kwaśnym
Miareczkowanie podstawieniowe - wykorzystuje się tutaj różnice w trwałości kompleksów różnych metali z EDTA. Do roztworu z oznaczanym kationem dodaje się stałego, słabszego kompleksu innego metalu z EDTA (np. Mg-EDTA) lub soli tego metaliu. Następuje reakcja podstawiania:
Wydzielony magnez miareczkujemy mianowanym roztworem EDTA.
metoda wykorzystywana, gdy brakuje odpowiedniego wskaźnika dla oznaczanego metalu
np. miareczkowanie wapnia wobec czerni ET po dodaniu soli magnezu
Miareczkowanie pośrednie - oznaczany anion wytrąca się w postaci osadu, następnie rozpuszcza się ten osad i oznacza zawartość kationu związanego z anionem, np. kompleksonometryczne oznaczanie glinu - jony glinu wiąże się z EDTA (odpowiednik wytrącenia osadu) dodanym w nadmiarze, nadmiar ten odmiareczkowuje się (solą Cu lub Zn); kompleks Al-EDTA rozkłada się za pomocą NaF (rozpuszczenie osadu), a uwolniony EDTA miareczkuje się (miareczkowanie anionu) i na tej podstawie oblicza się zawartość glinu (kationu).
ZWIĘKSZANIE SELEKTYWNOŚCI EDTA:
Wstępne rozdzielenie grup pierwiastków za pomocą wytrącania - wytrąca się osad kationów przeszkadzających odpowiednim odczynnikiem.
Dobór pH: w niskim pH (środowisko kwaśne i bardzo kwaśne) można miareczkować tylko kationy tworzące z EDTA najtrwalsze kompleksy, np. Fe3+ w pH=2 można miareczkować mimo obecności Ca2+, Mg2+, Mn2+ czy Al3+
Kompleksy metali dwuwartościowych trwałe w środowisku zasadowym
Kompleksy metali trójwartościowych trwałe w pH 1-3
Kompleksy metali czterowartościowych trwałe w pH poniżej 1
Maskowanie - związanie jonów przeszkadzających w związki o trwałości większej niż trwałość ich kompleksów z EDTA. Najczęściej stosowane środki maskujące:
cyjanek potasu (KCN) - wiąże Hg2+, Cd2+, Co2+, Zn2+, Fe2+, które przeszkadzają w oznaczaniu Ca2+ i Mg2+
trietanoloamina - wiąże Fe, Al i Mn przy miareczkowaniu Mg i Ca
fluorek amonu (NH4F) lub fluorek sodu (NaF) - maskuje Al, Ti, Be
kwas tiojabłkowy
ROZTWÓR MIANOWANY EDTA - metody otrzymywania:
Rozpuszczenie ściśle określonej ilości CZYSTEJ dwuwodnej soli sodowej wersenianu: Na2H2Y∙2H2O w wodzie destylowanej i rozcieńczenie roztworu do określonej objętości.
2. W przypadku zanieczyszczonego EDTA:
odważyć więcej wersenianu niż teoretycznie potrzeba
w razie potrzeby roztwór przesączyć
nastawić miano roztworu na roztwór wzorcowy odpowiedniego metalu
miano należy nastawiać przy zachowaniu takich samych warunków i takiej samej procedury, jakie będą stosowane podczas wykonywania oznaczeń
Roztwory Na2EDTA przechowywane w butelkach szklanych są trwałe i nie zmieniają miana nawet przez kilka miesięcy, ale roztwory o mniejszych stężeniach przechowuje się w butelkach polietylenowych, aby zapobiec reakcji kompleksonu ze składnikami szkła.
OZNACZENIA KOMPLEKSONOMETRYCZNE:
Oznaczanie wapnia i magnezu (PRACOWNIA):
Oznaczenie przeprowadza się w dwóch kolbkach:
KOLBKA I - oznaczanie wapnia i magnezu razem (a) |
KOLBKA II - oznaczanie samego wapnia (b) |
1) pH 10-10,5 (najwyraźniejsza zmiana barwy wskaźnika) WYKONANIE: - analizę rozcieńczyć do współmierności - 1 pipetę przenieść do zlewki - dodać 5 ml buforu amonowego (utrzymuje on pH w żądanym zakresie) - dodać szczyptę czerni ET - ogrzać do temperatury ok. 60°C - miareczkować mianowanym roztworem EDTA do zmiany barwy z czerwonej na niebieską |
1) pH = 12 (magnez wytrąca się jako wodorotlenek i nie przeszkadza) WYKONANIE: - 1 pipetę analizy przenieść do zlewki - dodać 5 ml roztworu NaOH (2 mol/dm3) (w celu wytrącenia magnezu) - dodać szczyptę kalcesu - OD RAZU miareczkować mianowanym roztworem EDTA do zmiany barwy z czerwonej na niebieską |
objętość EDTA zużyta na skompleksowanie Ca = b
objętość EDTA zużyta na skompleksowanie Mg = a-b
miareczkowanie samego wapnia (bez magnezu) wobec czerni ET jest trudne ze względu na mało wyraźną zmianę barwy wskaźnika (dodaje się wtedy znaną ilość soli magnezowej i uwzględnia to w obliczeniach)
przed oznaczaniem z analizowanego roztworu należy usunąć inne jony, np. Ba2+, Cu2+, Mn2+, Fe2+, Al3+ przez ich wytrącenie bądź maskowanie
2. Oznaczanie żelaza i glinu
a) najpierw oznaczamy ŻELAZO:
pH = 1-3 (jony Fe3+ tworzą jedne z najtrwalszych kompleksów z EDTA nawet w środowisku bardzo kwaśnym)
wskaźnik: kwas salicylowy lub kwas sulfosalicylowy
PK - zmiana barwy z czerwonofioletowej na żółtą
ogrzanie roztworu do 40-70°C przyspiesza reakcję kompleksowania
oznaczanie GLINU (w tym samym roztworze)
bezpośrednio przy pH = 3 w temperaturze wrzenia mianowanym roztworem EDTA wobec kompleksu Cu-EDTA i PAN jako wskaźnika
przez odmiareczkowanie - dodaje się nadmiar EDTA, gotuje się kilka minut, po czym odmiareczkowuje się nadmiar EDTA mianowanym roztworem soli cynku (lub innego metalu tworzącego z EDTA słabsze kompleksy niż glin) wobec odpowiedniego wskaźnika, np. układ wskaźnikowy Browna i Hayesa oraz 3,3'-dimetylonaftydyna (po zwiększeniu się potencjału red-oks w roztworze zmiana barwy na fioletowoczerwoną)
Oznaczanie bizmutu w preparatach farmaceutycznych:
w środowisku kwaśnym (pH = 2-3)
titrant: mianowany roztwór wersenianu
wskaźnik: fiolet pirokatechinowy
zmiana barwy z niebieskiej na żółtą (wolny wskaźnik) z przejściową barwą fioletową pod koniec miareczkowania
przeszkadzają Fe3+ redukcja kwasem askorbinowym do Fe2+ (tworzą słaby kompleks z EDTA)
Hg redukcja kwasem mrówkowym do rtęci metalicznej (nie wpływa na barwę wskaźnika)
przeszkadzają również chlorki, fosforany, winiany, cytryniany, szczawiany i fluorki
PRECYPITOMETRIA
Argentometria - dział oznaczeń precypitometrycznych opartych na tworzeniu się trudno rozpuszczalnych soli srebra.
Podstawa oznaczenia: wydzielenie oznaczanej substancji w postaci trudno rozpuszczalnego osadu przy użyciu mianowanego roztworu odpowiedniej drugiej substancji.
Punkt końcowy miareczkowania:
dodana kropla odczynnika nie wytrąca już kolejnej porcji osadu
zastosowanie odpowiedniego wskaźnika (zmiana barwy) częściej stosowane
Metoda Gay-Lussaca:
oznaczanie srebra:
przed końcem miareczkowania pobrać 2 jednakowe próbki klarownego roztworu znad osadu
do jednej dodać AgNO3 a do drugiej AgCl (w tych samych ilościach i stężeniu)
większe zmętnienie w próbce z AgNO3 przemiareczkowanie
większe zmętnienie w próbce z AgCl koniec miareczkowania nie osiągnięty
takie samo zmętnienie w obu próbkach punkt równoważnikowy
oznaczanie soli trudniej rozpuszczalnych niż chlorek srebra:
pobranie porcji klarownego roztworu znad osadu i dodanie odczynnika; zmętnienie oznacza, że miareczkowania nie można jeszcze zakończyć
KRZYWA MIARECZKOWANIA PRECYPITOMETRYCZNEGO:
Krzywa miareczkowania jonów Cl- mianowanym roztworem AgNO3
w miarę dolewania AgNO3 stężenie Cl- w roztworze początkowo maleje bardzo powoli, następnie coraz szybciej
w pobliżu punktu równoważnikowego zmniejszenie stężenia Cl- następuje skokowo
zgodnie z prawem iloczynu rozpuszczalności stężenie oznaczanego jonu nigdy nie może zmniejszyć się do zera
ŹRÓDŁA BŁĘDÓW W ANALIZIE WYTRĄCENIOWEJ:
Zbyt duża rozpuszczalność osadu - iloczyn stężeń jonów tworzących osad musi osiągnąć wartość iloczynu rozpuszczalności zanim osad się wytrąci; zbyt wysoka wartość Ir powoduje znaczące różnice w objętości zużytego odczynnika (zawyżenie wyników miareczkowania).
Adsorpcja - osad adsorbuje na powierzchni jony z jakich sam się składa część oznaczanej substancji zostaje uwięziona wewnątrz osadu (w postaci niezwiązanych jonów) co zaniża wyniki miareczkowania miareczkowanie należy przeprowadzać powoli, energicznie mieszając
Tworzenie się koloidów - osad w postaci koloidu jest bardziej reaktywny przez co łatwiej przebiegają reakcje uboczne
METODY: Mohra i Vohlarda - porównanie:
METODA MOHRA |
METODA VOHLARDA |
dla oznaczania Cl- lub Br-: |
dla oznaczania Ag+: |
wskaźnik: K2CrO4 |
wskaźnik: FeNH4(SO4)2∙12H2O |
titrant: mianowany roztwór AgNO3 |
titrant: mianowany roztwór NH4SCN |
PK: nadmiar titrantu wytrąca czerwonobru-natny osad Ag2CrO4
|
PK: nadmiar titrantu wywołuje czerwone zabarwienie (kompleks SCN- i Fe3+):
|
środowisko: obojętne - w kwasowym powstaje dichromian, następuje zmniejszenie stężenia CrO42- i zwiększa się błąd miareczkowania
- w zasadowym wytrąca się Ag2O zwiększenie wyników miareczkowania
|
środowisko: kwasowe - w środowisku obojętnym lub zasadowym jony Fe3+ ulegają hydrolizie zabarwiając roztwór i utrudniając uchwycenie punktu końcowego miareczkowania |
jony przeszkadzające: - aniony tworzące trudno rozpuszczalne sole srebra w środowisku obojętnym - kationy wytrącające CrO42- - substancje redukujące AgNO3 do srebra metalicznego
|
dzięki środowisku kwasowemu nie przeszkadzają fosforany, szczawiany ani arseniany |
BŁĄD METODY: Iloczyn rozpuszczalności Ag2CrO4 jest wyższy od Ir dla AgCl, więc stężenie Ag+ w punkcie równoważnikowym (momencie wytrącenia AgCl) jest niewystarczające do utworzenia osadu Ag2CrO4. Wytrąca się on dopiero po dodaniu pewnego nadmiaru AgNO3 (źródło błędu). |
BŁĄD METODY: W PR [Ag+] jest zbyt małe aby osiągnąć wartość Ir dla AgCl (ponieważ jest ona mniejsza niż Ir dla AgSCN). Dlatego część AgCl rozpuszcza się i roztwór zawiera więcej Ag+ niż powinien. Dodanie rodanku powoduje wytrącenie AgSCN (nadmiar SCN- reaguje z Fe3+ zabarwiając roztwór) i spada [Ag+] co powoduje ponowne rozpuszczenie części osadu AgCl. Powstałe w ten sposób Ag+ wiąże SCN- przez co roztwór odbarwia się. Dzieje się tak do momentu w którym [Cl-] nie będzie na tyle wysokie by Ir AgCl mógł być osiągnięty bez rozpuszczania osadu. |
dla oznaczania Ag+ |
dla oznaczania Cl- |
1) dodać nadmiar mianowanego roztworu NaCl 2) odmiareczkować nadmiar NaCl mianowanym roztworem AgNO3 (jak wyżej) |
1) do zakwaszonego roztworu chlorku dodać nadmiar mianowanego roztworu AgNO3 2) odmiareczkować nadmiar AgNO3 mianowanym roztworem NH4SCN w obecności Fe3+ |
MIANOWANE ROZTWORY:
Mianowany roztwór AgNO3:
bezpośrednio przez rozpuszczenie odpowiedniej naważki w wodzie destylowanej i rozcieńczenie do odpowiedniej objętości
AgNO3 można oczyścić przez krystalizację z roztworu w rozcieńczonym kwasie azotowym
po pewnym czasie miano może ulec zmianie
można też nastawić miano na roztwór mianowany NaCl lub KCl - miareczkując AgNO3 roztworem mianowanym w obecności K2CrO4 do pojawienia się czerwonobrunatnego osadu
Mianowany roztwór NH4SCN:
jest to sól higroskopijna, należy więc odważyć jej więcej niż wynika z masy molowej
miano NH4SCN ustala się na roztwór mianowany AgNO3 w obecności ałunu żelazowoamonowego (do uzyskania trwałej jasnoczerwonej barwy) lub na srebro metaliczne (rozpuszczone w roztworze HNO3) również wobec ałunu
WSKAŹNIKI ADSORPCYJNE:
Wskaźniki adsorpcyjne wywołują zmianę barwy na powierzchni osadu, a nie w roztworze.
Przed osiągnięciem punktu równoważnikowego cząsteczki osadu AgCl są naładowane ujemnie (z powodu nadmiar chlorków) i przyciągają kationy. Po osiągnięciu punktu równoważnikowego osad ten naładowany jest dodanio z powodu nadmiaru jonów Ag+ przez co przyciąga aniony NO32- (przeciwjony). Są one jednak przyciągane dosyć słabo, dlatego ich miejsce może zająć wskaźnik adsorpcyjny.
Fluoresceina:
w roztworze zawierającym nadmiar Ag+ cząsteczki osadu AgCl naładowane są dodatnio i silniej przyciągają jon fluoresceiny niż NO32-na powierzchni osadu utworzy się wtedy czerwony fluoresceinian srebra
po dodaniu anionu wchodzącego w skład osadu (w tym przypadku Cl-) fluoresceina jest przez niego wypierana z powrotem do roztworu, gdzie przyjmuje zabarwienie żółtozielone
może być stosowana tylko w środowisku obojętnym - jony wodorowe wiążą fluoresceinę w niezdysocjowane cząsteczki przez co nie może się ona absorbować na powierzchni osadu
Eozyna - wskaźnik adsorpcyjny, kwas organiczny mocniejszy od fluoresceiny dzięki czemu może być stosowana nawet przy pH = 2; przydatna do oznaczania bromków, jodków i rodanków.
Chlorki oznacza się przy użyciu dichlorofluoresceiny.
Oznaczanie chlorków metodą Fajansa - roztwór chlorku po dodaniu fluoresceiny lub dichlorofluoresceiny miareczkuje się mianowanym roztworem AgNO3 aż do zabarwienia się osadu na czerwono
INNE OZNACZENIA WYTRĄCENIOWE:
Oznaczanie cynku za pomocą mianowanego roztworu K4[Fe(CN)6]:
środowisko: kwasowe lub obojętne
wskaźnik: difenyloamina lub difenylobenzydyna w połączeniu z układem Browna-Hayesa
punkt końcowy: odbarwienie fioletowoniebieskiego roztworu
przeszkadzają: Cu, Cd, Co, Ni, Mn, większe ilości Fe (można związać w kompleks dodając NaF)
najdokładniejsze wyniki przez ostrożne dodanie nadmiaru titrantu, a następnie odmiareczkowanie tego nadmiaru mianowanym roztworem ZnSO4
Oznaczanie cynku za pomocą mianowanego roztworu ZnSO4:
punkt końcowy: różowe zabarwienie osadu
wskaźnik: czerwień metylowa (wskaźnik adsorpcyjny)
Oznaczanie: fosforanów przez wytrącenie octanem uranylu:
wskaźnik: K4[Fe(CN)6] razem z nadmiarem jonów uranylowych tworzy brunatny osad
Oznaczanie manganu za pomocą mianowanego roztworu KMnO4
Oznaczanie baru za pomocą mianowanego roztworu K2Cr2O7:
wskaźnik: AgNO3
Oznaczanie baru za pomocą mianowanego roztworu siarczanu wobec rodizonianu
wskaźnik: C5O6Na2 - rodizonian sodu
punkt końcowy: zmiana barwy z czerwonej na żółtą
miareczkowanie odwrotne: do roztworu siarczanu dodaje się nadmiar BaCl2 i niezwiązane jony barowe odmiareczkowuje się roztworem Na2SO4
przeszkadzają: Ca, Pb, Fe3+, fosforany
Merkurometryczne oznaczanie chlorków i bromków:
titrant: mianowany roztwór Hg2(NO3)2
wskaźnik: żółcień tytanowa (odwracalny wskaźnik adsorpcyjny)
![]()
Wyszukiwarka
Podobne podstrony:
ALKACYMETRIA1-1, rok numero deux, chemia analityczna, I semestr
pytania organiczna 2. rok, rok numero deux, chemia organiczna, koła ze skryptu
WF-Zagadnienia Egz-22.05.2014, rok numero uno, chemia nieorganiczna
WF-Irok-Tok-09.12.2013, rok numero uno, chemia nieorganiczna
sprawozdanie 5 - miareczkowanie NaOH, Studia, I rok, II semstr, Chemia analityczna, sprawozdania
narzady zmyslow, rok numero deux, fizjologia, semy+ćwiki
labolatorium 4 - indetyfikacja ktionow i anionow, Studia, I rok, II semstr, Chemia analityczna, spra
Podział mieszanin chemicznych, Science ^^, Farmacja, 1 rok, Chemia, ćwiczenia, Semestr II
Zasady nazewnictwa wybranych klas zwi-zk-w organicznych, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA
ĆWICZENIE 9, Studia TOŚ, chemia analityczna-labor. semestr III
ZAGADNIENIA TEORETYCZNE ĆW.7-8, Studia TOŚ, chemia analityczna-labor. semestr III
EGZAMIN TESTOWY Z CHEMII ANALITYCZNEJ SEMESTR III-1, PK, chemia, analityczna
kolos 2, studia, studia I rok, z dziennych od Majki, drugi semestr, chemia, chemiczna analiza instru
Chemia Analityczna kompleksometria (zagadnienia) i
cwiczenie11, Płyta farmacja Poznań, II rok, chemia analityczna, ćwiczenia
Anality zagadnienia, Technologia Chemiczna PW, III SEMESTR, Chemia analityczna I
FARMACJA2, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA CZŁOWIEKA, ROK I, SEM 2, CHEMIA ANALITYCZNA I
więcej podobnych podstron