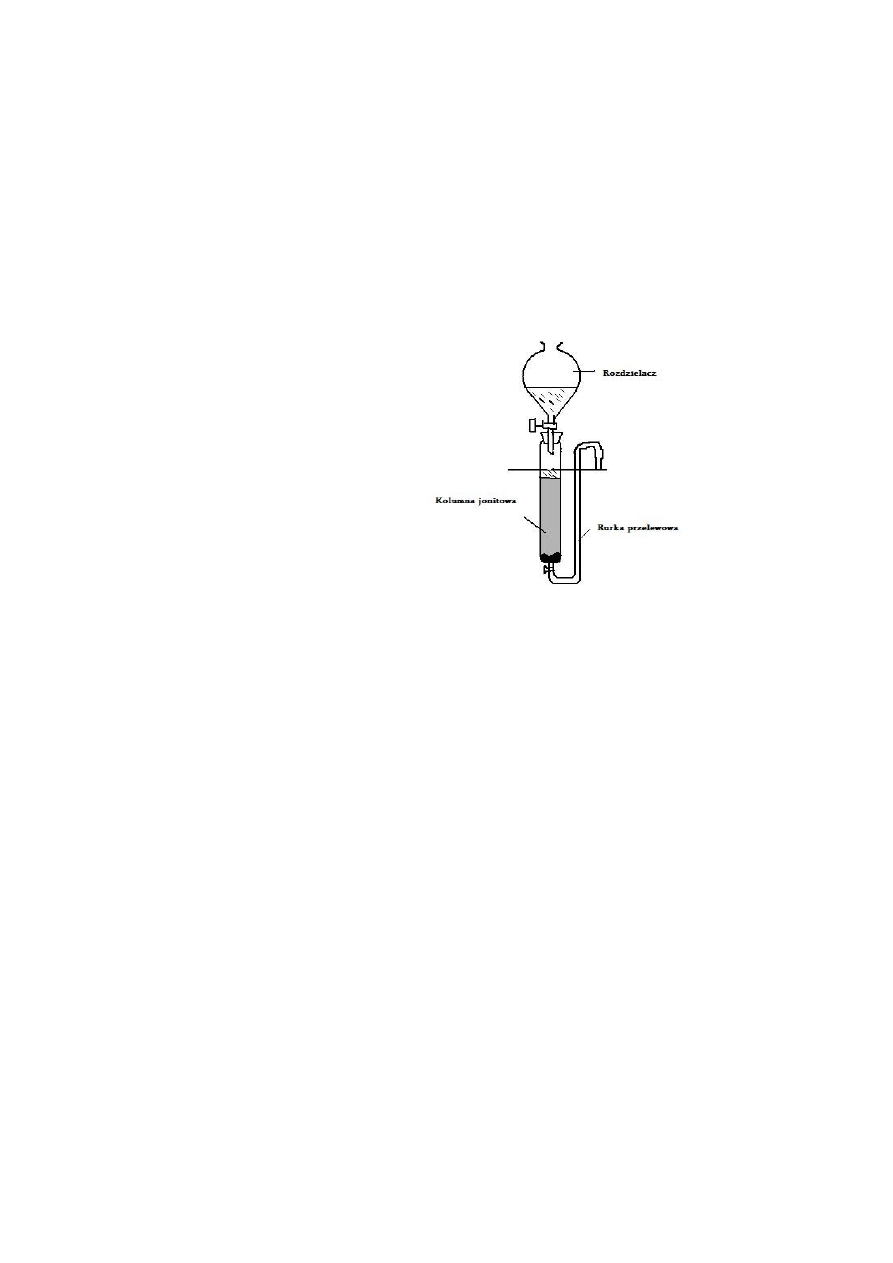
1
Jonity
Charakterystyka jonitów: wielocząsteczkowe polimery organiczne, zawierające czynne chemicznie
ugrupowanie jonowe. Wymieniacze kationowe (kationity: -SO
3
H, -COOH, -OH, wymieniają jony
wodorowe na inne kationy w procesie wymiany jonowej, anionity: -N
+
R
3
, -NR
2
, -NHR, -NH
2
, można
stosować w postaci wodorotlenkowej lub chlorkowej w zależności od obsadzenia grupy zasadowej
anionitu). Wymiana jonowa na kolumnie: Wymiana jonowa jest to odwracalny proces wymiany
jonów między jonitem a otaczającym roztworem. Między wewnętrzną fazą jonitową i omywającym
jonit roztworem ustala się stan równowagi. Ten stan równowagi jest ściśle związany z prawem
działania mas i powinowactwem określonych jonów do danej żywicy jonowymiennej. Powinowactwo
jonu rośnie wraz ze wzrostem ładunku lub
w przypadku jonów o takim samym
ładunku wraz z szeregiem. Jonity stosuje
się w analizie chemicznej do rozdzielenie
pierwiastków
i
oddzielenia
mikroskładników od makroskładników na
zasadzie różnoimienności ładunku jonów
oraz różnic w trwałości kompleksów
pierwiastków i związanych z tym różnic w
stałych podziału między fazę wymieniacza
jonowego a otaczająca go fazę roztworu w
stanie równowagi.
Regeneracja kolumny: po wysyceniu
kolumny zatrzymanymi jonami, przepuszcza się przez kationit na przykład $M kwas solny, a przez
anionit roztwór amoniaku lub wodorotlenku sodu, przemyciu wodą otrzymania obojętnego odczynu
w eluacie , kolumna jest gotowa do dalszej pracy.
Wykorzystanie kationitów do rozdzielania jonów. Po strąceniu matali II grupy analitycznej roztwór
się odparowuje w celu usunięcia HCl , po czym rozcieńcza wodą i wpuszcza do kationitu (z grupami
sulfonowymi w postaci wodorowej). Kationy zostają zatrzymane w kolumnie, aniony przechodzą do
eluatu . kationy wymywa się następnie z kolumny kwasem solnym o odpowiednim stężeniu.
Rozdzielanie cynku i niklu: Poprzez przepuszczanie roztworu tych metali w 8M kwasie solnym przez
anionit, nikiel przechodzi do eluatu, a cynk tworzy trwały kompleks chlorkowy i zostaje zatrzymany w
kolumnie. Kolumnę przemywa się 8M kwasem solnym, a następnie wodą, po czym kompleksy
chlorkowe rozpadają się i przechodzą do eluatu.
Oddzielanie magnezu od fosforanów: słabo kwaśny badany roztwór przepuszcza się przez kationit w
postaci wodorowej. Kationy zostają zatrzymane w kolumnie a aniony przechodzą do eluatu.
Zatrzymanie magnezu w kolumnie zachodzi poprzez wymianę wodoru z tym kationem, później
przemywamy kwasem solnym. LUB. Stosujemy anionit w postaci nadchloranowej i przepuszczając
słabo kwaśny roztwór z badanymi metalami magnez przechodzi do eluatu a jony fosforanowe zostają
zatrzymane.
2
Reakcje kompleksowania
Kompleksy proste - tworzone z ligandami, które maja jeden atom ligandowy; w ich cząsteczkach
mogą występować różne ligandy (NH
2
, H
2
O, N
2
H
4
, H
2
O
2
, Cl
-
, Br
-
, I
-
, SCN
-
, CN
-
, N
3
-
),
Kompleksy chelatowe – pierścieniowe kompleksy powstające z udziałem ligandów, w których
występują przynajmniej 2 atomy donorowe zdolne (ze względów sferycznych) do utworzenia wiązań
z jonem centralnym.
Pary jonowe - kompleksy asocjacyjne – powstające z udziałem 2 jonów (najczęściej kompleksowych)
o przeciwnych ładunkach (na zasadzie oddziaływań elektrostatycznych)
Kompleksy wielordzeniowe - zawierające więcej niż jeden jon centralny. Powstają, gdy
wielokleszczowy ligand wiąże się z więcej niż jednym jonem metalu.
Parametry (termodynamiczne i kinetyczne) charakteryzujące kompleksy
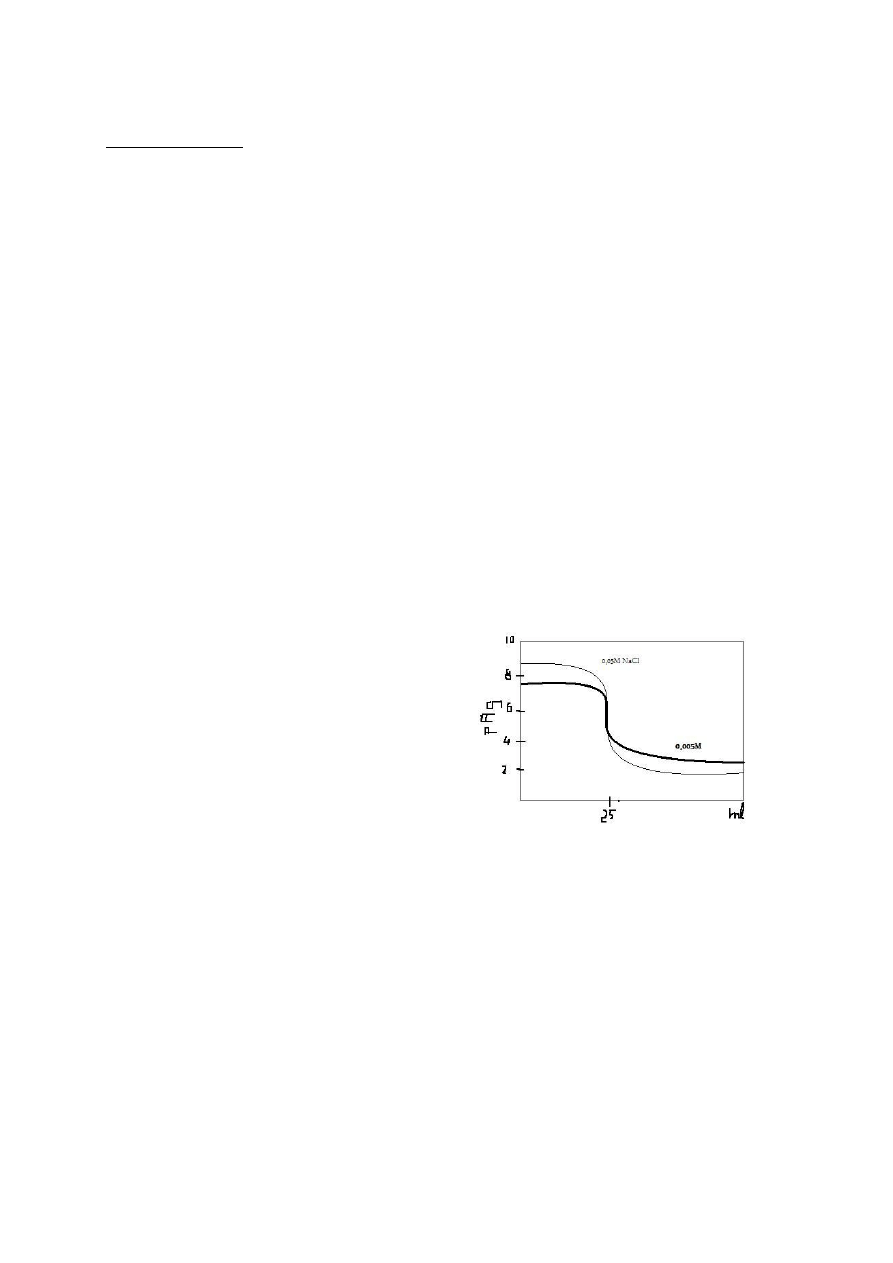
Reakcje EDTA z jonami metali:
Krzywe
miareczkowania.
Punkty:
punkt
początkowy:
pMe=-logc
Me
;
przed
PR:
pMe=-logc
Me
[(v
0
-v)/(v
0
+v)]; w PR: pMe=1/2*log(2B
MeL
/c
Me
);po PR: pMe=logB
Me
+log[(v-v
0
)/v
0
]. Kształt
taki jak w normalnym miareczkowaniu kwasu z zasadą.
Wskaźniki:
Czerń eriochromowa T: w roztworach kwaśnych-czerwona, w ph=7-11 – niebieska, w zasadowych
pomarańczowa; w ph=9-10 tworzy z jonami metali różowo-fioletową postać. Najtrwalsza z
magnezem.
Kalgamit: kwas-czerwona, od 8-12 niebieska, alkaliczne czerwono-pomarańczowa, z jonami metali w
środowisku 9-11 intensywnie czerwona,
Fiolet pirokatechinowy: kwas-czerwona, 2-6 żółta, 6-9 fiolet, alkaliczne czerwono-fiołkowe. Tworzy
niebieskie kompleksy z jonami metali
Mureksyd: do 9- czerwono-fiołkowe, dalej fioletowe (Ca w ph=12-13; Ni, Cu Co) kompleksy-róż
Kwas sulfosalicylowy (Fe
3+
w środowisku kwaśnym tworzy się czerwono-fioletowy kompleks, barwa
znika po PK odbarwia się )
Inne: metaloftaleine (Ba, Sr, Ca) oranż ksynelonowy (Bi, Al, Pb, Fe), tiron (Ti, Fe)
Wskaźniki redoks: błękit wariaminowy (odbarwia sie) 3,3’-dimetylonaftydyna (barwi się)
Mechanizm działania metalowskaźników
W określonych warunkach miareczkowanie tworzą one z oznaczanym jonem metalu barwny
kompleks, o warunkowej stałej trwałości dostatecznie mniejszej od warunkowej stałej trwałości w
tym roztworze kompleksu metal-EDTA. Uwolniony w PK miareczkowania z kompleksu z metalem
wskaźnik (In ) ma Inną barwę niż kompleks lub jest bezbarwny. W końcu miareczkowania z EDTA
zachodzi reakcja: MeIn + EDTA -> MeEDTA + In. W odpowiednich pH wskaźnik tworzy barwny
kompleks z jonem metalu, który ma się zmienić po miareczkowaniu z EDTA.
3
Wykorzystanie EDTA w analizie:
Typy miareczkowań:
-bezpośrednie: po dodaniu do roztworu wskaźnika ustaleniu pH na właściwym i wprowadzeniu
środków maskujących miareczkujemy EDTA do zmiany zabarwienia (Mg, Ca, Zn, Cd, Pb, Cu,Ni…)
- odwrotne: dodajemy nadmiar EDTA potem miareczkuje się odpowiednim zmianowanym roztworem
metalu: cynku lub magnezu (Al, Cr
3+
)
-pośrednie: do roztworu dodajemy kompleks magnezu z EDTA, w którym magnez zostaje wyparty
przez inny jon metalu, uwolniony magnez miareczkujemy EDTA przy czym dogodnym wskaźnikiem
jest czerń eriochromowa T (wapń wobec czerni) . W oznaczaniu anionów możemy dodać odpowiedni
kation żeby strącić osad a potem pozostałość kationu miareczkować EDTA (siarczany dodając BaCl2
lub dodając do cyjanków nikiel, który miareczkować EDTA w obecności mureksydu)
Przykłady oznaczeń: bezpośrednio Mg w obecności czerni eriochromowej T ph=10 (po strąceniu
zmaskowaniu ); bezpośrednio Zn w obecności czerni p=10 (maskowanie, odmiareczkowanie),
Strąceniowe metody objętościowe
- argentometria: miareczkowanie za pomocą roztworu AgNO
3
. Oznaczanie jonów halogenkowych,
fosforanowych, chromianowych, tiocyjanianowych.
-merkurometria- miareczkowanie za pomocą Hg
2
(NO
3
)
2
. Oznaczanie jonów chlorkowych
-miareczkowanie za pomocą roztworu K
4
[Fe(CN)
6
] oznaczanie cynku
Iloczyn rozpuszczalności - iloczyn stężeń jonów pozostających w równowadze z osadem.
Wskaźniki pK miareczkowania :
Wskaźnikami stosowanymi w kompleksometrii
można podzielić jak w przypadku wskaźników
alkacymetrycznych na dwie grupy: jedno i
dwubarwne. Są to związki które w warunkach
miareczkowania (przed lub po PR reakcji) są zdolne
do utworzenia barwnego kompleksu z oznaczanym
metalem. Barwa powinna różnić się od wolnego
wskaźnika w tych warunkach. W kompleksometrii
stosujemy również wskaźniki erdoks, lub sam
nadmiar titranta jest wskaźnikiem (AgCN lub HgI2)

4
Oznaczanie chlorków metodą Volharda
Metoda Volharda polega na dodaniu nadmiaru mianowanego roztworu AgNO3 do zakwaszonego
kwasem azotowym roztworu chlorków; nadmiar AgNO3 odmiareczkowuje się mianowanym
roztworem KSCN lub NH
4
SCN w obecności ałunu żelazowo-amonowego jako wskaźnika.
Po wytrąceniu srebra kropla nadmiaru roztworu tiocyjanianu powoduje powstanie różowego
zabarwienia, ponieważ tworzą się czerwone kompleksy żelaza o wzorze ogólnym Fe(SCN)
n
3-n
, w
którym liczba koordynacyjna n przyjmuje wartości od 1 do 6; skład tych kompleksów zależy od
stężenia tiocyjanianów, najczęściej jednak powstaje najprostszy kompleks FeSCN
2+
.
Zawartość chlorku oblicza się z różnicy początkowej objętości roztworu AgNO3 i objętości dodanego
nadmiaru, która określa się na podstawie zuzytej objetosci roztworu tiocyjanianu
w metodzie Volharda miareczkowany roztwór znajduje się w zetknięciu z dwoma osadami: AgCl i
AgSCN o rożnej rozpuszczalności przy czym AgSCN jest trudniej rozpuszczalny niż AgCl; po
odmiareczkowaniu wiec AgNO
3
tiocyjanianem, nadmiar dodanego rodanku amonu zaczyna reagować
z
uprzednio
wytraconym
AgCl,
na
skutek
czego
roztwór
się
odbarwia:
Cl
AgSCN
SCN
AgCl
Barwa kompleksu FeSCN
2+
zanika w ciągu ok. minuty, dalszy dodatek rodanku amonu przywraca
chwilowo różowe zabarwienie, które następnie zanika na skutek powyższej reakcji; dlatego zużycie
tiocyjanianu będzie znacznie większe niż jest to konieczne do osiągnięcia PR.
aby zapobiec reakcji tiocyjanianu z AgCl można zastosować niewielka ilość nitrobenzenu; nitrobenzen
ulega silnej adsorpcji na powierzchni cząstek osadu, lepiej zwilża osad niż woda i oddziela fazę stałą
od roztworu wodnego, uniemożliwiając tym samym reakcje jonów SCN
-
z AgCl
metoda Volharda można także oznaczać bromki, jodki i tiocyjaniany, duża zaleta tej metody jest
możliwość miareczkowania chlorków w środowisku kwaśnym.
Reakcje: Ag
+
+ Cl
-
-> AgCl (biały),
Ag
+
+ SCN
-
-> AgSCN (biały),
Fe
3+
+ SCN
-
-> Fe(SCN)
2+
(brunatny)
Oznaczanie chlorków metodą Mohra
Metoda Mohra polega na bezpośrednim miareczkowaniu obojętnego roztworu chlorku mianowanym
roztworem AgNO
3
, w obecności chromianu (VI) potasu jako wskaźnika.
W czasie miareczkowania wytraca się najpierw trudno rozpuszczalny osad AgCl:
AgCl
Cl
Ag
Gdy praktycznie cala ilość chlorków Cl
-
zostanie wytracona, nadmiar roztworu AgNO3 wytraca
chromian srebra, którego brunatnoczerwone zabarwienie wskazuje na koniec miareczkowania:
4
2
2
4
2
CrO
Ag
CrO
Ag
Odczyn roztworu powinien być obojętny ponieważ w roztworze kwaśnym jony wodorowe łączą się z
jonami CrO
4
2-
,
tworząc
jony wodorochromianu
(VI) HCrO
4
-
i
dwuchromianu
(VI):
O
H
O
Cr
H
CrO
2
2
7
2
2
4
2
2
Powoduje to zmniejszenie stężenia jonów chromianowych (VI) a w bardziej kwaśnych roztworach
osad nie wytraca się wcale.
Chromian (VI) srebra jako sol słabego kwasu ulega rozpuszczeniu w kwaśnych roztworach; w
roztworach
silnie
zasadowych
przy
pH>
10,5
następuje
wytracenie
osadu
Ag
2
O:
O
H
O
Ag
OH
Ag
2
2
2
2
Metody Mohra nie można stosować do oznaczania chlorków w obecności anionów tworzących w
roztworach obojętnych trudno rozpuszczalne sole srebrowe (Br
-
, I
-
. PO
4
3-
, CO
3
2-
, AsO
4
3-
), kationów
tworzących trudno rozpuszczalne chromiany (Ba
2+
i Pb
2+
) oraz substancji redukujących Ag
+
do srebra
metalicznego (np. jony Fe
2+
).
Metody Mohra można używać do oznaczania bromków.
Reakcje: Ag
+
+ Cl
-
-> AgCl (biały),Ag
+
+ CrO
4
2-
-> Ag
2
CrO
4
(brunatny)
Wyszukiwarka
Podobne podstrony:
KOMPLEKSOMETRIA- PRZYKŁADOWE ZADANIA (wersja zminimalizowana), studia, chemia analityczna, komplekso
Chemia Analityczna redoksometria (zagadnienia)
ZAGADNIENIA TEORETYCZNE ĆW.7-8, Studia TOŚ, chemia analityczna-labor. semestr III
Anality zagadnienia, Technologia Chemiczna PW, III SEMESTR, Chemia analityczna I
ZAGADNIENIA TEORETYCZNE ĆW.1-3, Studia TOŚ, chemia analityczna-labor. semestr III
ZAGADNIENIA TEORETYCZNE ĆW. 4-6, Studia TOŚ, chemia analityczna-labor. semestr III
Kompleksometria, studia, ochrona środowiska UJ, chemia analityczna, wyrównawcze
Precypitometria i kompleksometria (1), rok numero deux, chemia analityczna, I semestr
kompleksometria-zag kol, Technologia chemiczna, Chemia analityczna, analityczna
kompleksometria, Technologia chemiczna, Chemia analityczna
Chemia analityczna - zagadnienia farmacja
, chemia analityczna L, miareczkowanie kompleksometryczne zadania
, chemia analityczna L, miareczkowanie kompleksometryczne zadania
Zadanie 4 CHEMIA ANALITYCZNA
Chemia analityczna kolos
CHEMIA ANALITYCZNA 2 TEST poprawione przez G M
analiza wody sprawozdanie chemia analityczna analiza wody teoria
więcej podobnych podstron