Obliczyć przyrosty ilości ciepła przemian obiegu Diesela dla następujących wartości parametrów stanu:
p1=1[at], p2d=30[at], p3d=p2d, p4d=Ak · p1=257422[Pa]
t1=327[ºC], 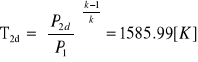
, T3d =A T2d = 3159,15[K],
T4d =Ak T2d = 1574,87[K]
V1 =10[dm3], 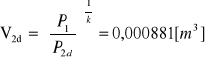
, V1=A V2d = 0,001755[dm3], V4d=A V1
gdy ma on w punkcie początku adiabatycznego zgęszczania czynnika roboczego wspólne z obiegiem Otto parametry stanu, oraz gdy zasób objętości końca przemiany izobarycznej wzgęszczenia gazu w obiegu Diesela V2d równy jest zasobowi objętości końca przemiany adiabatycznej zgęszczania gadu z w objętości Otto V2o. Przyjmując ilości ciepła dostarczonego do obiegu Diesela i Otto są sobie równe ΔQd = ΔQ2-3d = ΔQ2-3o =9[kJ].
Czynnik roboczy pracujący w obiegach scharakteryzowany jest przez indywidualną stałą gazową 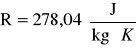
oraz wykładnik izentropy k=1,4. Wartość A jest znana
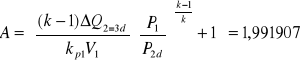
1.Wykresy odwracalnych obiegów Diesela i Otto we współrzędnych p,V oraz T,S
2. Wyznaczenie przyrostów ilości ciepła przemian obiegu Diesla.
2.1. Wyznaczenie przyrostu ilości ciepła pomiedzy puntkami 2d-3d obiebiegu. Między punktami 2d-3d obiegu zachodzi przemiana izobaryczna. Przyrost ilości ciepła dostarczonego do układu jest równy ΔQ2-3d = ΔQd
2.2. Wyznaczenie przyrostu ilości ciepła między punktami 4d-1 obiegu. Miedzy punktami 4d-1 obiegu zachodzi przemiana izochoryczna.
I postać I zasady termodynamiki
dE1= δQ - δL gdzie δL-pdV
Dla przemiany izochorycznej
dV =0 , δL=0
Zatem I postać pierwszej zasady termodynamiki przybiera postać:
dE1= δQ
Zasób energii wewnętrznej w układzie substancjalnym określony jest wnioskiem
dE1= Cν m T
Dla gazu doskonałego
Cν=const
Dla układu substancjalnego
m=const
Stąd
dE1= Cν m dT
Zatem bilans zasobu energii wewnętrznej przyjmie postać:
δQ = Cν m dT
Całkując powyższe równanie w granicach otrzymamy
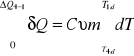
![]()
ΔQ1-4d =Cν m (T1 - T4d )
Uwzględniając równanie Meyera oraz definicję definicję wykładnika izentropy możemy napisać: z równania stanu gazu doskonałego określamy wartość
![]()
![]()
Zaś temperatura w punkcie 4d obiegu określona jest wzorem:
T4d = Ak - T1
Zatem przyrost ilości ciepła w przemianie izochorycznej między punktami 4d-1 obiegu jest równy
![]()
2.3 Wyznaczam przyrost ilości ciepła w przemianach między punktami 1-2d oraz 3d-4d. Między punktami 1-2d oraz 3d-4d obiegu zachodzą przemiany izotropowe, zatem
ΔQ1-2d = 0
ΔQ3d-4d = 0
(Nie ma wymiany ciepła)
3. Obliczam wartości przyrostów ilości ciepła przemian obiegu:
ΔQ2-3d = ΔQd = 9[kJ]
![]()
Krystian Bagiński WP-53
Termodynamika
Zadanie II. 5. 3a.
Wyszukiwarka
Podobne podstrony:
II 10, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 11, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 27.4.b, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 12, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 27.4.a, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 20, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 27, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 27.2.b, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 15, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 13, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 4.5a, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 23, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 5.1b, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 6.2, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 7, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 4.2, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 8.1, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 3.3, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
II 1.2, PW WIP MiBM, semestr 4, terma, 2 KOLOS, kol2
więcej podobnych podstron