IX. SZYBKOŚĆ REAKCJI CHEMICZNYCH
1. Definicja szybkości reakcji chemicznej
Rozpatrzmy reakcję chemiczną przebiegającą w fazie gazowej:
2NH3 = N2 + 3H2
Jako szybkość reakcji można uznać pochodne:
Możemy zapisać, że:
Wprowadźmy pojęcie postępu reakcji (ξ):
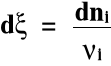
gdzie: ξ(ksi) - postęp reakcji
ν (ni) - współczynnik stechiometryczny
Szybkość reakcji:
dla V = const.
2. Od czego zależy szybkość reakcji chemicznej? Cząsteczkowość i rzędowość reakcji.
Dla reakcji:
a ⋅ A + b ⋅ B + c ⋅ C = .........
![]()
gdzie k - stała szybkości reakcji
cA, cB, cC - stężenia substratów A, B i C
Cząsteczkowość reakcji wynosi:
a + b + c
W rzeczywistości zdarza się, iż wyznaczone doświadczalnie współczynniki potęgowe nie wynoszą a, b i c lecz przyjmują inne wartości.
Załóżmy iż wynoszą one α, β, γ
α, β, γ - rzędy reakcji w stosunku do reagentów A, B i C.
n = α + β + γ ogólny rząd reakcji
n może być: 0, 1, 2
↑ ↑ ↑
reakcja rzędu: 0" "1" "2"
Rząd reakcji może też być ułamkowy lub nawet ujemny.
Jaka jest cząsteczkowość i rzędowość wybranych reakcji?
Przykład 1:
1NO(g) + 1O3(g) = 1NO2(g) + 1O2(g)
Cząsteczkowość tej reakcji wynosi 2 (a = 1, b = 1, a + b = 2)
Eksperymentalnie ustalono, że:
r = k ⋅ cNO ⋅ cO3
A więc rzędowość tej reakcji wynosi też 2 (α = 1, β = 1, α + β = n = 2)
Tutaj rzędowość pokrywa się z cząsteczkowością reakcji !
Przykład 2:
4HBr(g) + O2(g) = 2H2O(g) + 2Br2(g)
Cząsteczkowość tej reakcji wynosi 5 (4 + 1 = 5)
Doświadczalnie ustalono, że:
r = k ⋅ cHBr ⋅cO2
A więc rzędowość tej reakcji wynosi n = 1 + 1 =2 (n ≠ 5)
Tutaj rzędowość nie pokrywa się z cząsteczkowością reakcji !
Oznacza to, że reakcja ta przebiega poprzez kilka etapów.
Ustalono, że reakcja ta przebiega poprzez 3 etapy:
(1) HBr + O2 = HOOBr (etap powolny)
(2) HOOBr + HBr = 2HOBr (etap szybki)
(3) 2HOBr + 2HBr = 2H2O + 2Br2 (etap szybki)
4HBr + O2 = 2H2O + 2Br2 po dodaniu stronami
Szybkość sumaryczna reakcji chemicznej zależna jest od szybkości etapu najwolniejszego (w tym przypadku od reakcji (1)) |
Badania kinetyczne prowadzą do poznania mechanizmu reakcji.
3. Zmiana energii w czasie reakcji chemicznej
Jak zmienia się energia zespołu zderzających się cząsteczek w reakcji? Dla reakcji egzotermicznej:
CO + NO2 = CO2 + NO ΔHθ = -226 kJ/mol
Aktywny kompleks jest produktem pośrednim o bardzo krótkim okresie życia.
Schematycznie można to przedstawić następująco:
C O2 C O2 C O2
+ ⇔ ⇔
O N O N O N
substraty kompleks produkt
aktywny
(T1/2 = 10-10s)
Szybkość reakcji związana jest z wartością potrzebnej do jej przebiegu energii aktywacji. Im wyższa jest ta energia, tym wolniej przebiega reakcja. |
4. Wpływ temperatury
Równanie Arrheniusa:
Wzrost temperatury zawsze zwiększa szybkość reakcji chemicznej!
Szybkość reakcji chemicznej rośnie wraz z temperaturą wykładniczo!
5. Kataliza, katalizator
Katalizator jest to substancja, która przyspiesza reakcję chemiczną, a po zakończeniu reakcji pozostaje w stanie niezmienionym. Zjawisko przyspieszania reakcji chemicznej przez katalizatory nazywamy katalizą |
Katalizator nie zwiększa wydajności reakcji.
Katalizator obniża energię aktywacji reakcji chemicznej.
Przykład katalizatora stałego dla reakcji:
N2 + 3H2 = 2NH3
Energia aktywacji reakcji bez katalizatora 335 kJ/mol
z katalizatorem osmowym 195 kJ/mol
z katalizatorem wolframowym 165 kJ/mol
Enzymy pełnią rolę katalizatorów procesów biologicznych.
Inhibitor - działa odwrotnie niż katalizator, tzn.
podwyższa energię aktywacji, (np. inhibitory korozji).
Inhibitor obniża więc szybkość reakcji chemicznej.
Koniec rozdziału IX-go.
Władysław Walkowiak - Chemia Ogólna, kurs WPC 1002w
12 / 12
Rozdział IX. Szybkość reakcji chemicznych
gdzie:
EA - energia
aktywacji
R - stała
gazowa
T -temperatura
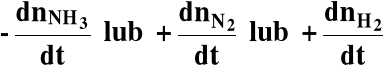
![]()
k
T
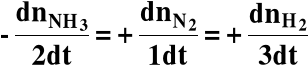
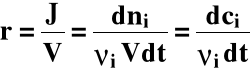
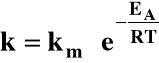
Wyszukiwarka
Podobne podstrony:
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 10.Równowaga chemiczna. Prawo działania mas, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DO
Wykład 1. Wstępne pojęcia chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 4. Reakcje utleniajaco-redukcyjne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 12. Reakcje jadrowe, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 7. Okresowosc wlasciwosci pierw. chemicznych, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) D
Wykład 5. Elektronowa struktura atomu, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 2. Roztwory i stężenia, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 11b. Elektrolity - cd., chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 11a. Elektrolity - kwasy, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wyklad 8. Szybkosc reakcji chemicznych PCHN SKP studport
Wyklad 9. Szybkosc reakcji chemicznych, chomikowe, WYKŁADY z Chemii
Walkowiak, Chemia ogólna, Szybkość reakcji chemicznych
szybkość reakcji chemicznej(1), NAUKA, chemia, lab
SZYBKOŚĆ REAKCJI CHEMICZNYCH, Szkoła, penek, Przedmioty, Chemia, Laboratoria
dr Wawrzyniak, chemia nieorganiczna, sprawodzanie Szybkość reakcji chemicznych i równowaga chemiczna
Chemia Ogólna - PROGRAM WPC1002w (Walkowiak), Biotechnologia PWR, Semestr 1, Chemia ogólna, Chemia o
więcej podobnych podstron