Szybkość reakcji chemicznej-jest to stosunek zmiany stężenia substratu lub produktu do czasu, w którym ta zmiana nastąpiła. Szybkość reakcji zależy od:
rodzaju i stężenia reagentów (zmniejsza się stężenie substratów to szybkość maleje)
temp. (wzrost temp. przyspiesza szybkość reakcji)
ciśnienia u gazów
katalizatora
rozdrobnienia substancji (większe rozdrobnienie-większa szybkość reakcji)
rodzaju reagentów
promieniowania elektromagnetycznego
![]()
Stała szybkości reakcji- jest to współczynnik proporcjonalności w równaniu kinetycznym charakterystyczny dla danej reakcji. Zależy od:
stężenia reagentów
wzrost stężenia substratów przesuwa stałą w prawo (do produktów)
zmniejszenie stężenia substratów przesuwa stałą w lewo (do substratów)
wzrost stężenia produktów przesuwa stałą w lewo (do substratów)
zmniejszenie stężenia produktów przesuwa stałą w prawo (do produktów)
ciśnienia u gazów( przynajmniej jeden substrat gazowy i różne objętości substratów i produktów)
wzrost ciśnienia przesuwa stałą w kierunku mniejszej objętości
zmniejszenie ciśnienia przesuwa stałą w kierunku większych objętości
temperatury
wzrost temp. powoduje przesunięcie stałej w lewo dla reakcji egzoenergetycznych
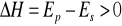
wzrost temp. powoduje przesunięcie stałej w prawo dla reakcji endoenergetycznych
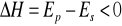
katalizator w jednakowym stopniu wpływa na przesunięcie stałej, za jego pomocą układ szybciej osiąga stan równowagi ale stała się nie zmienia.
Niekiedy stałą szybkości wyraża się za pomocą czasu połówkowego tj. czasu potrzebnego na to, aby przereagowała połowa substancji.
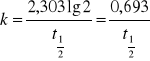
Stała równowagi chemicznej- jest równa stosunkowi iloczynu produktów do iloczynu substratów i jest wartością stałą w danej temperaturze.
A+B C+D ![]()
Energia aktywacji- jest to minimalna energia jaką muszą posiadać zderzające się cząsteczki, aby ich zderzenia były efektywne. Jeżeli dla danej reakcji wyznaczy się stałe szybkości w różnych temp. wówczas wykreślenie zależności logk=f(1/T) pozwala wyznaczyć energię aktywacji danej reakcji. Oznaczając przez A współczynnik nachylenia prostej logk=f(1/T): Ea=-2,3RA
Cząsteczkowość reakcji- jest to liczba cząsteczek, które muszą się spotkać, aby zaszedł akt reakcyjny.
Reguła Van`t Hoffa- w zwykłych warunkach podwyższenie temp. o 10oC zwiększa szybkość reakcji od 2 do 4 razy.
Równanie Arrheniusa- zakłada, że cząsteczki powinny posiadać pewną energię Ea, aby mogły przereagować. Im wyższa wymagana Ea, tym mniej cząsteczek jest nią obdarzonych w danej temp. i tym wolniej przebiega reakcja. Równanie to określa zależność stałej szybkości reakcji od temperatury.
![]()
Gdzie: A- stała empiryczna charakterystyczna dla danej reakcji
Ea- energia aktywacji
R- stała gazowa
T- temperatura
Rozpuszczalność I2 w czystej wodzie jest niewielka (ok. 1,2*10-3 mol/dm3 w temp.20oC), natomiast rozpuszcza się on dobrze w roztworze KI z utworzeniem I3-. Stała równowagi reakcji I2+I- =I3- w tem 25C wynosi K=800, dlatego w roztworze dominującym reagentem jest I3-. Szybkość reakcji jodowania acetonu determinuje stężenie formy enolowej, natomiast szybkość procesu przegrupowania formy ketonowej w enolową nie zależy od stężenia I2, dlatego szybkość reakcji jodowania acetonu również nie zależy od stężenia jodu.
Badanie:
t [min] |
Vt [ml] |
x |
a-x |
b+x |
|
0 |
12,6 |
0 |
0,1636 |
0,1 |
-0,4923 |
15 |
12,0 |
0,00024 |
0,1634 |
0,1002 |
-0,4890 |
30 |
11,6 |
0,0004 |
0,1632 |
0,1004 |
-0,4858 |
45 |
11,1 |
0,0006 |
0,1630 |
0,1006 |
-0,4826 |
60 |
10,6 |
0,0008 |
0,1628 |
0,1008 |
-0,4794 |
75 |
10,4 |
0,00088 |
0,1627 |
0,10088 |
-0,4779 |
90 |
9,6 |
0,0012 |
0,1624 |
0,1012 |
-0,4729 |
1. Obliczenie stężenia początkowego acetonu a i kwasu b znając objętość Vacetonu= 3 cm3 i gęstość dacetonu= 0,7905 g/dm3 oraz stężenie kwasu HCl cHCl= 1 mol/dm3
Macetonu=58g/mol
![]()
![]()
mol/dm3 [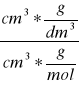
] = [mol/dm3]
![]()
![]()
mol/dm3 [ 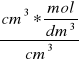
] = [mol/dm3]
2. Obliczanie ubytku stężenia acetonu x (=przyrostowi stężenia kwasu = ubytkowi stężenia jodu) po upływie czasu t w oparciu o wyniki miareczkowania. Ze stechiometrii reakcji redukcji jodu tiosiarczanem
I2+2Na2S2O3 Na2S4O6+2NaI
wynika, że ubytek stężenia I2 jest dwukrotnie mniejszy od ubytku tiosiarczanu, a wiec od różnicy ilości moli Na2S2O3 zużytych na początku (Vo) i po upływie czasu t (Vt) na zmiareczkowanie nadmiaru jodu:
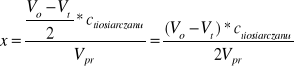
gdzie: Vo i Vt -ilości Na2S2O3 zużyte na zmiareczkowanie 25cm3 (Vpr) mieszaniny reagującej
na początku i po czasie t.
Obliczenia:
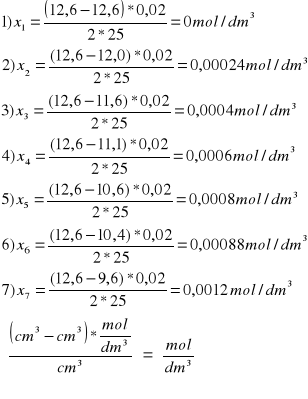
a-x: b+x:
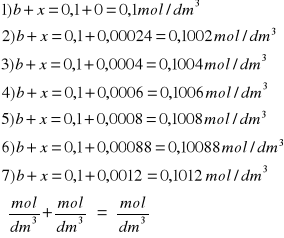
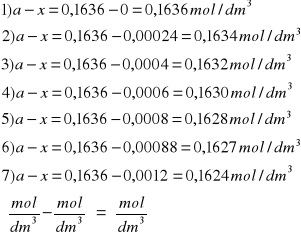
Obliczam wartość:
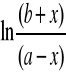
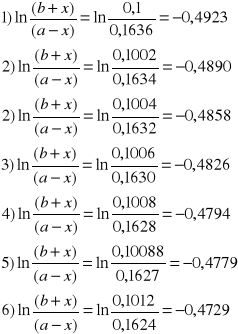
Wykres:
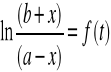
Wyznaczam wartość stałej szybkości k:
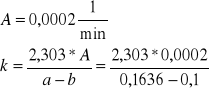
k = 0,0072 dm3/mol∗min
Obliczam nachylenie prostej:
y= 0,0002x - 0,4921
przyjmuje x =10, czyli y= - 0,4901
tgα = ![]()
=![]()
= - 0,0491
Wnioski:
Celem mojego doświadczenia było wyznaczenie stałej szybkości jodowania acetonu. Szybkość jodowania acetonu nie zależy od stężenia I2, tylko od stężenia jonów wodorowych oraz stężenia acetonu. Jony H+ w tej reakcji ulegają zobojętnieniu i reakcja jodowania zostaje zahamowana.
Wyznaczona przeze mnie stała reakcji jest bardzo niewielka i wynosi 0,0072 dm3/mol∗min.
Ćwiczenia powinienem przeprowadzać w temperaturze 25oC,dlatego korzystałem z termostatu - jednak podczas pobierania próbek roztworu kolba z roztworem musiała być przeze mnie wyciągana z termostatu - stąd wnioskuję, że temperatura mogła się nieznacznie zmienić powodując błędy.
Błędy wynikały także z nieprecyzyjnego odczytania zużytej objętości Na2S2O3. Doświadczenie to pozwala na dość dokładne określenie stałej szybkości jednak potrzebne są precyzyjne pomiary, duża ostrożność przy miareczkowaniu oraz przestrzeganie norm czasowych przy wykonywaniu ćwiczenia.
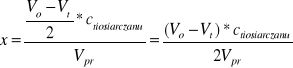
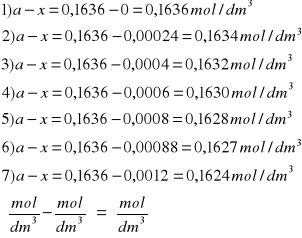
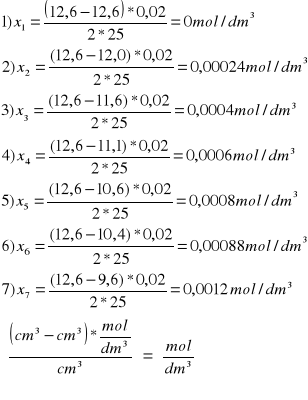
Wyszukiwarka
Podobne podstrony:
moje cwiczenie, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Sprawozdanie moje 44, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
moje 45, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
ćwiczenie nr 10 moje, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Sprawozdanie moje 44 koniec, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
nowe obliczenia, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
nowe sprawko z eie, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Moje sprawozdanie nr 45 koniec bez wnioskow, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Moje sprawozdanie nr 45 koniec + wnioski, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Tabelka pomiarowa do 21, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
obliczenia i wnioski, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
konsp15, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
konspekt 53, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
sprawozdanie 45miki, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Ch.f.44, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
więcej podobnych podstron