skan0022 (6)

Stany skupienia materii 25
skąd
Stany skupienia materii 25
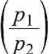
P\ . _
2 • 105
8,314 • 300,7
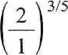
= 1,895 -10-2m3.
3 R
1 • 105- 1,895- 10~2 8,314
= 227,9 K. ■
Współczynnik rozszerzalności cieplnej, a, definiuje równanie

(2.15)
Współczynnik ściśliwości, /?, definiuje równanie
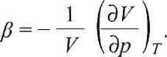
(2.16)
Stosunek współczynników rozszerzalności cieplnej i ściśliwości określa równanie

(2.17)
Zachowanie gazów rzeczywistych opisano na wiele sposobów. Równanie Van der Waalsa

(2.18)
poprawia równanie stanu gazu idealnego (2.9) przez uwzględnienie tzw. objętości wyłączonej gazu (stała b) i sił oddziaływań międzycząsteczkowych (stała a). Stosuje się je przy niezbyt dużych odstępstwach zachowania gazu od zachowania gazu idealnego. Nieco lepsze wyniki daje równanie Berthelota
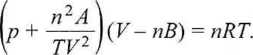
(2.19)
Przykład 2.4. Stałe a i b równania Van der Waalsa dla gazowego NH3 wynoszą ci = 4,17 atm • dm6 • mol-2, b = 0,0371 dm3 • mol-1. Obliczyć:
1) ciśnienie wywierane przez 3,5 mola NH3 zajmującego w 47°C objętość 5,2 dm3, stosując: a) równanie stanu gazów idealnych, b) równanie Van der Waalsa;
2) objętość 3,5 moli NH3 w tej temperaturze pod ciśnieniem otrzymanym w punkcie lb), przy założeniu, że jest to gaz Van der Waalsa.
Wyszukiwarka
Podobne podstrony:
skan0026 (3) Stany skupienia materii 29 Zatem dla gazowego argonu B = j -75,2 = 25,06 cm3 mol"1
skan0032 (3) Stany skupienia materii 35 i jest proporcjonalna do temperatury absolutnejpV = j MiP- =
skan0036 (3) Stany skupienia materii 39 gdzie M oznacza masę cząsteczkową (kg • mol-1), a - napięcie
więcej podobnych podstron