skan0032 (3)

Stany skupienia materii 35
i jest proporcjonalna do temperatury absolutnej
pV = j MiP- = j Ek = RT.
Zgodnie z prawem Grahama względne szybkości efuzji dwu różnych gazów, ucp vc,, są proporcjonalne do ich prędkości średnich i spełniają zależności
v
ei
Vc2
(2.34)
gdzie M] i M2 są masami cząsteczkowymi gazów 1 i 2.
Przykład 2.8. W pewnych warunkach ciśnienia i temperatury' 60 cm3 gazu X uległo efuzji przez otworek w ciągu 10 s. W tych samych warunkach efu-zja 480 cm3 H2 trwała 20 s. Obliczyć masę molową gazu X. Co to za gaz?
Rozwiązanie. Szybkość efuzji gazu X można wyrazić
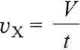
60
10
= 6 cm3 ■s 1
i analogicznie dla wodom
480
20
= 24 cm3 • s l.
Zgodnie z równaniem Grahama (2.34)
vx _ IMh2 vh2 y mx ’ _6_ _ / 2,016 24 V Mx ’
skąd Mx = 32,3 g • mol l, a więc gazem X może być tlen. ■
Średnia droga swobodna w czystym gazie wynosi
~^2,'K(T2N\ ’ ^2'35)
gdzie Ni oznacza liczbę cząsteczek gazu w jednostce objętości, a - średnicę zderzeniową cząsteczek gazu.
W mieszaninie dwóch gazów, których średnica zderzeniowa wynosi
^12 =łfal + CJ2),
Wyszukiwarka
Podobne podstrony:
78441 skan0030 (3) Stany skupienia materii 33 Kinetyczno-molekularna teoria gazów idealnych (Maxwell
83684 skan0034 (3) Stany skupienia materii 37 gdzie w jest szybkością efuzji masy przez otwór na jed
skan0022 (6) Stany skupienia materii 25 skąd Stany skupienia materii 25 P . _ 2 • 105 8,314 • 300,7
skan0026 (3) Stany skupienia materii 29 Zatem dla gazowego argonu B = j -75,2 = 25,06 cm3 mol"1
skan0036 (3) Stany skupienia materii 39 gdzie M oznacza masę cząsteczkową (kg • mol-1), a - napięcie
więcej podobnych podstron